反义hTR对人胃癌细胞株SGC-7901恶性表型的逆转作用
作者:杨金亮 房殿春 杨仕明 罗元辉 罗昆仑 鲁荣 刘为纹
单位:杨金亮(第三军医大学附属西南医院消化内科,重庆 400038);房殿春(第三军医大学附属西南医院消化内科,重庆 400038);杨仕明(第三军医大学附属西南医院消化内科,重庆 400038);罗元辉(第三军医大学附属西南医院消化内科,重庆 400038);罗昆仑(第三军医大学附属西南医院消化内科,重庆 400038)
关键词:人端粒酶RNA组份(hTR);端粒酶;真核表达载体;基因治疗;反义基因;胃癌细胞系
第三军医大学学报000601
提 要: 目的 探讨反义hTR基因转染对胃癌细胞系SGC-7901恶性表型的逆转作用及其在肿瘤基因治疗中的价值。方法 构建包含端粒重复序列模板区的反义hTR基因真核表达载体,用脂质体法将其转染至胃癌细胞系SGC-7901,比较观察反义hTR基因转染后7901细胞的hTR RNA表达、端粒酶活性、体外生长增殖特性和裸鼠体内致瘤能力的变化。结果 反义hTR基因转染的7901细胞hTR RNA表达和端粒酶活性明显降低、体外生长增殖能力降低、接触抑制恢复、细胞凋亡率增加、软琼脂集落形成能力和裸鼠体内致瘤能力完全消失。结论 反义hTR基因转染能使7901细胞的端粒酶活性明显下调并逆转其恶性表型,提示端粒酶是肿瘤治疗的较理想靶点,端粒酶抑制剂具有良好的临床应用前景。
, 百拇医药
中图法分类号: R735.202;R459.9 文献标识码: A
文章编号:1000-5404(2000)07-0611-04
Antisense human telomerase RNA reverses malignant phenotype of gastric carcinoma cell line SGC-7901
YANG Jin-liang, FANG Dian-chun, YANG Shi-ming, LUO Yuan-hui, LUO Kun-lun, LU Rong, LIU Wei-wen
(Department of Gastroenterology, Southwest Hospital, Third Military Medical University, Chongqing 400038,China)
, 百拇医药
Abstract: Objective To study the effects of the transfection of antisense human telomerase RNA (hTR) on the malignant phenotype of gastric carcinoma cell line SGC-7901 and its potential role in the gene therapy for cancers. Methods An antisense hTR gene eukaryotic expression vector pCL-ahTR including the template region of telomere repeats sequence was constructed with recombinant DNA technique and transfected into the cells of gastric carcinoma cell line SGC-7901 with liposome DOTAP. Then, the expression of hTR and antisense hTR was observed with RT-PCR, telomerase activity with PCR-ELISA, the cell morphology and cellular proliferation capacity with MTT assay and the efficiency of clone formation in soft agar, the cell cycle distribution and the apoptotic state with flow cytometry. The characteristics of the proliferation of SGC-7901 cells in vitro and the tumorigenecity in nude mice were also observed. Results The expression of hTR RNA, the activity of telomerase and the proliferative capacity of antisense hTR gene transfected SGC-7901 cells in vitro were obviously decreased and the apoptotic rate increased. The capability to form clones in soft agar and to develop carcinoma in nude mice totally vanished. Conclusion Our study demonstrated that after the transfection of antisense hTR gene, the telo-merase activity of SGC-7901 cells was obviously down-regulated and their malignant phenotype was reversed, which implies that telomerase is an ideal target in cancer therapy and telomerase inhibitors are promising agents in this aspect.
, 百拇医药
Key words: human telomerase RNA components; telomerase; eukaryotic expression vector; antisense gene; gene therapy; gastric carcinoma; cell line
端粒酶(Telomerase)是由RNA和蛋白质构成的一种特殊的逆转录酶,能催化合成染色体末端的端粒DNA重复序列,以维持染色体的稳定和完整[1]。1995年,Feng等[2]最先克隆了人端粒酶RNA组份(Human telomerase RNA components, hTR)的基因并证明了反义hTR能下调人宫颈Hela癌细胞的端粒酶活性,导致端粒进行性缩短,经23~26个倍增周期后,细胞增殖停止并死亡。这一研究为人们提供了干预端粒酶活性治疗肿瘤的新思路。胃癌组织的端粒酶阳性率高达90%,且与肿瘤恶性程度和预后密切相关[3,4]。为此,我们构建了反义hTR真核表达载体,将其转染至SGC-7901胃癌细胞,探讨了反义hTR对SGC-7901胃癌细胞恶性生物学行为的影响。
, 百拇医药
1 材料与方法
1.1 载体构建 包含成熟hTR cDNA的pGRN83克隆载体由美国Geron公司惠赠,真核表达载体pCL-neo购自Promega。用MluⅠ和SalⅠ限制性内切酶从pGRN83上切长约579 bp的hTR片段,反向插入pCL-neo表达载体,将连接产物转化JM109大肠杆菌(氯化钙法),少量提取质粒酶切鉴定,并经测序确认。
1.2 细胞培养
SGC-7901细胞培养于含10%灭活的小牛血清、100μg/ml链霉素、100U/ml青霉素的RPMI1640培养液中,培养条件为37℃、5%CO2、饱和湿度,每隔2~3d用0.25%胰酶/0.02%EDTA消化,以1∶3~1∶5传代1次。
1.3 基因转染 采用DOTAP脂质体(BoehringerMannheim),转染过程按试剂说明书进行。转染后48h将细胞以1∶5传代,加G418400μg/ml进行筛选,约2周左右抗性细胞克隆形成,在200μg/mlG418的选择压力下进行扩大培养,并冻存保种。反义hTR基因转染的7901细胞命名为7901-ahTR,空载体pCL-neo转染的7901细胞命名为7901-neo。
, 百拇医药
1.4 RT-PCR法鉴定转基因细胞的hTRRNA表达 RNA提取用Tripure试剂(Boehringermannheim)按说明书进行。RT-PCR采用一步一管法(AcessRT-PCRsystem,Promega)。hTR引物为P1:5′-TCTAACCCTAACTGAGAAGGGCGTAG-3′;P2:5′-GTTTGCTCTAGAATGAACGGTGGAAG-3′,扩增片段长度为126bp。扩增正义hTR时先加上游引物P1,反转录后再加下游引物P2进行PCR扩增;扩增反义hTR时先加下游引物P2,反转录后再加上游引物P1进行PCR扩增。GAPDH引物(作为外参照)为P1:5′-CCACCCATGGCAAATTCCATGGCA-3′,P2:5′-TCTAGACGGCAGGTCAGGTCCAC-3′,扩增片段长度为598bp。反应体系为:总体积25μl、dNTP0.2mmol/L,上下游引物各1mmol/L、MgSO41mmol/L、AMV逆转录酶0.1U/ml、TflDNA聚合酶0.1U/ml、1×反应缓冲液、RNA模板100ng、扩增条件为48℃,45min→94℃,2min→94℃,30s;60℃,40s;68℃,1min;40cycles→68℃,7min。取3~6μl扩增产物行2%琼脂糖凝胶电泳,紫外灯下观察并拍照。
, 百拇医药
1.5 端粒酶活性测定 采用TelomerasePCR-ELISA半定量法(试剂盒购自Boehringermannheim),按说明书标准程序进行。
1.6 细胞形态学观察 倒置显微镜下常规和HE染色比较观察SGC-7901细胞和反义hTR转染的SGC-7901细胞在大小、形态及生长方式上的差别。
1.7 细胞生长增殖能力测定 用MTT法测定细胞增殖能力。
1.8 细胞周期和细胞凋亡测定 收集对数生长期细胞,PBS漂洗后,70%冷乙醇固定24h以上,碘丙啶(PI)染色,采用流式细胞仪(FACS420)检测细胞各期的分布和细胞凋亡率。
1.9 软琼脂集落形成实验 参照文献[5]进行。
1.10 裸鼠致瘤能力观察 4周龄Balb/c裸鼠,雌性,分3组(3只/组),分别于左右侧背部皮下注射1.5×106个SGC-7901和7901-neo细胞、1.5×106个SGC-7901和7901-ahTR细胞、3×106和1×107个7901-ahTR细胞,观察肿瘤出现时间、生长速度、肿瘤大小及小鼠存活期。
, 百拇医药
2 结果
2.1 hTR反义真核表达载体(pCL-ahTR)的构建和鉴定 用MluⅠ和SalⅠ从pGRN83上切下长约579bp的hTRcDNA片段,定向连入pCL-neo载体的XhoⅠ/MluⅠ酶切位点上(XhoⅠ与SalⅠ酶切后的末端为匹配粘性末端),将连接产物转化大肠杆菌,抽提质粒,经PstⅠ、HindⅢ等酶切鉴定、所得片段与理论设计值完全符合,测序结果同报道的hTRcDNA序列一致,见图1。
图1 质粒pGRN83和pCL-ahTR酶切鉴定图谱
Fig 1 Restriction endonuclease map of pGRN83 and pCL-ahTR
1:pGRN83/MluⅠ and salⅠ digested(3.0 kb+0.58 kb);2:λDNA/HindⅢ marker;3:pCL-ahTR/PstⅠ digested(3.67 kb+2.38 kb);4:pCL-neo/PstⅠdigested(3.67 kb+1.81 kb)
, http://www.100md.com
2.2 7901-ahTR细胞反义hTR RNA的表达和hTR RNA表达水平的变化
7901-ahTR细胞有反义hTR RNA的表达,其正义hTR RNA表达水平较未转染细胞和转染对照质粒pCL-neo的细胞明显降低,见图2。
图2 hTR RT-PCR结果
Fig 2 Results of hTR RT-PCR
1:7901-ahTR cells/hTR RNA;2:7901-ahTR cells/antisense hTR RNA;3:7901-neo cells/hTR RNA;4:7901 cells/hTR RNA;5:PCR marker
, 百拇医药 2.3 反义hTR基因转染对7901细胞端粒酶活性的影响
反义hTR基因转染的7901细胞端粒酶活性明显下调,较父系7901细胞和空载体转染7901细胞的端粒酶活性下调了约2/3,见图3。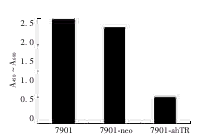
图3 7901-ahTR和7901细胞的端粒酶活性比较
Fig 3 Comparison of telomerase activity in 7901-ahTRcells and parent 7901 cells
2.4 反义hTR基因转染对7901细胞体外生长增殖特性的影响
反义hTR基因转染的7901细胞体积略有增大、呈圆形或梭形、轮廓清楚、核浆比例减少、瘤巨细胞减少、异形性降低,且7901-ahTR细胞只能呈单层生长,在长至100%汇合后恢复接触抑制和密度抑制,此后细胞分裂增殖速度显著降低,细胞容易脱壁、老化甚至死亡;而相应7901细胞和转染对照质粒pCL-neo的细胞大小形状不一、核深染不规则、瘤巨细胞较多,能叠加甚至悬浮成团生长,丧失了接触抑制和密度抑制的特性。
, http://www.100md.com
2.5 反义hTR基因转染对7901细胞体外增殖能力的影响
7901-ahTR细胞较7901和7901-neo细胞的生长速度明显减慢,尤其是在达到对数生长期后,见图4。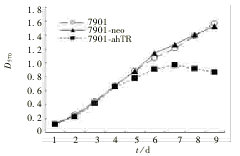
图4 7901和7901-ahTR细胞体外增殖能力比较
Fig 4 Comparison of cellular proliferation capacity of
7901-ahTR cells and parent 7901 cells in vitro
2.6 反义hTR基因转染对7901细胞软琼脂克隆形成能力的影响
, 百拇医药
亲本7901细胞和7901-neo细胞均能在软琼脂固体培养基中形成较大的集落,其集落形成率分别为10%和8.5%,而反义hTR基因转染的7901细胞在软琼脂培养基上不能形成克隆,说明反义hTR基因转染使7901 克隆形成能力降低或丧失。
2.7 反义hTR基因转染对7901细胞的细胞周期和细胞凋亡的影响
反义hTR基因转染的7901细胞和亲本及空载体转染的7901细胞相比,G0/G1期细胞从59.0%和60.2%上升至70.7%,S期细胞从18.2%和17.5%下降至12.0%,G2/M期细胞从22.8%和23.8%下降至17.3%,此说明反义hTR基因转染使7901细胞的细胞周期左移,分裂增殖能力下降。7901-ahTR细胞的流式细胞仪DNA直方图上出现了明显的亚二倍体“凋亡峰”,凋亡率为14.1%,较亲本7901细胞的2.6%和7901-neo细胞的3.2%明显增加,说明反义hTR基因转染能诱导7901细胞凋亡,见表1。
, http://www.100md.com
表1 7901细胞和7901-ahTR细胞的细胞周期分布和细胞凋亡率比较
Tab 1 Comparison of distribution of cell cycles and apoptoticrate of 7901-ahTR and 7901 cells
Distribution of cell cycles(%)
Apoptotic rate(%)
G0/G1
S
G2/M
7901
, 百拇医药
59.0
18.2
22.8
2.6
7901-neo
60.2
17.5
23.3
3.2
7901-ahTR
70.7
12.0
17.3
, 百拇医药
14.1
2.8 7901-ahTR细胞在裸鼠体内的致瘤能力
接种1.5×106个7901和7901-neo细胞的裸鼠在1周内全部成瘤,在1.5月观察期内其生长速度和肿瘤大小无明显差异,而3个接种量(1.5×106、3×106和1×107)的7901-ahTR细胞在1.5月的观察期内均未成瘤,说明反义hTR基因转染能使7901细胞的致瘤性丧失。
3 讨论
端粒酶是迄今发现的一个最为广谱特异的肿瘤标志,表达于80%以上的肿瘤组织,与细胞永生化和肿瘤的发生发展有密切关系[3,4,6,7]。此提示端粒酶是肿瘤治疗的较理想靶点。目前人端粒酶的结构与组成已初步明确,它至少包括3个组分:端粒酶RNA(hTR)、TP1蛋白和hEST2/hTRT蛋白,前者作为端粒酶合成端粒DNA的模板,后二者起逆转录酶作用。1995年,Feng等[2]最先证明了反义hTR能下调人宫颈癌Hela细胞的端粒酶活性,导致端粒进行性缩短,经23~26个倍增周期后,细胞增殖停止并死亡。之后的几项研究表明,以hTR为靶点的反义核酸和核酶等可有效地抑制端粒酶活性,且对裸鼠移植瘤有明显的治疗作用[8~10]。最近Kodon等[11](1998)将反义人hTR转染至恶性胶质瘤细胞系U251-MG,发现端粒酶活性明显下降,并使一部分细胞凋亡而另一部分细胞分化,分化的肿瘤细胞致瘤性完全丧失。但反义hTR干预能否使所有的肿瘤细胞(如胃癌细胞)的端粒酶活性下降和恶性表型逆转,目前尚缺乏广泛的研究。因此,我们将反义hTR基因转染至人胃癌细胞系SGC-7901,旨在探讨针对hTR的反义治疗对胃癌细胞恶性表型的影响。结果发现,反义hTR转染后的SGC-7901细胞hTR RNA表达减少、端粒酶活性明显下调,细胞的恶性表型完全逆转,主要表现为细胞生长减慢、细胞周期左移、细胞凋亡增加、接触抑制恢复、软琼脂集落形成能力和裸鼠致瘤能力完全丧失。不像反义hTR基因转染的Hela细胞和U251-MG细胞,7901-ahTR抗性细胞克隆在60个倍增周期内并未出现全部细胞衰老死亡或凋亡现象,说明端粒酶活性下调主要是诱导7901细胞分化而不是衰老或凋亡。尽管下调端粒酶活性对不同细胞生物效应的影响并不相同,但我们的实验结果再一次说明了端粒酶与肿瘤细胞的恶性生物学行为密切相关,干预端粒酶活性将会成为治疗肿瘤的一条新途径。
, 百拇医药
由于hTR也广泛表达于正常组织细胞,针对hTR的反义治疗对正常组织细胞可能会带来一定的副作用。新近研究表明hEST2/hTRT蛋白是端粒酶的催化亚单位,且在组织细胞中的表达量与端粒酶活性相平行,是端粒酶活性的限速者,因此针对hEST2/hTRT的反义治疗比针对hTR的反义治疗可能更有效,本实验室正在开展这方面的研究工作。
基金项目:国家自然科学基金资助项目(39770302)
作者简介:杨金亮(1967-),男,山西省平顺县人,博士研究生,主治医师,主要从事胃癌的免疫和基因治疗方面的研究,发表论文8篇。电话:(023)68754000-73094
作者单位:鲁荣(第三军医大学附属西南医院消化内科,重庆 400038)
刘为纹(第三军医大学附属西南医院消化内科,重庆 400038)
, 百拇医药
参考文献:
[1] Morin G B. The human telomere terminal transferase enzyme is a ribonucleoprotein that synthesize TTAGGG repeats[J]. Cell,1989,59(3):521-529.
[2] Feng J, Funk W D, Wang S S, et al. The RNA component of human telomerase[J]. Science,1995,269(1):1 236-1 241.
[3] 杨仕明,房殿春,罗元辉,等.胃癌及癌前组织端粒酶活性的检测及其临床意义[J].中华医学杂志,1998,78(3):207-211.
[4] Hiyama E, Okoyama T, Tatsumoto N, et al. Telomerase activity in gastric cancer[J]. Cancer Res,1995,55(15):3 258-3 261.
, http://www.100md.com
[5] 鄂 征 主编.组织培养和分子细胞学技术[M].北京:北京出版社,1995.157-158.
[6] Kim N W, Piatyszek M A, Prowse K R, et al. Specific association of human telomerase activity with immortal cells and cancer[J]. Science,1994,266(23):2 011-2 015.
[7] Harley C B, Futcher A B, Greider C W. Telomeres shorten du-ring ageing of human fibroblasts[J]. Nature,1990,345(6 274):458-460.
[8] Mata J C, Joshi S S, Palen B, et al. A hexameric phosphorothioate oligonucleotide telomerase inhibitor arrests growth of Burkitt′s lymphoma cells in vitro and in vivo[J]. Toxicol Appl Pharmacol,1997,144(1):189-197.
, 百拇医药
[9] Norton J C, Iatyszek M A, Wright W E, et al. Inhibition of human telomerase activity by peptide nucleic acids[J]. Nat Biotechnol,1996,14(5):615-619.
[10] Kanazawa Y, Ohkawa K, Ueda K, et al. Hammerhead ribozyme-mediated inhibition of telomerase activity in extracts of human hepatocellular carcinoma cells[J]. Biochem Biophys Res Commun,1996,225(2):570-576.
[11] Kodon S, Tanaka Y, Kondo Y, et al. Antisense telomerase treatment: induction of two distinct pathways, apoptosis and differentiation[J]. FASEB J,1999,12(7):801-811.
收稿日期:2000-01-15;修回日期:2000-03-14, 百拇医药
单位:杨金亮(第三军医大学附属西南医院消化内科,重庆 400038);房殿春(第三军医大学附属西南医院消化内科,重庆 400038);杨仕明(第三军医大学附属西南医院消化内科,重庆 400038);罗元辉(第三军医大学附属西南医院消化内科,重庆 400038);罗昆仑(第三军医大学附属西南医院消化内科,重庆 400038)
关键词:人端粒酶RNA组份(hTR);端粒酶;真核表达载体;基因治疗;反义基因;胃癌细胞系
第三军医大学学报000601
提 要: 目的 探讨反义hTR基因转染对胃癌细胞系SGC-7901恶性表型的逆转作用及其在肿瘤基因治疗中的价值。方法 构建包含端粒重复序列模板区的反义hTR基因真核表达载体,用脂质体法将其转染至胃癌细胞系SGC-7901,比较观察反义hTR基因转染后7901细胞的hTR RNA表达、端粒酶活性、体外生长增殖特性和裸鼠体内致瘤能力的变化。结果 反义hTR基因转染的7901细胞hTR RNA表达和端粒酶活性明显降低、体外生长增殖能力降低、接触抑制恢复、细胞凋亡率增加、软琼脂集落形成能力和裸鼠体内致瘤能力完全消失。结论 反义hTR基因转染能使7901细胞的端粒酶活性明显下调并逆转其恶性表型,提示端粒酶是肿瘤治疗的较理想靶点,端粒酶抑制剂具有良好的临床应用前景。
, 百拇医药
中图法分类号: R735.202;R459.9 文献标识码: A
文章编号:1000-5404(2000)07-0611-04
Antisense human telomerase RNA reverses malignant phenotype of gastric carcinoma cell line SGC-7901
YANG Jin-liang, FANG Dian-chun, YANG Shi-ming, LUO Yuan-hui, LUO Kun-lun, LU Rong, LIU Wei-wen
(Department of Gastroenterology, Southwest Hospital, Third Military Medical University, Chongqing 400038,China)
, 百拇医药
Abstract: Objective To study the effects of the transfection of antisense human telomerase RNA (hTR) on the malignant phenotype of gastric carcinoma cell line SGC-7901 and its potential role in the gene therapy for cancers. Methods An antisense hTR gene eukaryotic expression vector pCL-ahTR including the template region of telomere repeats sequence was constructed with recombinant DNA technique and transfected into the cells of gastric carcinoma cell line SGC-7901 with liposome DOTAP. Then, the expression of hTR and antisense hTR was observed with RT-PCR, telomerase activity with PCR-ELISA, the cell morphology and cellular proliferation capacity with MTT assay and the efficiency of clone formation in soft agar, the cell cycle distribution and the apoptotic state with flow cytometry. The characteristics of the proliferation of SGC-7901 cells in vitro and the tumorigenecity in nude mice were also observed. Results The expression of hTR RNA, the activity of telomerase and the proliferative capacity of antisense hTR gene transfected SGC-7901 cells in vitro were obviously decreased and the apoptotic rate increased. The capability to form clones in soft agar and to develop carcinoma in nude mice totally vanished. Conclusion Our study demonstrated that after the transfection of antisense hTR gene, the telo-merase activity of SGC-7901 cells was obviously down-regulated and their malignant phenotype was reversed, which implies that telomerase is an ideal target in cancer therapy and telomerase inhibitors are promising agents in this aspect.
, 百拇医药
Key words: human telomerase RNA components; telomerase; eukaryotic expression vector; antisense gene; gene therapy; gastric carcinoma; cell line
端粒酶(Telomerase)是由RNA和蛋白质构成的一种特殊的逆转录酶,能催化合成染色体末端的端粒DNA重复序列,以维持染色体的稳定和完整[1]。1995年,Feng等[2]最先克隆了人端粒酶RNA组份(Human telomerase RNA components, hTR)的基因并证明了反义hTR能下调人宫颈Hela癌细胞的端粒酶活性,导致端粒进行性缩短,经23~26个倍增周期后,细胞增殖停止并死亡。这一研究为人们提供了干预端粒酶活性治疗肿瘤的新思路。胃癌组织的端粒酶阳性率高达90%,且与肿瘤恶性程度和预后密切相关[3,4]。为此,我们构建了反义hTR真核表达载体,将其转染至SGC-7901胃癌细胞,探讨了反义hTR对SGC-7901胃癌细胞恶性生物学行为的影响。
, 百拇医药
1 材料与方法
1.1 载体构建 包含成熟hTR cDNA的pGRN83克隆载体由美国Geron公司惠赠,真核表达载体pCL-neo购自Promega。用MluⅠ和SalⅠ限制性内切酶从pGRN83上切长约579 bp的hTR片段,反向插入pCL-neo表达载体,将连接产物转化JM109大肠杆菌(氯化钙法),少量提取质粒酶切鉴定,并经测序确认。
1.2 细胞培养
SGC-7901细胞培养于含10%灭活的小牛血清、100μg/ml链霉素、100U/ml青霉素的RPMI1640培养液中,培养条件为37℃、5%CO2、饱和湿度,每隔2~3d用0.25%胰酶/0.02%EDTA消化,以1∶3~1∶5传代1次。
1.3 基因转染 采用DOTAP脂质体(BoehringerMannheim),转染过程按试剂说明书进行。转染后48h将细胞以1∶5传代,加G418400μg/ml进行筛选,约2周左右抗性细胞克隆形成,在200μg/mlG418的选择压力下进行扩大培养,并冻存保种。反义hTR基因转染的7901细胞命名为7901-ahTR,空载体pCL-neo转染的7901细胞命名为7901-neo。
, 百拇医药
1.4 RT-PCR法鉴定转基因细胞的hTRRNA表达 RNA提取用Tripure试剂(Boehringermannheim)按说明书进行。RT-PCR采用一步一管法(AcessRT-PCRsystem,Promega)。hTR引物为P1:5′-TCTAACCCTAACTGAGAAGGGCGTAG-3′;P2:5′-GTTTGCTCTAGAATGAACGGTGGAAG-3′,扩增片段长度为126bp。扩增正义hTR时先加上游引物P1,反转录后再加下游引物P2进行PCR扩增;扩增反义hTR时先加下游引物P2,反转录后再加上游引物P1进行PCR扩增。GAPDH引物(作为外参照)为P1:5′-CCACCCATGGCAAATTCCATGGCA-3′,P2:5′-TCTAGACGGCAGGTCAGGTCCAC-3′,扩增片段长度为598bp。反应体系为:总体积25μl、dNTP0.2mmol/L,上下游引物各1mmol/L、MgSO41mmol/L、AMV逆转录酶0.1U/ml、TflDNA聚合酶0.1U/ml、1×反应缓冲液、RNA模板100ng、扩增条件为48℃,45min→94℃,2min→94℃,30s;60℃,40s;68℃,1min;40cycles→68℃,7min。取3~6μl扩增产物行2%琼脂糖凝胶电泳,紫外灯下观察并拍照。
, 百拇医药
1.5 端粒酶活性测定 采用TelomerasePCR-ELISA半定量法(试剂盒购自Boehringermannheim),按说明书标准程序进行。
1.6 细胞形态学观察 倒置显微镜下常规和HE染色比较观察SGC-7901细胞和反义hTR转染的SGC-7901细胞在大小、形态及生长方式上的差别。
1.7 细胞生长增殖能力测定 用MTT法测定细胞增殖能力。
1.8 细胞周期和细胞凋亡测定 收集对数生长期细胞,PBS漂洗后,70%冷乙醇固定24h以上,碘丙啶(PI)染色,采用流式细胞仪(FACS420)检测细胞各期的分布和细胞凋亡率。
1.9 软琼脂集落形成实验 参照文献[5]进行。
1.10 裸鼠致瘤能力观察 4周龄Balb/c裸鼠,雌性,分3组(3只/组),分别于左右侧背部皮下注射1.5×106个SGC-7901和7901-neo细胞、1.5×106个SGC-7901和7901-ahTR细胞、3×106和1×107个7901-ahTR细胞,观察肿瘤出现时间、生长速度、肿瘤大小及小鼠存活期。
, 百拇医药
2 结果
2.1 hTR反义真核表达载体(pCL-ahTR)的构建和鉴定 用MluⅠ和SalⅠ从pGRN83上切下长约579bp的hTRcDNA片段,定向连入pCL-neo载体的XhoⅠ/MluⅠ酶切位点上(XhoⅠ与SalⅠ酶切后的末端为匹配粘性末端),将连接产物转化大肠杆菌,抽提质粒,经PstⅠ、HindⅢ等酶切鉴定、所得片段与理论设计值完全符合,测序结果同报道的hTRcDNA序列一致,见图1。

图1 质粒pGRN83和pCL-ahTR酶切鉴定图谱
Fig 1 Restriction endonuclease map of pGRN83 and pCL-ahTR
1:pGRN83/MluⅠ and salⅠ digested(3.0 kb+0.58 kb);2:λDNA/HindⅢ marker;3:pCL-ahTR/PstⅠ digested(3.67 kb+2.38 kb);4:pCL-neo/PstⅠdigested(3.67 kb+1.81 kb)
, http://www.100md.com
2.2 7901-ahTR细胞反义hTR RNA的表达和hTR RNA表达水平的变化
7901-ahTR细胞有反义hTR RNA的表达,其正义hTR RNA表达水平较未转染细胞和转染对照质粒pCL-neo的细胞明显降低,见图2。

图2 hTR RT-PCR结果
Fig 2 Results of hTR RT-PCR
1:7901-ahTR cells/hTR RNA;2:7901-ahTR cells/antisense hTR RNA;3:7901-neo cells/hTR RNA;4:7901 cells/hTR RNA;5:PCR marker
, 百拇医药 2.3 反义hTR基因转染对7901细胞端粒酶活性的影响
反义hTR基因转染的7901细胞端粒酶活性明显下调,较父系7901细胞和空载体转染7901细胞的端粒酶活性下调了约2/3,见图3。

图3 7901-ahTR和7901细胞的端粒酶活性比较
Fig 3 Comparison of telomerase activity in 7901-ahTRcells and parent 7901 cells
2.4 反义hTR基因转染对7901细胞体外生长增殖特性的影响
反义hTR基因转染的7901细胞体积略有增大、呈圆形或梭形、轮廓清楚、核浆比例减少、瘤巨细胞减少、异形性降低,且7901-ahTR细胞只能呈单层生长,在长至100%汇合后恢复接触抑制和密度抑制,此后细胞分裂增殖速度显著降低,细胞容易脱壁、老化甚至死亡;而相应7901细胞和转染对照质粒pCL-neo的细胞大小形状不一、核深染不规则、瘤巨细胞较多,能叠加甚至悬浮成团生长,丧失了接触抑制和密度抑制的特性。
, http://www.100md.com
2.5 反义hTR基因转染对7901细胞体外增殖能力的影响
7901-ahTR细胞较7901和7901-neo细胞的生长速度明显减慢,尤其是在达到对数生长期后,见图4。

图4 7901和7901-ahTR细胞体外增殖能力比较
Fig 4 Comparison of cellular proliferation capacity of
7901-ahTR cells and parent 7901 cells in vitro
2.6 反义hTR基因转染对7901细胞软琼脂克隆形成能力的影响
, 百拇医药
亲本7901细胞和7901-neo细胞均能在软琼脂固体培养基中形成较大的集落,其集落形成率分别为10%和8.5%,而反义hTR基因转染的7901细胞在软琼脂培养基上不能形成克隆,说明反义hTR基因转染使7901 克隆形成能力降低或丧失。
2.7 反义hTR基因转染对7901细胞的细胞周期和细胞凋亡的影响
反义hTR基因转染的7901细胞和亲本及空载体转染的7901细胞相比,G0/G1期细胞从59.0%和60.2%上升至70.7%,S期细胞从18.2%和17.5%下降至12.0%,G2/M期细胞从22.8%和23.8%下降至17.3%,此说明反义hTR基因转染使7901细胞的细胞周期左移,分裂增殖能力下降。7901-ahTR细胞的流式细胞仪DNA直方图上出现了明显的亚二倍体“凋亡峰”,凋亡率为14.1%,较亲本7901细胞的2.6%和7901-neo细胞的3.2%明显增加,说明反义hTR基因转染能诱导7901细胞凋亡,见表1。
, http://www.100md.com
表1 7901细胞和7901-ahTR细胞的细胞周期分布和细胞凋亡率比较
Tab 1 Comparison of distribution of cell cycles and apoptoticrate of 7901-ahTR and 7901 cells
Distribution of cell cycles(%)
Apoptotic rate(%)
G0/G1
S
G2/M
7901
, 百拇医药
59.0
18.2
22.8
2.6
7901-neo
60.2
17.5
23.3
3.2
7901-ahTR
70.7
12.0
17.3
, 百拇医药
14.1
2.8 7901-ahTR细胞在裸鼠体内的致瘤能力
接种1.5×106个7901和7901-neo细胞的裸鼠在1周内全部成瘤,在1.5月观察期内其生长速度和肿瘤大小无明显差异,而3个接种量(1.5×106、3×106和1×107)的7901-ahTR细胞在1.5月的观察期内均未成瘤,说明反义hTR基因转染能使7901细胞的致瘤性丧失。
3 讨论
端粒酶是迄今发现的一个最为广谱特异的肿瘤标志,表达于80%以上的肿瘤组织,与细胞永生化和肿瘤的发生发展有密切关系[3,4,6,7]。此提示端粒酶是肿瘤治疗的较理想靶点。目前人端粒酶的结构与组成已初步明确,它至少包括3个组分:端粒酶RNA(hTR)、TP1蛋白和hEST2/hTRT蛋白,前者作为端粒酶合成端粒DNA的模板,后二者起逆转录酶作用。1995年,Feng等[2]最先证明了反义hTR能下调人宫颈癌Hela细胞的端粒酶活性,导致端粒进行性缩短,经23~26个倍增周期后,细胞增殖停止并死亡。之后的几项研究表明,以hTR为靶点的反义核酸和核酶等可有效地抑制端粒酶活性,且对裸鼠移植瘤有明显的治疗作用[8~10]。最近Kodon等[11](1998)将反义人hTR转染至恶性胶质瘤细胞系U251-MG,发现端粒酶活性明显下降,并使一部分细胞凋亡而另一部分细胞分化,分化的肿瘤细胞致瘤性完全丧失。但反义hTR干预能否使所有的肿瘤细胞(如胃癌细胞)的端粒酶活性下降和恶性表型逆转,目前尚缺乏广泛的研究。因此,我们将反义hTR基因转染至人胃癌细胞系SGC-7901,旨在探讨针对hTR的反义治疗对胃癌细胞恶性表型的影响。结果发现,反义hTR转染后的SGC-7901细胞hTR RNA表达减少、端粒酶活性明显下调,细胞的恶性表型完全逆转,主要表现为细胞生长减慢、细胞周期左移、细胞凋亡增加、接触抑制恢复、软琼脂集落形成能力和裸鼠致瘤能力完全丧失。不像反义hTR基因转染的Hela细胞和U251-MG细胞,7901-ahTR抗性细胞克隆在60个倍增周期内并未出现全部细胞衰老死亡或凋亡现象,说明端粒酶活性下调主要是诱导7901细胞分化而不是衰老或凋亡。尽管下调端粒酶活性对不同细胞生物效应的影响并不相同,但我们的实验结果再一次说明了端粒酶与肿瘤细胞的恶性生物学行为密切相关,干预端粒酶活性将会成为治疗肿瘤的一条新途径。
, 百拇医药
由于hTR也广泛表达于正常组织细胞,针对hTR的反义治疗对正常组织细胞可能会带来一定的副作用。新近研究表明hEST2/hTRT蛋白是端粒酶的催化亚单位,且在组织细胞中的表达量与端粒酶活性相平行,是端粒酶活性的限速者,因此针对hEST2/hTRT的反义治疗比针对hTR的反义治疗可能更有效,本实验室正在开展这方面的研究工作。
基金项目:国家自然科学基金资助项目(39770302)
作者简介:杨金亮(1967-),男,山西省平顺县人,博士研究生,主治医师,主要从事胃癌的免疫和基因治疗方面的研究,发表论文8篇。电话:(023)68754000-73094
作者单位:鲁荣(第三军医大学附属西南医院消化内科,重庆 400038)
刘为纹(第三军医大学附属西南医院消化内科,重庆 400038)
, 百拇医药
参考文献:
[1] Morin G B. The human telomere terminal transferase enzyme is a ribonucleoprotein that synthesize TTAGGG repeats[J]. Cell,1989,59(3):521-529.
[2] Feng J, Funk W D, Wang S S, et al. The RNA component of human telomerase[J]. Science,1995,269(1):1 236-1 241.
[3] 杨仕明,房殿春,罗元辉,等.胃癌及癌前组织端粒酶活性的检测及其临床意义[J].中华医学杂志,1998,78(3):207-211.
[4] Hiyama E, Okoyama T, Tatsumoto N, et al. Telomerase activity in gastric cancer[J]. Cancer Res,1995,55(15):3 258-3 261.
, http://www.100md.com
[5] 鄂 征 主编.组织培养和分子细胞学技术[M].北京:北京出版社,1995.157-158.
[6] Kim N W, Piatyszek M A, Prowse K R, et al. Specific association of human telomerase activity with immortal cells and cancer[J]. Science,1994,266(23):2 011-2 015.
[7] Harley C B, Futcher A B, Greider C W. Telomeres shorten du-ring ageing of human fibroblasts[J]. Nature,1990,345(6 274):458-460.
[8] Mata J C, Joshi S S, Palen B, et al. A hexameric phosphorothioate oligonucleotide telomerase inhibitor arrests growth of Burkitt′s lymphoma cells in vitro and in vivo[J]. Toxicol Appl Pharmacol,1997,144(1):189-197.
, 百拇医药
[9] Norton J C, Iatyszek M A, Wright W E, et al. Inhibition of human telomerase activity by peptide nucleic acids[J]. Nat Biotechnol,1996,14(5):615-619.
[10] Kanazawa Y, Ohkawa K, Ueda K, et al. Hammerhead ribozyme-mediated inhibition of telomerase activity in extracts of human hepatocellular carcinoma cells[J]. Biochem Biophys Res Commun,1996,225(2):570-576.
[11] Kodon S, Tanaka Y, Kondo Y, et al. Antisense telomerase treatment: induction of two distinct pathways, apoptosis and differentiation[J]. FASEB J,1999,12(7):801-811.
收稿日期:2000-01-15;修回日期:2000-03-14, 百拇医药