经气道应用脂质体前列腺素E1对大鼠油酸型肺损伤的影响*
作者:潘雪蓉1 杜晓燕2 龚永生3 郑绿珍1 胡良冈3 蒋仲荪3 范小芳3 毕丽岩3
单位:1 温州医学院病理生理学教研室(325000); 2 温州医学院耳鼻咽喉科教研室(325000); 3 温州医学院肺心病研究室(325000)
关键词:
温州医学院学报990116 我们曾报道了从气道内给予脂质体携载前列腺素E1(L-PGE1)能有效地减轻油酸所致的大鼠急性肺损伤[1]。为探讨其作用机理,我们观察了肺组织髓过氧化酶(MPO)与丙二醛(MDA)含量的变化,现报告如下。
1 材料、方法和结果
, 百拇医药
1.1 实验方法及操作过程:按我们先前报道的进行[1]。
1.2 实验分组 健康雄性Wistar大鼠40只,体重150~200克,随机均分成五组:①正常对照组(NC),用生理盐水作对照;②油酸对照组(OA-C),油酸损伤后,气道内给予生理盐水作对照;③游离PGE1组(OA-F),气道内给予未经脂质体携载的PGE1;④空白脂质体组(OA-P),给予不含PGE1的脂质体;⑤L-PGE1组(OA-L)。
1.3 肺组织MPO活性测定 取肺组织约100mg,加1ml冰0.5%十六烷基三甲基溴化铵(HTAB)-磷酸缓冲液(50mM,pH6.0),低速匀浆(4,000r/min10sec)后离心(12,000r/min,20min,4℃),留上清测MPO。MPO用联大茴香胺盐酸盐(O-dianisidine chloride)法测定[2],结果以每克组织所含MPO的量表示。
, 百拇医药
1.4 肺组织MDA的测定 取约200mg肺组织,加2ml磷酸盐缓冲液(50mM,pH6.0)匀浆(13 500r/min,15s×3),匀浆液用铜网过滤后,用硫代巴比妥酸法测定匀浆液的MDA,以每克组织所含MDA的量表示。
1.5 统计学分析 用ANOVA法及组间q检验。
1.6 结果 油酸损伤后肺组织的MPO活性与MDA含量明显增加,OA-C组为29±5u/g,组织与73±9nmol/g组织,而NC组为11±3u/g组织与36±5nmol/g组织(P<0.01),游离的PGE1与脂质体携载的PGE1都使MPO活性与MDA含量降低(P<0.05,P<0.01),但后者的作用强于前者(P<0.05)。而空白脂质体的作用不明显(P>0.05)。结果见表1。
表1 各组MPO活性和MDA含量(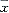 ±s) 组别
±s) 组别
, http://www.100md.com
n
MPO(u/g)
MDA(nmol/g)
NC组
8
11±3
36±5
OA-C组
8
29±5△△
73±9△△
OA-P组
, http://www.100md.com
8
26±5
71±10
OA-F组
8
23±4*
61±10*
OA-L组
8
17±6**#
50±8**#
注:与NC组相比:△△P<0.01,与OA-C组相比:*P<0.05,**P<0.01,与OA-F组相比:#P<0.05
, 百拇医药
2 讨论
油酸引起的急性肺损伤,因其形态和机能的改变与成人呼吸窘迫综合征(ARDS)相似,已被作为ARDS的实验模型之一。ARDS的发病机制很复杂,大量实验表明[3],与中性粒细胞在肺内聚集、释放氧自由基而引发的脂质过氧化损伤有关。MPO的活性可反映中性粒细胞聚集的程度[2]。本实验发现油酸致肺组织MPO活性明显增加,MDA含量显著提高,说明油酸损伤时,肺内中性粒细胞扣留、激活、释放氧自由基增加。
近年来,ARDS发病机制的研究进展,认为和NO与氧自由基形成的过氧化亚硝酸根后者再进一步分解活性更强的OH、N2O4、N2O3,导致细胞氧化损伤,以及NO气体吸入疗法在ARDS治疗上应用的展开,从而NO与氧自由基关系得到广泛关注[4]。
, http://www.100md.com NO吸入可选择性降低肺血管阻力,改善肺通气—灌流比例,提高血氧改善分流,但又存在NO的毒理和安全性问题。这一问题的本质是NO的具有抗氧化和强氧化作用,双重生物效应。
NO与超氧阴离子自由基在体内迅速形成过氧化亚硝酸根,过氧化亚硝酸根本身是一个强氧化剂,而且还可进一步形成毒性更强的羟自由基等,而适度的NO则可消除超氧阴离子的毒性作用,形成的少量过氧化亚硝根,通过质子重排,生成硝酸根,从尿中排出,而发挥NO生理效应。大量的强氧化剂过氧化亚硝酸根,是在NO及氧自由基增加的条件下形成的。我们的实验表明,应用脂质体前列腺素,消除了局部氧自由基,可减轻油酸型大鼠肺的氧化损伤,从另一侧面说明了这一问题。关于,此时过氧化亚硝根的含量改变情况,值得进一步探讨。
PGE1有抑制中性粒细胞聚集、减少氧自由基产生的作用[5]。脂质体作为药物载体能增强PGE1的生物效应[6]。Leff等的研究表明静脉内应用L-PGE1能减轻白细胞介素-1引起的急性肺损伤[7]。但静脉内给予L-PGE1不易有效地聚集在特定的靶器官,易被肝脾及网状内皮细胞系统所清除的特点,使人们试图从局部给药以提高疗效。我们的实验证明,从气道内局部给予L-PGE1有抑制中性粒细胞在肺内聚集,从而减轻脂质过氧化损伤的作用。结合我们先前实验[1]所发现的L-PGE1有减轻油酸致大鼠肺血管内皮细胞与肺Ⅱ型上皮细胞损伤的作用及降低肺水肿程度,说明L-PGE1保护作用的机制与其抗脂质过氧化损伤有关。
, http://www.100md.com
*温州医学院科研发展基金项目
3 参考文献
[1] 龚永生,李 夏,吴东红等.经气道应用脂质体携载前列腺素E1减轻油酸型大鼠肺损伤.温州医学院学报,1998,28(2)∶91
[2] Goldblum SE,Wu Kuei-Meng,Jay M.Lung myeloperoxidase as a measure of pulmonary leukostasis in rabbits.J Appl Physiol,1985,59(6)∶1978
[3] 景有伶,杨秋,郑俊国等.山莨菪碱对油酸致兔急性肺损伤的防治作用.中国危重病急救医学,1997,9(1)∶2
[4] 钟慈声,孙安阳.一氧化氮的生物医学.上海:上海医科大学出版社,1997.102
, http://www.100md.com
[5] 汪建新,黄念秋,赵中苏等.前列腺素E1对内毒素所致家兔损伤保护作用的实验研究.解放军医学杂志,1995,20∶36
[6] Scheffler P,Gross J,Markwirth T,et al.Progress in the prostaglandin E1 therapy of the intermittent claudication by means of bolous injection of LIPO-prostaglandin E1 (LIPO-PGE1).Eur J Clin Pharmacet,1996,51(3~4)∶239
[7] Leff JA,Bea JW,Kirkman JM,et al.Liposome-entrapped PGE1 posttreatment decreases IL-1 alpha-induced neutrophil accumulation and lung leuk in rats.J Appl Physiol,1994,76(1)∶151
(收稿:1998-06-17,修回:1998-09-10), 百拇医药(潘雪蓉1 杜晓燕2 龚永生3 郑绿珍1 胡良冈3 蒋仲荪3 范小芳3 毕丽岩3)
单位:1 温州医学院病理生理学教研室(325000); 2 温州医学院耳鼻咽喉科教研室(325000); 3 温州医学院肺心病研究室(325000)
关键词:
温州医学院学报990116 我们曾报道了从气道内给予脂质体携载前列腺素E1(L-PGE1)能有效地减轻油酸所致的大鼠急性肺损伤[1]。为探讨其作用机理,我们观察了肺组织髓过氧化酶(MPO)与丙二醛(MDA)含量的变化,现报告如下。
1 材料、方法和结果
, 百拇医药
1.1 实验方法及操作过程:按我们先前报道的进行[1]。
1.2 实验分组 健康雄性Wistar大鼠40只,体重150~200克,随机均分成五组:①正常对照组(NC),用生理盐水作对照;②油酸对照组(OA-C),油酸损伤后,气道内给予生理盐水作对照;③游离PGE1组(OA-F),气道内给予未经脂质体携载的PGE1;④空白脂质体组(OA-P),给予不含PGE1的脂质体;⑤L-PGE1组(OA-L)。
1.3 肺组织MPO活性测定 取肺组织约100mg,加1ml冰0.5%十六烷基三甲基溴化铵(HTAB)-磷酸缓冲液(50mM,pH6.0),低速匀浆(4,000r/min10sec)后离心(12,000r/min,20min,4℃),留上清测MPO。MPO用联大茴香胺盐酸盐(O-dianisidine chloride)法测定[2],结果以每克组织所含MPO的量表示。
, 百拇医药
1.4 肺组织MDA的测定 取约200mg肺组织,加2ml磷酸盐缓冲液(50mM,pH6.0)匀浆(13 500r/min,15s×3),匀浆液用铜网过滤后,用硫代巴比妥酸法测定匀浆液的MDA,以每克组织所含MDA的量表示。
1.5 统计学分析 用ANOVA法及组间q检验。
1.6 结果 油酸损伤后肺组织的MPO活性与MDA含量明显增加,OA-C组为29±5u/g,组织与73±9nmol/g组织,而NC组为11±3u/g组织与36±5nmol/g组织(P<0.01),游离的PGE1与脂质体携载的PGE1都使MPO活性与MDA含量降低(P<0.05,P<0.01),但后者的作用强于前者(P<0.05)。而空白脂质体的作用不明显(P>0.05)。结果见表1。
表1 各组MPO活性和MDA含量(
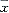 ±s) 组别
±s) 组别, http://www.100md.com
n
MPO(u/g)
MDA(nmol/g)
NC组
8
11±3
36±5
OA-C组
8
29±5△△
73±9△△
OA-P组
, http://www.100md.com
8
26±5
71±10
OA-F组
8
23±4*
61±10*
OA-L组
8
17±6**#
50±8**#
注:与NC组相比:△△P<0.01,与OA-C组相比:*P<0.05,**P<0.01,与OA-F组相比:#P<0.05
, 百拇医药
2 讨论
油酸引起的急性肺损伤,因其形态和机能的改变与成人呼吸窘迫综合征(ARDS)相似,已被作为ARDS的实验模型之一。ARDS的发病机制很复杂,大量实验表明[3],与中性粒细胞在肺内聚集、释放氧自由基而引发的脂质过氧化损伤有关。MPO的活性可反映中性粒细胞聚集的程度[2]。本实验发现油酸致肺组织MPO活性明显增加,MDA含量显著提高,说明油酸损伤时,肺内中性粒细胞扣留、激活、释放氧自由基增加。
近年来,ARDS发病机制的研究进展,认为和NO与氧自由基形成的过氧化亚硝酸根后者再进一步分解活性更强的OH、N2O4、N2O3,导致细胞氧化损伤,以及NO气体吸入疗法在ARDS治疗上应用的展开,从而NO与氧自由基关系得到广泛关注[4]。
, http://www.100md.com NO吸入可选择性降低肺血管阻力,改善肺通气—灌流比例,提高血氧改善分流,但又存在NO的毒理和安全性问题。这一问题的本质是NO的具有抗氧化和强氧化作用,双重生物效应。
NO与超氧阴离子自由基在体内迅速形成过氧化亚硝酸根,过氧化亚硝酸根本身是一个强氧化剂,而且还可进一步形成毒性更强的羟自由基等,而适度的NO则可消除超氧阴离子的毒性作用,形成的少量过氧化亚硝根,通过质子重排,生成硝酸根,从尿中排出,而发挥NO生理效应。大量的强氧化剂过氧化亚硝酸根,是在NO及氧自由基增加的条件下形成的。我们的实验表明,应用脂质体前列腺素,消除了局部氧自由基,可减轻油酸型大鼠肺的氧化损伤,从另一侧面说明了这一问题。关于,此时过氧化亚硝根的含量改变情况,值得进一步探讨。
PGE1有抑制中性粒细胞聚集、减少氧自由基产生的作用[5]。脂质体作为药物载体能增强PGE1的生物效应[6]。Leff等的研究表明静脉内应用L-PGE1能减轻白细胞介素-1引起的急性肺损伤[7]。但静脉内给予L-PGE1不易有效地聚集在特定的靶器官,易被肝脾及网状内皮细胞系统所清除的特点,使人们试图从局部给药以提高疗效。我们的实验证明,从气道内局部给予L-PGE1有抑制中性粒细胞在肺内聚集,从而减轻脂质过氧化损伤的作用。结合我们先前实验[1]所发现的L-PGE1有减轻油酸致大鼠肺血管内皮细胞与肺Ⅱ型上皮细胞损伤的作用及降低肺水肿程度,说明L-PGE1保护作用的机制与其抗脂质过氧化损伤有关。
, http://www.100md.com
*温州医学院科研发展基金项目
3 参考文献
[1] 龚永生,李 夏,吴东红等.经气道应用脂质体携载前列腺素E1减轻油酸型大鼠肺损伤.温州医学院学报,1998,28(2)∶91
[2] Goldblum SE,Wu Kuei-Meng,Jay M.Lung myeloperoxidase as a measure of pulmonary leukostasis in rabbits.J Appl Physiol,1985,59(6)∶1978
[3] 景有伶,杨秋,郑俊国等.山莨菪碱对油酸致兔急性肺损伤的防治作用.中国危重病急救医学,1997,9(1)∶2
[4] 钟慈声,孙安阳.一氧化氮的生物医学.上海:上海医科大学出版社,1997.102
, http://www.100md.com
[5] 汪建新,黄念秋,赵中苏等.前列腺素E1对内毒素所致家兔损伤保护作用的实验研究.解放军医学杂志,1995,20∶36
[6] Scheffler P,Gross J,Markwirth T,et al.Progress in the prostaglandin E1 therapy of the intermittent claudication by means of bolous injection of LIPO-prostaglandin E1 (LIPO-PGE1).Eur J Clin Pharmacet,1996,51(3~4)∶239
[7] Leff JA,Bea JW,Kirkman JM,et al.Liposome-entrapped PGE1 posttreatment decreases IL-1 alpha-induced neutrophil accumulation and lung leuk in rats.J Appl Physiol,1994,76(1)∶151
(收稿:1998-06-17,修回:1998-09-10), 百拇医药(潘雪蓉1 杜晓燕2 龚永生3 郑绿珍1 胡良冈3 蒋仲荪3 范小芳3 毕丽岩3)