混合脐血浆在人脐静脉内皮细胞培养中的应用
作者:李智萍 李金兰 付家瑜 陈珊珊
单位:北京医科大学人民医院血液病研究所,北京 100034
关键词:内皮;血管;生长和发育;人脐静脉;细胞;培养的
990328 摘 要 目的:观察混合脐血浆在人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)培养中的作用。方法: 在含20%(体积分数)混合脐血浆的内皮细胞培养体系中进行HUVEC的原代和传代培养,并对培养细胞进行纯度鉴定。同时用噻唑蓝试验观察不同体积分数的混合脐血浆对HUVEC增殖活力的影响。结果:20%(体积分数)的混合脐血浆对HUVEC培养有明显支持作用,该体系培养的HUVEC经第Ⅷ因子相关抗原(Ⅷ:Ag)和Ⅰ型荆豆凝集素(UEA-Ⅰ)鉴定纯度可达93.1%。结论:20份混合的脐血浆可以代替内皮细胞生长因子成功地用于HUVEC的培养,以获得高纯度可传代的内皮细胞。
, http://www.100md.com
中国图书资料分类法分类号 Q2-33
Effect of mixed umbilical cord blood plasma on the culture
of human umbilical vein endothelial cells
LI Zhi-Ping, LI Jin-Lan, FU Jia-Yu, CHEN Shan-Shan
(Institute of Hematology, People's Hospital, Beijing Medical University, Beijing 100034)
MeSH Endothelium, vascular/growth Umbilical veins Cells, culture
, 百拇医药
ABSTRACT Objective: To observe the effect of mixed umbilical cord blood plasma on the culture of human umbilical vein endothelia cells (HUVEC). Methods: Primary and passaged HUVEC were cultured in the medium with 20% mixed umbilical cord blood plasma and their purities were evaluated by Ⅷ:Ag and UEA-Ⅰ.Proliferative activities of HUVEC were compared in the medium containing different amounts of mixed umbilical cord blood plasma by methyl thiazolyl tetrazolium(MTT) assay. Results: 20% mixed umbilical cord blood plasma can maintain cell viability in the medium without endothelial cell growth factor(ECGF). The purity of endothelial cells was 93.1%. Conclusion: 20-portion-mixed umbilical cord blood plasma can be a substitute for ECGF and used successfully in the culture of HUVEC to obtain high purity and passagable endothelial cells.
, 百拇医药
(J Beijing Med Univ, 1999,31:280-282)
血管内皮具有多种功能,它除了是血液和组织间代谢交换的屏障外,还可以产生和分泌多种生物活性物质,对调节血压和体液平衡具有重要意义。尤其近年来证明内皮细胞可以支持造血[1]。为适应内皮细胞的研究需要,自从1973年Jaffe等[2]首先成功地在体外培养人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)以来,由于HUVEC来源充足,取材、操作方便,已成为内皮细胞体外试验的主要材料。HUVEC的传代培养必需加用内皮细胞生长因子(endothelial cell growth factor, ECGF),但其价格昂贵。本文应用混合脐血浆支持HUVEC的体外培养获得成功,并对培养细胞进行纯度鉴定。同时观察了不同体积分数的混合脐血浆对HUVEC增殖活力的影响。
1 材料与方法
, 百拇医药
1.1 混合脐血浆的制备
脐血采自健康产妇所生正常足月新生儿。胎盘娩出前无菌收集脐血,肝素(25U.ml-1)抗凝,400g离心20min,分离血浆,-20℃冻存。将分离的20份脐血浆混合,0.45μm和0.22μm微孔滤膜过滤,分装后-20℃保存备用。
1.2 HUVEC的培养
按Jaffe等[2]方法稍加改进。无菌条件下取健康产妇的胎儿脐带,如不立即培养可于脐带保存液中4℃保存(不超过24h)。剪除破损或有夹痕及血肿部分。脐静脉一端插入三通管并结扎。无钙、镁Hanks液(D-Hanks液)冲净脐静脉内的残血。脐静脉另一端也插入三通管并结扎,注入D-Hanks液充满血管,检察无外漏后,放出D-Hanks液,注入2.5g.L-1胰蛋白酶使血管充盈,37℃水浴中孵育8~10min。将细胞-酶液流入加有2ml小牛血清(FCS)的50ml离心管中,1000 r.min-1离心10min。再用含10%(体积分数)FCS的RPMI 1640洗涤1次,台盼蓝染色计数后接种于铺有10g.L-1明胶的35mm培养皿。培养体系为RPMI1640含10%(体积分数)FCS、20%(体积分数)混合脐血浆。37℃、5%(体积分数)CO2培养24h后换液去除红细胞和其它未粘附细胞。随后每周换液两次,直至细胞生长成单层。本实验中7~8d原代培养的细胞可以达到80%~90%汇合,用0.5g.L-1胰蛋白酶-0.2g.L-1 EDTA室温消化30~40s进行传代培养。
, http://www.100md.com
1.3 内皮细胞的鉴定
1.3.1 间接免疫荧光法检测第Ⅷ因子相关抗原(Ⅷ:Ag)细胞爬片经40g.L-1多聚甲醛固定后,与Ⅷ:Ag兔抗血清(上海生物制品研究所)37℃孵育30min,PBS洗涤后,再与羊抗兔IgG-FITC孵育30 min,荧光显微镜下观察结果。阴性对照用PBS代替兔抗血清。
1.3.2 Ⅰ型荆豆凝集素结合率 消化HUVEC呈单细胞悬液,PBS洗涤后,加入终浓度为80mg.L-1的FITC标记的Ⅰ型荆豆凝集素(UEA-I-FITC,Sigma),室温避光反应30min,PBS洗涤后,流式细胞仪(FCM)(FACStar,美国BD公司)进行检测。阴性对照用PBS代替UEA-I-FITC。
1.4 不同浓度混合脐血浆对HUVEC增殖活力的影响(MTT试验)
, http://www.100md.com
消化HUVEC呈单细胞悬液,用含10%(体积分数)FCS的RPMI 1640洗涤1次,调整细胞浓度至3×105ml-1。以3种培养体系分别含10%(体积分数)FCS、10%(体积分数)FCS加10%(体积分数)混合脐血浆、10%(体积分数)FCS加20%(体积分数)混合脐血浆,每孔100μl接种于96孔板,每一体系平行接种10孔,分别于24、48、72 h后加入MTT工作液(1g.L-1), 每孔10μl,37℃、5%(体积分数)CO2反应4 h后加入100g.L-1SDS-0.01mol.L-1HCl终止反应,用酶标仪在570nm波长下测定每孔A(光密度)值。
2 结果
, 百拇医药
2.1 HUVEC的形态学观察
倒置显微镜下HUVEC单层生长呈短梭形或鹅卵石样镶嵌排列。原代及传代细胞均具有上述特点(图1)。
图1 HUVEC的形态学观察×100
Figue 1 The morphology of HUVEC×100
2.2 Ⅷ:Ag检测
原代及传代细胞均呈阳性反应而对照为阴性。
FCM检测UEA-Ⅰ阳性率为93.1%(图2)。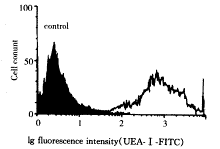
, http://www.100md.com
lg fluorescence intensity(UEA-Ⅰ-FITC).
图2 FCM检测HUVEC的UEA-Ⅰ阳性率
Figure 2 The binding rate of cultured HUVEC
and UEA-Ⅰ detected by FCM
2.3 混合脐血浆对HUVEC培养的影响
我们共进行了60次HUVEC原代培养,其中10次培养体系中未加脐血浆,均未能培养成功。在传代培养中如不用脐血浆,细胞生长缓慢,无法形成单细胞层,最后细胞脱落悬浮死亡。而加入混合脐血浆的HUVEC能较好地传代。另外,混合脐血浆的份数也影响内皮细胞的生长,应用8份混合的脐血浆,10次原代培养仅1次成功,而20份混合者10次原代培养有9次成功,表明脐血浆之间存在批间差异,多份混合方能消除此种差异。2.4 不同浓度的混合脐血浆对HUVEC增殖的影响
, http://www.100md.com
MTT试验结果表明不同浓度的混合脐血浆对HUVEC的增殖活力有不同影响。如表1所示,在不含混合脐血浆的培养体系中培养24h,HUVEC的活力即有减低(P<0.05), 此时低体积分数(10%)的混合脐血浆尚能维持其活力。至48h 10%(体积分数)混合脐血浆已不足以维持其活力。只有20%(体积分数)的混合脐血浆才能维持HUVEC的活力至72h。
表1 不同体积分数的混合脐血浆
对HUVEC增殖活力的影响(A570,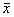 ±s, n=10)
±s, n=10)
Table 1 The effects of cord blood plasma of different
volume fraction on the proliferation of HUVEC(A570,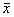 ±s, n=10) Groups
±s, n=10) Groups
, 百拇医药
t/h
24
48
72
10%FCS
0.065±0.003
0.046±0.005
0.038±0.004
10%FCS+
10%CBP
0.095±0.004*
0.070±0.008
, 百拇医药
0.065±0.004
10%FCS+
20%CBP
0.098±0.005*
0.111±0.005**
0.109±0.005**
*P<0.05, **P<0.01, compared with 10%FCS.
3 讨论
脐带血浆富含各种造血生长因子,已被用于造血祖细胞体外集落培养和CD34+细胞的体外扩增[3,4]。文献中有将正常人混合血清或肝素抗凝的混合血浆用于HUVEC培养的报道[5]。但脐血浆在HUVEC培养中的应用, 目前尚未见报道。我们试用混合脐血浆代替内皮细胞生长因子,能很好地支持HUVEC的原代及传代培养,说明脐血浆中含有一些能刺激内皮细胞生长的因子。由于脐血浆之间存在批间差异,必需多份混合。我们的经验是20份以上的混合脐血浆可以成功地用于HUVEC的培养。MTT试验结果表明,混合脐血浆达到20%(体积分数)时才能维持HUVEC的增殖活力,我们的经验表明,20%~30%的混合脐血浆能较好地用于HUVEC的传代培养。
, 百拇医药
Ⅷ:Ag兔抗血清可以检测内皮细胞胞浆内的Ⅷ:Ag,UEA-Ⅰ则能与内皮细胞表面的岩藻糖结合,两种方法均为目前公认的鉴定内皮细胞的可靠方法[6]。结果证明以上培养方法所获的内皮细胞纯度可达93.1%。
本实验证明,脐带血浆来源方便、经济,多份混合的脐血浆可以代替内皮细胞生长因子以获得纯度较高的可传代的人脐带血管内皮细胞供实验研究应用。
参考文献
1 Zini JM,Ternaux B,Rocha V, et al. Isolation of CD34+ cells is not essential for ex-vivo expansion of cord blood cells: Impact of coculture with umbilical vein endothelial cells(HUVEC).Blood, 1997,90/10 Suppl Ⅰ:176b
, http://www.100md.com
2 Jaffe EA,Nachman RL,Becker CG, et al. Culture of human endothelial cells derived from umbilical cord veins: Identification by morphologic and immunologic criteria. J Clin Invest, 1973,52:2745-2756
3 Carow CE,Hangoc G,Broxmeyer HE. Human multipotential progenitor cells(CFU-GEMM) have extensive replating capacity for secondary CFU-GEMM: an effect enhanced by cord blood plasma. Blood, 1993,81:942-949
4 张林生,王逸兰,陆道培.脐血血浆支持造血祖细胞体外集落培养的研究.实验血液学杂志, 1996,4:87-91
, 百拇医药
5 盛立民.血管内皮细胞与疾病.上海:上海医科大学出版社, 1993.206
6 Schweitzer KM, Vicart P, Delouis C, et al. Characterization of a newly established human bone marrow endothelial cell line: Distinct adhesive properties for hematopoietic progenitors compared with human umbilical vein endothelial cells. Lab Invest, 1997, 76:25-36
(1998-06-30收稿), 百拇医药
单位:北京医科大学人民医院血液病研究所,北京 100034
关键词:内皮;血管;生长和发育;人脐静脉;细胞;培养的
990328 摘 要 目的:观察混合脐血浆在人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)培养中的作用。方法: 在含20%(体积分数)混合脐血浆的内皮细胞培养体系中进行HUVEC的原代和传代培养,并对培养细胞进行纯度鉴定。同时用噻唑蓝试验观察不同体积分数的混合脐血浆对HUVEC增殖活力的影响。结果:20%(体积分数)的混合脐血浆对HUVEC培养有明显支持作用,该体系培养的HUVEC经第Ⅷ因子相关抗原(Ⅷ:Ag)和Ⅰ型荆豆凝集素(UEA-Ⅰ)鉴定纯度可达93.1%。结论:20份混合的脐血浆可以代替内皮细胞生长因子成功地用于HUVEC的培养,以获得高纯度可传代的内皮细胞。
, http://www.100md.com
中国图书资料分类法分类号 Q2-33
Effect of mixed umbilical cord blood plasma on the culture
of human umbilical vein endothelial cells
LI Zhi-Ping, LI Jin-Lan, FU Jia-Yu, CHEN Shan-Shan
(Institute of Hematology, People's Hospital, Beijing Medical University, Beijing 100034)
MeSH Endothelium, vascular/growth Umbilical veins Cells, culture
, 百拇医药
ABSTRACT Objective: To observe the effect of mixed umbilical cord blood plasma on the culture of human umbilical vein endothelia cells (HUVEC). Methods: Primary and passaged HUVEC were cultured in the medium with 20% mixed umbilical cord blood plasma and their purities were evaluated by Ⅷ:Ag and UEA-Ⅰ.Proliferative activities of HUVEC were compared in the medium containing different amounts of mixed umbilical cord blood plasma by methyl thiazolyl tetrazolium(MTT) assay. Results: 20% mixed umbilical cord blood plasma can maintain cell viability in the medium without endothelial cell growth factor(ECGF). The purity of endothelial cells was 93.1%. Conclusion: 20-portion-mixed umbilical cord blood plasma can be a substitute for ECGF and used successfully in the culture of HUVEC to obtain high purity and passagable endothelial cells.
, 百拇医药
(J Beijing Med Univ, 1999,31:280-282)
血管内皮具有多种功能,它除了是血液和组织间代谢交换的屏障外,还可以产生和分泌多种生物活性物质,对调节血压和体液平衡具有重要意义。尤其近年来证明内皮细胞可以支持造血[1]。为适应内皮细胞的研究需要,自从1973年Jaffe等[2]首先成功地在体外培养人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)以来,由于HUVEC来源充足,取材、操作方便,已成为内皮细胞体外试验的主要材料。HUVEC的传代培养必需加用内皮细胞生长因子(endothelial cell growth factor, ECGF),但其价格昂贵。本文应用混合脐血浆支持HUVEC的体外培养获得成功,并对培养细胞进行纯度鉴定。同时观察了不同体积分数的混合脐血浆对HUVEC增殖活力的影响。
1 材料与方法
, 百拇医药
1.1 混合脐血浆的制备
脐血采自健康产妇所生正常足月新生儿。胎盘娩出前无菌收集脐血,肝素(25U.ml-1)抗凝,400g离心20min,分离血浆,-20℃冻存。将分离的20份脐血浆混合,0.45μm和0.22μm微孔滤膜过滤,分装后-20℃保存备用。
1.2 HUVEC的培养
按Jaffe等[2]方法稍加改进。无菌条件下取健康产妇的胎儿脐带,如不立即培养可于脐带保存液中4℃保存(不超过24h)。剪除破损或有夹痕及血肿部分。脐静脉一端插入三通管并结扎。无钙、镁Hanks液(D-Hanks液)冲净脐静脉内的残血。脐静脉另一端也插入三通管并结扎,注入D-Hanks液充满血管,检察无外漏后,放出D-Hanks液,注入2.5g.L-1胰蛋白酶使血管充盈,37℃水浴中孵育8~10min。将细胞-酶液流入加有2ml小牛血清(FCS)的50ml离心管中,1000 r.min-1离心10min。再用含10%(体积分数)FCS的RPMI 1640洗涤1次,台盼蓝染色计数后接种于铺有10g.L-1明胶的35mm培养皿。培养体系为RPMI1640含10%(体积分数)FCS、20%(体积分数)混合脐血浆。37℃、5%(体积分数)CO2培养24h后换液去除红细胞和其它未粘附细胞。随后每周换液两次,直至细胞生长成单层。本实验中7~8d原代培养的细胞可以达到80%~90%汇合,用0.5g.L-1胰蛋白酶-0.2g.L-1 EDTA室温消化30~40s进行传代培养。
, http://www.100md.com
1.3 内皮细胞的鉴定
1.3.1 间接免疫荧光法检测第Ⅷ因子相关抗原(Ⅷ:Ag)细胞爬片经40g.L-1多聚甲醛固定后,与Ⅷ:Ag兔抗血清(上海生物制品研究所)37℃孵育30min,PBS洗涤后,再与羊抗兔IgG-FITC孵育30 min,荧光显微镜下观察结果。阴性对照用PBS代替兔抗血清。
1.3.2 Ⅰ型荆豆凝集素结合率 消化HUVEC呈单细胞悬液,PBS洗涤后,加入终浓度为80mg.L-1的FITC标记的Ⅰ型荆豆凝集素(UEA-I-FITC,Sigma),室温避光反应30min,PBS洗涤后,流式细胞仪(FCM)(FACStar,美国BD公司)进行检测。阴性对照用PBS代替UEA-I-FITC。
1.4 不同浓度混合脐血浆对HUVEC增殖活力的影响(MTT试验)
, http://www.100md.com
消化HUVEC呈单细胞悬液,用含10%(体积分数)FCS的RPMI 1640洗涤1次,调整细胞浓度至3×105ml-1。以3种培养体系分别含10%(体积分数)FCS、10%(体积分数)FCS加10%(体积分数)混合脐血浆、10%(体积分数)FCS加20%(体积分数)混合脐血浆,每孔100μl接种于96孔板,每一体系平行接种10孔,分别于24、48、72 h后加入MTT工作液(1g.L-1), 每孔10μl,37℃、5%(体积分数)CO2反应4 h后加入100g.L-1SDS-0.01mol.L-1HCl终止反应,用酶标仪在570nm波长下测定每孔A(光密度)值。
2 结果
, 百拇医药
2.1 HUVEC的形态学观察
倒置显微镜下HUVEC单层生长呈短梭形或鹅卵石样镶嵌排列。原代及传代细胞均具有上述特点(图1)。

图1 HUVEC的形态学观察×100
Figue 1 The morphology of HUVEC×100
2.2 Ⅷ:Ag检测
原代及传代细胞均呈阳性反应而对照为阴性。
FCM检测UEA-Ⅰ阳性率为93.1%(图2)。

, http://www.100md.com
lg fluorescence intensity(UEA-Ⅰ-FITC).
图2 FCM检测HUVEC的UEA-Ⅰ阳性率
Figure 2 The binding rate of cultured HUVEC
and UEA-Ⅰ detected by FCM
2.3 混合脐血浆对HUVEC培养的影响
我们共进行了60次HUVEC原代培养,其中10次培养体系中未加脐血浆,均未能培养成功。在传代培养中如不用脐血浆,细胞生长缓慢,无法形成单细胞层,最后细胞脱落悬浮死亡。而加入混合脐血浆的HUVEC能较好地传代。另外,混合脐血浆的份数也影响内皮细胞的生长,应用8份混合的脐血浆,10次原代培养仅1次成功,而20份混合者10次原代培养有9次成功,表明脐血浆之间存在批间差异,多份混合方能消除此种差异。2.4 不同浓度的混合脐血浆对HUVEC增殖的影响
, http://www.100md.com
MTT试验结果表明不同浓度的混合脐血浆对HUVEC的增殖活力有不同影响。如表1所示,在不含混合脐血浆的培养体系中培养24h,HUVEC的活力即有减低(P<0.05), 此时低体积分数(10%)的混合脐血浆尚能维持其活力。至48h 10%(体积分数)混合脐血浆已不足以维持其活力。只有20%(体积分数)的混合脐血浆才能维持HUVEC的活力至72h。
表1 不同体积分数的混合脐血浆
对HUVEC增殖活力的影响(A570,
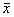 ±s, n=10)
±s, n=10)Table 1 The effects of cord blood plasma of different
volume fraction on the proliferation of HUVEC(A570,
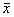 ±s, n=10) Groups
±s, n=10) Groups, 百拇医药
t/h
24
48
72
10%FCS
0.065±0.003
0.046±0.005
0.038±0.004
10%FCS+
10%CBP
0.095±0.004*
0.070±0.008
, 百拇医药
0.065±0.004
10%FCS+
20%CBP
0.098±0.005*
0.111±0.005**
0.109±0.005**
*P<0.05, **P<0.01, compared with 10%FCS.
3 讨论
脐带血浆富含各种造血生长因子,已被用于造血祖细胞体外集落培养和CD34+细胞的体外扩增[3,4]。文献中有将正常人混合血清或肝素抗凝的混合血浆用于HUVEC培养的报道[5]。但脐血浆在HUVEC培养中的应用, 目前尚未见报道。我们试用混合脐血浆代替内皮细胞生长因子,能很好地支持HUVEC的原代及传代培养,说明脐血浆中含有一些能刺激内皮细胞生长的因子。由于脐血浆之间存在批间差异,必需多份混合。我们的经验是20份以上的混合脐血浆可以成功地用于HUVEC的培养。MTT试验结果表明,混合脐血浆达到20%(体积分数)时才能维持HUVEC的增殖活力,我们的经验表明,20%~30%的混合脐血浆能较好地用于HUVEC的传代培养。
, 百拇医药
Ⅷ:Ag兔抗血清可以检测内皮细胞胞浆内的Ⅷ:Ag,UEA-Ⅰ则能与内皮细胞表面的岩藻糖结合,两种方法均为目前公认的鉴定内皮细胞的可靠方法[6]。结果证明以上培养方法所获的内皮细胞纯度可达93.1%。
本实验证明,脐带血浆来源方便、经济,多份混合的脐血浆可以代替内皮细胞生长因子以获得纯度较高的可传代的人脐带血管内皮细胞供实验研究应用。
参考文献
1 Zini JM,Ternaux B,Rocha V, et al. Isolation of CD34+ cells is not essential for ex-vivo expansion of cord blood cells: Impact of coculture with umbilical vein endothelial cells(HUVEC).Blood, 1997,90/10 Suppl Ⅰ:176b
, http://www.100md.com
2 Jaffe EA,Nachman RL,Becker CG, et al. Culture of human endothelial cells derived from umbilical cord veins: Identification by morphologic and immunologic criteria. J Clin Invest, 1973,52:2745-2756
3 Carow CE,Hangoc G,Broxmeyer HE. Human multipotential progenitor cells(CFU-GEMM) have extensive replating capacity for secondary CFU-GEMM: an effect enhanced by cord blood plasma. Blood, 1993,81:942-949
4 张林生,王逸兰,陆道培.脐血血浆支持造血祖细胞体外集落培养的研究.实验血液学杂志, 1996,4:87-91
, 百拇医药
5 盛立民.血管内皮细胞与疾病.上海:上海医科大学出版社, 1993.206
6 Schweitzer KM, Vicart P, Delouis C, et al. Characterization of a newly established human bone marrow endothelial cell line: Distinct adhesive properties for hematopoietic progenitors compared with human umbilical vein endothelial cells. Lab Invest, 1997, 76:25-36
(1998-06-30收稿), 百拇医药