T淋巴细胞产生的应激免疫抑制蛋白
作者:范少光 丁桂凤△
单位:北京医科大学生理学系 △免疫学系,北京 100083
关键词:T淋巴细胞;分泌;淋巴细胞转化;拮抗剂和抑制剂;应激免疫抑制蛋白☆
990303
摘 要 综述应激免疫抑制蛋白 (immunosuppressive pro tein of stress, ISPS)的研究概况和进展。 大鼠和小鼠在应激条件下,通过中枢神经系统的作用,由外周T淋巴 细胞产生了一种大分子 蛋白质,对某些免疫功能具有抑制作用。称之为应激免疫抑制蛋白 。它具有以下两个特点,一是相对分子质量很大,不像是已知的细 胞因子、干扰素、肽类激素、神经肽等。二是它的独特生成机制。它是在应激条件下,通过 中枢神经系统的作用,再以交感神经为介导,通过释放去甲肾上腺素,在T淋巴细胞生成的 。这种生成方式尚未见到类似的报道。
, http://www.100md.com
中国图书资料分类法分类号 Q26
T lymphocyte generates an immunosuppressive protein induced by stress
FAN Shao-Guang#, DING Gui-Feng
(#Department of Physiology, Beijing Medical University, Beijing 100083)
MeSH T-lymphocytes/secret Lymphocyte transformation/antag Immunosuppressive protein of stress☆
ABSTRACT Under the conditions of stress an immunosuppressive protein (immunosupp ressive p rotein of stress, ISPS) was generated in T lymphocyte, which acted as an immune suppressor. The generation of the protein was controlled by central nervous syst em and mediated by peripheral sympathetic nerves. Both the large molecular weigh t, which is much larger than interleukins, interferons, hormonal peptides, neuro peptides, etc., and the conditions of the generation of the protein implied that this protein is potentially a recently discovered protein. It may be a very impo rtant molecule that could be very important to our understanding of the interact ion between central nervous system and immune function.
, 百拇医药
(J Beijing Med Univ, 1999,31:197-203)
我们对应激免疫抑制蛋白已经进行了十年的研究,这一蛋白 是在应激条件下,通过神经系统 的作用,由外周T淋巴细胞产生的一种大分子蛋白质,对某些免疫功能具有抑制作用,称之 为应激免疫抑制蛋白(immunosuppressive protein of stress, ISPS)。这一蛋白是我们首 先发现和报道的。现将我们这方面的工作简要总结如下。
1 ISPS的发现
在应激条件下机体的各种功能会有很大的变化,很多在安静时不表现的调节机制,在应激条 件下可能显露出来。因此,在应激条件下,当机体的功能活动发生变化时,研究神经系 统和 免疫系统之间的相互作用,有可能发现一些新的、有意义的现象。 十多年来我们的研究主 要是在这一思路下进行的。这也是目前很多实验室采用的研究方向。
, http://www.100md.com
我们主要选择束缚应激进行研究。束缚应激的特点之一是束缚本身对机体不会产生直接的 损 伤。属于一种非损伤应激。我们发现,在束缚应激10h以上,大鼠或小鼠的血清在体外试 验中能抑制另一正常动物由Con A诱导的淋巴细胞的转化[1,2]。这一结果提示 ,应激后动物血清的成分发生了某些变化,从而对淋巴细胞的转化产生抑制作用(图1)。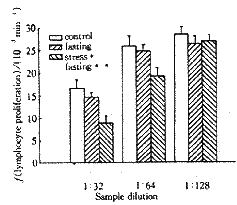
Vertical bar represents MSE. **, P<0.01,ANOVA, compar ed with control, n=8.
图1 小鼠应激后血清对淋巴细胞转化的作用
Figure 1 Effect of serum from stressed mice
, 百拇医药 on normal lymphocyte proliferation
究竟是甚么物质抑制了淋巴细胞的转化?已知在应激的条件下,下丘脑 -垂体-肾上腺轴被激 活,血中肾上腺皮质激素会明显升高,肾上腺皮质激素具有明显抑制免疫功能的作用。文献 报道和我们体外的实验也都证明,当培养液中肾上腺皮质激素的浓度达到10-6mol.L-1或更高 时,对淋巴细胞的转化具有明显的抑制作用。我们也检测了束缚应激时动物血清中肾上腺皮 质激素(皮质酮,corticosterone)的浓度,发现与不应激正常动物相比确有升高,但其浓 度还远远低于10-6mol.L-1[2]。说明血清 的抑制作用不像是由肾上腺皮质 激素引起。我们的透析试验也证明,将相对分子质量小于6000的物质去除后,应激血清仍 然具有 抑制淋巴细胞转化的作用。为了进一步明确应激血清抑制淋巴细胞转化与肾上腺皮质激素的 关系,我们在肾上腺切除的小鼠上重复束缚应激实验,结果表明,应激后肾上腺切除动物的 血清仍具有抑制淋巴细胞转化的作用。以上这些实验从不同角度证明血清抑制淋巴细胞转化 不是由肾上腺分泌的激素所引起[2]。透析的实验还说明,有一种相对分子质量大 于6000的物质,因此很可能是一种肽或蛋白质。
, http://www.100md.com
2 ISPS的特性[2]
我们的研究表明,这种物质对两种蛋白酶(胰蛋白酶和糜蛋白 酶)都十分敏感,在质量浓度为32 mg.L-1时,可以完全破坏应激血清的抑制活性。说明它可能是一种蛋白质。 它部分耐热,56℃30 min不破坏它的生物活性,100℃3min即可完全使其丧失活性。冷冻和30%(体积 分数)甲醇处理不影响它的活性。但60%(体积分数)的甲醇处理可以完全使其失活。
ISPS的抑制作用是否是和T细胞多克隆活化剂刀豆蛋白(Con A),和白细胞介素2(IL-2)竞争相应的受体 ,从而产生对淋巴细胞转化的抑制?我们使用部分纯化的ISPS进行研究。实验时将正常淋巴 细胞与部分纯化的ISPS共同孵育一定的时间后,然后冲洗去除ISPS,再加Con A检测对淋巴 细胞转化的影响。发现它和淋巴细胞共同孵育的时间,随时间延长,它的抑制作用也加强,10~12h到达顶峰。这一设计排除了竞争受体的可能性。已知IL-2可以促进淋巴细胞的 转化。我们的另一研究证明,将基因重组IL-2、应激血清和由Con A活化的脾细胞三者共同 培养,应激血清不能抑制IL-2加强脾淋巴细胞转化的作用,只有应激血清与Con A活化的脾 细胞共同培养几小时后,再加入重组IL-2,应激血清才能抑制脾细胞的增殖[3] 。这一结果进一步说明血清中的抑制因子不像是可溶性IL-2受体。
, http://www.100md.com
我们在动物应激后不同的间期抽取血液制成血清,检查对淋巴细胞转化的影响并计算抑制作 用消失的“半寿期”。结果表明,大约23 h其抑制作用下降一半[4]。
3 ISPS的相对分子质量测定
3.1 透析实验
当初我们并不知道抑制物的相对分子质量,因此使用的透析膜其截断相对分子质量为6000。试验中为了检验透析膜的效果,在同一透析系统中设置一装有皮质酮(10-5mol.L-1)的透 析袋同时透析。透析后的结果表明,血清经过透析后对淋巴细胞的抑制作用依然保存,而皮质酮透析的对照组,经过透析后完全丧失了抑制活性。说明透析袋的效率是好的,能将小分子的物质透析出去。血清的抑制活性依然存在,说明ISPS的相对分子质量大于6000。
, 百拇医药
3.2 HPLC凝胶过滤
我们在测定之前猜想抑制物的相对分子质量可能在几千和几万之间,因此使用能分离60000相对分子质量以下的分离柱(TSK 125)。分段收集流洗液(ml.min-1)并检 测它们对淋巴细 胞转化的作用(活性检测),发现在第10和11管具有明显的抑制活性。与标准相对分子质量相比,其相对分子质量已超过60000(在外髓体积之中)。随后我们改用可分离相对分子质量为700000的分离柱(TSK250)。发现在第12和14管具有抑制活性。与标准相对分子质量相比,这两个峰的相 对分子质量分别为370000和155000[2]。
从以往国外的研究看,烧伤、创伤、外科手术、出血等病人的血清也具有明显抑制正常 淋巴 细胞转化的作用。关于抑制物的相对分子质量,文献报告的结果各不相同(从1000到30000)。而 且有人认为这些物质可能主要是组织损伤后的代谢产物。我们所报道的蛋白质是在非损伤性 应激条件下产生的,而且相对分子质量大于上述抑制物,可能不属于上述物质。1989年Weis s等[5]报告,电击刺激(也是一种非损伤应激刺激)大鼠后,其血清能抑制由Con A 诱导的淋巴细 胞转化,并认为这是一种相对分子质量大于10000的物质。由于没有看到他们进一步的报 告,还很难判断是否是我们报道的蛋白质。目前我们也正在做这方面的研究。
, 百拇医药
由于这种蛋白质的相对分子质量比较大,不像是已知的细胞因子、干扰素、肽类激素、神经肽等,有可能是新发现的一种调节蛋白。
4 ISPS的组织和细胞来源
纯化这一蛋白并克隆它的基因是我们最为关心的工作。过去我们 试图从血清中提纯这一蛋白 ,但没有成功。失败的主要原因有二。一是血清中的杂蛋白太多,难以分离。二是血清中这 一蛋白的含量太低,经几步纯化后活性已丢失殆尽。因此最为迫切的工作是找到它的组织和 细胞来源,从组织或细胞中提取则更为方便。这方面的第一个研究是将应激后大鼠的血清和 脑脊液同时取出,检测它们对淋巴细胞转化的作用。发现只有血清能抑制淋巴细胞转化,而 脑脊液没有任何抑制作用。说明这一蛋白产生于外周[6]。随后在裸鼠的研究证明 ,缺乏 T细胞功能的裸鼠,在应激后血清对淋巴细胞转化的抑制作用明显小于正常小鼠[7] 。我们 的另一研究证明,在60Co照射后,小鼠应激后血清对淋巴细胞转化的抑制作用明显减 弱,当 照射剂量达到6Gy时,应激血清已不具有抑制活性[7]。这些结果从不同 侧面提示,此抑 制蛋白的产生可能与免疫细胞有关。随后,我们制备了以下5种组织的组织提取物(包括腹 腔淋巴结、脾、脑、骨骼肌和胸腺),检测它们对淋巴细胞转化的作用。提取方法与血清的提取方法相同。结果表明,淋巴结和脾的提取物具有明显抑制正常淋巴细胞转化的作用。而脑和骨骼肌完全没有抑制活性(图2)[6,8]。结果还表明,组织提取物的抑制活性远远大于血清,是血清的100至200倍。这为进一步提取ISPS创造了极好的条件。我们近来的研究还证明,小肠的提取物也具有抑制淋巴细胞转化的作用。这为我们提取工作提供了更多的组织来源[9]。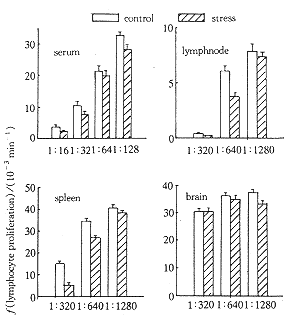

, 百拇医药
Lymphocyte proliferation was suppressed by the serum an d the tissue extracts from stressed rats (P<0.01, ANOVA, n=6). Howeve r, lymphocy te proliferation was not suppressed by tissue extracts from brain, skeletal musc le and thymus gland (P>0.05, compared with control, ANOVA, n=6) verti cal bar represents± .
.
图2 大鼠应激后血清和组织提取物对淋巴细胞转化的影响
Figure 2 Effect of serum and various tissue extracts from stres sed rats
, 百拇医药
on normal lymphocyte proliferation
究竟淋巴结和脾提取物的抑制物和血清的抑制物是否同一物质?为此我们研究了它们之间的关系。发现脑室注射基因重组IL-1β(1pg)可使应激后血清的抑制作用和淋巴结和脾提取物的抑制作用同时加强[10,11]。说明血清中的抑制物与组织提取物中的抑制物受同一机制的调节。回归和相关分析的结果表明,血清和组织提取物之间有明显的正相关关系[10],即组织提取物的抑制作用强,血清的抑制作用也强;组织提取物的抑制作用弱,血清的抑制作用也弱。相对分子质量测定的结果证明,组织提取物的抑制作用是由相对分子质量190000的物质所引起[10]。由于使用HPLC从功能上测定相对分子质量不会很准确,因此从相对分子质量上看,它与血清中的抑制物很可能是相同的物质。
在以HPLC分析组织提取物的相对分子质量时,我们使用的提取方法与血清的提取方法完全相同,如用酸和30%(体积分数)的甲醇提取、收集通过Sap-Pak柱的水溶相等。说明血清和组织提取物在某些生化特性上有共同之处,如耐酸,在30%(体积分数)甲醇中不变性,可溶于水等。此外,在对HPLC洗脱液进行活性测定时,在组织提取物的测定中只发现一个抑制峰,看不到在血清中370000的抑制峰。其确切原因还不清楚。是否血清中的大分子物质是一个ISPS的二倍体,或是ISPS与一携带蛋白相结合的复合体?这一问题还有待进一步的研究。
, 百拇医药
以上结果从相对分子质量、生化特性、相关关系、调节机制等不同侧面说明,在应激条件下,由外周淋巴组织产生一种大分子蛋白质释放到血液中,具有抑制淋巴细胞转化的作用。
5 神经系统的调节作用
ISPS的产生是否与神经系统的活动有关,是我们十分关心的问题。如果与神经系统毫无关系,这将是一免疫学的问题,而不属于神经免疫的领域。
5.1 中枢机制
我们以乌拉坦对小鼠作全身麻醉后再作束缚处理。结果表明,全身麻醉加束缚的动物血清,与不应激动物的血清一样,对淋巴细胞转化毫无抑制作用。如果以戊巴比妥作全身麻醉,束缚后动物血清的抑制活性虽然没有完全被取消,但也明显降低[2]。戊巴比妥翻转作用小于乌拉坦的原因,有可能是后者的麻醉作用时间短于前者。全身麻醉可以完全取消或明显降低束缚应激的作用,说明中枢神经系统的作用介导了ISPS的产生。
, 百拇医药
究竟中枢神经系统中哪种机制在这一过程中起主要作用?我们首先注意到了脑内IL-1。IL-1是由巨噬细胞产生的一种细胞因子,在免疫应答中起重要的调节作用。近年来的研究表明,它也存在于脑内,可由神经细胞和胶质细胞分泌。从1986年开始注意到它对神经内分泌功能的调节作用。证明它是联系神经和内分泌系统的重要介导物质。它除直接的免疫调节作用外,主要还有以下4种作用:对体温、睡眠、进食和神经内分泌功能有调节作用。近年来发现它通过神经系统对免疫功能具有很强的调节作用。由于它的这些作用,被认为是神经和免疫系统之间的桥梁物质并将其称之为“免疫神经递质,immunoneuro-transmitter”。它的另一特点是有内源性受体拮抗剂(IL-1Ra)。IL-1Ra是1990年克隆成功的一种蛋白质。能阻断IL-1的作用,现已证明在脑内也有它的存在。
我们首先以IL-1内源性受体阻断剂(IL-1Ra)作脑室注射。发现注射后可以明显对抗束缚应激的作用,使血清中ISPS的产生明显减少。当剂量达到5μg/只时,ISPS的产生完全被阻断。如果以极微量的IL-1β(1pg)作脑室注射,可以加强血清中由应激产生的ISPS。IL-1Ra和IL-1β不仅可以影响血清中ISPS的产生,同样可以影响淋巴结和脾ISPS的产生[10,11]。
, http://www.100md.com
由于IL-1是一种很强的升高体温的致热源,脑室注射后可以明显升高动物体温。上述作用是否由于体温升高所引起。从文献看,5ng的IL-1β作脑室注射可升高体温。而我们使用的IL-1β仅为1pg,远远小于上述剂量。为了进一步排除IL-1β这一作用,我们监测了动物的肛温。在注射IL-1β后的18h内,每30min测定一次体温,未发现体温有任何升高。此外,为了进一步了解脑室注射IL-1β后是否可以通过弥散作用到达外周而起作用的问题,我们以同样剂量的IL-1β做腹腔注射,未见对ISPS的产生有任何影响[10]。
我们还研究了脑内γ氨基丁酸(gamma aminobutyric acid, GABA)的作用。证明脑 内GABA也对ISPS的产生有调节作用。 注射氨氧乙酸(aminooxy acetic acid, AOAA)或注射安定增加脑内GABA的作用,可明显降低 ISPS的生成,而以3-巯基 丙酸(3-mercaptopropionic acid)阻断GABA的生成后,ISPS的生成受到明显抑制[1 2,13]。
, 百拇医药
虽然目前我们还不完全了解中枢神经系统的作用机制和通路,但以上结果从不同侧面说明 中枢神经系统的作用是产生ISPS的必要条件。
5.2 外周机制
中枢神经系统对内脏活动的调节可以有两条途径:下丘脑-垂体-肾上腺轴和 植物性神经系统。我们前面的实验证明,切除肾上腺后束缚仍然可以引起ISPS的生成,说明 垂体-肾上腺轴在ISPS的生成中不起主要作用。随后我们对交感神经的作用进行了研究。6 - 羟多巴胺(6-OHDA)可以选择性地被交感神经末梢重吸收。6-OHDA进入细胞内在酶的作用下 变 成一种能破坏神经末梢的毒素,从而损害交感神经纤维从而降低交感神经的作用,称之为“ 化学 性切断交感神经”。我们的研究证明注射6-OHDA后血清中去甲肾上腺素的浓度明显降低 ,说明交感神经的作用已经被阻断。此时,束缚应激后ISPS的生成受到明显抑制(另文发表 )。如果刚出生的小鼠接受6-OHDA的注射,成年后交感神经的功能仍然很低。对这一动物模型 也 进行了研究,发现束缚应激后ISPS的生成受到明显抑制。由于注射6-OHDA 可能产生某 些其它的副作用,为了进一步证明注射6-OHDA 对ISPS生成的调节作用是通过破坏交感神经 所引起,我们设计了另一对照试验,即在注射6-OHDA之前注射去甲丙咪嗪(desipramine), 阻断交感神经重吸收6-OHDA,从而保护交感神经。结果表明6-OHDA不再对ISPS的生成有任 何作用。说明6-OHDA的作用不是由它的其它副作用所引起。
, 百拇医药
已知交感神经末梢是通过释放去甲肾上腺素而发挥作用。上述交感神经的作用是否也是通过释放去甲肾上腺素引起?如果也是通过释放甲肾上腺素,在体外试验中,去甲肾上腺素应当也可以促进淋巴细胞生成ISPS。为此,我们以不同浓度的去甲肾上腺素培养正常淋巴细胞,再测定淋巴细胞提取物是否也能抑制正常淋巴细胞的转化。结果使我们很失望,提取液不能抑制正常淋巴细胞的转化。后来发现,如果在培养液中加入ConA活化T细胞,10-5mol.L-1以上的去甲肾上腺素可以刺激淋巴细胞生成ISPS(另文发表)。
以上结果从不同侧面证明交感神经介导了ISPS的生成。去甲肾上腺素在体外也可以引起ISPS生成,使我们得到了一种体外生成ISPS的实验模型,为进一步深入研究ISPS的生成机制创造了条件。
至此,我们可以认为以下结论是正确的:束缚应激首先作用于中枢神经系统,再以交感神经为介导,通过释放去甲肾上腺素,使淋巴细胞生成ISPS。
, 百拇医药
6 ISPS单克隆抗体的制备及ISPS生成的细胞定位
6.1 ISPS单克隆抗体的制备[14]
制作单克隆抗体并不需要十分纯的抗原,如果制备成功单克隆抗体,将为进一步纯化蛋白和基因克隆创造十分有利的条件。
6.1.1 抗原的制备 制作单克隆抗体需要2种抗原:一种抗原(抗原1)是用作给小鼠注射产生抗体;另一种抗原(抗原2)是在细胞克隆中用于筛选细胞。后者的纯度要求更高一些。本研究的抗原1是在酸提取后经硫酸铵沉淀,再经超滤去除相对分子质量100000以下的物质。最后经活性检测具有活性的蛋白用作注射。抗原2有两种,一种是应激抗原,一种是对照抗原。应激抗原的的制备是在抗原1的基础之上,再经G200的凝胶过滤分离,经活性检测具有抑制活性的组份。对照抗原的制作方法与应激抗原完全相同,只是蛋白来源于不应激动物。两者都用于细胞克隆。
, http://www.100md.com
6.1.2 免疫小鼠、细胞融合和筛选 以抗原1给BALB/c小鼠作腹腔注射,取其脾脏与SP2/0肿瘤细胞(myeloma)制成杂交瘤细胞(hybridoma)。以抗原2作酶标(ELASA)检测。凡细胞培养上清液能和应激抗原2有很强反应,而与对照抗原2反应很弱的细胞保留。最后成功获得了一株细胞(2C4)。
6.1.3 单克隆抗体的制备和检测 以上述杂交瘤细胞给小鼠作腹腔注射,腹腔液经硫酸铵沉淀和亲和层析(agarose-protein A column)获得单克隆抗体。WesternBlot检测发现,抗原经SDS处理后不能与此单抗相结合。如果抗原不作SDS处理,可以看到一条十分弥散的条带。SDS处理后不能与此单抗相结合的原因有可能是经SDS处理后,打开了蛋白质的空间结构,而本单克隆抗体只能识别这一蛋白的空间抗原决定簇。在功能检测的试验中,此单克隆抗体可以部分翻转应激血清和应激组织提取物的抑制活性。说明此单抗是有活性的。
以上的实验说明,此单抗具有以下特性:(1)它是由相对分子质量大于100000的抗原(蛋白)所诱导产生;(2)诱导产生抗体的蛋白来源于应激后的淋巴组织;(3)它能识别相对分子质量大于100000的抗原;(4)它具有部分对抗ISPS抑制淋巴细胞转化的活性。这些特性说明2C4具有与ISPS特异性相结合的特性。
, 百拇医药
6.2 产生ISPS细胞类型的研究
6.2.1 生物活性的研究
首先从脾和淋巴结中分离不同类型的细胞,然后制备成提取液,以淋巴细胞转化为生物检测手段,研究ISPS生成的细胞来源。
单个核细胞:从脾和淋巴结中获得细胞,以分层液(Ficoll-urografin,比重1.085)分离单个核细胞。再以我们实验室常规酸提取方法制备提取液,并以淋巴细胞转化实验检查提取液的生物活性。结果表明,应激后单个核细胞提取物具有明显抑制正常淋巴细胞转化的作用。说明ISPS存在于单个核细胞之中。
T和B细胞:以兔抗小鼠Ig平皿亲和法从上述细胞中分离B和T细胞。以FITC标记CD3和兔抗小鼠Ig,在流式细胞仪(FACS)中分别测定T和B细胞数。结果表明T和B细胞在各自细胞中所占的比例分别为93%和95%。将这些细胞以上述同样方法制备成提取液并作淋巴细胞转化检测。结果表明,应激T细胞提取液具有明显抑制淋巴细胞转化的作用,而应激B细胞提取液对淋巴细胞转化毫无影响。说明T细胞含有ISPS而B细胞则无。
, 百拇医药
回归和相关分析:为了进一步分析ISPS和T细胞之间的关系。我们以每一份标本的T细胞数为X,以同一份标本的淋巴细胞转化值(min-1)为Y作相关和回归分析。结果表明,它们之间呈明显的负相关(y=30356-4998x,r=0.936,n=5,P<0.01)。即T细胞数越多的标本,抑制淋巴细胞转化的作用也强,淋巴细胞转化值(min-1)低。提示T细胞数越多的标本,产生的ISPS也越多。
6.2.2 免疫组织化学研究
由于我们得到了抗ISPS的单克隆抗体(2C4),以此单抗作免疫组化研究,可以从形态学上观察ISPS的分布。
组织切片:摘取腹腔淋巴结、脾脏、胸腺、全脑皮层和动物后肢一小片骨骼肌,取出后以10%(体积分数)的福尔马林固定,作石蜡包埋切片(5μm)。以ABC法对组织片和涂片作检查。结果表明,应激后大鼠脑和骨骼肌的切片未见2/C4阳性细胞(含ISPS细胞),脾脏、淋巴结、胸腺以及小肠的切片显示出很多2/C4阳性细胞。以影象分析仪测定切片光密度和面积的结果表明,应激大鼠脾切片阳性着色面积(着色面积和总面积的百分数为27.3%±0.8%)和单位密度(单位面积D为0.360±0.006)均大于不应激大鼠的脾(12.70%±0.08%和0.180±0.009)(P<0.01,n=4,t检验)。这一结果与我们前述的以组织提取物分析ISPS产生来源的结果十分吻合。免疫组化的结果从形态上证明脾、淋巴结、胸腺以及小肠中有ISPS。在淋巴结切片中,着色最深的部位在副皮质区(T淋巴细胞集中分布的区域)。这再次提示ISPS可能由T细胞产生。
, 百拇医药
细胞涂片:以T和B细胞悬液(2×107ml-1)50μl滴于载玻片上,风干后以甲醇固定。同样以ABC法检查涂片。以FACS检测T和B细胞的分离纯度,它们分别为95.2%±3.7%和96.3%±6.8%。在T细胞涂片上,无论细胞来自应激或不应激动物都可见到很多2C4阳性细胞。而在B细胞涂片上则很少看到(图3)。以FACS计数2C4阳性细胞的结果表明,应激大鼠的阳性细胞占45.3%±4.6%,不应激大鼠的阳性细胞占16.4%±2.2%(P<0.01,n=6,t检验)。在B细胞的涂片上,应激和不应激大鼠2C4阳性细胞所占的比例都很小,分别为1.5%±1.1%和0.7%±0.9%。(P>0.05,n=6,t检验)。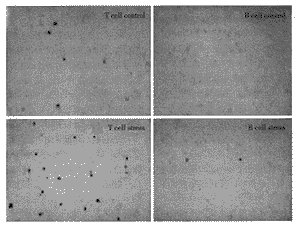
Many positive staining cells were in the T cell population, especially in T cell s from stressed rats. There were few positive staining cells in the B cell popul ation from either stressed or unstressed rats.×600, 5μm.
, http://www.100md.com
图3 T和B细胞的免疫组织化学涂片
Figure 3 Immunohistochemical staining of T and B lymphocytes
此外,我们还以CD3-FITC及2C4-PE作荧光抗体双标记,以显示CD3(T细胞)和2C4双阳性细胞。并以共聚焦显微镜检查涂片。结果表明2C4阳性和CD3双阳性细胞是在同一细胞之中。这进一步证明ISPS可以由T细胞产生。
以上从功能和形态两方面证明,T细胞可以产生ISPS,B细胞不能。
7 ISPS的功能
ISPS具有明显抑制淋巴细胞转化的作用,但这并不意味抑制淋巴细胞转化是它的唯一作用。由于我们可以制备ISPS部分纯化的产品,用这种产品作研究,发现ISPS对由LPS诱导的淋巴细胞转化也具有抑制作用。说明它可能对B淋巴细胞的转化有抑制作用[2]。另一研究证明,ISPS在体外培养中能抑制T细胞释放IL-2,对巨噬细胞释放IL-1没有作用[15]。在整体的研究中,发现它有降低正常大鼠动脉血压的作用,对心率的作用不明显。它的降血压机制目前还不了解[16]。此外,在以四氧嘧啶(alloxan)诱导大鼠产生糖尿病的大鼠,ISPS似乎具有对抗作用[17]。在佐剂性关节炎的大鼠,血清中ISPS的含量明显增高,当关节炎的症状在第21天达到最高峰时,血中的ISPS也到达最高峰。在第35天关节炎症状明显减弱,血清的抑制作用也明显减弱。两者有一正相关关系。目前还不知道它们之间的因果关系(待发表)。在银屑病(牛皮癣)人中,血清中ISPS的含量也升高。免疫组化研究发现,银屑病病人皮损区有很多ISPS阳性细胞[18]。ISPS和银屑病究竟有何关系,是值得进一步研究的问题。由于我们目前还没有拿到ISPS的纯品,也没有得到它的多克隆抗体,无法展开大规模研究,上述结果都是初步的。从目前这些并不系统的研究中,可以看出这一蛋白可能与某些自家免疫病有关。
, http://www.100md.com
我们在人体也作了一些研究。一组8名冬训期间超强运动(每天骑车180km)的运动员,运动10d后的血清具有明显抑制淋巴细胞转化的作用。休息12d后恢复正常。以HPLC测定这种抑制物的相对分子质量为150000。说明人体也可以产生ISPS[19]。我们在另一组正常自愿受试者中,进行大运动量实验,7d后受试者血清也具有明显抑制淋巴细胞转化的作用。这种作用似乎与受试者的情绪评分呈正相关。此外,我们在小鼠耗竭性游泳实验中,证明血中可产生ISPS。但寒冷刺激的应激不能诱导ISPS的产生[20]。从这些结果看,动物不运动(束缚)和动物及人强烈运动都可以产生ISPS。再结合上述自愿受试者的实验结果,提示这种蛋白可能与精神因素有关。是否为精神活动影响免疫功能的一种介导物质,我们正在建立精神影响免疫功能的动物模型,观察ISPS是否在其中有重要的作用。
8 神经系统和免疫系统之间的相互作用[21,22]
, 百拇医药 目前已有很多的研究证明,神经内分泌和免疫系统之间的相互作用,对机体在不同条件下稳态的维持起着决定性的作用。这是对传统神经内分泌调节概念的一种修正和补充。新的观点认为,免疫系统不仅是机体的一种防卫系统,它同时还是机体的一种重要的感受和调节系统。又由于免疫细胞可随血流循环在全身各处移动,因此提出免疫系统可以起“游动脑(mobilebrain)”的作用[23]。这一概括形象地勾画出了免疫系统的这种重要功能。
神经系统可以感受精神和躯体的刺激。免疫系统可感受肿瘤、病毒、毒素等的刺激。因此神经内分泌系统和免疫系统在体内成为机体的两大感受和调节系统,即两个“脑”。它们通过一些共同的介导物质(共同的生物学语言)交换信息,相互作用,使机体在生理和病理条件下保持稳态(图4)。我们发现和研究的ISPS可能是联系这两大系统的介导物质,特别是它的产生可能与精神活动有关,因此有可能是精神调节免疫功能的重要介导物质。它具有以下两个特点,一是相对分子质量很大,不像是已知的细胞因子、干扰素、肽类激素、神经肽等;二是它的独特生成机制,它是在应激条件下,通过中枢神经系统作用,再以交感神经为介导,通过释放去甲肾上腺素,在T淋巴细胞生成的,这种生成方式尚未见到类似的报道。在这一思路下,有可能发现更多的新蛋白质,成为一个新的研究领域。
, http://www.100md.com
图4 神经内分泌和免疫系统之间的相互作用
Figure 4 Interaction between nervou s, endocrine and immune system
☆ 自由词。
参考文献
1 范少光,查宏斌.束缚应激小鼠血清免疫抑制因子的产生及其调 节.科学通报, 1989, 34:1584-1587
2 Zha HB, Ding GF, Fan SG. Serum factor(s) induced by res traint stress in mic e and rats suppresses lymphocyte prolifration. Brain Behav Immun, 19 92,6:18-31
, 百拇医药
3 马 丽,邓玉兰,丁桂凤,等.束缚应激血清对免疫功能的影响 .中国神经免疫学及神经病学杂志, 1997,4:207-211
4 Huang QJ,Jiang C, Fan SG. Effective time o f immuno-suppressive protein in serum. Chn Sci Bull, 1998, 43:1387-1389
5 Weiss. JM, Sander SK, Becher KJ, et al. Behavioral and neur al influences on cellular immune response: effects of stress and interleukin-1. J Clin Psychiatry, 1989, 50:43-53
6 邵 黎,高 珊,张 勤,等.束缚应激能引起淋巴细胞产生 抑制淋巴细胞转化的因子.科学通报,1995, 40:164-166
, 百拇医药
7 汪静雪,陈 薇,梅 林,等.束缚应激动物血清中 免疫抑制因子产生部位的研究. 生理学报,1992, 44:9-16
8 Fan SG. Gao S, Li S, et al. A suppressive factor in lymph node and spleen induced by restraint stress suppresses lymphocyte proliferaation. Neuroi mmunomodulation, 1995,2, 274-281
9 Huang QJ, Zhou XS, Fan SG. Effect of th e extract of intestine from stressed rat on lymphocyte proliferation in vitro. Chn Sci Bull, 199 8, 43:1465-1467
, 百拇医药 10 Zuo YC; YF Li, Mei L, et al. Brain interleukin 1 i n the brain i s involved in generation of the serum suppressive factor induced by restraint st ress in mice. Neuroimmunomodulation, 1995, 2:82-87
11 李一凡,左永昌,丁桂凤,等.脑室注射白细胞介素1对淋巴细胞应激免 疫抑制因子生成的影响.药学学报,1995, 30:395-399
12 汪静雪,梅 林,陈 薇,等.GABA能神经元对抗束缚应 激后血清淋巴细胞转化抑制因子的产生.中国应用生理学杂志,1992, 8:120-124
13 Wang JX, Mei L, Tang HY, et al. An antagonistic e ffect of c entral GABA ergic system on the generation of serum suppressive factor(s) induce d by restraint stress in mice. Chn Sci Bul, 1993, l38:1230-1232
, 百拇医药
14 李乐群,邵 黎,吴晓婷,等.束缚应激免 疫抑制因子单克隆抗体的研制.北京医科大学学报,1998,30:574-575
15 刘 薇,范少光,丁桂凤.应激免疫抑制蛋白对免疫细胞功能的影响.北京医科大 学学报, 1997,29:86-87
16 汪静雪,李怡凡,黄庆军.应激免疫抑制蛋白降低大鼠动脉血压.北京医科 大学学报, 1998,30:449-500
17 高 珊,梅 林,范少光.束缚应激免疫抑制因子对抗由四氧嘧啶所致大鼠 糖尿病的发生.中国神经免疫学和神经病学杂志, 1996,3:96-99
18 杨雪琴,邵 黎,范少光.银屑病患者血清中神经免疫蛋白抑制淋巴细胞转 化的研究.中华皮科杂志, 1998,31:30-32
19 邵 黎,乔 伟,朱哓松,等.运动员剧烈运动后血中应激免疫抑制蛋 白的产生.中国应用生理学杂志, 1997,13:312-315
, 百拇医药
20 邵 黎,朱晓松,孙长伟,等.小鼠耗竭性游泳及寒冷对应激免疫抑 制蛋白的不同作用.北京医科大学学报, 1997, 29:323-325
21 范少光,丁桂凤.神经内分泌和免疫系统相互作用的介导物质:共用的生物学 语言.生理科学进展, 1995,26:175-183
22 Fan SG, Shao L, Ding GF. A suppressive protein generated in p eripheral lymph tissue induced by restraint stress. Adv Neuroimmunol, 1996,6:279-288
23 Blalock E, Smith EM. The immune system: our mobile brain. Immuno l Today, 1985,6:115-117
(1999-04-12收稿), http://www.100md.com
单位:北京医科大学生理学系 △免疫学系,北京 100083
关键词:T淋巴细胞;分泌;淋巴细胞转化;拮抗剂和抑制剂;应激免疫抑制蛋白☆
990303
摘 要 综述应激免疫抑制蛋白 (immunosuppressive pro tein of stress, ISPS)的研究概况和进展。 大鼠和小鼠在应激条件下,通过中枢神经系统的作用,由外周T淋巴 细胞产生了一种大分子 蛋白质,对某些免疫功能具有抑制作用。称之为应激免疫抑制蛋白 。它具有以下两个特点,一是相对分子质量很大,不像是已知的细 胞因子、干扰素、肽类激素、神经肽等。二是它的独特生成机制。它是在应激条件下,通过 中枢神经系统的作用,再以交感神经为介导,通过释放去甲肾上腺素,在T淋巴细胞生成的 。这种生成方式尚未见到类似的报道。
, http://www.100md.com
中国图书资料分类法分类号 Q26
T lymphocyte generates an immunosuppressive protein induced by stress
FAN Shao-Guang#, DING Gui-Feng
(#Department of Physiology, Beijing Medical University, Beijing 100083)
MeSH T-lymphocytes/secret Lymphocyte transformation/antag Immunosuppressive protein of stress☆
ABSTRACT Under the conditions of stress an immunosuppressive protein (immunosupp ressive p rotein of stress, ISPS) was generated in T lymphocyte, which acted as an immune suppressor. The generation of the protein was controlled by central nervous syst em and mediated by peripheral sympathetic nerves. Both the large molecular weigh t, which is much larger than interleukins, interferons, hormonal peptides, neuro peptides, etc., and the conditions of the generation of the protein implied that this protein is potentially a recently discovered protein. It may be a very impo rtant molecule that could be very important to our understanding of the interact ion between central nervous system and immune function.
, 百拇医药
(J Beijing Med Univ, 1999,31:197-203)
我们对应激免疫抑制蛋白已经进行了十年的研究,这一蛋白 是在应激条件下,通过神经系统 的作用,由外周T淋巴细胞产生的一种大分子蛋白质,对某些免疫功能具有抑制作用,称之 为应激免疫抑制蛋白(immunosuppressive protein of stress, ISPS)。这一蛋白是我们首 先发现和报道的。现将我们这方面的工作简要总结如下。
1 ISPS的发现
在应激条件下机体的各种功能会有很大的变化,很多在安静时不表现的调节机制,在应激条 件下可能显露出来。因此,在应激条件下,当机体的功能活动发生变化时,研究神经系 统和 免疫系统之间的相互作用,有可能发现一些新的、有意义的现象。 十多年来我们的研究主 要是在这一思路下进行的。这也是目前很多实验室采用的研究方向。
, http://www.100md.com
我们主要选择束缚应激进行研究。束缚应激的特点之一是束缚本身对机体不会产生直接的 损 伤。属于一种非损伤应激。我们发现,在束缚应激10h以上,大鼠或小鼠的血清在体外试 验中能抑制另一正常动物由Con A诱导的淋巴细胞的转化[1,2]。这一结果提示 ,应激后动物血清的成分发生了某些变化,从而对淋巴细胞的转化产生抑制作用(图1)。

Vertical bar represents MSE. **, P<0.01,ANOVA, compar ed with control, n=8.
图1 小鼠应激后血清对淋巴细胞转化的作用
Figure 1 Effect of serum from stressed mice
, 百拇医药 on normal lymphocyte proliferation
究竟是甚么物质抑制了淋巴细胞的转化?已知在应激的条件下,下丘脑 -垂体-肾上腺轴被激 活,血中肾上腺皮质激素会明显升高,肾上腺皮质激素具有明显抑制免疫功能的作用。文献 报道和我们体外的实验也都证明,当培养液中肾上腺皮质激素的浓度达到10-6mol.L-1或更高 时,对淋巴细胞的转化具有明显的抑制作用。我们也检测了束缚应激时动物血清中肾上腺皮 质激素(皮质酮,corticosterone)的浓度,发现与不应激正常动物相比确有升高,但其浓 度还远远低于10-6mol.L-1[2]。说明血清 的抑制作用不像是由肾上腺皮质 激素引起。我们的透析试验也证明,将相对分子质量小于6000的物质去除后,应激血清仍 然具有 抑制淋巴细胞转化的作用。为了进一步明确应激血清抑制淋巴细胞转化与肾上腺皮质激素的 关系,我们在肾上腺切除的小鼠上重复束缚应激实验,结果表明,应激后肾上腺切除动物的 血清仍具有抑制淋巴细胞转化的作用。以上这些实验从不同角度证明血清抑制淋巴细胞转化 不是由肾上腺分泌的激素所引起[2]。透析的实验还说明,有一种相对分子质量大 于6000的物质,因此很可能是一种肽或蛋白质。
, http://www.100md.com
2 ISPS的特性[2]
我们的研究表明,这种物质对两种蛋白酶(胰蛋白酶和糜蛋白 酶)都十分敏感,在质量浓度为32 mg.L-1时,可以完全破坏应激血清的抑制活性。说明它可能是一种蛋白质。 它部分耐热,56℃30 min不破坏它的生物活性,100℃3min即可完全使其丧失活性。冷冻和30%(体积 分数)甲醇处理不影响它的活性。但60%(体积分数)的甲醇处理可以完全使其失活。
ISPS的抑制作用是否是和T细胞多克隆活化剂刀豆蛋白(Con A),和白细胞介素2(IL-2)竞争相应的受体 ,从而产生对淋巴细胞转化的抑制?我们使用部分纯化的ISPS进行研究。实验时将正常淋巴 细胞与部分纯化的ISPS共同孵育一定的时间后,然后冲洗去除ISPS,再加Con A检测对淋巴 细胞转化的影响。发现它和淋巴细胞共同孵育的时间,随时间延长,它的抑制作用也加强,10~12h到达顶峰。这一设计排除了竞争受体的可能性。已知IL-2可以促进淋巴细胞的 转化。我们的另一研究证明,将基因重组IL-2、应激血清和由Con A活化的脾细胞三者共同 培养,应激血清不能抑制IL-2加强脾淋巴细胞转化的作用,只有应激血清与Con A活化的脾 细胞共同培养几小时后,再加入重组IL-2,应激血清才能抑制脾细胞的增殖[3] 。这一结果进一步说明血清中的抑制因子不像是可溶性IL-2受体。
, http://www.100md.com
我们在动物应激后不同的间期抽取血液制成血清,检查对淋巴细胞转化的影响并计算抑制作 用消失的“半寿期”。结果表明,大约23 h其抑制作用下降一半[4]。
3 ISPS的相对分子质量测定
3.1 透析实验
当初我们并不知道抑制物的相对分子质量,因此使用的透析膜其截断相对分子质量为6000。试验中为了检验透析膜的效果,在同一透析系统中设置一装有皮质酮(10-5mol.L-1)的透 析袋同时透析。透析后的结果表明,血清经过透析后对淋巴细胞的抑制作用依然保存,而皮质酮透析的对照组,经过透析后完全丧失了抑制活性。说明透析袋的效率是好的,能将小分子的物质透析出去。血清的抑制活性依然存在,说明ISPS的相对分子质量大于6000。
, 百拇医药
3.2 HPLC凝胶过滤
我们在测定之前猜想抑制物的相对分子质量可能在几千和几万之间,因此使用能分离60000相对分子质量以下的分离柱(TSK 125)。分段收集流洗液(ml.min-1)并检 测它们对淋巴细 胞转化的作用(活性检测),发现在第10和11管具有明显的抑制活性。与标准相对分子质量相比,其相对分子质量已超过60000(在外髓体积之中)。随后我们改用可分离相对分子质量为700000的分离柱(TSK250)。发现在第12和14管具有抑制活性。与标准相对分子质量相比,这两个峰的相 对分子质量分别为370000和155000[2]。
从以往国外的研究看,烧伤、创伤、外科手术、出血等病人的血清也具有明显抑制正常 淋巴 细胞转化的作用。关于抑制物的相对分子质量,文献报告的结果各不相同(从1000到30000)。而 且有人认为这些物质可能主要是组织损伤后的代谢产物。我们所报道的蛋白质是在非损伤性 应激条件下产生的,而且相对分子质量大于上述抑制物,可能不属于上述物质。1989年Weis s等[5]报告,电击刺激(也是一种非损伤应激刺激)大鼠后,其血清能抑制由Con A 诱导的淋巴细 胞转化,并认为这是一种相对分子质量大于10000的物质。由于没有看到他们进一步的报 告,还很难判断是否是我们报道的蛋白质。目前我们也正在做这方面的研究。
, 百拇医药
由于这种蛋白质的相对分子质量比较大,不像是已知的细胞因子、干扰素、肽类激素、神经肽等,有可能是新发现的一种调节蛋白。
4 ISPS的组织和细胞来源
纯化这一蛋白并克隆它的基因是我们最为关心的工作。过去我们 试图从血清中提纯这一蛋白 ,但没有成功。失败的主要原因有二。一是血清中的杂蛋白太多,难以分离。二是血清中这 一蛋白的含量太低,经几步纯化后活性已丢失殆尽。因此最为迫切的工作是找到它的组织和 细胞来源,从组织或细胞中提取则更为方便。这方面的第一个研究是将应激后大鼠的血清和 脑脊液同时取出,检测它们对淋巴细胞转化的作用。发现只有血清能抑制淋巴细胞转化,而 脑脊液没有任何抑制作用。说明这一蛋白产生于外周[6]。随后在裸鼠的研究证明 ,缺乏 T细胞功能的裸鼠,在应激后血清对淋巴细胞转化的抑制作用明显小于正常小鼠[7] 。我们 的另一研究证明,在60Co照射后,小鼠应激后血清对淋巴细胞转化的抑制作用明显减 弱,当 照射剂量达到6Gy时,应激血清已不具有抑制活性[7]。这些结果从不同 侧面提示,此抑 制蛋白的产生可能与免疫细胞有关。随后,我们制备了以下5种组织的组织提取物(包括腹 腔淋巴结、脾、脑、骨骼肌和胸腺),检测它们对淋巴细胞转化的作用。提取方法与血清的提取方法相同。结果表明,淋巴结和脾的提取物具有明显抑制正常淋巴细胞转化的作用。而脑和骨骼肌完全没有抑制活性(图2)[6,8]。结果还表明,组织提取物的抑制活性远远大于血清,是血清的100至200倍。这为进一步提取ISPS创造了极好的条件。我们近来的研究还证明,小肠的提取物也具有抑制淋巴细胞转化的作用。这为我们提取工作提供了更多的组织来源[9]。


, 百拇医药
Lymphocyte proliferation was suppressed by the serum an d the tissue extracts from stressed rats (P<0.01, ANOVA, n=6). Howeve r, lymphocy te proliferation was not suppressed by tissue extracts from brain, skeletal musc le and thymus gland (P>0.05, compared with control, ANOVA, n=6) verti cal bar represents±
 .
.图2 大鼠应激后血清和组织提取物对淋巴细胞转化的影响
Figure 2 Effect of serum and various tissue extracts from stres sed rats
, 百拇医药
on normal lymphocyte proliferation
究竟淋巴结和脾提取物的抑制物和血清的抑制物是否同一物质?为此我们研究了它们之间的关系。发现脑室注射基因重组IL-1β(1pg)可使应激后血清的抑制作用和淋巴结和脾提取物的抑制作用同时加强[10,11]。说明血清中的抑制物与组织提取物中的抑制物受同一机制的调节。回归和相关分析的结果表明,血清和组织提取物之间有明显的正相关关系[10],即组织提取物的抑制作用强,血清的抑制作用也强;组织提取物的抑制作用弱,血清的抑制作用也弱。相对分子质量测定的结果证明,组织提取物的抑制作用是由相对分子质量190000的物质所引起[10]。由于使用HPLC从功能上测定相对分子质量不会很准确,因此从相对分子质量上看,它与血清中的抑制物很可能是相同的物质。
在以HPLC分析组织提取物的相对分子质量时,我们使用的提取方法与血清的提取方法完全相同,如用酸和30%(体积分数)的甲醇提取、收集通过Sap-Pak柱的水溶相等。说明血清和组织提取物在某些生化特性上有共同之处,如耐酸,在30%(体积分数)甲醇中不变性,可溶于水等。此外,在对HPLC洗脱液进行活性测定时,在组织提取物的测定中只发现一个抑制峰,看不到在血清中370000的抑制峰。其确切原因还不清楚。是否血清中的大分子物质是一个ISPS的二倍体,或是ISPS与一携带蛋白相结合的复合体?这一问题还有待进一步的研究。
, 百拇医药
以上结果从相对分子质量、生化特性、相关关系、调节机制等不同侧面说明,在应激条件下,由外周淋巴组织产生一种大分子蛋白质释放到血液中,具有抑制淋巴细胞转化的作用。
5 神经系统的调节作用
ISPS的产生是否与神经系统的活动有关,是我们十分关心的问题。如果与神经系统毫无关系,这将是一免疫学的问题,而不属于神经免疫的领域。
5.1 中枢机制
我们以乌拉坦对小鼠作全身麻醉后再作束缚处理。结果表明,全身麻醉加束缚的动物血清,与不应激动物的血清一样,对淋巴细胞转化毫无抑制作用。如果以戊巴比妥作全身麻醉,束缚后动物血清的抑制活性虽然没有完全被取消,但也明显降低[2]。戊巴比妥翻转作用小于乌拉坦的原因,有可能是后者的麻醉作用时间短于前者。全身麻醉可以完全取消或明显降低束缚应激的作用,说明中枢神经系统的作用介导了ISPS的产生。
, 百拇医药
究竟中枢神经系统中哪种机制在这一过程中起主要作用?我们首先注意到了脑内IL-1。IL-1是由巨噬细胞产生的一种细胞因子,在免疫应答中起重要的调节作用。近年来的研究表明,它也存在于脑内,可由神经细胞和胶质细胞分泌。从1986年开始注意到它对神经内分泌功能的调节作用。证明它是联系神经和内分泌系统的重要介导物质。它除直接的免疫调节作用外,主要还有以下4种作用:对体温、睡眠、进食和神经内分泌功能有调节作用。近年来发现它通过神经系统对免疫功能具有很强的调节作用。由于它的这些作用,被认为是神经和免疫系统之间的桥梁物质并将其称之为“免疫神经递质,immunoneuro-transmitter”。它的另一特点是有内源性受体拮抗剂(IL-1Ra)。IL-1Ra是1990年克隆成功的一种蛋白质。能阻断IL-1的作用,现已证明在脑内也有它的存在。
我们首先以IL-1内源性受体阻断剂(IL-1Ra)作脑室注射。发现注射后可以明显对抗束缚应激的作用,使血清中ISPS的产生明显减少。当剂量达到5μg/只时,ISPS的产生完全被阻断。如果以极微量的IL-1β(1pg)作脑室注射,可以加强血清中由应激产生的ISPS。IL-1Ra和IL-1β不仅可以影响血清中ISPS的产生,同样可以影响淋巴结和脾ISPS的产生[10,11]。
, http://www.100md.com
由于IL-1是一种很强的升高体温的致热源,脑室注射后可以明显升高动物体温。上述作用是否由于体温升高所引起。从文献看,5ng的IL-1β作脑室注射可升高体温。而我们使用的IL-1β仅为1pg,远远小于上述剂量。为了进一步排除IL-1β这一作用,我们监测了动物的肛温。在注射IL-1β后的18h内,每30min测定一次体温,未发现体温有任何升高。此外,为了进一步了解脑室注射IL-1β后是否可以通过弥散作用到达外周而起作用的问题,我们以同样剂量的IL-1β做腹腔注射,未见对ISPS的产生有任何影响[10]。
我们还研究了脑内γ氨基丁酸(gamma aminobutyric acid, GABA)的作用。证明脑 内GABA也对ISPS的产生有调节作用。 注射氨氧乙酸(aminooxy acetic acid, AOAA)或注射安定增加脑内GABA的作用,可明显降低 ISPS的生成,而以3-巯基 丙酸(3-mercaptopropionic acid)阻断GABA的生成后,ISPS的生成受到明显抑制[1 2,13]。
, 百拇医药
虽然目前我们还不完全了解中枢神经系统的作用机制和通路,但以上结果从不同侧面说明 中枢神经系统的作用是产生ISPS的必要条件。
5.2 外周机制
中枢神经系统对内脏活动的调节可以有两条途径:下丘脑-垂体-肾上腺轴和 植物性神经系统。我们前面的实验证明,切除肾上腺后束缚仍然可以引起ISPS的生成,说明 垂体-肾上腺轴在ISPS的生成中不起主要作用。随后我们对交感神经的作用进行了研究。6 - 羟多巴胺(6-OHDA)可以选择性地被交感神经末梢重吸收。6-OHDA进入细胞内在酶的作用下 变 成一种能破坏神经末梢的毒素,从而损害交感神经纤维从而降低交感神经的作用,称之为“ 化学 性切断交感神经”。我们的研究证明注射6-OHDA后血清中去甲肾上腺素的浓度明显降低 ,说明交感神经的作用已经被阻断。此时,束缚应激后ISPS的生成受到明显抑制(另文发表 )。如果刚出生的小鼠接受6-OHDA的注射,成年后交感神经的功能仍然很低。对这一动物模型 也 进行了研究,发现束缚应激后ISPS的生成受到明显抑制。由于注射6-OHDA 可能产生某 些其它的副作用,为了进一步证明注射6-OHDA 对ISPS生成的调节作用是通过破坏交感神经 所引起,我们设计了另一对照试验,即在注射6-OHDA之前注射去甲丙咪嗪(desipramine), 阻断交感神经重吸收6-OHDA,从而保护交感神经。结果表明6-OHDA不再对ISPS的生成有任 何作用。说明6-OHDA的作用不是由它的其它副作用所引起。
, 百拇医药
已知交感神经末梢是通过释放去甲肾上腺素而发挥作用。上述交感神经的作用是否也是通过释放去甲肾上腺素引起?如果也是通过释放甲肾上腺素,在体外试验中,去甲肾上腺素应当也可以促进淋巴细胞生成ISPS。为此,我们以不同浓度的去甲肾上腺素培养正常淋巴细胞,再测定淋巴细胞提取物是否也能抑制正常淋巴细胞的转化。结果使我们很失望,提取液不能抑制正常淋巴细胞的转化。后来发现,如果在培养液中加入ConA活化T细胞,10-5mol.L-1以上的去甲肾上腺素可以刺激淋巴细胞生成ISPS(另文发表)。
以上结果从不同侧面证明交感神经介导了ISPS的生成。去甲肾上腺素在体外也可以引起ISPS生成,使我们得到了一种体外生成ISPS的实验模型,为进一步深入研究ISPS的生成机制创造了条件。
至此,我们可以认为以下结论是正确的:束缚应激首先作用于中枢神经系统,再以交感神经为介导,通过释放去甲肾上腺素,使淋巴细胞生成ISPS。
, 百拇医药
6 ISPS单克隆抗体的制备及ISPS生成的细胞定位
6.1 ISPS单克隆抗体的制备[14]
制作单克隆抗体并不需要十分纯的抗原,如果制备成功单克隆抗体,将为进一步纯化蛋白和基因克隆创造十分有利的条件。
6.1.1 抗原的制备 制作单克隆抗体需要2种抗原:一种抗原(抗原1)是用作给小鼠注射产生抗体;另一种抗原(抗原2)是在细胞克隆中用于筛选细胞。后者的纯度要求更高一些。本研究的抗原1是在酸提取后经硫酸铵沉淀,再经超滤去除相对分子质量100000以下的物质。最后经活性检测具有活性的蛋白用作注射。抗原2有两种,一种是应激抗原,一种是对照抗原。应激抗原的的制备是在抗原1的基础之上,再经G200的凝胶过滤分离,经活性检测具有抑制活性的组份。对照抗原的制作方法与应激抗原完全相同,只是蛋白来源于不应激动物。两者都用于细胞克隆。
, http://www.100md.com
6.1.2 免疫小鼠、细胞融合和筛选 以抗原1给BALB/c小鼠作腹腔注射,取其脾脏与SP2/0肿瘤细胞(myeloma)制成杂交瘤细胞(hybridoma)。以抗原2作酶标(ELASA)检测。凡细胞培养上清液能和应激抗原2有很强反应,而与对照抗原2反应很弱的细胞保留。最后成功获得了一株细胞(2C4)。
6.1.3 单克隆抗体的制备和检测 以上述杂交瘤细胞给小鼠作腹腔注射,腹腔液经硫酸铵沉淀和亲和层析(agarose-protein A column)获得单克隆抗体。WesternBlot检测发现,抗原经SDS处理后不能与此单抗相结合。如果抗原不作SDS处理,可以看到一条十分弥散的条带。SDS处理后不能与此单抗相结合的原因有可能是经SDS处理后,打开了蛋白质的空间结构,而本单克隆抗体只能识别这一蛋白的空间抗原决定簇。在功能检测的试验中,此单克隆抗体可以部分翻转应激血清和应激组织提取物的抑制活性。说明此单抗是有活性的。
以上的实验说明,此单抗具有以下特性:(1)它是由相对分子质量大于100000的抗原(蛋白)所诱导产生;(2)诱导产生抗体的蛋白来源于应激后的淋巴组织;(3)它能识别相对分子质量大于100000的抗原;(4)它具有部分对抗ISPS抑制淋巴细胞转化的活性。这些特性说明2C4具有与ISPS特异性相结合的特性。
, 百拇医药
6.2 产生ISPS细胞类型的研究
6.2.1 生物活性的研究
首先从脾和淋巴结中分离不同类型的细胞,然后制备成提取液,以淋巴细胞转化为生物检测手段,研究ISPS生成的细胞来源。
单个核细胞:从脾和淋巴结中获得细胞,以分层液(Ficoll-urografin,比重1.085)分离单个核细胞。再以我们实验室常规酸提取方法制备提取液,并以淋巴细胞转化实验检查提取液的生物活性。结果表明,应激后单个核细胞提取物具有明显抑制正常淋巴细胞转化的作用。说明ISPS存在于单个核细胞之中。
T和B细胞:以兔抗小鼠Ig平皿亲和法从上述细胞中分离B和T细胞。以FITC标记CD3和兔抗小鼠Ig,在流式细胞仪(FACS)中分别测定T和B细胞数。结果表明T和B细胞在各自细胞中所占的比例分别为93%和95%。将这些细胞以上述同样方法制备成提取液并作淋巴细胞转化检测。结果表明,应激T细胞提取液具有明显抑制淋巴细胞转化的作用,而应激B细胞提取液对淋巴细胞转化毫无影响。说明T细胞含有ISPS而B细胞则无。
, 百拇医药
回归和相关分析:为了进一步分析ISPS和T细胞之间的关系。我们以每一份标本的T细胞数为X,以同一份标本的淋巴细胞转化值(min-1)为Y作相关和回归分析。结果表明,它们之间呈明显的负相关(y=30356-4998x,r=0.936,n=5,P<0.01)。即T细胞数越多的标本,抑制淋巴细胞转化的作用也强,淋巴细胞转化值(min-1)低。提示T细胞数越多的标本,产生的ISPS也越多。
6.2.2 免疫组织化学研究
由于我们得到了抗ISPS的单克隆抗体(2C4),以此单抗作免疫组化研究,可以从形态学上观察ISPS的分布。
组织切片:摘取腹腔淋巴结、脾脏、胸腺、全脑皮层和动物后肢一小片骨骼肌,取出后以10%(体积分数)的福尔马林固定,作石蜡包埋切片(5μm)。以ABC法对组织片和涂片作检查。结果表明,应激后大鼠脑和骨骼肌的切片未见2/C4阳性细胞(含ISPS细胞),脾脏、淋巴结、胸腺以及小肠的切片显示出很多2/C4阳性细胞。以影象分析仪测定切片光密度和面积的结果表明,应激大鼠脾切片阳性着色面积(着色面积和总面积的百分数为27.3%±0.8%)和单位密度(单位面积D为0.360±0.006)均大于不应激大鼠的脾(12.70%±0.08%和0.180±0.009)(P<0.01,n=4,t检验)。这一结果与我们前述的以组织提取物分析ISPS产生来源的结果十分吻合。免疫组化的结果从形态上证明脾、淋巴结、胸腺以及小肠中有ISPS。在淋巴结切片中,着色最深的部位在副皮质区(T淋巴细胞集中分布的区域)。这再次提示ISPS可能由T细胞产生。
, 百拇医药
细胞涂片:以T和B细胞悬液(2×107ml-1)50μl滴于载玻片上,风干后以甲醇固定。同样以ABC法检查涂片。以FACS检测T和B细胞的分离纯度,它们分别为95.2%±3.7%和96.3%±6.8%。在T细胞涂片上,无论细胞来自应激或不应激动物都可见到很多2C4阳性细胞。而在B细胞涂片上则很少看到(图3)。以FACS计数2C4阳性细胞的结果表明,应激大鼠的阳性细胞占45.3%±4.6%,不应激大鼠的阳性细胞占16.4%±2.2%(P<0.01,n=6,t检验)。在B细胞的涂片上,应激和不应激大鼠2C4阳性细胞所占的比例都很小,分别为1.5%±1.1%和0.7%±0.9%。(P>0.05,n=6,t检验)。

Many positive staining cells were in the T cell population, especially in T cell s from stressed rats. There were few positive staining cells in the B cell popul ation from either stressed or unstressed rats.×600, 5μm.
, http://www.100md.com
图3 T和B细胞的免疫组织化学涂片
Figure 3 Immunohistochemical staining of T and B lymphocytes
此外,我们还以CD3-FITC及2C4-PE作荧光抗体双标记,以显示CD3(T细胞)和2C4双阳性细胞。并以共聚焦显微镜检查涂片。结果表明2C4阳性和CD3双阳性细胞是在同一细胞之中。这进一步证明ISPS可以由T细胞产生。
以上从功能和形态两方面证明,T细胞可以产生ISPS,B细胞不能。
7 ISPS的功能
ISPS具有明显抑制淋巴细胞转化的作用,但这并不意味抑制淋巴细胞转化是它的唯一作用。由于我们可以制备ISPS部分纯化的产品,用这种产品作研究,发现ISPS对由LPS诱导的淋巴细胞转化也具有抑制作用。说明它可能对B淋巴细胞的转化有抑制作用[2]。另一研究证明,ISPS在体外培养中能抑制T细胞释放IL-2,对巨噬细胞释放IL-1没有作用[15]。在整体的研究中,发现它有降低正常大鼠动脉血压的作用,对心率的作用不明显。它的降血压机制目前还不了解[16]。此外,在以四氧嘧啶(alloxan)诱导大鼠产生糖尿病的大鼠,ISPS似乎具有对抗作用[17]。在佐剂性关节炎的大鼠,血清中ISPS的含量明显增高,当关节炎的症状在第21天达到最高峰时,血中的ISPS也到达最高峰。在第35天关节炎症状明显减弱,血清的抑制作用也明显减弱。两者有一正相关关系。目前还不知道它们之间的因果关系(待发表)。在银屑病(牛皮癣)人中,血清中ISPS的含量也升高。免疫组化研究发现,银屑病病人皮损区有很多ISPS阳性细胞[18]。ISPS和银屑病究竟有何关系,是值得进一步研究的问题。由于我们目前还没有拿到ISPS的纯品,也没有得到它的多克隆抗体,无法展开大规模研究,上述结果都是初步的。从目前这些并不系统的研究中,可以看出这一蛋白可能与某些自家免疫病有关。
, http://www.100md.com
我们在人体也作了一些研究。一组8名冬训期间超强运动(每天骑车180km)的运动员,运动10d后的血清具有明显抑制淋巴细胞转化的作用。休息12d后恢复正常。以HPLC测定这种抑制物的相对分子质量为150000。说明人体也可以产生ISPS[19]。我们在另一组正常自愿受试者中,进行大运动量实验,7d后受试者血清也具有明显抑制淋巴细胞转化的作用。这种作用似乎与受试者的情绪评分呈正相关。此外,我们在小鼠耗竭性游泳实验中,证明血中可产生ISPS。但寒冷刺激的应激不能诱导ISPS的产生[20]。从这些结果看,动物不运动(束缚)和动物及人强烈运动都可以产生ISPS。再结合上述自愿受试者的实验结果,提示这种蛋白可能与精神因素有关。是否为精神活动影响免疫功能的一种介导物质,我们正在建立精神影响免疫功能的动物模型,观察ISPS是否在其中有重要的作用。
8 神经系统和免疫系统之间的相互作用[21,22]
, 百拇医药 目前已有很多的研究证明,神经内分泌和免疫系统之间的相互作用,对机体在不同条件下稳态的维持起着决定性的作用。这是对传统神经内分泌调节概念的一种修正和补充。新的观点认为,免疫系统不仅是机体的一种防卫系统,它同时还是机体的一种重要的感受和调节系统。又由于免疫细胞可随血流循环在全身各处移动,因此提出免疫系统可以起“游动脑(mobilebrain)”的作用[23]。这一概括形象地勾画出了免疫系统的这种重要功能。
神经系统可以感受精神和躯体的刺激。免疫系统可感受肿瘤、病毒、毒素等的刺激。因此神经内分泌系统和免疫系统在体内成为机体的两大感受和调节系统,即两个“脑”。它们通过一些共同的介导物质(共同的生物学语言)交换信息,相互作用,使机体在生理和病理条件下保持稳态(图4)。我们发现和研究的ISPS可能是联系这两大系统的介导物质,特别是它的产生可能与精神活动有关,因此有可能是精神调节免疫功能的重要介导物质。它具有以下两个特点,一是相对分子质量很大,不像是已知的细胞因子、干扰素、肽类激素、神经肽等;二是它的独特生成机制,它是在应激条件下,通过中枢神经系统作用,再以交感神经为介导,通过释放去甲肾上腺素,在T淋巴细胞生成的,这种生成方式尚未见到类似的报道。在这一思路下,有可能发现更多的新蛋白质,成为一个新的研究领域。

, http://www.100md.com
图4 神经内分泌和免疫系统之间的相互作用
Figure 4 Interaction between nervou s, endocrine and immune system
☆ 自由词。
参考文献
1 范少光,查宏斌.束缚应激小鼠血清免疫抑制因子的产生及其调 节.科学通报, 1989, 34:1584-1587
2 Zha HB, Ding GF, Fan SG. Serum factor(s) induced by res traint stress in mic e and rats suppresses lymphocyte prolifration. Brain Behav Immun, 19 92,6:18-31
, 百拇医药
3 马 丽,邓玉兰,丁桂凤,等.束缚应激血清对免疫功能的影响 .中国神经免疫学及神经病学杂志, 1997,4:207-211
4 Huang QJ,Jiang C, Fan SG. Effective time o f immuno-suppressive protein in serum. Chn Sci Bull, 1998, 43:1387-1389
5 Weiss. JM, Sander SK, Becher KJ, et al. Behavioral and neur al influences on cellular immune response: effects of stress and interleukin-1. J Clin Psychiatry, 1989, 50:43-53
6 邵 黎,高 珊,张 勤,等.束缚应激能引起淋巴细胞产生 抑制淋巴细胞转化的因子.科学通报,1995, 40:164-166
, 百拇医药
7 汪静雪,陈 薇,梅 林,等.束缚应激动物血清中 免疫抑制因子产生部位的研究. 生理学报,1992, 44:9-16
8 Fan SG. Gao S, Li S, et al. A suppressive factor in lymph node and spleen induced by restraint stress suppresses lymphocyte proliferaation. Neuroi mmunomodulation, 1995,2, 274-281
9 Huang QJ, Zhou XS, Fan SG. Effect of th e extract of intestine from stressed rat on lymphocyte proliferation in vitro. Chn Sci Bull, 199 8, 43:1465-1467
, 百拇医药 10 Zuo YC; YF Li, Mei L, et al. Brain interleukin 1 i n the brain i s involved in generation of the serum suppressive factor induced by restraint st ress in mice. Neuroimmunomodulation, 1995, 2:82-87
11 李一凡,左永昌,丁桂凤,等.脑室注射白细胞介素1对淋巴细胞应激免 疫抑制因子生成的影响.药学学报,1995, 30:395-399
12 汪静雪,梅 林,陈 薇,等.GABA能神经元对抗束缚应 激后血清淋巴细胞转化抑制因子的产生.中国应用生理学杂志,1992, 8:120-124
13 Wang JX, Mei L, Tang HY, et al. An antagonistic e ffect of c entral GABA ergic system on the generation of serum suppressive factor(s) induce d by restraint stress in mice. Chn Sci Bul, 1993, l38:1230-1232
, 百拇医药
14 李乐群,邵 黎,吴晓婷,等.束缚应激免 疫抑制因子单克隆抗体的研制.北京医科大学学报,1998,30:574-575
15 刘 薇,范少光,丁桂凤.应激免疫抑制蛋白对免疫细胞功能的影响.北京医科大 学学报, 1997,29:86-87
16 汪静雪,李怡凡,黄庆军.应激免疫抑制蛋白降低大鼠动脉血压.北京医科 大学学报, 1998,30:449-500
17 高 珊,梅 林,范少光.束缚应激免疫抑制因子对抗由四氧嘧啶所致大鼠 糖尿病的发生.中国神经免疫学和神经病学杂志, 1996,3:96-99
18 杨雪琴,邵 黎,范少光.银屑病患者血清中神经免疫蛋白抑制淋巴细胞转 化的研究.中华皮科杂志, 1998,31:30-32
19 邵 黎,乔 伟,朱哓松,等.运动员剧烈运动后血中应激免疫抑制蛋 白的产生.中国应用生理学杂志, 1997,13:312-315
, 百拇医药
20 邵 黎,朱晓松,孙长伟,等.小鼠耗竭性游泳及寒冷对应激免疫抑 制蛋白的不同作用.北京医科大学学报, 1997, 29:323-325
21 范少光,丁桂凤.神经内分泌和免疫系统相互作用的介导物质:共用的生物学 语言.生理科学进展, 1995,26:175-183
22 Fan SG, Shao L, Ding GF. A suppressive protein generated in p eripheral lymph tissue induced by restraint stress. Adv Neuroimmunol, 1996,6:279-288
23 Blalock E, Smith EM. The immune system: our mobile brain. Immuno l Today, 1985,6:115-117
(1999-04-12收稿), http://www.100md.com