骨巨细胞瘤中成纤维样基质细胞体外钙化能力的研究
作者:赵宁侠 于世凤
单位:北京医科大学口腔医学院口腔病理研究室,北京 100081
关键词:巨细胞瘤;骨;成纤维样基质细胞☆;骨钙素;代谢;钙化;生理性;碱性磷酸酶;代谢
北京医科大学学报990424 摘 要 目的:探讨骨巨细胞瘤的组织来源。方法:体外培养。Gomori法碱性磷酸酶染色,生化检测细胞培养上清液中的碱性磷酸酶含量。免疫组织化学染色检测骨钙素在成纤维样基质细胞中的表达。使用含B-甘油磷酸钠和CaCl2的培养液,观察成纤维样基质细胞体外钙化能力。结果:成纤维样基质细胞中碱性磷酸酶和骨钙素呈阳性表达,在体外具有钙化能力。在细胞培养上清液中有碱性磷酸酶。结论:骨巨细胞瘤中的成纤维样基质细胞具有某些成骨细胞的特点,为进一步探讨其组织来源提供了实验依据。
中国图书资料分类法分类号 R738.1
, http://www.100md.com
Calcification by the fibroblast-like stromal cell from giant
cell tumour of bone in vitro
ZHAO Ning-Xia, YU Shi-Feng
(Department of Pathology, School of Stomatology, Beijing Medical University, Beijing 100081)
ABASTRACT Objective: To study the origin of the giant cell tumour of bone(GCT). Methods: It was culture in vitro. The expression of alkaline phosphatase (AlP) in the fibroblast-like stromal cell (FSTC) was detected by Gomori method and the osteocalcin expression by immunhistochemistry method. AlP in the culture medium was assayed by biochemical method. The capability of calcification in vitro was by FSTC. Results: FSTC expressed AlP and osteocalcin. In the culture medium, there was AlP also. FSTC could format calcification grain in vitro. Conclusion: FSTC has some osteoblast features. Our findings may provide a basis for further discussing the origin of the GCT.
, http://www.100md.com
MeSH Giant cell tumour of bone Fibroblast-like stromal cell☆ Osteocalcin/metab Calcification, physiologic Alkaline phosphatase/metab
关于骨巨细胞瘤(giant cell tumor of bone, GCT)的来源一直存有争议,尽管学者们一致认为GCT中成纤维样基质细胞(fibroblast-like stromal cell, FSTC)是肿瘤实质成份,破骨样细胞(osteoclast-like cell, OLC)和巨噬细胞型单核基质细胞(macrophage-like stromal cell, MSTC)是其反应性细胞[1,2],但有关FSTC究竟起源于何种组织,仍不十分清楚。
与骨代谢密切相关的细胞主要有两种,即破骨细胞和成骨细胞。GCT中存在具有破骨细胞特点成熟和前体细胞[3,4],因此,推测FSTC可能是一种与破骨细胞相关系的细胞。基于以上特点,本文采用鉴定成骨细胞的标志,对FSTC的某些生物学特征进行观察研究。
, http://www.100md.com
1 材料与方法
1.1 FSTC的体外分离培养
4例GCT采用酶消化法,将消化液内的FSTC细胞清洗,传代培养(每周一次),部分细胞种于玻片上,以备以下实验。1.2 检测AlP
Gomori法AlP染色:取出长有FSTC的玻片(<5代),PBS漂洗,95%(体积分数)乙醇固定1 min,入孵育液20 g.L-1β甘油磷酸钠25 ml,20 g.L-1巴比妥钠25 ml,蒸馏水50 ml,20 g.L-1CaCl2 5 ml,20 g.L-1硫酸镁2 ml,氯仿数滴,37 ℃,1~3 h。取出玻片,蒸馏水洗,20 g.L-1硝酸钴处理2 min,水洗1 min去除多余硝酸钴。10 g.L-1黄色硫化铵处理1 min,水洗2 min后脱水、透明、封固。
, http://www.100md.com
取1例培养到第4代的FSTC,充分混匀,种于24孔培养板(每孔2×105),10 h后清洗,换等量无血清培养液(1 ml),分别于细胞贴壁后第16、24小时、第2、3、4、5、6天取条件培养液上清,每个时间点取4个样孔,进行生化检测AlP,同时胰酶消化,对其相应时间点的细胞在计数板下计数。取平均值。
1.3 骨钙素免疫组织化学染色
取第3、6、10代FSTC细胞玻片,PBS洗,95%(体积分数)乙醇固定5 min:(1)0.5%(体积分数)Trison-X100,10 min,(2)PBS洗3次,入0.88 mol.L-1 H2O2,5 min,(3)PBS洗3次,1∶10(体积比)正常羊血清封闭10 min,(4)吸去血清,滴加骨钙素抗体(体积比1∶200)4 ℃过夜,(5)PBS漂洗3次,滴加生物素标记的二抗1∶400(体积比)室温下30 min,(6)PBS洗3次,滴加1∶400的链霉卵白素三抗,室温下30 min,(7)PBS洗,DAB显色5 min(PBS代替1抗作阴性对照)。
, 百拇医药
1.4 FSTC体外钙化能力检测
第3代FSTC从接种当天开始,采用特殊培养液(含体积分数为10%的FCS的α-MEM 200 ml,维生素C 50 mg.L-1,β-甘油磷酸钠3~10 mol.L-1),CaCl2 100 mg.L-1进行培养,隔天换液。4周后取出盖玻片,95%(体积分数)乙醇固定,利用茜素红对钙染色:(1)5 g.L-1茜素红溶液染色20 min,(2)巴比妥缓冲液漂洗5 min,(3)100%(体积分数)乙醇漂洗2 min,封片,光镜下检查。
2 结果
2.1 AlP表达
FSTC使用Gromori染色,可见胞浆内有黑色颗粒样沉淀(图1)。在体外培养的FSTC上清内,可测得AlP,其含量随培养时间延长而增加,前3 d增加较快,3 d后减慢,与细胞增殖基本符合(表1)。
, http://www.100md.com
表1 AlP(U/L)与细胞数(×105)随时间延长、细胞增加,AlP增加
Table 1 Mean of AlP(U/L) and cells (×105) at different time (n=4, ±s)
±s)
16 h
1 d
2 d
3 d
4 d
5 d
6 d
, http://www.100md.com
ρ(ALP)/U.L-1
5.50±1.29
9.00±0.82
12.75±0.96
15.00±1.83
16.25±0.96
16.75±0.50
17.25±0.96
Number of cell/×105
2.30±0.16
, 百拇医药 4.78±0.25
7.38±0.05
9.23±0.13
10.03±0.30
10.45±0.40
10.93±0.39
2.2 骨钙素表达
免疫组化显示,第3代、6代和10代的FSTC皆有骨钙素表达,胞浆内呈棕色。其中第10代染色明显降低(图2)。
2.3 体外钙化能力
经茜素红染色,可见密集细胞之间散在许多红染的钙化颗粒,部分区域可见阳性反应物互相融合,形成大小不一的团块(图3)。
, 百拇医药
3 讨论
作为GCT的实质成份,FSTC的细胞来源一直悬而未决,关于其来源的假说也众说纷纭。但是,最近有资料显示,FSTC具有成骨细胞的某些特征[5,6],如有AlP和Ⅰ型胶原表达、具有趋化破骨细胞和调节其功能的作用等[7]。
本研究采用鉴定成骨细胞的指标,对FSTC进行了观察,结果显示:(1)FSTC不仅能合成AlP,还能分泌AlP。其分泌量与细胞生长分化呈平行关系;(2)骨钙素表达阳性;(3)体外长期培养,具有钙化能力。其中体外钙化能力是鉴定成骨细胞的重要依据,这是因为成骨细胞能够直接参与钙、磷代谢,与非骨组织相比有更高的钙摄入率。其钙化机制可能是成骨细胞内的AlP以培养液中的β-甘油磷酸钠为底物,使有机磷向无机磷转化,从而使培养液内的钙盐沉淀。
本研究还观察到,随体外传代次数增加,FSTC中的骨钙素含量下降。这可能与FSTC在体外反复传代后,其生物学特征丢失有关,这种现象在其它培养的细胞株中也可观察到。James等[8]采用不同代FSTC注入动物体内,观察到FSTC在动物体内可形成骨组织,但随FSTC体外传代次数增加,其在动物体内形成骨的能力下降,也说明了这一点。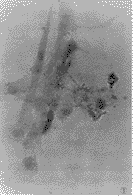
, 百拇医药
图1 Gomori法染色,体外的FSTC中AlP呈阳性表达。胞浆内有黑色颗粒。光镜×512
Figure 1 FSTC cultured in vitro express AlP stained by Gomori method. There are some black grains in the cells. LM×512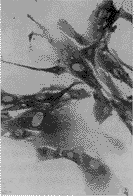
图2 体外培养的FSTC中骨钙素免疫组织化学染色呈阳性表达。光镜×640
Figure 2 FSTC cultured in vitro express osteocalcin stained by immunohistochemical method. LM×640
, http://www.100md.com
图3 FSTC在特殊培养液下培养数月,茜素红染色可见钙化颗粒 相差显微镜×256
Figure 3 FSTC cultured in special mediurn for 1 month, there are some calcification grains in the cells. phase contrast light microscopy×256
总之,本研究结果(1)为说明GCT可能来源于成骨细胞某一分化阶段的细胞亚群,提供了一定依据。(2)从另一方面,进一步说明了OLC可能是破骨细胞,是由于具有成骨细胞特征的FSTC吸引、诱导和分化而来。两者组成了含有骨器官中赖以作用的成骨细胞和破骨细胞的肿瘤体系。(3)为研究成骨细胞与破骨细胞相互作用,以及成骨细胞对破骨细胞前体的分化、成熟影响,提供体外模型,具有参考价值。
(本研究采用的骨巨细胞瘤病例由积水潭医院肿瘤科提供,谨致谢意。)
, http://www.100md.com
国家自然科学基金(39330220)资助项目。
参考文献
1 Zhang Y. Cellular elements in giant cell tumour of bone, feulgen-DNA quantitation H-TdR incorportation and ultrastructure observation. Chin Med J, 1986,99:268-269
2 Bayer VS. Quantitive immunofluorescence studies of the tumour antigen-bearing cell in giant cell tumour of bone and osteogenic sarcoma. Cancer Res, 1975,35:2520
3 Nicholson GC, Horton MA, Sexton PM. Calcitonin resorptors of human osteoclastoma. Horm Metabol Res, 1987,19:585-589
, 百拇医药
4 Zheng MH, Fan Y, Wysocki S, et al. Detection of mRNA for carbonic annhydrase Ⅱ in human osteoclast-like cells by in situ hybridization. J Bone Mineral Res, 1993,8:113-117
5 Aqel NM, Pringle JAS, Horton MA. Cellular heterogeneity in giant cell tumour of bone (osteoclastoma): an immunohistological study of 16 cases. Histopathology, 1988,13:675-685
6 Robinson D, Einhorn TA. Giant cell tumour of bone: A unique paradigm of stromal-hematopoietic cellular interactions. J Cell Biochem, 1994,55:300-303
, http://www.100md.com
7 Zheng MH, Fan Y, Wysocki SJ, et al. Gene expression of transforming growth factor β1 and its type Ⅱ receptor in giant cell tumour of bone. Am J Pathol, 1994,145(5):1 095-1 104
8 James IE, Dodds RA. Olivera DL. Human osteoclastoma-derived stromal cell: correlation of the ability to from mineralized modules in vitro with formation of bone in vivo. J Bone Mineral Res, 1996,11(10):145-146
(1998-08-26收稿), http://www.100md.com
单位:北京医科大学口腔医学院口腔病理研究室,北京 100081
关键词:巨细胞瘤;骨;成纤维样基质细胞☆;骨钙素;代谢;钙化;生理性;碱性磷酸酶;代谢
北京医科大学学报990424 摘 要 目的:探讨骨巨细胞瘤的组织来源。方法:体外培养。Gomori法碱性磷酸酶染色,生化检测细胞培养上清液中的碱性磷酸酶含量。免疫组织化学染色检测骨钙素在成纤维样基质细胞中的表达。使用含B-甘油磷酸钠和CaCl2的培养液,观察成纤维样基质细胞体外钙化能力。结果:成纤维样基质细胞中碱性磷酸酶和骨钙素呈阳性表达,在体外具有钙化能力。在细胞培养上清液中有碱性磷酸酶。结论:骨巨细胞瘤中的成纤维样基质细胞具有某些成骨细胞的特点,为进一步探讨其组织来源提供了实验依据。
中国图书资料分类法分类号 R738.1
, http://www.100md.com
Calcification by the fibroblast-like stromal cell from giant
cell tumour of bone in vitro
ZHAO Ning-Xia, YU Shi-Feng
(Department of Pathology, School of Stomatology, Beijing Medical University, Beijing 100081)
ABASTRACT Objective: To study the origin of the giant cell tumour of bone(GCT). Methods: It was culture in vitro. The expression of alkaline phosphatase (AlP) in the fibroblast-like stromal cell (FSTC) was detected by Gomori method and the osteocalcin expression by immunhistochemistry method. AlP in the culture medium was assayed by biochemical method. The capability of calcification in vitro was by FSTC. Results: FSTC expressed AlP and osteocalcin. In the culture medium, there was AlP also. FSTC could format calcification grain in vitro. Conclusion: FSTC has some osteoblast features. Our findings may provide a basis for further discussing the origin of the GCT.
, http://www.100md.com
MeSH Giant cell tumour of bone Fibroblast-like stromal cell☆ Osteocalcin/metab Calcification, physiologic Alkaline phosphatase/metab
关于骨巨细胞瘤(giant cell tumor of bone, GCT)的来源一直存有争议,尽管学者们一致认为GCT中成纤维样基质细胞(fibroblast-like stromal cell, FSTC)是肿瘤实质成份,破骨样细胞(osteoclast-like cell, OLC)和巨噬细胞型单核基质细胞(macrophage-like stromal cell, MSTC)是其反应性细胞[1,2],但有关FSTC究竟起源于何种组织,仍不十分清楚。
与骨代谢密切相关的细胞主要有两种,即破骨细胞和成骨细胞。GCT中存在具有破骨细胞特点成熟和前体细胞[3,4],因此,推测FSTC可能是一种与破骨细胞相关系的细胞。基于以上特点,本文采用鉴定成骨细胞的标志,对FSTC的某些生物学特征进行观察研究。
, http://www.100md.com
1 材料与方法
1.1 FSTC的体外分离培养
4例GCT采用酶消化法,将消化液内的FSTC细胞清洗,传代培养(每周一次),部分细胞种于玻片上,以备以下实验。1.2 检测AlP
Gomori法AlP染色:取出长有FSTC的玻片(<5代),PBS漂洗,95%(体积分数)乙醇固定1 min,入孵育液20 g.L-1β甘油磷酸钠25 ml,20 g.L-1巴比妥钠25 ml,蒸馏水50 ml,20 g.L-1CaCl2 5 ml,20 g.L-1硫酸镁2 ml,氯仿数滴,37 ℃,1~3 h。取出玻片,蒸馏水洗,20 g.L-1硝酸钴处理2 min,水洗1 min去除多余硝酸钴。10 g.L-1黄色硫化铵处理1 min,水洗2 min后脱水、透明、封固。
, http://www.100md.com
取1例培养到第4代的FSTC,充分混匀,种于24孔培养板(每孔2×105),10 h后清洗,换等量无血清培养液(1 ml),分别于细胞贴壁后第16、24小时、第2、3、4、5、6天取条件培养液上清,每个时间点取4个样孔,进行生化检测AlP,同时胰酶消化,对其相应时间点的细胞在计数板下计数。取平均值。
1.3 骨钙素免疫组织化学染色
取第3、6、10代FSTC细胞玻片,PBS洗,95%(体积分数)乙醇固定5 min:(1)0.5%(体积分数)Trison-X100,10 min,(2)PBS洗3次,入0.88 mol.L-1 H2O2,5 min,(3)PBS洗3次,1∶10(体积比)正常羊血清封闭10 min,(4)吸去血清,滴加骨钙素抗体(体积比1∶200)4 ℃过夜,(5)PBS漂洗3次,滴加生物素标记的二抗1∶400(体积比)室温下30 min,(6)PBS洗3次,滴加1∶400的链霉卵白素三抗,室温下30 min,(7)PBS洗,DAB显色5 min(PBS代替1抗作阴性对照)。
, 百拇医药
1.4 FSTC体外钙化能力检测
第3代FSTC从接种当天开始,采用特殊培养液(含体积分数为10%的FCS的α-MEM 200 ml,维生素C 50 mg.L-1,β-甘油磷酸钠3~10 mol.L-1),CaCl2 100 mg.L-1进行培养,隔天换液。4周后取出盖玻片,95%(体积分数)乙醇固定,利用茜素红对钙染色:(1)5 g.L-1茜素红溶液染色20 min,(2)巴比妥缓冲液漂洗5 min,(3)100%(体积分数)乙醇漂洗2 min,封片,光镜下检查。
2 结果
2.1 AlP表达
FSTC使用Gromori染色,可见胞浆内有黑色颗粒样沉淀(图1)。在体外培养的FSTC上清内,可测得AlP,其含量随培养时间延长而增加,前3 d增加较快,3 d后减慢,与细胞增殖基本符合(表1)。
, http://www.100md.com
表1 AlP(U/L)与细胞数(×105)随时间延长、细胞增加,AlP增加
Table 1 Mean of AlP(U/L) and cells (×105) at different time (n=4,
 ±s)
±s)16 h
1 d
2 d
3 d
4 d
5 d
6 d
, http://www.100md.com
ρ(ALP)/U.L-1
5.50±1.29
9.00±0.82
12.75±0.96
15.00±1.83
16.25±0.96
16.75±0.50
17.25±0.96
Number of cell/×105
2.30±0.16
, 百拇医药 4.78±0.25
7.38±0.05
9.23±0.13
10.03±0.30
10.45±0.40
10.93±0.39
2.2 骨钙素表达
免疫组化显示,第3代、6代和10代的FSTC皆有骨钙素表达,胞浆内呈棕色。其中第10代染色明显降低(图2)。
2.3 体外钙化能力
经茜素红染色,可见密集细胞之间散在许多红染的钙化颗粒,部分区域可见阳性反应物互相融合,形成大小不一的团块(图3)。
, 百拇医药
3 讨论
作为GCT的实质成份,FSTC的细胞来源一直悬而未决,关于其来源的假说也众说纷纭。但是,最近有资料显示,FSTC具有成骨细胞的某些特征[5,6],如有AlP和Ⅰ型胶原表达、具有趋化破骨细胞和调节其功能的作用等[7]。
本研究采用鉴定成骨细胞的指标,对FSTC进行了观察,结果显示:(1)FSTC不仅能合成AlP,还能分泌AlP。其分泌量与细胞生长分化呈平行关系;(2)骨钙素表达阳性;(3)体外长期培养,具有钙化能力。其中体外钙化能力是鉴定成骨细胞的重要依据,这是因为成骨细胞能够直接参与钙、磷代谢,与非骨组织相比有更高的钙摄入率。其钙化机制可能是成骨细胞内的AlP以培养液中的β-甘油磷酸钠为底物,使有机磷向无机磷转化,从而使培养液内的钙盐沉淀。
本研究还观察到,随体外传代次数增加,FSTC中的骨钙素含量下降。这可能与FSTC在体外反复传代后,其生物学特征丢失有关,这种现象在其它培养的细胞株中也可观察到。James等[8]采用不同代FSTC注入动物体内,观察到FSTC在动物体内可形成骨组织,但随FSTC体外传代次数增加,其在动物体内形成骨的能力下降,也说明了这一点。

, 百拇医药
图1 Gomori法染色,体外的FSTC中AlP呈阳性表达。胞浆内有黑色颗粒。光镜×512
Figure 1 FSTC cultured in vitro express AlP stained by Gomori method. There are some black grains in the cells. LM×512

图2 体外培养的FSTC中骨钙素免疫组织化学染色呈阳性表达。光镜×640
Figure 2 FSTC cultured in vitro express osteocalcin stained by immunohistochemical method. LM×640

, http://www.100md.com
图3 FSTC在特殊培养液下培养数月,茜素红染色可见钙化颗粒 相差显微镜×256
Figure 3 FSTC cultured in special mediurn for 1 month, there are some calcification grains in the cells. phase contrast light microscopy×256
总之,本研究结果(1)为说明GCT可能来源于成骨细胞某一分化阶段的细胞亚群,提供了一定依据。(2)从另一方面,进一步说明了OLC可能是破骨细胞,是由于具有成骨细胞特征的FSTC吸引、诱导和分化而来。两者组成了含有骨器官中赖以作用的成骨细胞和破骨细胞的肿瘤体系。(3)为研究成骨细胞与破骨细胞相互作用,以及成骨细胞对破骨细胞前体的分化、成熟影响,提供体外模型,具有参考价值。
(本研究采用的骨巨细胞瘤病例由积水潭医院肿瘤科提供,谨致谢意。)
, http://www.100md.com
国家自然科学基金(39330220)资助项目。
参考文献
1 Zhang Y. Cellular elements in giant cell tumour of bone, feulgen-DNA quantitation H-TdR incorportation and ultrastructure observation. Chin Med J, 1986,99:268-269
2 Bayer VS. Quantitive immunofluorescence studies of the tumour antigen-bearing cell in giant cell tumour of bone and osteogenic sarcoma. Cancer Res, 1975,35:2520
3 Nicholson GC, Horton MA, Sexton PM. Calcitonin resorptors of human osteoclastoma. Horm Metabol Res, 1987,19:585-589
, 百拇医药
4 Zheng MH, Fan Y, Wysocki S, et al. Detection of mRNA for carbonic annhydrase Ⅱ in human osteoclast-like cells by in situ hybridization. J Bone Mineral Res, 1993,8:113-117
5 Aqel NM, Pringle JAS, Horton MA. Cellular heterogeneity in giant cell tumour of bone (osteoclastoma): an immunohistological study of 16 cases. Histopathology, 1988,13:675-685
6 Robinson D, Einhorn TA. Giant cell tumour of bone: A unique paradigm of stromal-hematopoietic cellular interactions. J Cell Biochem, 1994,55:300-303
, http://www.100md.com
7 Zheng MH, Fan Y, Wysocki SJ, et al. Gene expression of transforming growth factor β1 and its type Ⅱ receptor in giant cell tumour of bone. Am J Pathol, 1994,145(5):1 095-1 104
8 James IE, Dodds RA. Olivera DL. Human osteoclastoma-derived stromal cell: correlation of the ability to from mineralized modules in vitro with formation of bone in vivo. J Bone Mineral Res, 1996,11(10):145-146
(1998-08-26收稿), http://www.100md.com