延迟整流性K+通道在人肝癌细胞增殖中的作用
作者:傅 卫 周孝思 张宗明 周培爱 吴才宏
单位:傅 卫 周孝思 张宗明 北京医科大学第三医院普通外科,北京 100083;周培爱 吴才宏 北京大学生物膜与膜生物工程国家重点实验室
关键词:延迟整流性K+通道☆;癌;肝细胞;代谢;钾通道;内皮生长因子;药理学
北京医科大学学报990409 摘 要 目的:研究延迟整流性K+通道在人肝癌细胞增殖中的作用。方法:采用膜片钳技术的全细胞记录方式记录人肝癌细胞在不同浓度EGF中延迟整流性K+通道的跨膜电流。利用氚标记的胸腺嘧啶核苷(3H-TdR)掺入技术观察EGF和K+通道阻断剂(TEA)对人肝癌细胞DNA合成的影响。结果:发现表皮生长因子(EGF)促进肝癌细胞增殖的同时使肝癌细胞膜离子通道的跨膜K+电流增加。K+通道阻断剂四乙胺(TEA)能显著抑制EGF促进DNA合成的作用,具有明显的量效关系和时间依赖性,但对细胞的活力无明显影响。结论:人肝癌细胞的增殖活动需要延迟整流性K+通道参与。
, 百拇医药
中国图书资料分类法分类号 R735.7
The role of delayed rectifier K+ channel
in the proliferation of the human hepatocyte carcinoma cells
FU Wei#, ZHOU Xiao-Si , ZHANG Zong-Ming, ZHOU Pei-Ai, WU Cai-Hong
(#Department of General Surgery, the Third Hospital, Beijing Medical University, Beijing 100083)
ABSTRACT Objective: To study the role of the delayed rectifier K+ channel in the proliferation of the human hepatocyte carcinoma cells. Methods: The transmembrane current of human hepatocyte carcinoma cells was recorded by the whole-cell recording technique of patch clamp in different concentration of EGF. The effect of EGF and K+ channel blocker on the DNA synthesis of human hepatic carcinoma cells was observed by 3H-TdR incorporation technique. Results: EGF promoted the cell proliferatetion of the human hepatocyte carcinoma cells. At the same time, EGF made the K+ channel current of hepatocyte carcinoma cells increased. TEA of K+ channel blocker could significantly inhibited DNA synthesis induced by EGF. There was a linear relationship between the concentration of TEA and the effect of inhibition as well as time-dependence. But TEA didn't reduce the viability of hepatocyte carcinoma cells. Conclusion: K+ channel was necessary for the proliferation of the human hepatocyte carcinoma cells.
, 百拇医药
MeSH Delayed rectifier K+ channel☆ Carcinoma hepatocellular/metab Potassium channels
Endothelial growth factor/pharmacol
在淋巴细胞[1]、人的乳癌细胞系MCF-2[2]、人黑色素瘤细胞[3]中各种K+通道与细胞的增殖有关。本实验是在我们发现人肝癌细胞存在延迟整流性K+通道的基础上[4],研究K+通道在人肝癌细胞系BEL-7402细胞增殖中的作用。
1 材料与方法
1.1 细胞系
, http://www.100md.com
人肝癌细胞系BEL-7402由北京医科大学药学及化学分析中心赠送。
1.2 主要仪器
电极拉制器(Narishige, PP-83, Japan),EPC-7膜片钳放大器(List, Darmstadt Co., Germany),5.5.1版PClamp电信号采集程序、数据采集系统(Axon Instrument, Inc., USA)。
1.3 主要试剂
盐酸四乙胺(TEA-Cl),Mg-ATP,KF均为Sigma产品。RPMI1640培养基(Gibco),EGF(Boehringer Mannheim),3H-TdR(上海原子能研究所)。
1.4 细胞外液和电极液的配制以及玻璃微电极的制备
, 百拇医药
细胞外液和电极液的配制以及玻璃微电极的制备见参考文献[4]。
1.5 人肝癌细胞系BEL-7402细胞的准备
当细胞在培养瓶中长成单层后,转入35 mm×10 mm的培养皿或培养板中继续培养48 h后,按试验要求在各个培养皿中分别加入一定量的EGF、TEA,或者兼有二者的RPMI1640培养液继续培养24 h。最后以全细胞方式记录细胞的跨膜电流,同时进行细胞计数,测定3H-TdR掺入的cpm值。
1.6 全细胞膜片钳记录
倒置显微镜下,在微操纵器操纵下,进行全细胞膜片钳的记录(室温下)。
1.7 数据处理及统计分析
计量资料以 ±s表示,并采用t检验或方差分析进行显著性检验,对二组数据的相关性采用直线回归的方法,对相关系数进行检验。
±s表示,并采用t检验或方差分析进行显著性检验,对二组数据的相关性采用直线回归的方法,对相关系数进行检验。
, 百拇医药
2 结果
2.1 EGF对肝癌细胞延迟整流性K+通道的影响
不同质量浓度的EGF加入细胞的培养液中培养24 h后,用膜片钳的全细胞记录方式记录细胞的跨膜电流,在钳制电压(holding potential, HP)=-100 mV,测试电压(test potential,TP)=-100~90 mV条件下,不同TP的跨膜电流ITP均增高(表1)。EGF对肝癌细胞膜的延迟整流性K+通道电压门控特性有影响,使跨膜电流增强。
2.2 EGF对肝癌细胞计数的影响
细胞在含有0、1、10、20 μg.L-1 EGF的培养液中分别培养24 h后,细胞计数分别为32±5(×104个,n=4)、35±7(×104个,n=4)、47±7(×104个,n=4)、56±11(×104个,n=4)。表明EGF使细胞数目明显增加,促进细胞的增殖。
, http://www.100md.com
2.3 对肝癌细胞活力的影响
在含有10 μg.L-1 EGF的培养液中培养的细胞,分为2组,分别加入终浓度0和20 mmol.L-1 TEA培养24 h后,用4 g.L-1台盼蓝染色进行细胞活力鉴定。TEA组细胞存活率为0.918[279(个)/304(个)],而未加TEA组为0.946[315(个)/333(个)],两者差异无显著性(χ2=2.005 3,P=0.156 8)。
2.4 EGF本身和EGF加K+通道阻断剂(TEA)对肝癌细胞DNA合成的影响
2.4.1 EGF本身对肝癌细胞DNA合成的影响 细胞在含有不同质量浓度EGF的培养液中分别培养24 h后,3H-TdR掺入后测定cpm(图1中Without TEA组),EGF明显促进DNA的合成。
, http://www.100md.com
表1 不同质量浓度的EGF对人肝癌细胞系BEL-7402
细胞跨膜电流ITP的影响( ±s)
±s)
Table 1 The effect of different mass concentration of EGF
on the transmembrane current of carcinoma cells
of cell line BEL-7402( ±s)I/pA TP
±s)I/pA TP
(mV)
, http://www.100md.com
ρ(EGF)/μg.L-1
0(n=12)
1(n=11)
10(n=12)
20(n=9)
-100
-63±35
-64±30
-79±22
-82±21
-90
-46±34
, http://www.100md.com
-38±25
-49±27
-39±24
-80
-23±37
-15±23
-9±33
6±39
-70
-2±42
9±31
33±29
, 百拇医药 53±60
-60
24±45
35±42
69±34
110±78
-50
50±49
57±53
113±42
155±92
, 百拇医药
-40
82±63
86±66
154±47
206±101
-30
112±80
123±81
208±42
259±112
-20
, http://www.100md.com
142±92
164±96
264±47
316±125
-10
175±110
211±114
326±55
378±128
0
217±124
, 百拇医药
268±131
387±67
445±134
10
261±143
328±146
450±78
515±139
20
301±166
407±154
, 百拇医药
516±88
606±130
30
362±179
483±164
593±95
689±128
40
423±195
564±182
682±108
, http://www.100md.com
773±123
50
501±210
661±192
781±129
880±122
60
605±217
759±204
889±138
997±138
, 百拇医药
70
718±230
872±233
1017±163
1150±158
80
838±238
887±362
1146±171
1250±201
90
, 百拇医药
961±257
1128±261
1298±217
1386±248
There was significant difference ,the groups of 10 μg.L-1 and 20 μg.L-1 were compared with the group of 0 μg.L-1 at TP=-70~90 mV level.There was not significant difference,the group of 1 μg.L-1 was compared with the group of 0 μg.L-1 at TP=-100~90 mV level.
, 百拇医药
2.4.2 10 mmol.L-1的TEA与不同质量浓度的EGF对DNA合成的影响 10 μmol.L-1 TEA与含有不同质量浓度EGF的培养液共同培养细胞24 h后,3H-TdR掺入后测定cpm值(图1)。
2.4.3 不同浓度的TEA与10 μg.L-1的EGF对肝癌细胞DNA合成的影响 在含有10 μg.L-1 EGF的细胞培养基中,再加入0、5、10、20 mmol.L-14种不同浓度的TEA,培养24 h后,进行3H-TdR掺入后测定其cpm值(图2)。
2.4.4 在含有10 μg.L-1 EGF的培养基中培养的肝癌细胞接触TEA(10 mmol.L-1)的时间对DNA合成的影响 用含有10 μg.L-1 EGF的培养液培养肝癌细胞,分别在进行3H-TdR掺入前23、18、12 h和掺入前即刻加入TEA,使终浓度为10 mmol.L-1,然后测定其cpm值(图3)。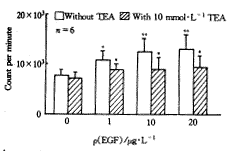
, http://www.100md.com
* the group of 10 mmol.L-1 TEA was compared with the group of without TEA, P<0.05; +, the group of 0 μg.L-1 EGF was compared with the group of other EGF concentration, P<0.05, ++P<0.01; ρ, mass concentration.
图1 10 mmol.L-1 TEA对肝癌细胞在不同质量浓度的EGF中DNA合成的影响(n=6)
Figure 1 The effect of 10 mmol.L-1 TEA on the liver
, 百拇医药
carcinoma cells in the different mass concentration of EGF(n=6)
** P<0.01, compared with 0 mmol.L-1 TEA; ±s in each point was the result of six paralleling samples; c, concentration.
±s in each point was the result of six paralleling samples; c, concentration.
图2 TEA浓度与EGF(10 μg.L-1)中培养的
肝癌细胞DNA合成量的关系(图中每一点为6份平行标本
, 百拇医药
测定结果的 ±s)
±s)
Figure 2 The relationship of the concentration of EGF
with the DNA synthesis of liver carcinoma cells
in the culture medium (EGF 10 μg.L-1)
3 讨论
Ik在神经、肌肉等可兴奋性组织的细胞中主要起决定动作电位的复极相、动作电位的间期和维持不应期的作用[5]。K+通道在肿瘤细胞中的作用亦有报告,如在人的乳癌细胞系MCF-2中,发现电导为23pS的K+通道与细胞的增殖密切相关[2]。在人黑色素瘤细胞的研究中同样发现类似神经肌肉细胞的Ik与细胞的增殖有关[3]。
, 百拇医药
在本实验中EGF能明显使人肝癌细胞系BEL-7402细胞的数目(2.2)和DNA合成增加(图1),而且培养液中的EGF质量浓度愈高,这种作用也愈明显。表明EGF能促进肝癌细胞系BEL-7402细胞的增殖。此外不同质量浓度的EGF使细胞的跨膜电流明显增加(表1)。10、20 μg.L-1 EGF明显改变了人肝癌细胞系BEL-7402细胞Ik的电压门控特性。以上表明EGF在促进细胞增殖的同时,K+通道开放,Ik也增大,提示肝癌细胞增殖的过程中需要K+通道的开放。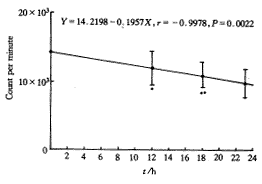
* P<0.05, ** P<0.01, compared with 0 hour; t, contacting 10 mmol.L-1 TEA time; each point was ±s of six paralleling samples.
±s of six paralleling samples.
, 百拇医药
图3 细胞在含有10 μg.L-1 EGF的培养基中
与10 mmol.L-1 TEA接触的时间对DNA合成的
影响(图中每一点为6份平行标本测定结果的 ±s)
±s)
Figure 3 The effect of 10 μg.L-1 EGF culture medium
with 10 mmol.L-1 TEA on DNA synthesis of liver
carcinoma cells in at different contacting time
, 百拇医药
在加入不同质量浓度EGF的培养液中,10 mmol.L-1的K+通道特异性阻断剂TEA都能显著抑制DNA的合成,使3H-TdR掺入的cpm值下降,与未加入TEA的对照组相比差异有显著性(图1),而TEA对细胞的存活率无影响(结果2.3),说明TEA抑制DNA的合成不是由于对细胞的直接毒性作用,而是由于TEA阻断了K+通道。这是本试验中肝癌细胞增殖的同时需要K+通道开放的第2个证据。
在图1的EGF 0 μg.L-1组,TEA的作用不明显,这提示在肝癌细胞的非增殖期间,TEA不直接抑制DNA的合成,而在EGF促进细胞增殖期间,对K+通道开放需求提高后,K+通道阻断剂才减少DNA合成,同时TEA对肝癌细胞无毒性作用。这是本试验中肝癌细胞增殖需要K+通道开放的第3个证据。
, 百拇医药
TEA的剂量与抑制DNA合成的幅度之间有明显的量效关系(图2),肝癌细胞在含有10 mmol.L-1 EGF的培养液中与10 mmol.L-1 TEA培养的接触时间愈长,EGF促进DNA合成的作用被抑制的程度也愈明显,表明随着与TEA接触时间的增长,抑制DNA合成的作用也增强(图3)。对细胞活力的鉴定,TEA对肝癌细胞增殖的影响非毒性作用(结果2.3),这是本试验中为肝癌细胞的增殖活动需要K+通道开放这一结论提供的第4个试验依据。
EGF是如何影响人肝癌细胞系BEL-7402细胞的K+通道?目前无明确的结论,人肝癌细胞存在EGF受体[6],EGF与人肝癌细胞系BEL-7402细胞膜上的受体结合后,可能通过蛋白激酶和蛋白质磷酸化系统以及G-蛋白途径影响K+通道,这在可兴奋性细胞中有许多研究[7]。由于延迟整流性K+通道允许Ca2+通过[8],EGF使K+通道的电压门控特性发生了改变,使Ca2+内流增加,亦即K+通道可能为细胞外Ca2+离子进入细胞内提供了通道。
, 百拇医药
☆ 自由词。
参考文献
1 Lewis R, Cahalan M. Ion channels and signal transduction in lymphocytes. Annu Physiol, 1990,52:415-430
2 Wangman EA, Young JA, Cook DI.A 23-PS Ca2+-activated K+ channel in MCF-7 human breast carcinoma cells: an apparent correlation of channel incidence proliferation. Pflugers Arch, 1991,417:562-570
3 Lepple-Wienhuesk A, Berweck S, Bohming M, et al. K+ channels and the intracellular calcium signal in melanoma cell proliferation. J Membr Biol, 1996,151:149-157
, 百拇医药
4 傅 卫,张宗明,周培爱,等.人肝癌细胞膜离子通道特性研究. 北京医科大学学报. 1998,30:115
5 Rudy B. Diversity and ubiquity of K channels. Neuroscience, 1988,25:729-749
6 徐永华,江万里,彭素芬. 人肝癌细胞株中EGFR的表达和EGF对肝癌细胞生长的促进作用. 实验生物学报, 1989,22:445-453
7 Brown AM. Membrance-delimited cell signaling complexes:direct ion channel regulation by G proteins. J Membrance Biol, 1993,131:93-104
8 Inoue ISAO. Activation-inactivation of potassium channels and development of the potassium channel spile in internally perfused squid giant axon. J Gen Physiol, 1987,78:43-61
(1998-08-26收稿), 百拇医药
单位:傅 卫 周孝思 张宗明 北京医科大学第三医院普通外科,北京 100083;周培爱 吴才宏 北京大学生物膜与膜生物工程国家重点实验室
关键词:延迟整流性K+通道☆;癌;肝细胞;代谢;钾通道;内皮生长因子;药理学
北京医科大学学报990409 摘 要 目的:研究延迟整流性K+通道在人肝癌细胞增殖中的作用。方法:采用膜片钳技术的全细胞记录方式记录人肝癌细胞在不同浓度EGF中延迟整流性K+通道的跨膜电流。利用氚标记的胸腺嘧啶核苷(3H-TdR)掺入技术观察EGF和K+通道阻断剂(TEA)对人肝癌细胞DNA合成的影响。结果:发现表皮生长因子(EGF)促进肝癌细胞增殖的同时使肝癌细胞膜离子通道的跨膜K+电流增加。K+通道阻断剂四乙胺(TEA)能显著抑制EGF促进DNA合成的作用,具有明显的量效关系和时间依赖性,但对细胞的活力无明显影响。结论:人肝癌细胞的增殖活动需要延迟整流性K+通道参与。
, 百拇医药
中国图书资料分类法分类号 R735.7
The role of delayed rectifier K+ channel
in the proliferation of the human hepatocyte carcinoma cells
FU Wei#, ZHOU Xiao-Si , ZHANG Zong-Ming, ZHOU Pei-Ai, WU Cai-Hong
(#Department of General Surgery, the Third Hospital, Beijing Medical University, Beijing 100083)
ABSTRACT Objective: To study the role of the delayed rectifier K+ channel in the proliferation of the human hepatocyte carcinoma cells. Methods: The transmembrane current of human hepatocyte carcinoma cells was recorded by the whole-cell recording technique of patch clamp in different concentration of EGF. The effect of EGF and K+ channel blocker on the DNA synthesis of human hepatic carcinoma cells was observed by 3H-TdR incorporation technique. Results: EGF promoted the cell proliferatetion of the human hepatocyte carcinoma cells. At the same time, EGF made the K+ channel current of hepatocyte carcinoma cells increased. TEA of K+ channel blocker could significantly inhibited DNA synthesis induced by EGF. There was a linear relationship between the concentration of TEA and the effect of inhibition as well as time-dependence. But TEA didn't reduce the viability of hepatocyte carcinoma cells. Conclusion: K+ channel was necessary for the proliferation of the human hepatocyte carcinoma cells.
, 百拇医药
MeSH Delayed rectifier K+ channel☆ Carcinoma hepatocellular/metab Potassium channels
Endothelial growth factor/pharmacol
在淋巴细胞[1]、人的乳癌细胞系MCF-2[2]、人黑色素瘤细胞[3]中各种K+通道与细胞的增殖有关。本实验是在我们发现人肝癌细胞存在延迟整流性K+通道的基础上[4],研究K+通道在人肝癌细胞系BEL-7402细胞增殖中的作用。
1 材料与方法
1.1 细胞系
, http://www.100md.com
人肝癌细胞系BEL-7402由北京医科大学药学及化学分析中心赠送。
1.2 主要仪器
电极拉制器(Narishige, PP-83, Japan),EPC-7膜片钳放大器(List, Darmstadt Co., Germany),5.5.1版PClamp电信号采集程序、数据采集系统(Axon Instrument, Inc., USA)。
1.3 主要试剂
盐酸四乙胺(TEA-Cl),Mg-ATP,KF均为Sigma产品。RPMI1640培养基(Gibco),EGF(Boehringer Mannheim),3H-TdR(上海原子能研究所)。
1.4 细胞外液和电极液的配制以及玻璃微电极的制备
, 百拇医药
细胞外液和电极液的配制以及玻璃微电极的制备见参考文献[4]。
1.5 人肝癌细胞系BEL-7402细胞的准备
当细胞在培养瓶中长成单层后,转入35 mm×10 mm的培养皿或培养板中继续培养48 h后,按试验要求在各个培养皿中分别加入一定量的EGF、TEA,或者兼有二者的RPMI1640培养液继续培养24 h。最后以全细胞方式记录细胞的跨膜电流,同时进行细胞计数,测定3H-TdR掺入的cpm值。
1.6 全细胞膜片钳记录
倒置显微镜下,在微操纵器操纵下,进行全细胞膜片钳的记录(室温下)。
1.7 数据处理及统计分析
计量资料以
 ±s表示,并采用t检验或方差分析进行显著性检验,对二组数据的相关性采用直线回归的方法,对相关系数进行检验。
±s表示,并采用t检验或方差分析进行显著性检验,对二组数据的相关性采用直线回归的方法,对相关系数进行检验。, 百拇医药
2 结果
2.1 EGF对肝癌细胞延迟整流性K+通道的影响
不同质量浓度的EGF加入细胞的培养液中培养24 h后,用膜片钳的全细胞记录方式记录细胞的跨膜电流,在钳制电压(holding potential, HP)=-100 mV,测试电压(test potential,TP)=-100~90 mV条件下,不同TP的跨膜电流ITP均增高(表1)。EGF对肝癌细胞膜的延迟整流性K+通道电压门控特性有影响,使跨膜电流增强。
2.2 EGF对肝癌细胞计数的影响
细胞在含有0、1、10、20 μg.L-1 EGF的培养液中分别培养24 h后,细胞计数分别为32±5(×104个,n=4)、35±7(×104个,n=4)、47±7(×104个,n=4)、56±11(×104个,n=4)。表明EGF使细胞数目明显增加,促进细胞的增殖。
, http://www.100md.com
2.3 对肝癌细胞活力的影响
在含有10 μg.L-1 EGF的培养液中培养的细胞,分为2组,分别加入终浓度0和20 mmol.L-1 TEA培养24 h后,用4 g.L-1台盼蓝染色进行细胞活力鉴定。TEA组细胞存活率为0.918[279(个)/304(个)],而未加TEA组为0.946[315(个)/333(个)],两者差异无显著性(χ2=2.005 3,P=0.156 8)。
2.4 EGF本身和EGF加K+通道阻断剂(TEA)对肝癌细胞DNA合成的影响
2.4.1 EGF本身对肝癌细胞DNA合成的影响 细胞在含有不同质量浓度EGF的培养液中分别培养24 h后,3H-TdR掺入后测定cpm(图1中Without TEA组),EGF明显促进DNA的合成。
, http://www.100md.com
表1 不同质量浓度的EGF对人肝癌细胞系BEL-7402
细胞跨膜电流ITP的影响(
 ±s)
±s)Table 1 The effect of different mass concentration of EGF
on the transmembrane current of carcinoma cells
of cell line BEL-7402(
 ±s)I/pA TP
±s)I/pA TP(mV)
, http://www.100md.com
ρ(EGF)/μg.L-1
0(n=12)
1(n=11)
10(n=12)
20(n=9)
-100
-63±35
-64±30
-79±22
-82±21
-90
-46±34
, http://www.100md.com
-38±25
-49±27
-39±24
-80
-23±37
-15±23
-9±33
6±39
-70
-2±42
9±31
33±29
, 百拇医药 53±60
-60
24±45
35±42
69±34
110±78
-50
50±49
57±53
113±42
155±92
, 百拇医药
-40
82±63
86±66
154±47
206±101
-30
112±80
123±81
208±42
259±112
-20
, http://www.100md.com
142±92
164±96
264±47
316±125
-10
175±110
211±114
326±55
378±128
0
217±124
, 百拇医药
268±131
387±67
445±134
10
261±143
328±146
450±78
515±139
20
301±166
407±154
, 百拇医药
516±88
606±130
30
362±179
483±164
593±95
689±128
40
423±195
564±182
682±108
, http://www.100md.com
773±123
50
501±210
661±192
781±129
880±122
60
605±217
759±204
889±138
997±138
, 百拇医药
70
718±230
872±233
1017±163
1150±158
80
838±238
887±362
1146±171
1250±201
90
, 百拇医药
961±257
1128±261
1298±217
1386±248
There was significant difference ,the groups of 10 μg.L-1 and 20 μg.L-1 were compared with the group of 0 μg.L-1 at TP=-70~90 mV level.There was not significant difference,the group of 1 μg.L-1 was compared with the group of 0 μg.L-1 at TP=-100~90 mV level.
, 百拇医药
2.4.2 10 mmol.L-1的TEA与不同质量浓度的EGF对DNA合成的影响 10 μmol.L-1 TEA与含有不同质量浓度EGF的培养液共同培养细胞24 h后,3H-TdR掺入后测定cpm值(图1)。
2.4.3 不同浓度的TEA与10 μg.L-1的EGF对肝癌细胞DNA合成的影响 在含有10 μg.L-1 EGF的细胞培养基中,再加入0、5、10、20 mmol.L-14种不同浓度的TEA,培养24 h后,进行3H-TdR掺入后测定其cpm值(图2)。
2.4.4 在含有10 μg.L-1 EGF的培养基中培养的肝癌细胞接触TEA(10 mmol.L-1)的时间对DNA合成的影响 用含有10 μg.L-1 EGF的培养液培养肝癌细胞,分别在进行3H-TdR掺入前23、18、12 h和掺入前即刻加入TEA,使终浓度为10 mmol.L-1,然后测定其cpm值(图3)。

, http://www.100md.com
* the group of 10 mmol.L-1 TEA was compared with the group of without TEA, P<0.05; +, the group of 0 μg.L-1 EGF was compared with the group of other EGF concentration, P<0.05, ++P<0.01; ρ, mass concentration.
图1 10 mmol.L-1 TEA对肝癌细胞在不同质量浓度的EGF中DNA合成的影响(n=6)
Figure 1 The effect of 10 mmol.L-1 TEA on the liver
, 百拇医药
carcinoma cells in the different mass concentration of EGF(n=6)

** P<0.01, compared with 0 mmol.L-1 TEA;
 ±s in each point was the result of six paralleling samples; c, concentration.
±s in each point was the result of six paralleling samples; c, concentration.图2 TEA浓度与EGF(10 μg.L-1)中培养的
肝癌细胞DNA合成量的关系(图中每一点为6份平行标本
, 百拇医药
测定结果的
 ±s)
±s)Figure 2 The relationship of the concentration of EGF
with the DNA synthesis of liver carcinoma cells
in the culture medium (EGF 10 μg.L-1)
3 讨论
Ik在神经、肌肉等可兴奋性组织的细胞中主要起决定动作电位的复极相、动作电位的间期和维持不应期的作用[5]。K+通道在肿瘤细胞中的作用亦有报告,如在人的乳癌细胞系MCF-2中,发现电导为23pS的K+通道与细胞的增殖密切相关[2]。在人黑色素瘤细胞的研究中同样发现类似神经肌肉细胞的Ik与细胞的增殖有关[3]。
, 百拇医药
在本实验中EGF能明显使人肝癌细胞系BEL-7402细胞的数目(2.2)和DNA合成增加(图1),而且培养液中的EGF质量浓度愈高,这种作用也愈明显。表明EGF能促进肝癌细胞系BEL-7402细胞的增殖。此外不同质量浓度的EGF使细胞的跨膜电流明显增加(表1)。10、20 μg.L-1 EGF明显改变了人肝癌细胞系BEL-7402细胞Ik的电压门控特性。以上表明EGF在促进细胞增殖的同时,K+通道开放,Ik也增大,提示肝癌细胞增殖的过程中需要K+通道的开放。

* P<0.05, ** P<0.01, compared with 0 hour; t, contacting 10 mmol.L-1 TEA time; each point was
 ±s of six paralleling samples.
±s of six paralleling samples., 百拇医药
图3 细胞在含有10 μg.L-1 EGF的培养基中
与10 mmol.L-1 TEA接触的时间对DNA合成的
影响(图中每一点为6份平行标本测定结果的
 ±s)
±s)Figure 3 The effect of 10 μg.L-1 EGF culture medium
with 10 mmol.L-1 TEA on DNA synthesis of liver
carcinoma cells in at different contacting time
, 百拇医药
在加入不同质量浓度EGF的培养液中,10 mmol.L-1的K+通道特异性阻断剂TEA都能显著抑制DNA的合成,使3H-TdR掺入的cpm值下降,与未加入TEA的对照组相比差异有显著性(图1),而TEA对细胞的存活率无影响(结果2.3),说明TEA抑制DNA的合成不是由于对细胞的直接毒性作用,而是由于TEA阻断了K+通道。这是本试验中肝癌细胞增殖的同时需要K+通道开放的第2个证据。
在图1的EGF 0 μg.L-1组,TEA的作用不明显,这提示在肝癌细胞的非增殖期间,TEA不直接抑制DNA的合成,而在EGF促进细胞增殖期间,对K+通道开放需求提高后,K+通道阻断剂才减少DNA合成,同时TEA对肝癌细胞无毒性作用。这是本试验中肝癌细胞增殖需要K+通道开放的第3个证据。
, 百拇医药
TEA的剂量与抑制DNA合成的幅度之间有明显的量效关系(图2),肝癌细胞在含有10 mmol.L-1 EGF的培养液中与10 mmol.L-1 TEA培养的接触时间愈长,EGF促进DNA合成的作用被抑制的程度也愈明显,表明随着与TEA接触时间的增长,抑制DNA合成的作用也增强(图3)。对细胞活力的鉴定,TEA对肝癌细胞增殖的影响非毒性作用(结果2.3),这是本试验中为肝癌细胞的增殖活动需要K+通道开放这一结论提供的第4个试验依据。
EGF是如何影响人肝癌细胞系BEL-7402细胞的K+通道?目前无明确的结论,人肝癌细胞存在EGF受体[6],EGF与人肝癌细胞系BEL-7402细胞膜上的受体结合后,可能通过蛋白激酶和蛋白质磷酸化系统以及G-蛋白途径影响K+通道,这在可兴奋性细胞中有许多研究[7]。由于延迟整流性K+通道允许Ca2+通过[8],EGF使K+通道的电压门控特性发生了改变,使Ca2+内流增加,亦即K+通道可能为细胞外Ca2+离子进入细胞内提供了通道。
, 百拇医药
☆ 自由词。
参考文献
1 Lewis R, Cahalan M. Ion channels and signal transduction in lymphocytes. Annu Physiol, 1990,52:415-430
2 Wangman EA, Young JA, Cook DI.A 23-PS Ca2+-activated K+ channel in MCF-7 human breast carcinoma cells: an apparent correlation of channel incidence proliferation. Pflugers Arch, 1991,417:562-570
3 Lepple-Wienhuesk A, Berweck S, Bohming M, et al. K+ channels and the intracellular calcium signal in melanoma cell proliferation. J Membr Biol, 1996,151:149-157
, 百拇医药
4 傅 卫,张宗明,周培爱,等.人肝癌细胞膜离子通道特性研究. 北京医科大学学报. 1998,30:115
5 Rudy B. Diversity and ubiquity of K channels. Neuroscience, 1988,25:729-749
6 徐永华,江万里,彭素芬. 人肝癌细胞株中EGFR的表达和EGF对肝癌细胞生长的促进作用. 实验生物学报, 1989,22:445-453
7 Brown AM. Membrance-delimited cell signaling complexes:direct ion channel regulation by G proteins. J Membrance Biol, 1993,131:93-104
8 Inoue ISAO. Activation-inactivation of potassium channels and development of the potassium channel spile in internally perfused squid giant axon. J Gen Physiol, 1987,78:43-61
(1998-08-26收稿), 百拇医药