败血症大鼠肝细胞内核膜三磷酸肌醇受体的改变
作者:郝胜利 杨 军 张孙曦 庞永政 苏静怡 唐朝枢
单位:郝胜利 张孙曦 北京医科大学生物物理系,北京 100083;庞永政 苏静怡 唐朝枢 杨 军 第一医院心血管研究所
关键词:败血病;肝;细胞核;肌醇1,4,5-三磷酸;受体
北京医科大学学报990406 摘 要 目的:观察早期、晚期败血症大鼠肝细胞内核膜上1,4,5-三磷酸肌醇受体(inositol 1,4,5-triphosphate receptors, IP3R)的变化。方法:通过结扎并穿刺盲肠制作大鼠败血症模型,差速离心分离内核膜,[3H]IP3放射配体分析肝内核膜IP3R与其配体的最大结合容量(Bmax)及亲和力(Kd)。45Ca2+转运测定内核膜IP3R释放Ca2+功能。结果:早期和晚期败血症Bmax分别增加14%(P<0.05)和91%(P<0.01)。但Kd值无明显变化(P>0.05)。IP3引起45Ca2+转运在败血症时也相应增加。结论:在败血症时肝细胞核被膜IP3R发生上调,其释放Ca2+的能力增强, 但结构可能未发生变化。
, 百拇医药
中国图书资料分类法分类号 R631.3-332
Changes of inositol 1,4,5-triphosphate receptors
in inner nuclear membrane of rat liver during sepsis
HAO Sheng-Li#, YANG Jun, ZHANG Sun-Xi, PANG Yong-Zheng, SU Jing-Yi, TANG Chao-Shu
(#Department of Biophysics, Beijing Medical University, Beijing 100083)
ABSTRACT Objective: To investigate the changes of inositol triphosphate receptors in the inner nuclear membrane of rat liver during sepsis. Methods: Septic rat model was prepared by cecal ligation and puncture (LCP). The binding site density (Bmax) and affinity (Kd) of IP3 to the inner nuclear membrane were measured by [3H]IP3 binding assay. The function of IP3 receptors to release Ca2+ was assessed by 45Ca2+ movement to the inner nuclear membrane vesicle upon the action of IP3. Results: Bmax was increased by 14% (P<0.05) during early sepsis and by 91% (P<0.01) during late sepsis while no alterations of the affinity of IP3R to its ligand was shown during sepsis. 45Ca2+ movement to the inner nuclear membrane vesicle was also increased accordingly during sepsis. Conclusion: Binding site density and the function of IP3R in the inner nuclear membrane were progressively increased during sepsis, while there might be no change in the structure.
, 百拇医药
MeSH Septicemia Liver Cell nucleus Inositol 1,4,5-triphosphate Receptors
败血症及继发的多器官功能衰竭是感染性死亡的常见原因[1]。由于败血症的发病机制迄今尚未完全阐明,尽管目前医疗手段不断提高,病死率仍呈上升趋势[1]。现已发现参与败血症的体液因子很多[1],研究这些因子在细胞水平上的相互作用是阐明败血症的关键。其中细胞核内Ca2+信号变化尤其值得关注。Ca2+是调节细胞功能代谢的重要信使物质,近来发现Ca2+不仅为胞浆信使,还是核内信使,参与调控细胞分裂、分化、凋亡、基因转录等核内重要过程[2]。核存在一整套Ca2+信号产生系统[2]:内、外两层核膜形成的腔(即内核膜腔)贮有大量的钙亦为一钙库,Ca2+-ATPase,和1,3,4,5-四磷酸肌醇受体(IP4R)是核Ca2+ 摄取系统,分布于外层核膜上。1,4,5-三磷酸肌醇(inositol 1,4,5 triphosphate, IP3) 受体(IP3 receptor, IP3R)和ryanodine受体(ryanodine receptor, RyR)是核Ca2+释放系统,分布在内核膜上,它们本身即为Ca2+通道, 分别在IP3和环腺苷二磷酸核糖(cyclic ADP ribose, cADPr)作用下,将核被膜腔内贮存的Ca2+释入核浆。核Ca2+摄取和释放系统精确地调控核内[Ca2+]变化,进而影响核的各种功能[2]。本室曾报道败血症大鼠肝细胞核Ca2+泵功能的改变[3],在此基础上本实验观察败血症大鼠肝细胞核内核膜IP3R的变化。以探讨败血症时造成核Ca2+信号改变的机制。
, 百拇医药
1 材料与方法
1.1 大鼠败血症模型的制作[4]
雄性SD大鼠200~250 g(北京医科大学实验动物中心提供),术前禁食8 h,自由饮水,异戊巴比妥钠(每1千克体重60 mg, i.p.)麻醉下,开腹,3-0号线结扎盲肠并用18号针头穿刺两孔,分层缝合腹壁。术后皮下注射生理盐水(每1千克体重40 ml)。术后9,18 h分别为早期败血症和晚期败血症。
1.2 肝细胞核内核膜的提纯[5]
所有操作在0~4℃下进行。用50 ml冰冷TKM液(mmol.L-1:Tris/HCl 50, KCl 25, MgCl2 5; pH 7.5)从门静脉原位灌洗肝,取肝剪碎置于40 ml匀浆液(含0.25 mol.L-1蔗糖, 1.0 mmol.L-1 EGTA 的TKM液)中,匀浆,纱布过滤, 离心(2 250 r.min-1, 10 min), 弃上清,将沉淀加6 ml匀浆液,12 ml含2.3 mol.L-1蔗糖的TKM液混匀, 装入离心管,下铺6 ml含2.3 mol.L-1蔗糖的TKM液。再离心(27 000 r.min-1, 30 min), 沉淀即为核。 核用缓冲液A(含0.25 mol.L-1蔗糖,10 mmol.L-1 MgCl2,1 mmol.L-1 DTT1, 10 mg.L-1 leupeptin, 2 mmol.L-1 PMSF2, 50 mmol.L-1 Tris- HCl, pH 7.4)重悬, 加入10 g.L-1柠檬酸钠, 冰浴30 min并轻轻搅拌,离心(500 r.min-1, 15 min),去外膜核沉于管底。再用缓冲液A重悬沉淀,使核浓度为5 g.L-1,加入DNase I (250 mg.L-1), 在4℃消化14 h, 进行蔗糖密度梯度(0.25、1.6、2.4 mol.L-1)离心(27 000 r.min-1, 2 h), 内核膜位于0.25/1.60 mol.L-1蔗糖溶液界面。考马斯亮蓝法定量蛋白。按文献[6]方法测定标志酶活性:NAD焦磷酸化酶,NADPH细胞色素C还原酶。
, http://www.100md.com
1.3 [3H]IP3结合测定[5]
内核膜用含50 mmol.L-1 Tris-HCl,pH 8.0,2 mmol.L-1 EDTA悬浮,进行[3H] IP3结合反应,分别加浓度递增的[3H] IP3(0.05~1.5 nmol.L-1), 反应体积400 μl,加入核0.1 mg蛋白/管 ,0℃下反应10 min。 结合与游离的放射性配体([3H]IP3)用离心法(12 000 r.min-1, 5 min)分离,上清抽吸去除,沉淀加1 ml 组织溶解液(Soluene 350, Packard)、乙酸70 μl,转至液闪杯中,用液闪仪测定[3H] IP3放射活性。 非特异结合通过加10 μmol.L-1 IP3测定。由Scatchard分析得到Kd, Bmax值。
, 百拇医药
1.4 45Ca2+ 转运测定[5]
内核膜置于缓冲液B( mmol.L-1, 250蔗糖,2 EGTA, 2 EDTA, 4 K2HPO4, 4 MgCl2, 50 Tris-HCl, pH 8.0 ),并含2.08 mmol.L-1 CaCl2 (游离[Ca2+] 为1 μmol.L-1)。 加入7.4×104 Bq.ml-1 45Ca2+ (Amersham公司), 实验分两组, 一组加5 μmol.L-1 IP3,另一组加2 μmol.L-1离子霉素(ionomycin), 37℃反应并计时, 按不同时间点通过真空抽滤中止反应,内核膜被截留在GF/ B (whatman) 玻璃纤维膜。用3 ml冰冷的缓冲液B快速冲洗纤维膜, 后将其置于液闪杯中,干燥后在液闪仪测定45Ca2+放射活性。转运的45Ca2+ 量由给定时间点放射性减去开始的放射性求得。
, 百拇医药
1.5 数据处理
实验数据均以 ±s表示,单因素方差分析或Student- Newman- Keuls检验。
±s表示,单因素方差分析或Student- Newman- Keuls检验。
2 结果
2.1 肝细胞核及内层核膜的鉴定
NAD焦磷酸酶是细胞核的标志酶[5],内层核膜上的活性约为匀浆的21倍[每分每毫克蛋白(78.26±5.44) vs (3.68±0.27) nmol]。而微粒体的标志酶NADPH细胞色素C还原酶,在内层核膜只有匀浆的1/8[每分每毫克蛋白(1.27±0.11) vs(10.27±0.87) nmol]。表明得到的核及内层核膜纯度高、污染小。上述标识酶在败血症组与对照组之间相近, 差别无统计学意义(P>0.05)。
, 百拇医药
2.2 [3H] IP3 与内核被膜上IP3R的结合
本实验置内核膜于低渗缓冲液,使其破碎成小片, 进行[3H] IP3 结合实验. 结果显示IP3与内核膜结合的最大容量Bmax在早期败血症组比对照组增加14.2%[每毫克蛋白(2 629±221) vs (2 302±186) fmol, P<0.05]。晚期败血症时Bmax进一步升高,为每毫克蛋白4408±286 fmol,是对照组的1.91倍(P<0.01 ), 亦比早期败血症组增加了 17% (P<0.01)。IP3 与内核膜上IP3R的亲和力在早期败血症时无变化(3组Kd分别为:nmol.L-1,对照组1.18±0.20;早期组1.16±0.22;晚期组1.38±0.24,各组间P>0.05,见图1A,1B)。
, 百拇医药
2.3 IP3 诱发的45Ca2+向内核膜囊泡中的转运
内核膜在等渗液中自发形成内面朝里的囊泡[5](vesicle)。加入5 μmol.L-1 IP3发现45Ca2+转入内核膜囊泡的量随时间呈先升后降的双相变化(见图2A)。早期败血症组, 各时间点45Ca2+转运的量均高于对照; 晚期败血症组45Ca2+转运量进一步增加,当以2 μmol.L-1离子霉素代替IP3时,发现Ca2+进入囊泡的量约为这一作用的2~5倍,其中峰值(30S时)差别最大。败血症过程引起的Ca2+转运量也呈进行性增加(见图2B)。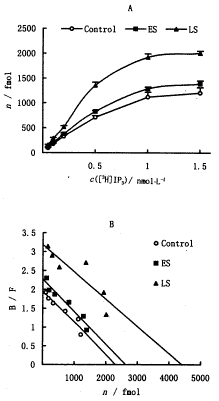
, http://www.100md.com
图1 [3H]IP3与败血症大鼠肝细胞内层核膜结合的饱和曲线(A)
及Scatchard曲线(B), ±s, n=8, control, ES, LS
±s, n=8, control, ES, LS
分别表示对照组、早期和晚期败血症组(下同)
Figure 1 Saturation curve (A) and Scatchard plot (B) of [3H]IP3
binding to liver inner nuclear membrane from septic rat, ±s, n=8,ES, LS represent early sepsis group and late sepsis group, respectively
±s, n=8,ES, LS represent early sepsis group and late sepsis group, respectively
, http://www.100md.com
3 讨论
本实验发现败血症不同时期IP3与内膜结合的最大容量(Bmax)呈进行性增加,表明IP3受体数量增加,而且在晚期比早期增加更为显著。IP3和IP3R的亲合力在败血症时变化不显著,表明IP3R结构可能未发生变化。败血症时IP3诱发45Ca2+进入内核膜囊泡的量高于对照,表明核IP3R释放Ca2+功能在败血症时呈进行性增强,与 IP3R数量的增加一致。造成IP3R上调的机制尚待进一步研究。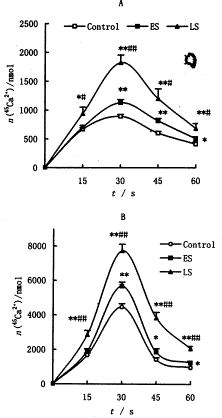
图2 5 μmol.L-1 IP3 (A) 及2 μmol/L离子霉素 (B) 作用下45Ca2+
, 百拇医药
向内核膜囊泡转运的时间关系曲线, ±s, n=8, *P<0.05,** P<0.01(与对照组相比);# P<0.05,## P<0.01 (与ES相比)
±s, n=8, *P<0.05,** P<0.01(与对照组相比);# P<0.05,## P<0.01 (与ES相比)
Figure 2 45Ca2+ transport to the inner nuclear membrane vesicle acted
by 5 μmol.L-1 IP3 (A) or 2 μmol.L-1 ionomycin (B), ±s,n=8, * P<0.05, ** P<0.01 (vs control);
±s,n=8, * P<0.05, ** P<0.01 (vs control);
, http://www.100md.com
# P<0.05, ## P<0.01 (vs ES)
IP3R数目的变化可能会影响到核内Ca2+信号的幅度及频率,近来发现在肝细胞胞浆Ca2+信号频率和幅度与内质网上的IP3R数目、分布及功能直接相关[7], 推测核Ca2+信号也与核被膜上IP3R有关。Ca2+信号频率和幅度的差异是Ca2+特异调控细胞内不同生理过程的内在机制[6]。肝是体内代谢及防御的重要器官,在败血症的发生发展过程中起重要作用[8]。在早期败血症时肝细胞蛋白表达迅速发生改变[8],表明核功能发生了改变(如基因转录等)。本实验发现IP3R在早期败血症时受体上调可能是造成这些改变的重要原因; 晚期败血症时IP3R受体进一步上调,向核浆内释放Ca2+能力增加,核内可能出现Ca2+超载,这些变化可能是晚期时肝细胞蛋白合成减少,细胞发生凋亡,进而导致肝功能衰竭的一个机制[8]。
, 百拇医药
参考文献
1 Bone RC, Grodzin CJ, Balk RA. Sepsis: a new hypothesis for pathogenesis of the disease process, Chest, 1997, 112: 235-243
2 Santella L, Carafoli E. Calcium signalling in the nucleus. FASEB J, 1997, 11: 1091-1109
3 王培勇,叶 赤,庞永政,等.败血症大鼠肝细胞核Ca2+ 转运功能的改变. 生理学报,1997,49:191-196
4 Wichterman KA, Baue AE, Chaudry IH. Sepsis and septic shock: a review of laboratory models and a proposal. J Surg Res, 1980, 29: 189-201
, 百拇医药
5. Humbert JP, Matter N, Artault JC, et al. Inositol 1,4,5-triphosphate receptor is located to the inner nuclear membrane vindicating regulation of nuclear calcium signalling by inositol 1,4,5-triphosphate. J Biol Chem, 1996, 271: 478-485
6 Dolmetsch RE, Lewis RS, Goodnow CC, et al. Differentisl activation of transcription factors induced by Ca2+ response amplitude and duration. Nature, 1997, 368: 855-858
7 Joseph SK. Making waves: regulation of inositol triphosphate receptors and propagation of calcium signals in the liver, Hepatology, 1997, 26: 799-801
8 Biolo G, Toigo G, Cioocchi B, et al. Metabolic response to injury and sepsis: change in protein metabolism. Nutrition, 1997, 13: 52S-57S
(1998-07-20收稿), 百拇医药
单位:郝胜利 张孙曦 北京医科大学生物物理系,北京 100083;庞永政 苏静怡 唐朝枢 杨 军 第一医院心血管研究所
关键词:败血病;肝;细胞核;肌醇1,4,5-三磷酸;受体
北京医科大学学报990406 摘 要 目的:观察早期、晚期败血症大鼠肝细胞内核膜上1,4,5-三磷酸肌醇受体(inositol 1,4,5-triphosphate receptors, IP3R)的变化。方法:通过结扎并穿刺盲肠制作大鼠败血症模型,差速离心分离内核膜,[3H]IP3放射配体分析肝内核膜IP3R与其配体的最大结合容量(Bmax)及亲和力(Kd)。45Ca2+转运测定内核膜IP3R释放Ca2+功能。结果:早期和晚期败血症Bmax分别增加14%(P<0.05)和91%(P<0.01)。但Kd值无明显变化(P>0.05)。IP3引起45Ca2+转运在败血症时也相应增加。结论:在败血症时肝细胞核被膜IP3R发生上调,其释放Ca2+的能力增强, 但结构可能未发生变化。
, 百拇医药
中国图书资料分类法分类号 R631.3-332
Changes of inositol 1,4,5-triphosphate receptors
in inner nuclear membrane of rat liver during sepsis
HAO Sheng-Li#, YANG Jun, ZHANG Sun-Xi, PANG Yong-Zheng, SU Jing-Yi, TANG Chao-Shu
(#Department of Biophysics, Beijing Medical University, Beijing 100083)
ABSTRACT Objective: To investigate the changes of inositol triphosphate receptors in the inner nuclear membrane of rat liver during sepsis. Methods: Septic rat model was prepared by cecal ligation and puncture (LCP). The binding site density (Bmax) and affinity (Kd) of IP3 to the inner nuclear membrane were measured by [3H]IP3 binding assay. The function of IP3 receptors to release Ca2+ was assessed by 45Ca2+ movement to the inner nuclear membrane vesicle upon the action of IP3. Results: Bmax was increased by 14% (P<0.05) during early sepsis and by 91% (P<0.01) during late sepsis while no alterations of the affinity of IP3R to its ligand was shown during sepsis. 45Ca2+ movement to the inner nuclear membrane vesicle was also increased accordingly during sepsis. Conclusion: Binding site density and the function of IP3R in the inner nuclear membrane were progressively increased during sepsis, while there might be no change in the structure.
, 百拇医药
MeSH Septicemia Liver Cell nucleus Inositol 1,4,5-triphosphate Receptors
败血症及继发的多器官功能衰竭是感染性死亡的常见原因[1]。由于败血症的发病机制迄今尚未完全阐明,尽管目前医疗手段不断提高,病死率仍呈上升趋势[1]。现已发现参与败血症的体液因子很多[1],研究这些因子在细胞水平上的相互作用是阐明败血症的关键。其中细胞核内Ca2+信号变化尤其值得关注。Ca2+是调节细胞功能代谢的重要信使物质,近来发现Ca2+不仅为胞浆信使,还是核内信使,参与调控细胞分裂、分化、凋亡、基因转录等核内重要过程[2]。核存在一整套Ca2+信号产生系统[2]:内、外两层核膜形成的腔(即内核膜腔)贮有大量的钙亦为一钙库,Ca2+-ATPase,和1,3,4,5-四磷酸肌醇受体(IP4R)是核Ca2+ 摄取系统,分布于外层核膜上。1,4,5-三磷酸肌醇(inositol 1,4,5 triphosphate, IP3) 受体(IP3 receptor, IP3R)和ryanodine受体(ryanodine receptor, RyR)是核Ca2+释放系统,分布在内核膜上,它们本身即为Ca2+通道, 分别在IP3和环腺苷二磷酸核糖(cyclic ADP ribose, cADPr)作用下,将核被膜腔内贮存的Ca2+释入核浆。核Ca2+摄取和释放系统精确地调控核内[Ca2+]变化,进而影响核的各种功能[2]。本室曾报道败血症大鼠肝细胞核Ca2+泵功能的改变[3],在此基础上本实验观察败血症大鼠肝细胞核内核膜IP3R的变化。以探讨败血症时造成核Ca2+信号改变的机制。
, 百拇医药
1 材料与方法
1.1 大鼠败血症模型的制作[4]
雄性SD大鼠200~250 g(北京医科大学实验动物中心提供),术前禁食8 h,自由饮水,异戊巴比妥钠(每1千克体重60 mg, i.p.)麻醉下,开腹,3-0号线结扎盲肠并用18号针头穿刺两孔,分层缝合腹壁。术后皮下注射生理盐水(每1千克体重40 ml)。术后9,18 h分别为早期败血症和晚期败血症。
1.2 肝细胞核内核膜的提纯[5]
所有操作在0~4℃下进行。用50 ml冰冷TKM液(mmol.L-1:Tris/HCl 50, KCl 25, MgCl2 5; pH 7.5)从门静脉原位灌洗肝,取肝剪碎置于40 ml匀浆液(含0.25 mol.L-1蔗糖, 1.0 mmol.L-1 EGTA 的TKM液)中,匀浆,纱布过滤, 离心(2 250 r.min-1, 10 min), 弃上清,将沉淀加6 ml匀浆液,12 ml含2.3 mol.L-1蔗糖的TKM液混匀, 装入离心管,下铺6 ml含2.3 mol.L-1蔗糖的TKM液。再离心(27 000 r.min-1, 30 min), 沉淀即为核。 核用缓冲液A(含0.25 mol.L-1蔗糖,10 mmol.L-1 MgCl2,1 mmol.L-1 DTT1, 10 mg.L-1 leupeptin, 2 mmol.L-1 PMSF2, 50 mmol.L-1 Tris- HCl, pH 7.4)重悬, 加入10 g.L-1柠檬酸钠, 冰浴30 min并轻轻搅拌,离心(500 r.min-1, 15 min),去外膜核沉于管底。再用缓冲液A重悬沉淀,使核浓度为5 g.L-1,加入DNase I (250 mg.L-1), 在4℃消化14 h, 进行蔗糖密度梯度(0.25、1.6、2.4 mol.L-1)离心(27 000 r.min-1, 2 h), 内核膜位于0.25/1.60 mol.L-1蔗糖溶液界面。考马斯亮蓝法定量蛋白。按文献[6]方法测定标志酶活性:NAD焦磷酸化酶,NADPH细胞色素C还原酶。
, http://www.100md.com
1.3 [3H]IP3结合测定[5]
内核膜用含50 mmol.L-1 Tris-HCl,pH 8.0,2 mmol.L-1 EDTA悬浮,进行[3H] IP3结合反应,分别加浓度递增的[3H] IP3(0.05~1.5 nmol.L-1), 反应体积400 μl,加入核0.1 mg蛋白/管 ,0℃下反应10 min。 结合与游离的放射性配体([3H]IP3)用离心法(12 000 r.min-1, 5 min)分离,上清抽吸去除,沉淀加1 ml 组织溶解液(Soluene 350, Packard)、乙酸70 μl,转至液闪杯中,用液闪仪测定[3H] IP3放射活性。 非特异结合通过加10 μmol.L-1 IP3测定。由Scatchard分析得到Kd, Bmax值。
, 百拇医药
1.4 45Ca2+ 转运测定[5]
内核膜置于缓冲液B( mmol.L-1, 250蔗糖,2 EGTA, 2 EDTA, 4 K2HPO4, 4 MgCl2, 50 Tris-HCl, pH 8.0 ),并含2.08 mmol.L-1 CaCl2 (游离[Ca2+] 为1 μmol.L-1)。 加入7.4×104 Bq.ml-1 45Ca2+ (Amersham公司), 实验分两组, 一组加5 μmol.L-1 IP3,另一组加2 μmol.L-1离子霉素(ionomycin), 37℃反应并计时, 按不同时间点通过真空抽滤中止反应,内核膜被截留在GF/ B (whatman) 玻璃纤维膜。用3 ml冰冷的缓冲液B快速冲洗纤维膜, 后将其置于液闪杯中,干燥后在液闪仪测定45Ca2+放射活性。转运的45Ca2+ 量由给定时间点放射性减去开始的放射性求得。
, 百拇医药
1.5 数据处理
实验数据均以
 ±s表示,单因素方差分析或Student- Newman- Keuls检验。
±s表示,单因素方差分析或Student- Newman- Keuls检验。2 结果
2.1 肝细胞核及内层核膜的鉴定
NAD焦磷酸酶是细胞核的标志酶[5],内层核膜上的活性约为匀浆的21倍[每分每毫克蛋白(78.26±5.44) vs (3.68±0.27) nmol]。而微粒体的标志酶NADPH细胞色素C还原酶,在内层核膜只有匀浆的1/8[每分每毫克蛋白(1.27±0.11) vs(10.27±0.87) nmol]。表明得到的核及内层核膜纯度高、污染小。上述标识酶在败血症组与对照组之间相近, 差别无统计学意义(P>0.05)。
, 百拇医药
2.2 [3H] IP3 与内核被膜上IP3R的结合
本实验置内核膜于低渗缓冲液,使其破碎成小片, 进行[3H] IP3 结合实验. 结果显示IP3与内核膜结合的最大容量Bmax在早期败血症组比对照组增加14.2%[每毫克蛋白(2 629±221) vs (2 302±186) fmol, P<0.05]。晚期败血症时Bmax进一步升高,为每毫克蛋白4408±286 fmol,是对照组的1.91倍(P<0.01 ), 亦比早期败血症组增加了 17% (P<0.01)。IP3 与内核膜上IP3R的亲和力在早期败血症时无变化(3组Kd分别为:nmol.L-1,对照组1.18±0.20;早期组1.16±0.22;晚期组1.38±0.24,各组间P>0.05,见图1A,1B)。
, 百拇医药
2.3 IP3 诱发的45Ca2+向内核膜囊泡中的转运
内核膜在等渗液中自发形成内面朝里的囊泡[5](vesicle)。加入5 μmol.L-1 IP3发现45Ca2+转入内核膜囊泡的量随时间呈先升后降的双相变化(见图2A)。早期败血症组, 各时间点45Ca2+转运的量均高于对照; 晚期败血症组45Ca2+转运量进一步增加,当以2 μmol.L-1离子霉素代替IP3时,发现Ca2+进入囊泡的量约为这一作用的2~5倍,其中峰值(30S时)差别最大。败血症过程引起的Ca2+转运量也呈进行性增加(见图2B)。

, http://www.100md.com
图1 [3H]IP3与败血症大鼠肝细胞内层核膜结合的饱和曲线(A)
及Scatchard曲线(B),
 ±s, n=8, control, ES, LS
±s, n=8, control, ES, LS分别表示对照组、早期和晚期败血症组(下同)
Figure 1 Saturation curve (A) and Scatchard plot (B) of [3H]IP3
binding to liver inner nuclear membrane from septic rat,
 ±s, n=8,ES, LS represent early sepsis group and late sepsis group, respectively
±s, n=8,ES, LS represent early sepsis group and late sepsis group, respectively, http://www.100md.com
3 讨论
本实验发现败血症不同时期IP3与内膜结合的最大容量(Bmax)呈进行性增加,表明IP3受体数量增加,而且在晚期比早期增加更为显著。IP3和IP3R的亲合力在败血症时变化不显著,表明IP3R结构可能未发生变化。败血症时IP3诱发45Ca2+进入内核膜囊泡的量高于对照,表明核IP3R释放Ca2+功能在败血症时呈进行性增强,与 IP3R数量的增加一致。造成IP3R上调的机制尚待进一步研究。

图2 5 μmol.L-1 IP3 (A) 及2 μmol/L离子霉素 (B) 作用下45Ca2+
, 百拇医药
向内核膜囊泡转运的时间关系曲线,
 ±s, n=8, *P<0.05,** P<0.01(与对照组相比);# P<0.05,## P<0.01 (与ES相比)
±s, n=8, *P<0.05,** P<0.01(与对照组相比);# P<0.05,## P<0.01 (与ES相比)Figure 2 45Ca2+ transport to the inner nuclear membrane vesicle acted
by 5 μmol.L-1 IP3 (A) or 2 μmol.L-1 ionomycin (B),
 ±s,n=8, * P<0.05, ** P<0.01 (vs control);
±s,n=8, * P<0.05, ** P<0.01 (vs control);, http://www.100md.com
# P<0.05, ## P<0.01 (vs ES)
IP3R数目的变化可能会影响到核内Ca2+信号的幅度及频率,近来发现在肝细胞胞浆Ca2+信号频率和幅度与内质网上的IP3R数目、分布及功能直接相关[7], 推测核Ca2+信号也与核被膜上IP3R有关。Ca2+信号频率和幅度的差异是Ca2+特异调控细胞内不同生理过程的内在机制[6]。肝是体内代谢及防御的重要器官,在败血症的发生发展过程中起重要作用[8]。在早期败血症时肝细胞蛋白表达迅速发生改变[8],表明核功能发生了改变(如基因转录等)。本实验发现IP3R在早期败血症时受体上调可能是造成这些改变的重要原因; 晚期败血症时IP3R受体进一步上调,向核浆内释放Ca2+能力增加,核内可能出现Ca2+超载,这些变化可能是晚期时肝细胞蛋白合成减少,细胞发生凋亡,进而导致肝功能衰竭的一个机制[8]。
, 百拇医药
参考文献
1 Bone RC, Grodzin CJ, Balk RA. Sepsis: a new hypothesis for pathogenesis of the disease process, Chest, 1997, 112: 235-243
2 Santella L, Carafoli E. Calcium signalling in the nucleus. FASEB J, 1997, 11: 1091-1109
3 王培勇,叶 赤,庞永政,等.败血症大鼠肝细胞核Ca2+ 转运功能的改变. 生理学报,1997,49:191-196
4 Wichterman KA, Baue AE, Chaudry IH. Sepsis and septic shock: a review of laboratory models and a proposal. J Surg Res, 1980, 29: 189-201
, 百拇医药
5. Humbert JP, Matter N, Artault JC, et al. Inositol 1,4,5-triphosphate receptor is located to the inner nuclear membrane vindicating regulation of nuclear calcium signalling by inositol 1,4,5-triphosphate. J Biol Chem, 1996, 271: 478-485
6 Dolmetsch RE, Lewis RS, Goodnow CC, et al. Differentisl activation of transcription factors induced by Ca2+ response amplitude and duration. Nature, 1997, 368: 855-858
7 Joseph SK. Making waves: regulation of inositol triphosphate receptors and propagation of calcium signals in the liver, Hepatology, 1997, 26: 799-801
8 Biolo G, Toigo G, Cioocchi B, et al. Metabolic response to injury and sepsis: change in protein metabolism. Nutrition, 1997, 13: 52S-57S
(1998-07-20收稿), 百拇医药