缺氧性肺动脉高压大鼠肺动脉一氧化氮合酶的实验研究*
作者:崔燕南 马郁文 杜军保
单位:北京医科大学第一医院儿科,北京 100034
关键词:高血压;肺性;流行病学;一氧化氮合酶☆;肺动脉;酶学;一氧化氮;血液
北京医科大学学报990619 摘 要 目的:研究大鼠肺动脉中一氧化氮合酶(nitric oxide synthase, NOS)的含量及分布变化与慢性缺氧性肺动脉高压(hypoxic pulmonary hypertension, HPH)发生的关系。方法:采用eNOS多克隆抗体,对慢性HPH大鼠的肺组织进行免疫组织化学分析,观察缺氧组及对照组大鼠各级肺动脉中eNOS含量及定位;同时应用分光光度计测定缺氧组及对照组大鼠血浆中NO的间接浓度。结果:正常大鼠肺动脉内皮细胞及平滑肌细胞均含有较高的eNOS表达,且各级肺动脉中eNOS含量差异无显著性;缺氧组大鼠各级肺动脉内皮细胞及平滑肌细胞eNOS含量均较对照组显著减少;缺氧组大鼠血浆NO间接浓度较对照组明显降低。结论:大鼠肺动脉内皮细胞和平滑肌细胞eNOS含量下降及血浆NO浓度下降参与慢性HPH的形成。
, 百拇医药
中国图书资料分类法分类号 R563-332
A study on endothelial nitric oxide synthase in pulmonary arteries
of hypoxic pulmonary hypertensive rats
CUI Yan-Nan, MA Yu-Wen, DU Jun-Bao
(Department of Pediatrics, the First Hospital, Beijing Medical University, Beijing 100034)
MeSH Hypertension, pulmonary/epidemiol Nitric oxide synthase☆ Pulmonary artery/enzymol Nitric oxide/blood
, 百拇医药
ABSTRACT Objective: To study the abundance and localization of nitric oxide synthase (NOS) in pulmonary arteries of rats and to explore the relationship between their changes and chronic hypoxic pulmonary hypertension (HPH). Methods: Immunohistochemistry technique was performed on the lung tissues of the HPH rats with eNOS multiclonal antibody to assay the abundance and localization of eNOS in different segments of pulmonary arteries of the hypoxic and control rats. At the same time, the plasma concentration of nitric oxide (NO) metabolite, nitrite, was measured by spectrophotometry. Results: eNOS expression was found in pulmonary artery endothelial cells and smooth muscle cells, and there was no significant difference among the different segments of pulmonary arteries, whereas the eNOS expression was inhibited in endothelial cells and smooth muscle cells of pulmonary arteries in hypoxia group; The plasma concentration of nitrite in hypoxia group was significantly decreased compared with that of control rats. Conclusion: The results suggest that the decrease in eNOS in pulmonary artery endothelial cells and smooth muscle cells by hypoxia as well as the decrease in plasma concentration of NO may play a role in the development of chronic HPH.
, 百拇医药
(J Beijing Med Univ, 1999,31:552-554)
缺氧性肺动脉高压( hypoxic pulmonary hypertension, HPH)是多种心肺疾病发展过程中的病理生理环节,其发生机制尚未完全清楚。研究发现血管内皮细胞产生的一氧化氮(nitric oxide, NO)在HPH的发生机制中起重要调节作用。动物实验表明外源性L-精氨酸(L-Arginine, L-Arg),可使NO合成增多,从而降低肺动脉压力;反之给予NO合酶(nitric oxide synthase, NOS)抑制剂如L-精氨酸甲脂(Nω-L-Arginine methyl ester, L-NAME)注射,则可使NO合成减少,致肺动脉压力进一步升高。NOS是NO合成中重要的限速酶。迄今为止关于慢性HPH时肺动脉中NO体系,特别是肺动脉内皮细胞及平滑肌细胞内内皮源性NOS (endothelial NOS, eNOS)含量及定位的研究较少。我们应用eNOS多克隆抗体,对慢性HPH大鼠的肺组织进行免疫组织化学分析,与正常情况下肺动脉eNOS的含量及定位相对比,研究HPH时,肺动脉eNOS含量变化及其定位,探讨NOS对HPH的调节作用。
, 百拇医药
1 材料与方法
1.1 建立缺氧性肺动脉高压模型
雄性Wistar大鼠共12只,体重200~300g,随机分为缺氧组及对照组,各6只。将缺氧组大鼠置于CG1型常压低氧箱内(中国医学科学院基础医学研究所),通入氮气,使箱内氧体积分数在30min左右达(10.0±0.5)%,每天缺氧6h,共缺氧1周。对照组大鼠呼吸室内空气。实验期间两组大鼠在相同室温下,饲养条件相同。
1.2 肺动脉压力测定
将大鼠麻醉后,经上腔静脉插入右心导管,经右心房、右心室达肺动脉。用P50压力传感器连接RM-6000型多导生理记录仪记录肺动脉收缩压(pulmonary artery systolic pressure, PASP)、肺动脉舒张压(pulmonary artery diastolic pressure, PADP)及肺动脉平均压(pulmonary artery mean pressure, PAMP)。
, http://www.100md.com
1.3 血浆NO的Greiss反应法测定
将血液离心后,用干燥抗凝玻璃管收取血浆0.1 ml,加1.5 g.L-1硫酸锌0.6ml,加双蒸水0.4ml混匀,加40g.L-1氢氧化钠0.1ml混匀,冰上孵育60min,10000×g离心2min,取上清0.6ml,加双蒸水0.4ml及3g.L-1磺胺0.1ml,冰上孵育15min,之后加6mmol.L-1萘乙烯二胺盐酸盐0.1ml,室温放置1h,545nm比色读光密度值,根据样品光密度值,按标准曲线计算NO间接浓度。在亚硝酸钠所作标准曲线上,光密度值(545nm比色)可测范围为0.02~0.14(NO间接浓度相应为0~100μmol.L-1)[1]。
1.4 免疫组织化学分析
, 百拇医药
标本制备:取一侧肺叶组织,在恒冷切片机内,连续冰冻切片,片厚8~10 μm,裱贴于经5g.L-1明胶化的载玻片上。取冰冻切片室温干燥1h,纯丙酮中加0.3%(体积分数)H2O2室温固定10~20min,PBS清洗2min×3次。1∶50(体积比)正常血清封闭20min,滴加体积比为1∶50稀释的一抗,4°C过夜, PBS洗2min×3次,滴加1∶100(体积比)稀释的生物素化二抗,37°C ,20min,PBS冲洗,滴加1∶100(体积比)稀释的SABC液,37°C, 20min,PBS冲洗,DAB显色3~5min,苏木素复染,梯度酒精脱水,二甲苯透明,封片镜检。光镜下,肺动脉中eNOS的分布呈棕黄色颗粒为其阳性信号。
1.5 肺动脉组织中eNOS的免疫活性表达分析
用半定量法分析eNOS的含量。首先根据肺动脉在肺内的位置将其分为3级:Ⅰ级肺动脉, 伴呼吸性支气管的动脉;Ⅱ级肺动脉, 伴终末支气管的动脉; Ⅲ级肺动脉,伴细支气管的动脉。在光学显微镜下,根据每条肺动脉内皮细胞或平滑肌细胞呈现eNOS阳性表达的百分比,将其免疫活性分为3个等级。肺动脉内皮细胞或平滑肌细胞中无eNOS阳性表达者为(-);肺动脉0~50%的内皮细胞或平滑肌细胞中eNOS呈现阳性表达者为(+);肺动脉51%~100%的内皮细胞或平滑肌细胞中eNOS呈现阳性表达者为(++)。每份标本各级血管至少检测10条。为便于理解,肺动脉中eNOS含量用积分表示,即:以肺动脉的百分比乘以反应强度加权值(“-”者,其反应强度加权值为0;“+”者,其反应强度加权值为0.5;“++”者,其反应强度加权值为1)[2]。
, 百拇医药
1.6 统计学处理
采用组间t检验对肺动脉压力在两组间的差异进行统计学处理;采用卡方检验对两组不同节段肺动脉eNOS表达强度之肺动脉百分比进行统计学分析。由于二组大鼠肺动脉中eNOS表达的积分值来源于反应强度加权值与该表达强度的肺动脉之百分比之乘积(间接计算),因此对此指标未行统计学处理[2]。
2 结果
2.1 肺动脉压力的变化
缺氧组大鼠的PASP、PAMP及PADP均较对照组明显升高(P值均<0.01, 表1)。
表1 二组大鼠肺动脉压力的变化(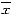 ±s
±s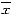 )
)
, 百拇医药
Table 1 Changes in pulmonary artery pressure in hypoxic rats(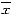 ±s
±s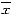 ) Groups
) Groups
n
p/kPa
PASP
PAMP
PADP
Control
6
3.14±0.13
, http://www.100md.com
2.23±0.16
1.55±0.22
Hypoxia
6
6.74±0.22**
4.75±0.27**
3.33±0.38**
PASP, pulmonary artery systolic pressure; PAMP, pulmonary artery mean pressure; PADP, pulmonary artery diastolic pressure; **P<0.01, compared with the control group.2.2 血浆NO间接浓度的变化
, http://www.100md.com
缺氧组大鼠血浆NO间接浓度[(2.2±0.3)μmol.L-1)]较对照组[(10.0±3.0) μmol.L-1]明显降低(t'=2.940,P<0.05)。
2.3 肺动脉组织中eNOS的免疫活性表达(表2)
2.3.1 肺动脉内皮细胞中eNOS的免疫活性表达 对照组大鼠各级肺动脉内皮细胞eNOS免疫活性表达均为阳性(+或++),其中(58±20)%Ⅰ级肺动脉、(52±15)%Ⅱ级肺动脉、(83±9)%Ⅲ级肺动脉其内皮细胞eNOS免疫活性表达为++;缺氧组大鼠(100±0)%Ⅰ级肺动脉、(92±5)%Ⅱ级肺动脉及(83±14)%Ⅲ级肺动脉其内皮细胞eNOS免疫活性表达为-,两组比较差异有显著性 (P均<0.01)。
表2 不同eNOS表达强度之肺动脉百分比(%)(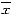 ±s
±s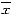 )
)
, 百拇医药
Table 2 The percentage of pulmonary arteries expressing
the different strength of signals of eNOS(%)(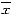 ±s
±s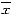 ) Strength of
) Strength of
signals
Control
Hypoxia group
EC
SMC
, 百拇医药
EC
SMC
PA segment Ⅰ
-
9±8
11±5
100±0
94±6
+
33±17
42±20
0
6±6
, 百拇医药
++
58±20
47±18
0
0
PA segment Ⅱ
-
8±8
0
92±5
74±16
+
40±10
, 百拇医药
38±14
8±5
26±16
++
52±15
62±14
0
0
PA segment Ⅲ
-
5±6
0
83±14
, http://www.100md.com
72±20
+
12±8
21±12
17±14
28±18
++
83±9
79±12
0
0
EC, endothelial cell; SMC, smooth muscle cell; PA, pulmonary artery. Comparison of the percentages of PA expressing different signals(-,+,++) between control and hypoxia groups: EC of segment Ⅰ:χ2=166.0, P<0.01; EC of segment Ⅱ: χ2=143.9, P<0.01; EC of segment Ⅲ: χ2=152.9, P<0.01; SMC of segment Ⅰ: χ2=139.6, P<0.01; SMC of segment Ⅱ: χ2=59.9, P<0.01; SMC of segment Ⅲ: χ2=152.0, P<0.01.
, http://www.100md.com
2.3.2 肺动脉平滑肌细胞中eNOS的免疫活性表达 对照组大鼠各级肺动脉平滑肌细胞eNOS免疫活性表达均为阳性(+或++),其中(47±18)%Ⅰ级肺动脉、(62±14)%Ⅱ级肺动脉及(79±12)%Ⅲ级肺动脉其平滑肌细胞中eNOS免疫活性表达为++;缺氧组大鼠(94±6)%Ⅰ级肺动脉、(74±16)%Ⅱ级肺动脉及(39±20)%Ⅲ级肺动脉其平滑肌细胞中eNOS的免疫活性表达为-。
2.3.3 二组大鼠肺动脉中eNOS表达积分情况见表3。
表3 二组大鼠肺动脉中eNOS表达的积分值(分)
Table 3 The expressing score of eNOS in pulmonary arteries of rats PA segment
Control
, 百拇医药
Hypoxia group
SMC
EC
SMC
EC
Ⅰ
68.05
74.50
2.78
0
Ⅱ
81.22
71.83
, 百拇医药
12.92
3.75
Ⅲ
89.44
88.62
13.89
8.56
EC, endothelial cell; SMC, smooth muscle cell; PA, pulmonary artery. Satistical analysis was not performed because the above scores were indirectly derived data.
3 讨论
, 百拇医药
肺血管床的内皮细胞对肺循环的调节具有重要作用[3]。许多血管活性因子作用于内皮细胞,通过内皮细胞衍化舒张因子(endothelium-derived relaxing factor, EDRF)引起血管舒张,或通过内皮细胞衍化收缩因子(endothelium-derived contracting factors, EDCFs)引起血管收缩[4]。HPH时上述两者之间的关系异常,包括EDRF与EDCFs之间的作用失衡,这一观点已越来越为人们所接受。
人们已认识到NO是调节肺血管弹性的重要介质之一,而NOS是NO形成所必需的酶,NOS以L-精氨酸和分子氧为底物,形成NO和L-瓜氨酸,NOS是NO生成的限速因子。NOS有3种同功酶,即内皮细胞型NOS(eNOS)、脑型NOS(bNOS)及诱导型NOS(iNOS),已由分子克隆和基因表达所证实。Jennifer等[5]第一次用多克隆抗体免疫组织化学方法证明,eNOS存在于几个种属(包括人)的各种血管内皮细胞,这种多克隆抗体是特异的,与来自脑和巨噬细胞的bNOS和iNOS均无交叉反应。
, 百拇医药
实验证明,NO主要产生于血管内皮细胞[6],eNOS仅存在于内皮细胞中。随着研究的进展,人们发现eNOS不仅存在于肺动脉内皮细胞,同时亦存在于平滑肌细胞[7]。本实验用免疫组织化学方法证实,eNOS不仅存在于肺动脉内皮细胞,同时亦大量存在于肺动脉的平滑肌细胞中,二者含量均无显著差异,推测NO也同时产生于内皮细胞及平滑肌细胞。
我们还观察到对照组大鼠各级肺动脉中eNOS含量较高,NO间接含量较高,其肺动脉压力在正常范围;缺氧后各级肺动脉中eNOS含量显著下降,NO间接含量明显下降,而其PAP明显升高,提示缺氧状态下肺动脉eNOS的表达减少,随之NO生成与释放减少,舒张血管作用减弱,表明肺动脉中eNOS确实参与了HPH的发生过程。同时,结合以往实验证实,缺氧刺激ETmRNA表达增加[8],使ET合成与释放增加,缩血管作用增强,二者共同作用的结果是促进血管压力增高,血管阻力增大,从而形成肺动脉高压。
, 百拇医药
综上所述,我们的研究结果为正常肺动脉组织中无论内皮细胞或平滑肌细胞均含有eNOS,HPH大鼠各级肺动脉内皮细胞和平滑肌细胞中eNOS含量均较对照组明显降低,缺氧抑制了eNOS的表达,NO产生与释放下降,舒张血管作用减弱,形成肺动脉高压。
本文在分析大鼠肺动脉组织NOS表达时,还采用了表达强度积分这一指标。即肺动脉中eNOS含量用积分表示[2]。以肺动脉的百分比乘以反应强度加权值即为表达强度积分。该分析方法的优点在于便于从大鼠整体肺组织角度认识其肺动脉中内皮细胞或平滑肌细胞NOS表达强度,较从单一肺动脉组织所得出的某一表达强度更加全面。
*国家自然科学基金(39870844)与卫生部科研基金资助课题;
参考文献
1 齐建光,杜军保,贾建锋,等.低氧性肺动脉高压大鼠肺血管结构及血浆一氧化氮的变化.北京医科大学学报,1999,4:324-327
, 百拇医药
2 Hislop AA, Springgall DR, Buttery LDK, et al. Aboundance of endothelial nitric oxide synthase in newborn intrapulmonary arteries. Arch Dis Child, 1995, 73: F17-F21
3 Loesch A, Burnstock G. Ultrastructural localization of nitric oxide synthase and endothelin in rat pulmonary artery and vein during postnatal development and aging. Cell Tissue Res, 1996,283:355-365
4 Shepherd JT, Vanhontte PM. Endothelium derived relaxing factor (EDRF) and contracting factors (EDCF) in the control of cardiovascular homeostasis: the pioneering observations. In:Rubanyi G, ed. Cardiovascular significance of endothelium derived vasoactive factors. New York: Futara, 1991.39-64
, 百拇医药
5 Jennifer SP, Nakane M, Buttery LDK, et al. Characterization and localization of endothelial nitric oxide synthase using specific monoclonal antibodies. Am J Physiol,1993,265:C1379-1387
6 Clive JL, Barry AB. What is the relationship between the endothelium derived relaxant factor and nitric oxide? Life Sci, 1989,45(1):1-14
7 Loesch A, Burnstock G. Ultrastructural localization of nitric oxide synthase and endothelin in coronary and pulmonary arteries of newborn rats. Cell Tissue Res, 1995,279:475-483
8 杜军保,李万镇,黎 文,等.慢性低氧大鼠肺动脉内皮素mRNA的表达及定位.北京医科大学学报, 1997,29(1):15-17
(1999-04-21收稿), 百拇医药
单位:北京医科大学第一医院儿科,北京 100034
关键词:高血压;肺性;流行病学;一氧化氮合酶☆;肺动脉;酶学;一氧化氮;血液
北京医科大学学报990619 摘 要 目的:研究大鼠肺动脉中一氧化氮合酶(nitric oxide synthase, NOS)的含量及分布变化与慢性缺氧性肺动脉高压(hypoxic pulmonary hypertension, HPH)发生的关系。方法:采用eNOS多克隆抗体,对慢性HPH大鼠的肺组织进行免疫组织化学分析,观察缺氧组及对照组大鼠各级肺动脉中eNOS含量及定位;同时应用分光光度计测定缺氧组及对照组大鼠血浆中NO的间接浓度。结果:正常大鼠肺动脉内皮细胞及平滑肌细胞均含有较高的eNOS表达,且各级肺动脉中eNOS含量差异无显著性;缺氧组大鼠各级肺动脉内皮细胞及平滑肌细胞eNOS含量均较对照组显著减少;缺氧组大鼠血浆NO间接浓度较对照组明显降低。结论:大鼠肺动脉内皮细胞和平滑肌细胞eNOS含量下降及血浆NO浓度下降参与慢性HPH的形成。
, 百拇医药
中国图书资料分类法分类号 R563-332
A study on endothelial nitric oxide synthase in pulmonary arteries
of hypoxic pulmonary hypertensive rats
CUI Yan-Nan, MA Yu-Wen, DU Jun-Bao
(Department of Pediatrics, the First Hospital, Beijing Medical University, Beijing 100034)
MeSH Hypertension, pulmonary/epidemiol Nitric oxide synthase☆ Pulmonary artery/enzymol Nitric oxide/blood
, 百拇医药
ABSTRACT Objective: To study the abundance and localization of nitric oxide synthase (NOS) in pulmonary arteries of rats and to explore the relationship between their changes and chronic hypoxic pulmonary hypertension (HPH). Methods: Immunohistochemistry technique was performed on the lung tissues of the HPH rats with eNOS multiclonal antibody to assay the abundance and localization of eNOS in different segments of pulmonary arteries of the hypoxic and control rats. At the same time, the plasma concentration of nitric oxide (NO) metabolite, nitrite, was measured by spectrophotometry. Results: eNOS expression was found in pulmonary artery endothelial cells and smooth muscle cells, and there was no significant difference among the different segments of pulmonary arteries, whereas the eNOS expression was inhibited in endothelial cells and smooth muscle cells of pulmonary arteries in hypoxia group; The plasma concentration of nitrite in hypoxia group was significantly decreased compared with that of control rats. Conclusion: The results suggest that the decrease in eNOS in pulmonary artery endothelial cells and smooth muscle cells by hypoxia as well as the decrease in plasma concentration of NO may play a role in the development of chronic HPH.
, 百拇医药
(J Beijing Med Univ, 1999,31:552-554)
缺氧性肺动脉高压( hypoxic pulmonary hypertension, HPH)是多种心肺疾病发展过程中的病理生理环节,其发生机制尚未完全清楚。研究发现血管内皮细胞产生的一氧化氮(nitric oxide, NO)在HPH的发生机制中起重要调节作用。动物实验表明外源性L-精氨酸(L-Arginine, L-Arg),可使NO合成增多,从而降低肺动脉压力;反之给予NO合酶(nitric oxide synthase, NOS)抑制剂如L-精氨酸甲脂(Nω-L-Arginine methyl ester, L-NAME)注射,则可使NO合成减少,致肺动脉压力进一步升高。NOS是NO合成中重要的限速酶。迄今为止关于慢性HPH时肺动脉中NO体系,特别是肺动脉内皮细胞及平滑肌细胞内内皮源性NOS (endothelial NOS, eNOS)含量及定位的研究较少。我们应用eNOS多克隆抗体,对慢性HPH大鼠的肺组织进行免疫组织化学分析,与正常情况下肺动脉eNOS的含量及定位相对比,研究HPH时,肺动脉eNOS含量变化及其定位,探讨NOS对HPH的调节作用。
, 百拇医药
1 材料与方法
1.1 建立缺氧性肺动脉高压模型
雄性Wistar大鼠共12只,体重200~300g,随机分为缺氧组及对照组,各6只。将缺氧组大鼠置于CG1型常压低氧箱内(中国医学科学院基础医学研究所),通入氮气,使箱内氧体积分数在30min左右达(10.0±0.5)%,每天缺氧6h,共缺氧1周。对照组大鼠呼吸室内空气。实验期间两组大鼠在相同室温下,饲养条件相同。
1.2 肺动脉压力测定
将大鼠麻醉后,经上腔静脉插入右心导管,经右心房、右心室达肺动脉。用P50压力传感器连接RM-6000型多导生理记录仪记录肺动脉收缩压(pulmonary artery systolic pressure, PASP)、肺动脉舒张压(pulmonary artery diastolic pressure, PADP)及肺动脉平均压(pulmonary artery mean pressure, PAMP)。
, http://www.100md.com
1.3 血浆NO的Greiss反应法测定
将血液离心后,用干燥抗凝玻璃管收取血浆0.1 ml,加1.5 g.L-1硫酸锌0.6ml,加双蒸水0.4ml混匀,加40g.L-1氢氧化钠0.1ml混匀,冰上孵育60min,10000×g离心2min,取上清0.6ml,加双蒸水0.4ml及3g.L-1磺胺0.1ml,冰上孵育15min,之后加6mmol.L-1萘乙烯二胺盐酸盐0.1ml,室温放置1h,545nm比色读光密度值,根据样品光密度值,按标准曲线计算NO间接浓度。在亚硝酸钠所作标准曲线上,光密度值(545nm比色)可测范围为0.02~0.14(NO间接浓度相应为0~100μmol.L-1)[1]。
1.4 免疫组织化学分析
, 百拇医药
标本制备:取一侧肺叶组织,在恒冷切片机内,连续冰冻切片,片厚8~10 μm,裱贴于经5g.L-1明胶化的载玻片上。取冰冻切片室温干燥1h,纯丙酮中加0.3%(体积分数)H2O2室温固定10~20min,PBS清洗2min×3次。1∶50(体积比)正常血清封闭20min,滴加体积比为1∶50稀释的一抗,4°C过夜, PBS洗2min×3次,滴加1∶100(体积比)稀释的生物素化二抗,37°C ,20min,PBS冲洗,滴加1∶100(体积比)稀释的SABC液,37°C, 20min,PBS冲洗,DAB显色3~5min,苏木素复染,梯度酒精脱水,二甲苯透明,封片镜检。光镜下,肺动脉中eNOS的分布呈棕黄色颗粒为其阳性信号。
1.5 肺动脉组织中eNOS的免疫活性表达分析
用半定量法分析eNOS的含量。首先根据肺动脉在肺内的位置将其分为3级:Ⅰ级肺动脉, 伴呼吸性支气管的动脉;Ⅱ级肺动脉, 伴终末支气管的动脉; Ⅲ级肺动脉,伴细支气管的动脉。在光学显微镜下,根据每条肺动脉内皮细胞或平滑肌细胞呈现eNOS阳性表达的百分比,将其免疫活性分为3个等级。肺动脉内皮细胞或平滑肌细胞中无eNOS阳性表达者为(-);肺动脉0~50%的内皮细胞或平滑肌细胞中eNOS呈现阳性表达者为(+);肺动脉51%~100%的内皮细胞或平滑肌细胞中eNOS呈现阳性表达者为(++)。每份标本各级血管至少检测10条。为便于理解,肺动脉中eNOS含量用积分表示,即:以肺动脉的百分比乘以反应强度加权值(“-”者,其反应强度加权值为0;“+”者,其反应强度加权值为0.5;“++”者,其反应强度加权值为1)[2]。
, 百拇医药
1.6 统计学处理
采用组间t检验对肺动脉压力在两组间的差异进行统计学处理;采用卡方检验对两组不同节段肺动脉eNOS表达强度之肺动脉百分比进行统计学分析。由于二组大鼠肺动脉中eNOS表达的积分值来源于反应强度加权值与该表达强度的肺动脉之百分比之乘积(间接计算),因此对此指标未行统计学处理[2]。
2 结果
2.1 肺动脉压力的变化
缺氧组大鼠的PASP、PAMP及PADP均较对照组明显升高(P值均<0.01, 表1)。
表1 二组大鼠肺动脉压力的变化(
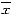 ±s
±s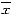 )
), 百拇医药
Table 1 Changes in pulmonary artery pressure in hypoxic rats(
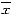 ±s
±s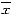 ) Groups
) Groupsn
p/kPa
PASP
PAMP
PADP
Control
6
3.14±0.13
, http://www.100md.com
2.23±0.16
1.55±0.22
Hypoxia
6
6.74±0.22**
4.75±0.27**
3.33±0.38**
PASP, pulmonary artery systolic pressure; PAMP, pulmonary artery mean pressure; PADP, pulmonary artery diastolic pressure; **P<0.01, compared with the control group.2.2 血浆NO间接浓度的变化
, http://www.100md.com
缺氧组大鼠血浆NO间接浓度[(2.2±0.3)μmol.L-1)]较对照组[(10.0±3.0) μmol.L-1]明显降低(t'=2.940,P<0.05)。
2.3 肺动脉组织中eNOS的免疫活性表达(表2)
2.3.1 肺动脉内皮细胞中eNOS的免疫活性表达 对照组大鼠各级肺动脉内皮细胞eNOS免疫活性表达均为阳性(+或++),其中(58±20)%Ⅰ级肺动脉、(52±15)%Ⅱ级肺动脉、(83±9)%Ⅲ级肺动脉其内皮细胞eNOS免疫活性表达为++;缺氧组大鼠(100±0)%Ⅰ级肺动脉、(92±5)%Ⅱ级肺动脉及(83±14)%Ⅲ级肺动脉其内皮细胞eNOS免疫活性表达为-,两组比较差异有显著性 (P均<0.01)。
表2 不同eNOS表达强度之肺动脉百分比(%)(
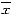 ±s
±s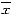 )
), 百拇医药
Table 2 The percentage of pulmonary arteries expressing
the different strength of signals of eNOS(%)(
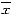 ±s
±s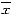 ) Strength of
) Strength ofsignals
Control
Hypoxia group
EC
SMC
, 百拇医药
EC
SMC
PA segment Ⅰ
-
9±8
11±5
100±0
94±6
+
33±17
42±20
0
6±6
, 百拇医药
++
58±20
47±18
0
0
PA segment Ⅱ
-
8±8
0
92±5
74±16
+
40±10
, 百拇医药
38±14
8±5
26±16
++
52±15
62±14
0
0
PA segment Ⅲ
-
5±6
0
83±14
, http://www.100md.com
72±20
+
12±8
21±12
17±14
28±18
++
83±9
79±12
0
0
EC, endothelial cell; SMC, smooth muscle cell; PA, pulmonary artery. Comparison of the percentages of PA expressing different signals(-,+,++) between control and hypoxia groups: EC of segment Ⅰ:χ2=166.0, P<0.01; EC of segment Ⅱ: χ2=143.9, P<0.01; EC of segment Ⅲ: χ2=152.9, P<0.01; SMC of segment Ⅰ: χ2=139.6, P<0.01; SMC of segment Ⅱ: χ2=59.9, P<0.01; SMC of segment Ⅲ: χ2=152.0, P<0.01.
, http://www.100md.com
2.3.2 肺动脉平滑肌细胞中eNOS的免疫活性表达 对照组大鼠各级肺动脉平滑肌细胞eNOS免疫活性表达均为阳性(+或++),其中(47±18)%Ⅰ级肺动脉、(62±14)%Ⅱ级肺动脉及(79±12)%Ⅲ级肺动脉其平滑肌细胞中eNOS免疫活性表达为++;缺氧组大鼠(94±6)%Ⅰ级肺动脉、(74±16)%Ⅱ级肺动脉及(39±20)%Ⅲ级肺动脉其平滑肌细胞中eNOS的免疫活性表达为-。
2.3.3 二组大鼠肺动脉中eNOS表达积分情况见表3。
表3 二组大鼠肺动脉中eNOS表达的积分值(分)
Table 3 The expressing score of eNOS in pulmonary arteries of rats PA segment
Control
, 百拇医药
Hypoxia group
SMC
EC
SMC
EC
Ⅰ
68.05
74.50
2.78
0
Ⅱ
81.22
71.83
, 百拇医药
12.92
3.75
Ⅲ
89.44
88.62
13.89
8.56
EC, endothelial cell; SMC, smooth muscle cell; PA, pulmonary artery. Satistical analysis was not performed because the above scores were indirectly derived data.
3 讨论
, 百拇医药
肺血管床的内皮细胞对肺循环的调节具有重要作用[3]。许多血管活性因子作用于内皮细胞,通过内皮细胞衍化舒张因子(endothelium-derived relaxing factor, EDRF)引起血管舒张,或通过内皮细胞衍化收缩因子(endothelium-derived contracting factors, EDCFs)引起血管收缩[4]。HPH时上述两者之间的关系异常,包括EDRF与EDCFs之间的作用失衡,这一观点已越来越为人们所接受。
人们已认识到NO是调节肺血管弹性的重要介质之一,而NOS是NO形成所必需的酶,NOS以L-精氨酸和分子氧为底物,形成NO和L-瓜氨酸,NOS是NO生成的限速因子。NOS有3种同功酶,即内皮细胞型NOS(eNOS)、脑型NOS(bNOS)及诱导型NOS(iNOS),已由分子克隆和基因表达所证实。Jennifer等[5]第一次用多克隆抗体免疫组织化学方法证明,eNOS存在于几个种属(包括人)的各种血管内皮细胞,这种多克隆抗体是特异的,与来自脑和巨噬细胞的bNOS和iNOS均无交叉反应。
, 百拇医药
实验证明,NO主要产生于血管内皮细胞[6],eNOS仅存在于内皮细胞中。随着研究的进展,人们发现eNOS不仅存在于肺动脉内皮细胞,同时亦存在于平滑肌细胞[7]。本实验用免疫组织化学方法证实,eNOS不仅存在于肺动脉内皮细胞,同时亦大量存在于肺动脉的平滑肌细胞中,二者含量均无显著差异,推测NO也同时产生于内皮细胞及平滑肌细胞。
我们还观察到对照组大鼠各级肺动脉中eNOS含量较高,NO间接含量较高,其肺动脉压力在正常范围;缺氧后各级肺动脉中eNOS含量显著下降,NO间接含量明显下降,而其PAP明显升高,提示缺氧状态下肺动脉eNOS的表达减少,随之NO生成与释放减少,舒张血管作用减弱,表明肺动脉中eNOS确实参与了HPH的发生过程。同时,结合以往实验证实,缺氧刺激ETmRNA表达增加[8],使ET合成与释放增加,缩血管作用增强,二者共同作用的结果是促进血管压力增高,血管阻力增大,从而形成肺动脉高压。
, 百拇医药
综上所述,我们的研究结果为正常肺动脉组织中无论内皮细胞或平滑肌细胞均含有eNOS,HPH大鼠各级肺动脉内皮细胞和平滑肌细胞中eNOS含量均较对照组明显降低,缺氧抑制了eNOS的表达,NO产生与释放下降,舒张血管作用减弱,形成肺动脉高压。
本文在分析大鼠肺动脉组织NOS表达时,还采用了表达强度积分这一指标。即肺动脉中eNOS含量用积分表示[2]。以肺动脉的百分比乘以反应强度加权值即为表达强度积分。该分析方法的优点在于便于从大鼠整体肺组织角度认识其肺动脉中内皮细胞或平滑肌细胞NOS表达强度,较从单一肺动脉组织所得出的某一表达强度更加全面。
*国家自然科学基金(39870844)与卫生部科研基金资助课题;
参考文献
1 齐建光,杜军保,贾建锋,等.低氧性肺动脉高压大鼠肺血管结构及血浆一氧化氮的变化.北京医科大学学报,1999,4:324-327
, 百拇医药
2 Hislop AA, Springgall DR, Buttery LDK, et al. Aboundance of endothelial nitric oxide synthase in newborn intrapulmonary arteries. Arch Dis Child, 1995, 73: F17-F21
3 Loesch A, Burnstock G. Ultrastructural localization of nitric oxide synthase and endothelin in rat pulmonary artery and vein during postnatal development and aging. Cell Tissue Res, 1996,283:355-365
4 Shepherd JT, Vanhontte PM. Endothelium derived relaxing factor (EDRF) and contracting factors (EDCF) in the control of cardiovascular homeostasis: the pioneering observations. In:Rubanyi G, ed. Cardiovascular significance of endothelium derived vasoactive factors. New York: Futara, 1991.39-64
, 百拇医药
5 Jennifer SP, Nakane M, Buttery LDK, et al. Characterization and localization of endothelial nitric oxide synthase using specific monoclonal antibodies. Am J Physiol,1993,265:C1379-1387
6 Clive JL, Barry AB. What is the relationship between the endothelium derived relaxant factor and nitric oxide? Life Sci, 1989,45(1):1-14
7 Loesch A, Burnstock G. Ultrastructural localization of nitric oxide synthase and endothelin in coronary and pulmonary arteries of newborn rats. Cell Tissue Res, 1995,279:475-483
8 杜军保,李万镇,黎 文,等.慢性低氧大鼠肺动脉内皮素mRNA的表达及定位.北京医科大学学报, 1997,29(1):15-17
(1999-04-21收稿), 百拇医药