内皮氧化低密度脂蛋白受体介导了氧化低密度脂蛋白对内皮细胞的损伤
作者:徐雅琴 张钧华 唐朝枢 张春丽 王荣福 宁涛 柯杨
单位:徐雅琴 张钧华 北京医科大学第一医院心内科;唐朝枢 心血管病研究所;张春丽 王荣福 核医学科,北京 100034;宁涛 柯杨 北京医科大学临床肿瘤学院
关键词:受体;脂蛋白类;脂蛋白类;LDL;内皮;血管;病理学;纤溶酶原激活剂;分析;纤溶酶原灭活剂;分析;钙;代谢
北京医科大学学报990618 摘 要 目的:探讨氧化低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)血管内皮受体(lectin-like ox-LDL receptor, LOX1)在ox-LDL致内皮细胞损伤中的作用及其机制。方法:放射配基结合及竞争抑制实验检测人脐静脉内皮细胞(human umbilical vein endothelia cells, HUVECs)存在LOX1的高亲和位点,采用倒置相差显微镜观察细胞形态的改变,测定细胞及上清乳酸脱氢酶(lactic dehydrogenase, LDH)活性,计算细胞死亡率,发色底物法检测内皮细胞培养液中的组织纤溶酶原激活物(tissue plasminogen activator, t-PA)和纤溶酶原激活物抑制剂(plasminogen activator inhibitor-1, PAI-1)的活性; 反转录聚合酶链反应检测LOX1 mRNA表达水平,Ca2+示踪测定细胞钙转运功能。结果:HUVECs存在LOX1的高亲和位点[Bmax(54±20)ng/106 cells, Kd(2.0±0.6)×10-8 mol.L-1],单纯加入ox-LDL作用24h后,内皮细胞出现胞体收缩,细胞膜破坏等明显的损伤性改变,细胞死亡率增加,培养液中PAI-1活性较对照组增高3倍(P<0.05),LOX1 mRNA水平表达增高,而且ox-LDL引起细胞钙摄取增强;而当培养液中同时加有LOX1抑制剂polyinosinic acid时,减轻了ox-LDL引起的内皮细胞损伤,培养液中PAI-1活性降低约260%(P<0.05),LOX1mRNA水平降低,抑制了ox-LDL引起的细胞钙摄取。结论:LOX1介导了ox-LDL对内皮细胞的损伤。
, http://www.100md.com
中国图书资料分类法分类号 R543
Oxidized low density lipoprotein receptor mediated the injury
of endothelial cells by oxidized low density lipoprotein
XU Ya-Qin, ZHANG Jun-Hua, TANG Chao-Shu, ZHANG Chun-Li, WANG Rong-Fu, NING Tao, et al
(#Institute of Cardiovascular Diseases Research, the First Hospital, Beijing Medical University, Beijing 100034)
, http://www.100md.com
MeSH Receptor, lipoprotein Lipoproteins, LDL Endothelial, vascular/pathol Plasminogen activators/anal Plasminogen inactivators/anal Calcium/metab
ABSTRACT Objective:To explore the role and mechanism of lectin-like ox-LDL receptor (LOX1) in injury of endothelial cells by oxidized low density lipoprotein (ox-LDL). Methods:Radioligand binding assessed if human umbilical vein endothelial cells (HUVECs) possessed high affinity binding sites for LOX1. The morphological changes of endothelial cells were observed with inverted phasecontrast microscope; the mortality of HUVECs was assessed by the measurement of LDH, the dysfunction of HUVECs was determined by measuring tissue plasminogen activator(t-PA) and plasminogen activator inhibitor-1(PAI-1)activity with Chromogenix;LOX1 mRNA expression was detected by reverse transcription-polymerase chain reaction(RT-PCR),and the calcium transportation of endothelial cells was measured. Results: HUVECs possessed high affinity binding sites for LOX1[Bmax(54.5±20.3) ng/106 cell, Kd(2.0±0.6)×10-8 mol.L-1]. Incubation of ox-LDL induced endothelial cells contraction and cellular membrane rupture, enhanced the mortality of HUVECs, increased PAI-1 activity 3 times more than control per 24 h per 105 cells (P<0.05), enhanced LOX1 mRNA expression and the calcium uptaking, but had only minor effects on t-PA activity and calcium releasing of endothelial cells. When HUVECs were incubated with ox-LDL as well as the inhibitor of LOX1, polyinosinic acid, these changes of endothelial cells were attenuated. Conclusion: There are high affinity binding site to LOX1 in HUVECs. Ox-LDL upregulated LOX1 mRNA expression in a concentration-dependent manner. LOX1 may mediate the injury of HUVECs by ox-LDL ,and the rise of calcium uptaking may involve the injury of endothelial cells by LOX1 mediated.
, http://www.100md.com
(J Beijing Med Univ, 1999,31:547-551)
大量证据表明由氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)诱发的内皮细胞损伤是导致动脉粥样硬化、高血压等血管损伤性疾病的重要因素,但其详尽机制还不甚明了。近年研究发现不同组织细胞上存在多种ox-LDL受体,其中血凝素样的ox-LDL受体(lectin-like ox-LDL receptor, LOX1)是1997年Sawamura等[1]新发现的存在于血管内皮细胞表面的ox-LDL特异受体,本工作在培养的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)上,观察LOX1是否介导了ox-LDL致内皮细胞的损伤,并探讨其作用机制。
1 材料与方法
1.1 材料
, http://www.100md.com
HUVECs由北京市肿瘤防治研究所提供,组织纤溶酶原激活物(tissue plasminogen activator, tPA)和纤溶酶原激活物抑制剂(plasminogen activator inhibitor, PAI)活性检测试剂盒购自上海荣盛公司,引物由Gibco公司合成,逆转录试剂盒、Taq酶、dNTP、RNA提取试剂盒购自Gibco公司。45Ca为Dupont NEN产品,Nicardipine、 polyinosinic acid(PIA)购自Sigma公司,LDL购自中国医学科学院基础医学研究所,125I和Idogen由本院核医学科提供。
1.2 方法
1.2.1 HUVECs系培养 用含10%(体积分数)小牛血清的1640培养基培养,细胞汇集成单层达80%,0.1 g.L-1胰酶37℃消化5min,以2×105接种于24孔板,培养24h后加药。
, 百拇医药
实验分组:(1)对照组;(2)ox-LDL 25 mg.L-1;(3)ox-LDL 50 mg.L-1;(4)ox-LDL 100 mg.L-1;(5)ox-LDL 50 mg.L-1+polyinosinic acid(250 mg.L-1);(6)Nicardipine(10-6mol.L-1)+ox-LDL(50 mg.L-1)。
1.2.2 ox-LDL制备 参照文献中所述[2],采用考马斯亮蓝法定量LDL,LDL在含5μmol.L-1 CuSO4的PBS中37℃氧化20 h。LDL氧化修饰程度通过测定硫代巴比妥酸反应物质(TBARS)值,ox-LDL产生的丙二醛是LDL的4.3倍。
, http://www.100md.com
1.2.3 LOX1的放射性配基结合测定 2.5×106贴壁内皮细胞分别加入终质量浓度为0.5~16 mg.L-1的125I-ox-LDL,另一组同时加入非标记的ox-LDL600mg.L-1,室温孵育2h,冰上用含150mmol.L-1NaCl,50mmol.L-1Tris,2mmol.L-1EDTA,pH7.4,2g.L-1BSA的溶液洗5遍,最后用无BSA的冰生理盐水洗一遍,室温下0.2mol.L-1 NaOH裂解细胞,γ-放射测定仪测定细胞放射活性,绘Scatchard曲线,求出LOX1的Bmax与Kd值。
1.2.4 LOX1的竞争抑制实验 加入终质量浓度为5 mg.L-1125I-ox-LDL后,分别加333mg.L-1ox-LDL、nLDL、清道夫受体阻滞剂Fucoidan、LOX1阻断剂PIA,行放射配基结合实验,操作同前。
, http://www.100md.com
1.2.5 内皮细胞形态观察 不同组内皮细胞在倒置相差显微镜下观察细胞单层和形态改变。
1.2.6 LDH活性测定 采用Mohan[3]报道的方法。分别测培养液和细胞内的LDH活性,细胞死亡率=培养液LDH活性/(细胞内LDH活性+培养液LDH活性)×100%。
1.2.7 tPA、PAI活性测定 采用发色底物法,操作按试剂盒说明进行。
1.2.8 RNA提取 应用一步法提取细胞总RNA,提取的RNA经电泳鉴定未被降解,SDU-68型紫外分光光度计对RNA初步定量,测定A260/A280>1.8,260 nm测吸光度(A)值,调整RNA质量浓度为1 g.L-1。
1.2.9 RT-PCR 采用反转录试剂盒,用Superscript RT 1μl,取1μl细胞总RNA在37℃孵育1 h反转录合成cDNA链,72℃15min终止反应,取2μl合成的cDNA,1μl人LOX1上下游引物(sense primer 5′-TTACTCTCCATGGTGGTGCC-3′,antisense primer 5′-AGCTTCTTCTGCTTGTTGCC-3′)和内参照上下游引物各1μl,在TagDNA聚合酶作用下进行PCR,PCR条件:94℃变性40s,55℃退火1min,72℃延伸1min,扩增产物用加了溴化乙锭的琼脂糖电泳进行显影,β-actin作为LOX1mRNA定量的内参对照同时被扩增。
, 百拇医药
1.2.10 电泳鉴定 配加了溴化乙锭的1.5%(质量浓度)琼脂糖凝胶板,取PCR扩增产物20 μl,加入溴酚蓝上样液2 μl后上样,稳压电泳(7 V.cm-1)约50 min,紫外灯下观察、摄影,结果进行计算机图像分析,求 LOX1/β-actin的图像灰度比值。
1.2.11 细胞钙摄取测定 2×105内皮细胞无血清培养24 h,分组加药,37℃孵育8 h,冷PBS洗3遍,KRB液(葡萄糖11 mmol.L-1,HEPES30mmol.L-1,体积分数0.1%牛血清白蛋白,NaCl 136mmol.L-1,KCl4.0mmol.L-1,CaCl21.0mmol.L-1,MgCl21.0mmol.L-1,pH7.35)37℃预孵育10min,加45CaCl237kBq.ml-137℃孵育5min,冰浴下刮下细胞置于滤膜上,抽干加闪烁液 ,液闪仪测定滤膜放射性计数。
, 百拇医药
1.2.12 细胞钙释放测定 细胞45Ca负载操作同上述,45CaCl237 kBq.ml-137℃孵育10min,冷PBS洗5遍,无Ca2+的KRB液37℃孵育2min取0.2ml孵育液,加闪烁液,在液闪仪上测定放射性计数。
1.2.13 数据分析 所有数据以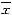 ±s表示,方差分析组间q检验作统计学处理,P<0.05有统计学意义。
±s表示,方差分析组间q检验作统计学处理,P<0.05有统计学意义。
2 结果
2.1 LOX1受体结合功能的变化
配基受体结合分析表明HUVECs存在与ox-LDL有高度亲和力的特异受体LOX1,Scatchard分析表明此受体结合最大值Bmax为(54.5±20.3) ng/106cell,Kd为(2.01±0.6)×10-8 mol.L-1。过量未标记ox-LDL和LOX1受体阻断剂抑制了125I-ox-LDL与LOX1的结合,而过量未标记的n-LDL、清道夫受体阻滞剂未阻断125I-ox-LDL与受体LOX1的结合(图1)。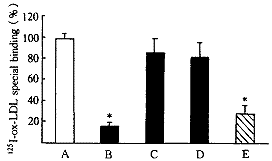
, 百拇医药
A,control; B,ox-LDL; C,nLDL, D,fucoidan; E,polyinosinic acid.
图1 未标记ox-LDL、nLDL、清道夫受体抑制剂fucoidan、LOX1抑制剂
PIA对125I-ox-LDL与LOX1结合的影响
Figure 1 Effect of unlabeled ox-LDL, nLDL, scavenger receptor inhibitor
and LOX1 inhibitor polyinosinic acid on binding of 125 I-ox-LDL to LOX1
2.2 内皮细胞形态学变化
, http://www.100md.com
对照组细胞呈单层鹅卵石样排列,胞核居中呈椭圆形,核仁明显,细胞无重叠生长,ox-LDL组,细胞表面出现黑色颗粒,胞内见空泡,核膜模糊,较多的细胞变圆脱落,有细胞破碎,未脱落细胞收缩变小,多有细长突起相互牵连。
2.3 ox-LDL对内皮细胞死亡率的影响
与对照组比ox-LDL(25、50、100 mg.L-1)呈(质量)浓度依赖地增加内皮细胞死亡率(28%,124%,173%,P<0.05),预先加LOX1抑制剂和钙通道阻断剂后细胞死亡率明显下降(10.7%,11.31% vs 15.78%,P<0.05),见表1。
2.4 细胞培养液tPA、PAI活性测定
ox-LDL使(25~100 mg.L-1)细胞培养液中PAI活性呈(质量)浓度依赖地升高(32%~242%,P<0.05或P<0.01),但对tPA活性无明显影响(P>0.05),LOX1抑制剂PIA有效地抑制了ox-LDL的促PAI活性增加作用,结果见表1。
, http://www.100md.com
表1 ox-LDL对内皮细胞死亡率、分泌的tPA和PAI活性的影响(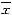 ±s,n=6)
±s,n=6)
Table 1 Effects of ox-LDL on the motality of endothelial cells,the activity of tPA and PAI(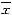 ±s, n=6)
±s, n=6)
Control
ρ(ox-LDL)/mg.L-1
ρ1/50 mg.L-1
, 百拇医药
ρ2/50 mg.L-1
25
50
100
Motality(%)
7.03±0.21
9.02±1.35*
15.78±2.53*
19.22±3.68*
10.7±1.41#
, 百拇医药
11.31±1.32#
PAI(U.ml-1)
0.19±0.02
0.25±0.04*
0.44±0.10**
0.65±0.07**
0.17±0.01#
tPA(U.ml-1)
0.72±0.03
, http://www.100md.com
0.70±0.01
0.69±0.01
0.71±0.01
0.71±0.02
ρ, mass concentration; ρ1 PIA+ox-LDL; ρ2, N+ox-LDL; *P<0.05 **P<0.01 vs control; #P<0.05 vs ox-LDL50 mg.L-1 group; N,nicardipine; PIA,polyinosinic acid.2.5 LOX1mRNA水平的检测(RT-PCR)
LOX1的PCR产物为193 bp,β-actin的PCR产物为392 bp,与理论设计相符。ox-LDL组(25~100 mg.L-1)内皮细胞LOX1mRNA表达较对照组呈浓度依赖地增加(P<0.01),加入LOX1抑制剂PIA后,LOX1mRNA水平降低,结果见图2A,B,表2。
, 百拇医药
2.6 ox-LDL对内皮细胞钙摄取和释放的影响
ox-LDL(25~100mg.L-1)呈(质量)浓度依赖刺激内皮细胞钙摄取增加(69%~192%,P<0.01),预先加LOX1抑制剂PIA和钙通道拮抗剂nicardipine处理则抑制了此效应;对内皮细胞钙释放无明显影响,结果见表2。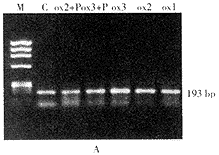
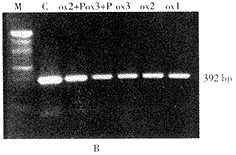
M,marker; C,control; P,polyinosinic acid; ox1,ox-LDL 25 mg.L-1; ox2,ox-LDL 50 mg.L-1; ox3,ox-LDL 100 mg.L-1.
, 百拇医药
图2A LOX1 RT-PCR扩增产物电泳图谱
Figure 2A Results of LOX1 gene expression obtained by RT-PCR
图2B β-actin RT-PCR扩增产物电泳图谱
Figure 2B Results of β-actin gene expression obtained by RT-PCR
表2 ox-LDL对内皮细胞LOX1基因表达和钙转运的影响(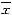 ±s,n=6)
±s,n=6)
Table 2 Effects of ox-LDL on the gene expression of LOX1 and calcium transportation of endothelial cells(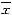 ±s,n=6)
±s,n=6)
, 百拇医药
Control
ρ(ox-LDL)/mg.L-1
ρ1/50 mg.L-1
ρ1/100 mg.L-1
ρ2/50 mg.L-1
25
50
100
LOX1mRNA/β-actin mRNA
, http://www.100md.com
0.02±0.01
0.24±0.04*
0.34±0.09#
0.38±0.08*
0.07±0.04#
0.14±0.07△
Ca2+uptaking(μmol/106 cell)
520±158
880±183*
, http://www.100md.com
1204±386*
1519±518*
550±161#
436±181#
Ca2+realising(μmol/106 cell)
78±23
73±14
78±17
107±45
86±21
, 百拇医药
74±17
ρ,mass concentration; ρ1,PIA+ox-LDL; ρ2,N+ox-LDL; *P<0.01 vs control; #P<0.05 vs ox-LDL 50mg.L-1 group; △P<0.05 vs ox-LDL 100mg.L-1 group; N,nicardipine 10-6mol.L-1; PIA, polyinosinic acid 250mg.L-1.3 讨论
ox-LDL是动脉粥样硬化中内皮损伤的重要危险因子[4],它不仅引起内皮细胞结构及形态损伤,而且降低内皮细胞的抗凝纤溶活性和舒血管功能,诱导内皮细胞表型改变[5,6]。近年研究证明内皮细胞摄取代谢ox-LDL是通过受体途径,而这一受体与经典的清道夫受体不同[7]。Sawamura等[1]在1997年克隆出了ox-LDL的特异内皮受体即LOX1,结构上属于C型血凝素家族,研究认为LOX1识别摄取ox-LDL参与了ox-LDL对内皮依赖舒张功能的损害[8]。本工作在体外培养的HUVECs上研究,发现HUVECs上存在LOX1高亲和性位点。应用不同质量浓度ox-LDL引起内皮细胞形态结构损伤和细胞死亡率增加,这与文献报告一致[5],同时发现ox-LDL呈(质量)浓度依赖地提高PAI活性,而未影响tPA活性,用LOX1抑制剂PIA后抑制了ox-LDL的上述作用,说明LOX1介导了ox-LDL对内皮细胞的损伤,导致PAI与tPA平衡失调,损伤内皮抗凝纤溶功能。用RT-PCR本实验进一步观察到ox-LDL刺激了内皮细胞LOX1mRNA表达增加,且呈(质量)浓度依赖效应,应用LOX1抑制剂PIA后拮抗其LOX1 mRNA表达增加,表明LOX1受体介导的ox-LDL损伤作用在ox-LDL作用下呈正反馈过程。
, 百拇医药
在此基础上,我们探讨了LOX1介导的ox-LDL细胞损伤作用的机制。近年来,关于ox-LDL与细胞特异受体结合激活胞内第二信使途径进而产生一系列生物学效应的信号转导通路的研究备受关注。其中,ox-LDL引起细胞内游离钙浓度升高被认为是ox-LDL造成内皮细胞损伤的机制之一。胞浆Ca2+源于细胞外Ca2+内流和胞内Ca2+库(如内质网)释放,细胞外Ca2+主要通过Ca2+通道进入细胞,而细胞内Ca2+主要通过质膜钙泵和Na+/Ca2+交换释放出细胞外。
本工作应用不同质量浓度的ox-LDL刺激HUVECs,发现ox-LDL对细胞钙释放功能无影响,而呈(质量)浓度依赖地促进细胞钙摄取增加,应用钙通道阻断剂和LOX1抑制剂可有效抑制此效应,表明ox-LDL刺激细胞Ca2+摄入是通过质膜钙通道进行的,而且这可能是LOX1介导的ox-LDL细胞损伤的机制之一。Mabile等[9]研究亦显示ox-LDL引起内皮细胞内游离Ca2+浓度的升高,同时对内皮细胞产生毒性作用,这与我们的实验结果一致。Murase等[10]在培养的内皮细胞上研究发现,流体切应力可诱发LOX1蛋白和mRNA表达增加,同时引起细胞内Ca2+浓度增加,应用钙通道拮抗剂可抑制上述效应。而有关ox-LDL与LOX1结合刺激血管内皮细胞钙通道开放的细胞内信号转导途径正在研究中。
, 百拇医药
参考文献
1 Sawamura T, Kume N, Aoyama T, et al. An endothelial receptor for oxidized low-density lipoprotein. Nature ,1997,386(6):73-77
2 Vieiva OV, Laranjinha JAN, Madeoira VMC, et al. Rapid isolation of low density lipoproteins in a concentrated fraction free from water-soluble plasma antioxidants. J Lipid Res, 1996,37:2715-2721
3 Mohan PF. Lipoprotein activated macrophages in co-culture with mesangial and endothelial cells:nitric oxide and tissue injury. Biomed Sci Instrum, 1997,33:544-549
, 百拇医药
4 王小东,周 玫,陈 瑗,等.高密度脂蛋白对氧化修饰的低密度脂蛋白损伤内皮细胞的防护作用.中华医学杂志,1994,74(9):567-68
5 Zhao B, Zhang Y,Lin B, et al. Endothelial cells injured by oxidized low density lipoproteins. Am J Hematol, 1995, 49(3):250-252
6 Grafe M, Auch-Schwelk W, Hertel H, et al. Human Cardiac microvascular and macrovascular endothelial cells respond differently to oxidatively modified LDL. Atherosclerosis, 1998,137:87-95
7 Krieger M, Acton S, Ashkenas J, et al. Molecular flypaper,host defence and atherosclerosis. J Biol Chem, 1993,268:4569-4572
, 百拇医药
8 Nagase M, Hirose S, Sawamura T, et al. Enhanced expression of endothelial oxidized low-density lipoprotein receptor(LOX1)in hypertensive rats. Biochem Biophys Res Commun,1997,237;496-498
9 Mabile L,Fitoussi G,Periquet B, et al. α-Tocopherol and trolox block the early intracellular events (TBARS and calcium rises)elicited by oxidized low density lipoproteins in cultured endothelial cells. Free Radic Biol Med,1995,(19):177-187
10 Murase T,Kume N,Korenaga R, et al. Fluid shear stress transcriptionally induces lectin-like oxidized LDL receptor-1 in vascular Endothelial cells. Circ Res,1998,83:328-333
(1999-08-31收稿), 百拇医药
单位:徐雅琴 张钧华 北京医科大学第一医院心内科;唐朝枢 心血管病研究所;张春丽 王荣福 核医学科,北京 100034;宁涛 柯杨 北京医科大学临床肿瘤学院
关键词:受体;脂蛋白类;脂蛋白类;LDL;内皮;血管;病理学;纤溶酶原激活剂;分析;纤溶酶原灭活剂;分析;钙;代谢
北京医科大学学报990618 摘 要 目的:探讨氧化低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)血管内皮受体(lectin-like ox-LDL receptor, LOX1)在ox-LDL致内皮细胞损伤中的作用及其机制。方法:放射配基结合及竞争抑制实验检测人脐静脉内皮细胞(human umbilical vein endothelia cells, HUVECs)存在LOX1的高亲和位点,采用倒置相差显微镜观察细胞形态的改变,测定细胞及上清乳酸脱氢酶(lactic dehydrogenase, LDH)活性,计算细胞死亡率,发色底物法检测内皮细胞培养液中的组织纤溶酶原激活物(tissue plasminogen activator, t-PA)和纤溶酶原激活物抑制剂(plasminogen activator inhibitor-1, PAI-1)的活性; 反转录聚合酶链反应检测LOX1 mRNA表达水平,Ca2+示踪测定细胞钙转运功能。结果:HUVECs存在LOX1的高亲和位点[Bmax(54±20)ng/106 cells, Kd(2.0±0.6)×10-8 mol.L-1],单纯加入ox-LDL作用24h后,内皮细胞出现胞体收缩,细胞膜破坏等明显的损伤性改变,细胞死亡率增加,培养液中PAI-1活性较对照组增高3倍(P<0.05),LOX1 mRNA水平表达增高,而且ox-LDL引起细胞钙摄取增强;而当培养液中同时加有LOX1抑制剂polyinosinic acid时,减轻了ox-LDL引起的内皮细胞损伤,培养液中PAI-1活性降低约260%(P<0.05),LOX1mRNA水平降低,抑制了ox-LDL引起的细胞钙摄取。结论:LOX1介导了ox-LDL对内皮细胞的损伤。
, http://www.100md.com
中国图书资料分类法分类号 R543
Oxidized low density lipoprotein receptor mediated the injury
of endothelial cells by oxidized low density lipoprotein
XU Ya-Qin, ZHANG Jun-Hua, TANG Chao-Shu, ZHANG Chun-Li, WANG Rong-Fu, NING Tao, et al
(#Institute of Cardiovascular Diseases Research, the First Hospital, Beijing Medical University, Beijing 100034)
, http://www.100md.com
MeSH Receptor, lipoprotein Lipoproteins, LDL Endothelial, vascular/pathol Plasminogen activators/anal Plasminogen inactivators/anal Calcium/metab
ABSTRACT Objective:To explore the role and mechanism of lectin-like ox-LDL receptor (LOX1) in injury of endothelial cells by oxidized low density lipoprotein (ox-LDL). Methods:Radioligand binding assessed if human umbilical vein endothelial cells (HUVECs) possessed high affinity binding sites for LOX1. The morphological changes of endothelial cells were observed with inverted phasecontrast microscope; the mortality of HUVECs was assessed by the measurement of LDH, the dysfunction of HUVECs was determined by measuring tissue plasminogen activator(t-PA) and plasminogen activator inhibitor-1(PAI-1)activity with Chromogenix;LOX1 mRNA expression was detected by reverse transcription-polymerase chain reaction(RT-PCR),and the calcium transportation of endothelial cells was measured. Results: HUVECs possessed high affinity binding sites for LOX1[Bmax(54.5±20.3) ng/106 cell, Kd(2.0±0.6)×10-8 mol.L-1]. Incubation of ox-LDL induced endothelial cells contraction and cellular membrane rupture, enhanced the mortality of HUVECs, increased PAI-1 activity 3 times more than control per 24 h per 105 cells (P<0.05), enhanced LOX1 mRNA expression and the calcium uptaking, but had only minor effects on t-PA activity and calcium releasing of endothelial cells. When HUVECs were incubated with ox-LDL as well as the inhibitor of LOX1, polyinosinic acid, these changes of endothelial cells were attenuated. Conclusion: There are high affinity binding site to LOX1 in HUVECs. Ox-LDL upregulated LOX1 mRNA expression in a concentration-dependent manner. LOX1 may mediate the injury of HUVECs by ox-LDL ,and the rise of calcium uptaking may involve the injury of endothelial cells by LOX1 mediated.
, http://www.100md.com
(J Beijing Med Univ, 1999,31:547-551)
大量证据表明由氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)诱发的内皮细胞损伤是导致动脉粥样硬化、高血压等血管损伤性疾病的重要因素,但其详尽机制还不甚明了。近年研究发现不同组织细胞上存在多种ox-LDL受体,其中血凝素样的ox-LDL受体(lectin-like ox-LDL receptor, LOX1)是1997年Sawamura等[1]新发现的存在于血管内皮细胞表面的ox-LDL特异受体,本工作在培养的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)上,观察LOX1是否介导了ox-LDL致内皮细胞的损伤,并探讨其作用机制。
1 材料与方法
1.1 材料
, http://www.100md.com
HUVECs由北京市肿瘤防治研究所提供,组织纤溶酶原激活物(tissue plasminogen activator, tPA)和纤溶酶原激活物抑制剂(plasminogen activator inhibitor, PAI)活性检测试剂盒购自上海荣盛公司,引物由Gibco公司合成,逆转录试剂盒、Taq酶、dNTP、RNA提取试剂盒购自Gibco公司。45Ca为Dupont NEN产品,Nicardipine、 polyinosinic acid(PIA)购自Sigma公司,LDL购自中国医学科学院基础医学研究所,125I和Idogen由本院核医学科提供。
1.2 方法
1.2.1 HUVECs系培养 用含10%(体积分数)小牛血清的1640培养基培养,细胞汇集成单层达80%,0.1 g.L-1胰酶37℃消化5min,以2×105接种于24孔板,培养24h后加药。
, 百拇医药
实验分组:(1)对照组;(2)ox-LDL 25 mg.L-1;(3)ox-LDL 50 mg.L-1;(4)ox-LDL 100 mg.L-1;(5)ox-LDL 50 mg.L-1+polyinosinic acid(250 mg.L-1);(6)Nicardipine(10-6mol.L-1)+ox-LDL(50 mg.L-1)。
1.2.2 ox-LDL制备 参照文献中所述[2],采用考马斯亮蓝法定量LDL,LDL在含5μmol.L-1 CuSO4的PBS中37℃氧化20 h。LDL氧化修饰程度通过测定硫代巴比妥酸反应物质(TBARS)值,ox-LDL产生的丙二醛是LDL的4.3倍。
, http://www.100md.com
1.2.3 LOX1的放射性配基结合测定 2.5×106贴壁内皮细胞分别加入终质量浓度为0.5~16 mg.L-1的125I-ox-LDL,另一组同时加入非标记的ox-LDL600mg.L-1,室温孵育2h,冰上用含150mmol.L-1NaCl,50mmol.L-1Tris,2mmol.L-1EDTA,pH7.4,2g.L-1BSA的溶液洗5遍,最后用无BSA的冰生理盐水洗一遍,室温下0.2mol.L-1 NaOH裂解细胞,γ-放射测定仪测定细胞放射活性,绘Scatchard曲线,求出LOX1的Bmax与Kd值。
1.2.4 LOX1的竞争抑制实验 加入终质量浓度为5 mg.L-1125I-ox-LDL后,分别加333mg.L-1ox-LDL、nLDL、清道夫受体阻滞剂Fucoidan、LOX1阻断剂PIA,行放射配基结合实验,操作同前。
, http://www.100md.com
1.2.5 内皮细胞形态观察 不同组内皮细胞在倒置相差显微镜下观察细胞单层和形态改变。
1.2.6 LDH活性测定 采用Mohan[3]报道的方法。分别测培养液和细胞内的LDH活性,细胞死亡率=培养液LDH活性/(细胞内LDH活性+培养液LDH活性)×100%。
1.2.7 tPA、PAI活性测定 采用发色底物法,操作按试剂盒说明进行。
1.2.8 RNA提取 应用一步法提取细胞总RNA,提取的RNA经电泳鉴定未被降解,SDU-68型紫外分光光度计对RNA初步定量,测定A260/A280>1.8,260 nm测吸光度(A)值,调整RNA质量浓度为1 g.L-1。
1.2.9 RT-PCR 采用反转录试剂盒,用Superscript RT 1μl,取1μl细胞总RNA在37℃孵育1 h反转录合成cDNA链,72℃15min终止反应,取2μl合成的cDNA,1μl人LOX1上下游引物(sense primer 5′-TTACTCTCCATGGTGGTGCC-3′,antisense primer 5′-AGCTTCTTCTGCTTGTTGCC-3′)和内参照上下游引物各1μl,在TagDNA聚合酶作用下进行PCR,PCR条件:94℃变性40s,55℃退火1min,72℃延伸1min,扩增产物用加了溴化乙锭的琼脂糖电泳进行显影,β-actin作为LOX1mRNA定量的内参对照同时被扩增。
, 百拇医药
1.2.10 电泳鉴定 配加了溴化乙锭的1.5%(质量浓度)琼脂糖凝胶板,取PCR扩增产物20 μl,加入溴酚蓝上样液2 μl后上样,稳压电泳(7 V.cm-1)约50 min,紫外灯下观察、摄影,结果进行计算机图像分析,求 LOX1/β-actin的图像灰度比值。
1.2.11 细胞钙摄取测定 2×105内皮细胞无血清培养24 h,分组加药,37℃孵育8 h,冷PBS洗3遍,KRB液(葡萄糖11 mmol.L-1,HEPES30mmol.L-1,体积分数0.1%牛血清白蛋白,NaCl 136mmol.L-1,KCl4.0mmol.L-1,CaCl21.0mmol.L-1,MgCl21.0mmol.L-1,pH7.35)37℃预孵育10min,加45CaCl237kBq.ml-137℃孵育5min,冰浴下刮下细胞置于滤膜上,抽干加闪烁液 ,液闪仪测定滤膜放射性计数。
, 百拇医药
1.2.12 细胞钙释放测定 细胞45Ca负载操作同上述,45CaCl237 kBq.ml-137℃孵育10min,冷PBS洗5遍,无Ca2+的KRB液37℃孵育2min取0.2ml孵育液,加闪烁液,在液闪仪上测定放射性计数。
1.2.13 数据分析 所有数据以
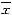 ±s表示,方差分析组间q检验作统计学处理,P<0.05有统计学意义。
±s表示,方差分析组间q检验作统计学处理,P<0.05有统计学意义。2 结果
2.1 LOX1受体结合功能的变化
配基受体结合分析表明HUVECs存在与ox-LDL有高度亲和力的特异受体LOX1,Scatchard分析表明此受体结合最大值Bmax为(54.5±20.3) ng/106cell,Kd为(2.01±0.6)×10-8 mol.L-1。过量未标记ox-LDL和LOX1受体阻断剂抑制了125I-ox-LDL与LOX1的结合,而过量未标记的n-LDL、清道夫受体阻滞剂未阻断125I-ox-LDL与受体LOX1的结合(图1)。

, 百拇医药
A,control; B,ox-LDL; C,nLDL, D,fucoidan; E,polyinosinic acid.
图1 未标记ox-LDL、nLDL、清道夫受体抑制剂fucoidan、LOX1抑制剂
PIA对125I-ox-LDL与LOX1结合的影响
Figure 1 Effect of unlabeled ox-LDL, nLDL, scavenger receptor inhibitor
and LOX1 inhibitor polyinosinic acid on binding of 125 I-ox-LDL to LOX1
2.2 内皮细胞形态学变化
, http://www.100md.com
对照组细胞呈单层鹅卵石样排列,胞核居中呈椭圆形,核仁明显,细胞无重叠生长,ox-LDL组,细胞表面出现黑色颗粒,胞内见空泡,核膜模糊,较多的细胞变圆脱落,有细胞破碎,未脱落细胞收缩变小,多有细长突起相互牵连。
2.3 ox-LDL对内皮细胞死亡率的影响
与对照组比ox-LDL(25、50、100 mg.L-1)呈(质量)浓度依赖地增加内皮细胞死亡率(28%,124%,173%,P<0.05),预先加LOX1抑制剂和钙通道阻断剂后细胞死亡率明显下降(10.7%,11.31% vs 15.78%,P<0.05),见表1。
2.4 细胞培养液tPA、PAI活性测定
ox-LDL使(25~100 mg.L-1)细胞培养液中PAI活性呈(质量)浓度依赖地升高(32%~242%,P<0.05或P<0.01),但对tPA活性无明显影响(P>0.05),LOX1抑制剂PIA有效地抑制了ox-LDL的促PAI活性增加作用,结果见表1。
, http://www.100md.com
表1 ox-LDL对内皮细胞死亡率、分泌的tPA和PAI活性的影响(
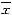 ±s,n=6)
±s,n=6)Table 1 Effects of ox-LDL on the motality of endothelial cells,the activity of tPA and PAI(
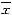 ±s, n=6)
±s, n=6)Control
ρ(ox-LDL)/mg.L-1
ρ1/50 mg.L-1
, 百拇医药
ρ2/50 mg.L-1
25
50
100
Motality(%)
7.03±0.21
9.02±1.35*
15.78±2.53*
19.22±3.68*
10.7±1.41#
, 百拇医药
11.31±1.32#
PAI(U.ml-1)
0.19±0.02
0.25±0.04*
0.44±0.10**
0.65±0.07**
0.17±0.01#
tPA(U.ml-1)
0.72±0.03
, http://www.100md.com
0.70±0.01
0.69±0.01
0.71±0.01
0.71±0.02
ρ, mass concentration; ρ1 PIA+ox-LDL; ρ2, N+ox-LDL; *P<0.05 **P<0.01 vs control; #P<0.05 vs ox-LDL50 mg.L-1 group; N,nicardipine; PIA,polyinosinic acid.2.5 LOX1mRNA水平的检测(RT-PCR)
LOX1的PCR产物为193 bp,β-actin的PCR产物为392 bp,与理论设计相符。ox-LDL组(25~100 mg.L-1)内皮细胞LOX1mRNA表达较对照组呈浓度依赖地增加(P<0.01),加入LOX1抑制剂PIA后,LOX1mRNA水平降低,结果见图2A,B,表2。
, 百拇医药
2.6 ox-LDL对内皮细胞钙摄取和释放的影响
ox-LDL(25~100mg.L-1)呈(质量)浓度依赖刺激内皮细胞钙摄取增加(69%~192%,P<0.01),预先加LOX1抑制剂PIA和钙通道拮抗剂nicardipine处理则抑制了此效应;对内皮细胞钙释放无明显影响,结果见表2。


M,marker; C,control; P,polyinosinic acid; ox1,ox-LDL 25 mg.L-1; ox2,ox-LDL 50 mg.L-1; ox3,ox-LDL 100 mg.L-1.
, 百拇医药
图2A LOX1 RT-PCR扩增产物电泳图谱
Figure 2A Results of LOX1 gene expression obtained by RT-PCR
图2B β-actin RT-PCR扩增产物电泳图谱
Figure 2B Results of β-actin gene expression obtained by RT-PCR
表2 ox-LDL对内皮细胞LOX1基因表达和钙转运的影响(
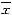 ±s,n=6)
±s,n=6)Table 2 Effects of ox-LDL on the gene expression of LOX1 and calcium transportation of endothelial cells(
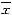 ±s,n=6)
±s,n=6), 百拇医药
Control
ρ(ox-LDL)/mg.L-1
ρ1/50 mg.L-1
ρ1/100 mg.L-1
ρ2/50 mg.L-1
25
50
100
LOX1mRNA/β-actin mRNA
, http://www.100md.com
0.02±0.01
0.24±0.04*
0.34±0.09#
0.38±0.08*
0.07±0.04#
0.14±0.07△
Ca2+uptaking(μmol/106 cell)
520±158
880±183*
, http://www.100md.com
1204±386*
1519±518*
550±161#
436±181#
Ca2+realising(μmol/106 cell)
78±23
73±14
78±17
107±45
86±21
, 百拇医药
74±17
ρ,mass concentration; ρ1,PIA+ox-LDL; ρ2,N+ox-LDL; *P<0.01 vs control; #P<0.05 vs ox-LDL 50mg.L-1 group; △P<0.05 vs ox-LDL 100mg.L-1 group; N,nicardipine 10-6mol.L-1; PIA, polyinosinic acid 250mg.L-1.3 讨论
ox-LDL是动脉粥样硬化中内皮损伤的重要危险因子[4],它不仅引起内皮细胞结构及形态损伤,而且降低内皮细胞的抗凝纤溶活性和舒血管功能,诱导内皮细胞表型改变[5,6]。近年研究证明内皮细胞摄取代谢ox-LDL是通过受体途径,而这一受体与经典的清道夫受体不同[7]。Sawamura等[1]在1997年克隆出了ox-LDL的特异内皮受体即LOX1,结构上属于C型血凝素家族,研究认为LOX1识别摄取ox-LDL参与了ox-LDL对内皮依赖舒张功能的损害[8]。本工作在体外培养的HUVECs上研究,发现HUVECs上存在LOX1高亲和性位点。应用不同质量浓度ox-LDL引起内皮细胞形态结构损伤和细胞死亡率增加,这与文献报告一致[5],同时发现ox-LDL呈(质量)浓度依赖地提高PAI活性,而未影响tPA活性,用LOX1抑制剂PIA后抑制了ox-LDL的上述作用,说明LOX1介导了ox-LDL对内皮细胞的损伤,导致PAI与tPA平衡失调,损伤内皮抗凝纤溶功能。用RT-PCR本实验进一步观察到ox-LDL刺激了内皮细胞LOX1mRNA表达增加,且呈(质量)浓度依赖效应,应用LOX1抑制剂PIA后拮抗其LOX1 mRNA表达增加,表明LOX1受体介导的ox-LDL损伤作用在ox-LDL作用下呈正反馈过程。
, 百拇医药
在此基础上,我们探讨了LOX1介导的ox-LDL细胞损伤作用的机制。近年来,关于ox-LDL与细胞特异受体结合激活胞内第二信使途径进而产生一系列生物学效应的信号转导通路的研究备受关注。其中,ox-LDL引起细胞内游离钙浓度升高被认为是ox-LDL造成内皮细胞损伤的机制之一。胞浆Ca2+源于细胞外Ca2+内流和胞内Ca2+库(如内质网)释放,细胞外Ca2+主要通过Ca2+通道进入细胞,而细胞内Ca2+主要通过质膜钙泵和Na+/Ca2+交换释放出细胞外。
本工作应用不同质量浓度的ox-LDL刺激HUVECs,发现ox-LDL对细胞钙释放功能无影响,而呈(质量)浓度依赖地促进细胞钙摄取增加,应用钙通道阻断剂和LOX1抑制剂可有效抑制此效应,表明ox-LDL刺激细胞Ca2+摄入是通过质膜钙通道进行的,而且这可能是LOX1介导的ox-LDL细胞损伤的机制之一。Mabile等[9]研究亦显示ox-LDL引起内皮细胞内游离Ca2+浓度的升高,同时对内皮细胞产生毒性作用,这与我们的实验结果一致。Murase等[10]在培养的内皮细胞上研究发现,流体切应力可诱发LOX1蛋白和mRNA表达增加,同时引起细胞内Ca2+浓度增加,应用钙通道拮抗剂可抑制上述效应。而有关ox-LDL与LOX1结合刺激血管内皮细胞钙通道开放的细胞内信号转导途径正在研究中。
, 百拇医药
参考文献
1 Sawamura T, Kume N, Aoyama T, et al. An endothelial receptor for oxidized low-density lipoprotein. Nature ,1997,386(6):73-77
2 Vieiva OV, Laranjinha JAN, Madeoira VMC, et al. Rapid isolation of low density lipoproteins in a concentrated fraction free from water-soluble plasma antioxidants. J Lipid Res, 1996,37:2715-2721
3 Mohan PF. Lipoprotein activated macrophages in co-culture with mesangial and endothelial cells:nitric oxide and tissue injury. Biomed Sci Instrum, 1997,33:544-549
, 百拇医药
4 王小东,周 玫,陈 瑗,等.高密度脂蛋白对氧化修饰的低密度脂蛋白损伤内皮细胞的防护作用.中华医学杂志,1994,74(9):567-68
5 Zhao B, Zhang Y,Lin B, et al. Endothelial cells injured by oxidized low density lipoproteins. Am J Hematol, 1995, 49(3):250-252
6 Grafe M, Auch-Schwelk W, Hertel H, et al. Human Cardiac microvascular and macrovascular endothelial cells respond differently to oxidatively modified LDL. Atherosclerosis, 1998,137:87-95
7 Krieger M, Acton S, Ashkenas J, et al. Molecular flypaper,host defence and atherosclerosis. J Biol Chem, 1993,268:4569-4572
, 百拇医药
8 Nagase M, Hirose S, Sawamura T, et al. Enhanced expression of endothelial oxidized low-density lipoprotein receptor(LOX1)in hypertensive rats. Biochem Biophys Res Commun,1997,237;496-498
9 Mabile L,Fitoussi G,Periquet B, et al. α-Tocopherol and trolox block the early intracellular events (TBARS and calcium rises)elicited by oxidized low density lipoproteins in cultured endothelial cells. Free Radic Biol Med,1995,(19):177-187
10 Murase T,Kume N,Korenaga R, et al. Fluid shear stress transcriptionally induces lectin-like oxidized LDL receptor-1 in vascular Endothelial cells. Circ Res,1998,83:328-333
(1999-08-31收稿), 百拇医药