头孢呋辛酯片剂在健康志愿受试者体内生物等效性的研究
作者:吕万良 张强 赵甘霖 孙华东 张大卫 马付勇 刘欣 李洁 高晔
单位:北京大学药学院药剂学研究室,北京 100083
关键词:头孢呋辛酯片;生物利用度;治疗等效;头孢菌素类;药代动力学
北京医科大学学报000314 [摘 要] 目的:研究国内研制的头孢呋辛酯片剂与参比制剂(西力欣)在健康人体内的生物利用度与生物等效性。方法:用高效液相-紫外法测定血浆中的头孢呋辛的浓度,以头孢呋辛酯的市售片剂西力欣为对照,通过22名受试者的单剂量交叉给药, 对研制的头孢呋辛酯片剂进行相对人体生物利用度及生物等效性考察。结果:研制的头孢呋辛酯片剂和西力欣片的AUC[0-∞]分别为(12.7±4.5)和(13.2±4.8)mg.L-1.h;Cmax分别为(3.5±1.2)和(3.9±1.7)mg.L-1;Tmax分别为(1.9±0.9)和(2.2±1.0)h;MRT分别为(3.9±1.3)和(3.8±1.5) h;T1/2分别为(2.3±1.8)和(1.9±1.7) h。说明研制的头孢呋辛酯片和西力欣片的各种主要的药物动力学参数接近。研制的头孢呋辛酯片的相对生物利用度(F)达到95.42%。研制的头孢呋辛酯片剂和参比制剂西力欣片的AUC[0-∞]之间差异无显著性(P>0.05),90%的置信区间在80%~125%范围内;Cmax的90%置信区间也在70%~143%的范围内。结论:研制的头孢呋辛酯片和市售进口的西力欣片在健康人体内达生物等效。
, 百拇医药
[中图分类号] R978.1 [文献标识码] A
[文章编号] 1000-1530(2000)03-0244-04
Bioequivalance of cefuroxime axetil tablets in the human healthy volunteers
LU Wan-Liang, ZHANG Qiang, ZHAO Gan-Lin, SUN Hua-Dong,ZHANG Da-Wei, MA Fu-Yong, LIU Xin, LI Jie, GAO Ye
(Department of Pharmaceutics, School of Pharmaceutical Sciences,Peking University, Beijing 100083,China)
, 百拇医药
ABSTRACT Objective:To study the bioequivalence between the generic cefuroxime axetil tablets and the commericial ones (Zinacef tablets). Methods: An HPLC-UV method was established to determine the concentrations of cefuroxime axetil following oral administration of the two preparations. A single dosage crossover design was applied and 22 male healthy volunteers were included in this trial after the informed consent agreement was signed for each. Results: The mobile phase was acetonitril-0.05 mol.L-1 sodium dihydrogen phosphate (11:89, volume fraction), the flow rate 1.5 ml.min-1 and the determination wavelength 273 nm. The main pharmacokinetic parameters of generic tablets, AUC[0-∞], Cmax, Tmax, MRT, T1/2, were (12.7±4.5)mg.L-1.h,(3.5±1.2)mg.L-1,(1.9±0.9) h, (3.9±1.3) h,and (2.3±1.8) h,respectively. The relative bioavailability of generic tablets was 95.42% compared with that of Zinacef tablets. No significant differences were found between the AUC[0-∞] of the two preparations according to statistical methods of the two one-side t-test, etc.. Conclusion: The bioequivalence can be reached between the generic cefuroxime axetil tablets and the Zinacef ones.
, http://www.100md.com
KEY WORDS Cefuroxime axetil tablets; Biological availability; Therapeutic equivalency; Cephalosporins/pharmacokin▲
头孢呋辛酯(cefuroxime axetil)为半合成的第二代广谱头孢菌素类药物。近年,国内临床上应用的制剂主要有进口的头孢呋辛钠注射剂和头孢呋辛酯片剂,尚未有国产的头孢呋辛制剂上市。为此,本文对国内研制的头孢呋辛酯片剂进行生物等效性研究,为该品临床应用提供依据。
1 材料与方法
1.1 仪器和试药
HP1100型高效液相色谱仪系统,包括1100型单泵,手动进样器,1100型紫外可见光检测器,HP3395型积分仪(美国惠普公司);Hypersil ODS-C18 分析柱( 5 μm,46 mm×250 mm,大连依利特科学仪器有限公司);ZorbaxR ○预柱( 5 μm,4.0 mm×80 mm,美国惠普公司);YKH-Ⅱ型旋涡混合器(江西医疗器械厂)。头孢呋辛钠标准品(美国Sigma公司);Cephaloridine(本实验用作内标,美国Sigma公司); 受试制剂为研制的头孢呋辛酯片剂( 125 mg/片,德众万全药物技术开发有限公司与成都倍特药业有限公司联合研制并提供,批号为990120);参比制剂为头孢呋辛酯普通片(250 mg/片,英国Glaxo公司产品,国内已进口, 商品名为西力欣R ○, 批号为B8997LN);新鲜冰冻人血浆,购自北京红十字血液中心;三氯醋酸, 分析纯,北京金龙化学试剂有限公司供应;磷酸二氢钠, 分析纯(北京红星化工厂);乙腈,HPLC级(Fischer公司)。
, 百拇医药
1.2 研究对象
22名健康成年男性,年龄(23±7)岁,体重(65±6) kg,身高(172±5) cm。体检证明身体健康,精神状况良好。实验前停药1个月,实验过程中禁止服用其它药物, 并禁烟酒。在说明了本实验的目的、药物特性、临床应用和可能出现的不良反应之后,受试者均签定了知情同意书。
1.3 实验方法
1.3.1 生物样品测定方法[1~3] (1)色谱操作条件:以Hypersil ODS-C18 柱( 5 μm,4.6 mm×250 mm)为分析柱, ZorbaxR ○柱( 5 μm,4.0 mm×80 mm)为预柱,乙腈∶磷酸二氢钠(0.05 mol.L-1)=11∶89 (体积比)为流动相,流速为1.5 ml.min-1,室温下在273 nm进行检测。积分仪的纸速为 0.2 cm.min-1,噪音阈值为0。衰减为0。每次进样50 μl,记录色谱图,以头孢呋辛与内标的峰面积之比为定量依据。(2)贮备液制备:称取12 mg头孢呋辛钠标准品,于50 ml容量瓶中以重蒸馏水溶解并定容,使成240 mg.L-1的头孢呋辛钠浓贮备液。称取12 mg的内标物Cephaloridine,于100 ml容量瓶中以重蒸馏水溶解定容,使成120 mg.L-1的Cephaloridine浓贮备液。(3)标准液配制:分别精密吸取240 mg.L-1的头孢呋辛钠贮备液0.12、0.25、1.0、2.0 和4.0 ml于50 ml容量瓶中,以重蒸馏水定容,分别得到质量浓度为0.576、1.2、4.8、9.6和19.2 mg.L-1的标准溶液。精密吸取240 mg.L-1的头孢呋辛钠贮备液4.0 ml,于25 ml容量瓶中,以重蒸馏水定容,得38.4 mg.L-1的头孢呋辛钠标准溶液。精密吸取240 mg.L-1 的头孢呋辛钠贮备液2.4 ml, 于10 ml容量瓶中,以重蒸馏水定容,得57.6 mg.L-1头孢呋辛钠标准溶液。精密吸取120 mg.L-1的Cephaloridine浓贮备液5 ml于 25 ml容量瓶中,以重蒸馏水定容,得到浓度为24 mg.L-1的内标溶液。(4)标准曲线制备:精密吸取空白血浆0.3 ml,加入50 μl内标物Cephaloridine的标准溶液(24 mg.L-1),再加入50 μl上述不同质量浓度的药物标准溶液,使药物质量浓度分别为96、200、800、1 600、3 200、6 400和9 600 μg.L-1,旋涡混合使之均匀,加入200 g.L-1的三氯醋酸100 μl,旋涡混合2 min,离心(20 000×g)10 min,取上清液用一次性的高效液相专用滤头过滤,取50 μl进样。
, 百拇医药
1.3.2 血样测定方法 取含药血清300 μl,置1.5 ml具塞塑料离心试管内,精密加入内标物溶液(含24 mg.L-1的Cephaloridine标准溶液)50 μl,加重蒸馏水50 μl,旋涡混合,其后操作同上。(1)方法回收率:精密吸取空白血浆0.3 ml,加入50 μl内标物Cephaloridine的标准溶液(24 mg.L-1),再加入50 μl 3种不同浓度的药物标准溶液,使药物质量浓度分别为0.096、1.588和9.528 mg.L-1。分别按血样处理方法进行测定,所得结果与加入量之比即为方法回收率。(2)日内、日间变异:样品制备方法同方法回收率。分别按血样处理方法进行测定,一天内不同时间重复测定5次,计算日内变异;连续测定5 d,计算日间变异。(3)最低检测浓度和最小检测量:当信噪比为3时,确定最低检测浓度和最小检测量。
1.3.3 实验设计 将受试者随机分为甲、乙两组,交叉给药,间隔1周。第1周甲组受试者口服供试品(研制的头孢呋辛酯片,125 mg/片,2片),乙组受试者口服对照品(西力欣片250 mg/片)。第2周甲组受试者口服对照品,乙组受试者口服供试品。在禁食12 h情况下给药, 服药前取空白血3.5 ml,早8:00用200 ml温开水服药。继续禁食4 h后统一进餐。于服药后0.5,1,1.5,2,2.5,3,4,5,6,7,8,和10 h分别取前臂静脉血3.5 ml,于室温下放置10 min,5 000×g离心15 min,分离血清于1.5 ml具塞塑料离心试管内,于-20℃冰箱保存备用。
, http://www.100md.com
2 结果与讨论
头孢呋辛酯进入体内水解后生成活性成分头孢呋辛,故测定的血药浓度是头孢呋辛的质量浓度。以头孢呋辛色谱峰面积与内标峰面积之比(A1/A2)对头孢呋辛钠质量浓度(C)作线性回归,其回归方程为:
(A1/A2)=0.408 7C+0.059 7 r=0.999 6
即在0.096~9.600 mg.L-1的范围内,头孢呋辛色谱峰面积与内标峰面积之比和头孢呋辛钠质量浓度有较好的相关性。头孢呋辛及内标色谱峰分离可达1.5。方法回收率测定结果见表1,日内和日间相对标准偏差测定结果见表2。可见在3个不同质量浓度下,回收率在92%~113%之间,日内、日间相对标准偏差分别小于7.22%、9.33%。结果表明,该生物样品测定方法符合要求。
表1 高效液相-紫外法测定头孢呋辛钠在人血浆中的回收率
, 百拇医药
Table 1 Recovery of cefuroxime from the human plasma determined
by the high performance liquid chromatography-ultraviolet method ρ1/mg.L-1
ρ2/mg.L-1
Recovery
(%)
Mean
recovery
(%)
, 百拇医药
RSD
(%)
0.109
114.64
0.100
105.54
0.096
0.117
123.45
113.35
5.78
0.106
111.12
, http://www.100md.com
0.106
112.00
1.558
98.16
1.356
85.40
1.588
1.512
95.23
93.98
5.53
1.554
97.86
, 百拇医药
1.481
93.27
8.761
91.95
8.890
93.31
9.528
8.827
92.65
92.38
0.65
8.761
91.95
, http://www.100md.com
8.768
92.03
ρ1, added mass concentration; ρ2, found mass concentration; RSD, relative standard deviation.
生物利用度是评价新研制药剂质量的非常重要的指标,它可以直接反映某种特定剂型中药物的吸收速度和程度。用高效液相色谱法代替微生物方法测定抗生素的生物利用度具有简便、工作量小和更加准确的特点,因此,本文建立的方法,对于头孢呋辛酯其它制剂的生物利用度评价以及该药的临床血药浓度监测有较大的参考意义。
22名受试者单剂量交叉口服研制的头孢呋辛酯片剂和头孢呋辛酯对照制剂的经时平均血药浓度-时间曲线见图1。药代动力学参数的求算参见国家新药审评中心《药物制剂人体生物利用度和生物等效性试验指导原则》。
, 百拇医药
表2 高效液相-紫外法测定人血浆中头孢呋辛钠质量浓度,日内、日间相对标准偏差
Table 2 Relative standard deviation of the determined
cefuroxime from the human plasma by the
high performance liquid chromatography-ultraviolet method ρ1/mg.L-1
Intra-day
Between-day
ρ2/mg.L-1
, http://www.100md.com
RSD
(%)
ρ2/mg.L-1
RSD
(%)
0.120
0.110
0.108
0.130
0.096
0.980
7.22
, 百拇医药
0.111
9.33
0.108
0.115
0.108
0.134
1.410
1.469
1.583
1.356
1.588
1.567
6.19
, http://www.100md.com
1.445
3.40
1.500
1.370
1.377
1.410
8.579
8.559
8.469
7.997
9.528
8.963
2.29
, http://www.100md.com
8.402
5.46
8.626
8.649
8.499
9.287
ρ1, added mass concentration; ρ2, found mass concentration; RDS, relative standard deviation.图1 22名男性健康受试者口服头孢呋辛酯片
和西力欣片后平均血清药物浓度-时间曲线
Figure 1 The mean serum concentrations-time profiles following oral
, http://www.100md.com
administration of the generic of Cefuroxime axetil tablets and
Zinacef tablets to twenty-two male healthy volunteers (dose, 250 mg)
22名受试者单剂量口服研制的头孢呋辛酯片剂和对照制剂(西力欣片)的药代动力学参数见表3。可见22名受试者单剂量口服研制的头孢呋辛酯片剂和西力欣片后,研制的头孢呋辛酯片剂和西力欣片的AUC[0-∞]分别为(12.7±4.5)和(13.2±4.8) mg.L-1.h;Cmax分别为(3.5±1.2)和(3.9±1.7) mg.L-1;Tmax分别为(1.9±0.8)和(2.2±1.0) h;MRT分别为(3.9±1.3)和(3.8±1.5)h;T1/2分别为(2.3±1.8)和(1.9±1.7)h。说明研制的头孢呋辛酯片剂和西力欣片的各种主要的药物动力学参数是比较接近的。根据上述公式计算研制的头孢呋辛酯片剂的相对生物利用度(F)达到95.4%。
, 百拇医药
表3 22名健康受试者口服头孢呋辛酯片(受试品)和西力欣片(对照品)后测得的主要药物动力学参数
Table 3 Main pharmacokinetic parameters of Cefuroxime axetil following oral administration
of the generic tablets and the Zinacef tablets to twenty-two healthy male human volunteers No.
AUC
Cmax
Tmax
MRT
, 百拇医药
T1/2
Fr
T△
R▲
T
R
T
R
T
R
T
R
1
, 百拇医药
13.6
12.6
3.0
4.9
2.5
3.0
3.8
3.5
1.3
2.0
109.6
2
6.6
, http://www.100md.com
8.3
2.3
2.4
2.0
1.5
2.9
2.8
1.7
1.4
79.6
3
10.5
10.9
, http://www.100md.com
2.6
2.6
2.5
4.0
3.3
4.3
1.5
1.1
96.3
4
16.9
16.9
5.8
, 百拇医药
5.9
1.5
3.0
3.1
3.3
1.9
1.4
97.6
5
18.8
14.9
3.9
6.0
, http://www.100md.com
3.0
1.5
8.2
2.8
8.2
1.3
94.5
6
15.7
18.2
4.0
3.8
2.0
, 百拇医药
2.5
4.1
5.7
2.6
4.9
93.4
7
19.1
26.2
3.7
4.6
3.0
1.0
, 百拇医药
6.0
9.6
5.3
8.3
97.5
8
14.7
12.9
3.2
4.2
0.5
1.5
4.2
, http://www.100md.com
2.8
2.6
1.4
106.2
9
18.5
16.8
3.4
4.6
1.5
2.0
4.6
4.2
, 百拇医药
4.4
2.0
107.2
10
16.3
15.3
6.0
5.0
1.0
1.5
2.8
3.3
1.7
, http://www.100md.com
1.8
107.6
11
15.7
14.0
4.3
4.8
2.5
1.0
3.8
2.7
2.8
2.2
, 百拇医药
114.1
12
4.6
4.9
2.3
1.4
1.5
1.0
4.1
3.9
2.7
2.9
92.0
, 百拇医药
13
6.3
6.0
1.2
1.0
4.0
2.5
5.7
4.9
3.8
2.0
89.4
14
, http://www.100md.com
7.9
8.9
2.5
3.1
1.0
1.0
3.3
3.4
2.0
1.9
88.8
15
15.8
, 百拇医药
14.8
4.5
3.2
1.0
2.5
2.7
3.5
1.1
0.9
107.6
16
13.1
15.5
, 百拇医药
4.1
7.4
1.0
1.5
2.5
2.5
0.8
1.2
85.0
17
15.4
9.9
5.4
, 百拇医药
2.6
2.0
2.5
3.0
3.4
1.6
0.5
150.5
18
8.3
10.7
2.6
2.6
, 百拇医药
2.5
4.0
3.2
3.9
1.7
1.4
76.9
19
5.4
6.8
2.2
1.6
2.0
, 百拇医药
2.0
2.9
3.7
1.5
1.2
79.4
20
11.1
15.8
2.8
3.9
1.5
4.0
, 百拇医药
3.6
3.3
0.5
0.5
70.1
21
12.5
11.5
3.7
5.3
1.5
2.5
4.1
, 百拇医药
2.4
0.8
0.4
89.4
22
12.1
17.6
3.2
5.6
1.0
2.0
3.0
3.3
, http://www.100md.com
1.1
1.2
66.8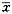
12.7
13.2
3.5
3.9
1.9
2.2
3.9
3.8
2.3
, 百拇医药
1.9
95.4
s
4.5
4.8
1.2
1.7
0.8
1.0
1.3
1.5
1.8
1.7
, 百拇医药
17.9
Where AUC is the area under concentration-time profile (mg.L-1.h). Cmax (mg.L-1), Tmax(h), and MRT(h) denote the maximal concentration, time to reach the maximal concentration and the mean resident time, respectively. Fr represents the relative bioavailability(%). △, test tablets; ▲, reference tablets.
将AUC和Cmax分别进行对数变换后再做统计分析。本研究采用了3P97程序进行方差分析、双单侧检验法(two one-side test)和(1-2α)置信区间的检验。对AUC[0-∞]、AUC[0-Tn]和Cmax进行了统计分析。分析结果表明,研制的头孢呋辛酯片剂和西力欣片的AUC[0-∞]和AUC[0-Tn]之间差异无显著性(P>0.05),90%的置信区间也落在80%~125%范围内;Cmax的90%置信区间也落在70%~143%的范围内,根据有关规定,认为这两个制剂生物等效。■
, http://www.100md.com
参考文献
[1]薛闻鹂, 钟帼英, 胡 新. HPLC法测定头孢呋辛钠的含量[J]. 药物分析杂志, 1996, 16(2):95-97
[2]Donn KH, James NC, Powell JR. Bioavailability of cefuroxime axetil formulations[J]. J Pharm Sci, 1994,83(6):842-844
[3]Kees F, Lukassek U, Naber KG, et al. Comparative investigations on the bioavailability of cefuroxime axetil[J]. Arzneim Forsch/Drug Res, 1991, 41(8):843-846
收稿日期:1999-12-17, 百拇医药
单位:北京大学药学院药剂学研究室,北京 100083
关键词:头孢呋辛酯片;生物利用度;治疗等效;头孢菌素类;药代动力学
北京医科大学学报000314 [摘 要] 目的:研究国内研制的头孢呋辛酯片剂与参比制剂(西力欣)在健康人体内的生物利用度与生物等效性。方法:用高效液相-紫外法测定血浆中的头孢呋辛的浓度,以头孢呋辛酯的市售片剂西力欣为对照,通过22名受试者的单剂量交叉给药, 对研制的头孢呋辛酯片剂进行相对人体生物利用度及生物等效性考察。结果:研制的头孢呋辛酯片剂和西力欣片的AUC[0-∞]分别为(12.7±4.5)和(13.2±4.8)mg.L-1.h;Cmax分别为(3.5±1.2)和(3.9±1.7)mg.L-1;Tmax分别为(1.9±0.9)和(2.2±1.0)h;MRT分别为(3.9±1.3)和(3.8±1.5) h;T1/2分别为(2.3±1.8)和(1.9±1.7) h。说明研制的头孢呋辛酯片和西力欣片的各种主要的药物动力学参数接近。研制的头孢呋辛酯片的相对生物利用度(F)达到95.42%。研制的头孢呋辛酯片剂和参比制剂西力欣片的AUC[0-∞]之间差异无显著性(P>0.05),90%的置信区间在80%~125%范围内;Cmax的90%置信区间也在70%~143%的范围内。结论:研制的头孢呋辛酯片和市售进口的西力欣片在健康人体内达生物等效。
, 百拇医药
[中图分类号] R978.1 [文献标识码] A
[文章编号] 1000-1530(2000)03-0244-04
Bioequivalance of cefuroxime axetil tablets in the human healthy volunteers
LU Wan-Liang, ZHANG Qiang, ZHAO Gan-Lin, SUN Hua-Dong,ZHANG Da-Wei, MA Fu-Yong, LIU Xin, LI Jie, GAO Ye
(Department of Pharmaceutics, School of Pharmaceutical Sciences,Peking University, Beijing 100083,China)
, 百拇医药
ABSTRACT Objective:To study the bioequivalence between the generic cefuroxime axetil tablets and the commericial ones (Zinacef tablets). Methods: An HPLC-UV method was established to determine the concentrations of cefuroxime axetil following oral administration of the two preparations. A single dosage crossover design was applied and 22 male healthy volunteers were included in this trial after the informed consent agreement was signed for each. Results: The mobile phase was acetonitril-0.05 mol.L-1 sodium dihydrogen phosphate (11:89, volume fraction), the flow rate 1.5 ml.min-1 and the determination wavelength 273 nm. The main pharmacokinetic parameters of generic tablets, AUC[0-∞], Cmax, Tmax, MRT, T1/2, were (12.7±4.5)mg.L-1.h,(3.5±1.2)mg.L-1,(1.9±0.9) h, (3.9±1.3) h,and (2.3±1.8) h,respectively. The relative bioavailability of generic tablets was 95.42% compared with that of Zinacef tablets. No significant differences were found between the AUC[0-∞] of the two preparations according to statistical methods of the two one-side t-test, etc.. Conclusion: The bioequivalence can be reached between the generic cefuroxime axetil tablets and the Zinacef ones.
, http://www.100md.com
KEY WORDS Cefuroxime axetil tablets; Biological availability; Therapeutic equivalency; Cephalosporins/pharmacokin▲
头孢呋辛酯(cefuroxime axetil)为半合成的第二代广谱头孢菌素类药物。近年,国内临床上应用的制剂主要有进口的头孢呋辛钠注射剂和头孢呋辛酯片剂,尚未有国产的头孢呋辛制剂上市。为此,本文对国内研制的头孢呋辛酯片剂进行生物等效性研究,为该品临床应用提供依据。
1 材料与方法
1.1 仪器和试药
HP1100型高效液相色谱仪系统,包括1100型单泵,手动进样器,1100型紫外可见光检测器,HP3395型积分仪(美国惠普公司);Hypersil ODS-C18 分析柱( 5 μm,46 mm×250 mm,大连依利特科学仪器有限公司);ZorbaxR ○预柱( 5 μm,4.0 mm×80 mm,美国惠普公司);YKH-Ⅱ型旋涡混合器(江西医疗器械厂)。头孢呋辛钠标准品(美国Sigma公司);Cephaloridine(本实验用作内标,美国Sigma公司); 受试制剂为研制的头孢呋辛酯片剂( 125 mg/片,德众万全药物技术开发有限公司与成都倍特药业有限公司联合研制并提供,批号为990120);参比制剂为头孢呋辛酯普通片(250 mg/片,英国Glaxo公司产品,国内已进口, 商品名为西力欣R ○, 批号为B8997LN);新鲜冰冻人血浆,购自北京红十字血液中心;三氯醋酸, 分析纯,北京金龙化学试剂有限公司供应;磷酸二氢钠, 分析纯(北京红星化工厂);乙腈,HPLC级(Fischer公司)。
, 百拇医药
1.2 研究对象
22名健康成年男性,年龄(23±7)岁,体重(65±6) kg,身高(172±5) cm。体检证明身体健康,精神状况良好。实验前停药1个月,实验过程中禁止服用其它药物, 并禁烟酒。在说明了本实验的目的、药物特性、临床应用和可能出现的不良反应之后,受试者均签定了知情同意书。
1.3 实验方法
1.3.1 生物样品测定方法[1~3] (1)色谱操作条件:以Hypersil ODS-C18 柱( 5 μm,4.6 mm×250 mm)为分析柱, ZorbaxR ○柱( 5 μm,4.0 mm×80 mm)为预柱,乙腈∶磷酸二氢钠(0.05 mol.L-1)=11∶89 (体积比)为流动相,流速为1.5 ml.min-1,室温下在273 nm进行检测。积分仪的纸速为 0.2 cm.min-1,噪音阈值为0。衰减为0。每次进样50 μl,记录色谱图,以头孢呋辛与内标的峰面积之比为定量依据。(2)贮备液制备:称取12 mg头孢呋辛钠标准品,于50 ml容量瓶中以重蒸馏水溶解并定容,使成240 mg.L-1的头孢呋辛钠浓贮备液。称取12 mg的内标物Cephaloridine,于100 ml容量瓶中以重蒸馏水溶解定容,使成120 mg.L-1的Cephaloridine浓贮备液。(3)标准液配制:分别精密吸取240 mg.L-1的头孢呋辛钠贮备液0.12、0.25、1.0、2.0 和4.0 ml于50 ml容量瓶中,以重蒸馏水定容,分别得到质量浓度为0.576、1.2、4.8、9.6和19.2 mg.L-1的标准溶液。精密吸取240 mg.L-1的头孢呋辛钠贮备液4.0 ml,于25 ml容量瓶中,以重蒸馏水定容,得38.4 mg.L-1的头孢呋辛钠标准溶液。精密吸取240 mg.L-1 的头孢呋辛钠贮备液2.4 ml, 于10 ml容量瓶中,以重蒸馏水定容,得57.6 mg.L-1头孢呋辛钠标准溶液。精密吸取120 mg.L-1的Cephaloridine浓贮备液5 ml于 25 ml容量瓶中,以重蒸馏水定容,得到浓度为24 mg.L-1的内标溶液。(4)标准曲线制备:精密吸取空白血浆0.3 ml,加入50 μl内标物Cephaloridine的标准溶液(24 mg.L-1),再加入50 μl上述不同质量浓度的药物标准溶液,使药物质量浓度分别为96、200、800、1 600、3 200、6 400和9 600 μg.L-1,旋涡混合使之均匀,加入200 g.L-1的三氯醋酸100 μl,旋涡混合2 min,离心(20 000×g)10 min,取上清液用一次性的高效液相专用滤头过滤,取50 μl进样。
, 百拇医药
1.3.2 血样测定方法 取含药血清300 μl,置1.5 ml具塞塑料离心试管内,精密加入内标物溶液(含24 mg.L-1的Cephaloridine标准溶液)50 μl,加重蒸馏水50 μl,旋涡混合,其后操作同上。(1)方法回收率:精密吸取空白血浆0.3 ml,加入50 μl内标物Cephaloridine的标准溶液(24 mg.L-1),再加入50 μl 3种不同浓度的药物标准溶液,使药物质量浓度分别为0.096、1.588和9.528 mg.L-1。分别按血样处理方法进行测定,所得结果与加入量之比即为方法回收率。(2)日内、日间变异:样品制备方法同方法回收率。分别按血样处理方法进行测定,一天内不同时间重复测定5次,计算日内变异;连续测定5 d,计算日间变异。(3)最低检测浓度和最小检测量:当信噪比为3时,确定最低检测浓度和最小检测量。
1.3.3 实验设计 将受试者随机分为甲、乙两组,交叉给药,间隔1周。第1周甲组受试者口服供试品(研制的头孢呋辛酯片,125 mg/片,2片),乙组受试者口服对照品(西力欣片250 mg/片)。第2周甲组受试者口服对照品,乙组受试者口服供试品。在禁食12 h情况下给药, 服药前取空白血3.5 ml,早8:00用200 ml温开水服药。继续禁食4 h后统一进餐。于服药后0.5,1,1.5,2,2.5,3,4,5,6,7,8,和10 h分别取前臂静脉血3.5 ml,于室温下放置10 min,5 000×g离心15 min,分离血清于1.5 ml具塞塑料离心试管内,于-20℃冰箱保存备用。
, http://www.100md.com
2 结果与讨论
头孢呋辛酯进入体内水解后生成活性成分头孢呋辛,故测定的血药浓度是头孢呋辛的质量浓度。以头孢呋辛色谱峰面积与内标峰面积之比(A1/A2)对头孢呋辛钠质量浓度(C)作线性回归,其回归方程为:
(A1/A2)=0.408 7C+0.059 7 r=0.999 6
即在0.096~9.600 mg.L-1的范围内,头孢呋辛色谱峰面积与内标峰面积之比和头孢呋辛钠质量浓度有较好的相关性。头孢呋辛及内标色谱峰分离可达1.5。方法回收率测定结果见表1,日内和日间相对标准偏差测定结果见表2。可见在3个不同质量浓度下,回收率在92%~113%之间,日内、日间相对标准偏差分别小于7.22%、9.33%。结果表明,该生物样品测定方法符合要求。
表1 高效液相-紫外法测定头孢呋辛钠在人血浆中的回收率
, 百拇医药
Table 1 Recovery of cefuroxime from the human plasma determined
by the high performance liquid chromatography-ultraviolet method ρ1/mg.L-1
ρ2/mg.L-1
Recovery
(%)
Mean
recovery
(%)
, 百拇医药
RSD
(%)
0.109
114.64
0.100
105.54
0.096
0.117
123.45
113.35
5.78
0.106
111.12
, http://www.100md.com
0.106
112.00
1.558
98.16
1.356
85.40
1.588
1.512
95.23
93.98
5.53
1.554
97.86
, 百拇医药
1.481
93.27
8.761
91.95
8.890
93.31
9.528
8.827
92.65
92.38
0.65
8.761
91.95
, http://www.100md.com
8.768
92.03
ρ1, added mass concentration; ρ2, found mass concentration; RSD, relative standard deviation.
生物利用度是评价新研制药剂质量的非常重要的指标,它可以直接反映某种特定剂型中药物的吸收速度和程度。用高效液相色谱法代替微生物方法测定抗生素的生物利用度具有简便、工作量小和更加准确的特点,因此,本文建立的方法,对于头孢呋辛酯其它制剂的生物利用度评价以及该药的临床血药浓度监测有较大的参考意义。
22名受试者单剂量交叉口服研制的头孢呋辛酯片剂和头孢呋辛酯对照制剂的经时平均血药浓度-时间曲线见图1。药代动力学参数的求算参见国家新药审评中心《药物制剂人体生物利用度和生物等效性试验指导原则》。
, 百拇医药
表2 高效液相-紫外法测定人血浆中头孢呋辛钠质量浓度,日内、日间相对标准偏差
Table 2 Relative standard deviation of the determined
cefuroxime from the human plasma by the
high performance liquid chromatography-ultraviolet method ρ1/mg.L-1
Intra-day
Between-day
ρ2/mg.L-1
, http://www.100md.com
RSD
(%)
ρ2/mg.L-1
RSD
(%)
0.120
0.110
0.108
0.130
0.096
0.980
7.22
, 百拇医药
0.111
9.33
0.108
0.115
0.108
0.134
1.410
1.469
1.583
1.356
1.588
1.567
6.19
, http://www.100md.com
1.445
3.40
1.500
1.370
1.377
1.410
8.579
8.559
8.469
7.997
9.528
8.963
2.29
, http://www.100md.com
8.402
5.46
8.626
8.649
8.499
9.287
ρ1, added mass concentration; ρ2, found mass concentration; RDS, relative standard deviation.图1 22名男性健康受试者口服头孢呋辛酯片
和西力欣片后平均血清药物浓度-时间曲线
Figure 1 The mean serum concentrations-time profiles following oral
, http://www.100md.com
administration of the generic of Cefuroxime axetil tablets and
Zinacef tablets to twenty-two male healthy volunteers (dose, 250 mg)
22名受试者单剂量口服研制的头孢呋辛酯片剂和对照制剂(西力欣片)的药代动力学参数见表3。可见22名受试者单剂量口服研制的头孢呋辛酯片剂和西力欣片后,研制的头孢呋辛酯片剂和西力欣片的AUC[0-∞]分别为(12.7±4.5)和(13.2±4.8) mg.L-1.h;Cmax分别为(3.5±1.2)和(3.9±1.7) mg.L-1;Tmax分别为(1.9±0.8)和(2.2±1.0) h;MRT分别为(3.9±1.3)和(3.8±1.5)h;T1/2分别为(2.3±1.8)和(1.9±1.7)h。说明研制的头孢呋辛酯片剂和西力欣片的各种主要的药物动力学参数是比较接近的。根据上述公式计算研制的头孢呋辛酯片剂的相对生物利用度(F)达到95.4%。
, 百拇医药
表3 22名健康受试者口服头孢呋辛酯片(受试品)和西力欣片(对照品)后测得的主要药物动力学参数
Table 3 Main pharmacokinetic parameters of Cefuroxime axetil following oral administration
of the generic tablets and the Zinacef tablets to twenty-two healthy male human volunteers No.
AUC
Cmax
Tmax
MRT
, 百拇医药
T1/2
Fr
T△
R▲
T
R
T
R
T
R
T
R
1
, 百拇医药
13.6
12.6
3.0
4.9
2.5
3.0
3.8
3.5
1.3
2.0
109.6
2
6.6
, http://www.100md.com
8.3
2.3
2.4
2.0
1.5
2.9
2.8
1.7
1.4
79.6
3
10.5
10.9
, http://www.100md.com
2.6
2.6
2.5
4.0
3.3
4.3
1.5
1.1
96.3
4
16.9
16.9
5.8
, 百拇医药
5.9
1.5
3.0
3.1
3.3
1.9
1.4
97.6
5
18.8
14.9
3.9
6.0
, http://www.100md.com
3.0
1.5
8.2
2.8
8.2
1.3
94.5
6
15.7
18.2
4.0
3.8
2.0
, 百拇医药
2.5
4.1
5.7
2.6
4.9
93.4
7
19.1
26.2
3.7
4.6
3.0
1.0
, 百拇医药
6.0
9.6
5.3
8.3
97.5
8
14.7
12.9
3.2
4.2
0.5
1.5
4.2
, http://www.100md.com
2.8
2.6
1.4
106.2
9
18.5
16.8
3.4
4.6
1.5
2.0
4.6
4.2
, 百拇医药
4.4
2.0
107.2
10
16.3
15.3
6.0
5.0
1.0
1.5
2.8
3.3
1.7
, http://www.100md.com
1.8
107.6
11
15.7
14.0
4.3
4.8
2.5
1.0
3.8
2.7
2.8
2.2
, 百拇医药
114.1
12
4.6
4.9
2.3
1.4
1.5
1.0
4.1
3.9
2.7
2.9
92.0
, 百拇医药
13
6.3
6.0
1.2
1.0
4.0
2.5
5.7
4.9
3.8
2.0
89.4
14
, http://www.100md.com
7.9
8.9
2.5
3.1
1.0
1.0
3.3
3.4
2.0
1.9
88.8
15
15.8
, 百拇医药
14.8
4.5
3.2
1.0
2.5
2.7
3.5
1.1
0.9
107.6
16
13.1
15.5
, 百拇医药
4.1
7.4
1.0
1.5
2.5
2.5
0.8
1.2
85.0
17
15.4
9.9
5.4
, 百拇医药
2.6
2.0
2.5
3.0
3.4
1.6
0.5
150.5
18
8.3
10.7
2.6
2.6
, 百拇医药
2.5
4.0
3.2
3.9
1.7
1.4
76.9
19
5.4
6.8
2.2
1.6
2.0
, 百拇医药
2.0
2.9
3.7
1.5
1.2
79.4
20
11.1
15.8
2.8
3.9
1.5
4.0
, 百拇医药
3.6
3.3
0.5
0.5
70.1
21
12.5
11.5
3.7
5.3
1.5
2.5
4.1
, 百拇医药
2.4
0.8
0.4
89.4
22
12.1
17.6
3.2
5.6
1.0
2.0
3.0
3.3
, http://www.100md.com
1.1
1.2
66.8
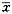
12.7
13.2
3.5
3.9
1.9
2.2
3.9
3.8
2.3
, 百拇医药
1.9
95.4
s
4.5
4.8
1.2
1.7
0.8
1.0
1.3
1.5
1.8
1.7
, 百拇医药
17.9
Where AUC is the area under concentration-time profile (mg.L-1.h). Cmax (mg.L-1), Tmax(h), and MRT(h) denote the maximal concentration, time to reach the maximal concentration and the mean resident time, respectively. Fr represents the relative bioavailability(%). △, test tablets; ▲, reference tablets.
将AUC和Cmax分别进行对数变换后再做统计分析。本研究采用了3P97程序进行方差分析、双单侧检验法(two one-side test)和(1-2α)置信区间的检验。对AUC[0-∞]、AUC[0-Tn]和Cmax进行了统计分析。分析结果表明,研制的头孢呋辛酯片剂和西力欣片的AUC[0-∞]和AUC[0-Tn]之间差异无显著性(P>0.05),90%的置信区间也落在80%~125%范围内;Cmax的90%置信区间也落在70%~143%的范围内,根据有关规定,认为这两个制剂生物等效。■
, http://www.100md.com
参考文献
[1]薛闻鹂, 钟帼英, 胡 新. HPLC法测定头孢呋辛钠的含量[J]. 药物分析杂志, 1996, 16(2):95-97
[2]Donn KH, James NC, Powell JR. Bioavailability of cefuroxime axetil formulations[J]. J Pharm Sci, 1994,83(6):842-844
[3]Kees F, Lukassek U, Naber KG, et al. Comparative investigations on the bioavailability of cefuroxime axetil[J]. Arzneim Forsch/Drug Res, 1991, 41(8):843-846
收稿日期:1999-12-17, 百拇医药