狼疮诱导药物对小鼠免疫系统功能的影响
作者:康自珍 吕平 张岩 朱小辉 郭长占 张玲 高晓明
单位:北京大学基础医学院免疫学系,北京 100083
关键词:狼疮诱导药物;抗体;抗核;普鲁卡因胺;药理学;肼屈嗪(肼苯哒嗪);药理学
北京医科大学学报000409 [摘 要] 目的:建立药物诱导狼疮(drug-induced lupus, DIL)的动物模型,研究狼疮诱导药物对小鼠免疫功能的影响。方法:用普鲁卡因酰胺(procainamide, Pca)、盐酸肼苯哒嗪(hydralazine, Hyd)和2,2′-偶氮-双(3-乙苯基-噻唑啉-6-硫酸)诱导DIL的动物模型。用3H-TdR参人法分析细胞增殖,流式细胞分析法分析细胞表型。结果:Pca和Hyd能诱导BALB/C小鼠而不是C57BL/6小鼠产生抗核抗体。对用药BALB/C小鼠的免疫功能(包括对外来抗原的免疫应答、外周血中淋巴细胞的分型等)的分析发现其部分免疫功能的异常。结论:狼疮诱导药物能够导致BALB/C小鼠部分免疫功能的紊乱。
, http://www.100md.com
[中图分类号] R979.5 [文献标识码] A [文章编号] 1000-1530(2000)04-0316-04
Influence of lupus-induced drugs on immune functions of mice
KANG Zi-Zhen
(Department of Immunology, Peking University, Beijing 100083, China)
LU Ping
(Department of Immunology, Peking University, Beijing 100083, China)
ZHANG Yan
, 百拇医药
(Department of Immunology, Peking University, Beijing 100083, China)
ZHU Xiao-Hui
(Department of Immunology, Peking University, Beijing 100083, China)
GUO Chang-Zhan
(Department of Immunology, Peking University, Beijing 100083, China)
ZHANG Ling
(Department of Immunology, Peking University, Beijing 100083, China)
, 百拇医药
GAO Xiao-Ming
(Department of Immunology, Peking University, Beijing 100083, China)
ABSTRACT Objective:
To investigate the mechanisms of drug-induced lupus in a mouse model. Methods: Procainamide(Pca), hydralazine(Hyd) and azino-bis(3-ethylbenz-thioline-6-sulfolic acid)(ABTS) were used to treat mice of different strains for up to 8 months. Serum anti-nuclear antibody levels were assesed by ELISA and immuno-fluorescence staining. Cell proliferation was measured by 3H-TdR incorporation. Results: Pca and Hyd could induce production of anti-nuclear antibodies in BALB/C mice but not C57BL/6 mice. Assays of immune functions of drug-treated BALB/C mice found part of immune functions abnormal, including immune response to protein antigen, assays for phenotype of T and B cells from peripheral blood et al. Conclusion: Lupus-inducing drugs can induce functional changes of the immune function in BALB/C mice, leading to production of ANA.
, 百拇医药
KEY WORDS Drug-induced lupus; Antibodies anti-nuclear; Procainamide/pharmacol; Hydralazine/pharmacol
(J Beijing Med Univ, 2000,32:316-319)
已知至少有40多种药物由于长期使用而诱导患者产生红斑狼疮(systemic lupus erythematosus, SLE)样症状,即药物诱导的狼疮(drug-induced lupus, DIL)。DIL具有停药后症状缓解或消失的特征,而且临床上DIL的诱发率较低,因此直接研究人DIL致病机制的材料和标本来源比较困难。建立DIL的动物模型不但有利于更深入地研究狼疮诱导药物对免疫系统功能的影响,而且对研究SLE等自身免疫病的致病机制具有重要意义。在狼疮诱导药物中普鲁卡因胺(procainamide, Pca)的危险性最大,治疗过的病人中约20%的发病率[1],而肼屈嗪(盐酸肼苯哒嗪,hydralazine, Hyd)次之,诱发率约10%[2]。我们用Pca,Hyd和2,2′-偶氮-双(3-乙苯基-噻唑啉-6-硫酸 )[azino-bis(3-ethylbenz-thioline-6-sulfolic acid), ABTS] ABTS对BALB/C小鼠和C57BL/6小鼠进行了长时间的处理,并分析用药小鼠的免疫功能。
, 百拇医药
1 材料与方法
1.1 动物及其处理
BALB/C小鼠(H-2d),C57BL/6(H-2b)小鼠,两种品系小鼠均为雌性,开始试验年龄为6~8周。小鼠购于中国科学院遗传研究所。动物都在无病原体的环境下培养。BALB/C、C57BL/6小鼠各分成4组,每组12只,每一品系的小鼠设一对照组,注射生理盐水,其它各组分别用3种药物处理,药物质量浓度均为1g.L-1,每只每次腹腔注射1 ml,每周3次。血清的制备采用眼眶取血。
1.2 试剂
Pca、Hyd和ABTS购于Sigma公司,Saponin(佐剂),胎牛血清(hyclone),Click's培养基(gibco BRL),绿色荧光蛋白[green fluorescent protein, GFP,本实验室自制,纯度(质量分数)在95%以上],3H-TdR(北京原子能研究所)。卵清蛋白(ovalbumin,OVA) ,FITC标记的兔抗小鼠丙球(自制),FITC标记的大鼠抗小鼠CD8抗体和PE标记的大鼠抗小鼠CD4抗体(殷金珠教授惠赠)。
, 百拇医药
1.3 细胞的制备,培养与增殖分析
小鼠引颈处死后,取淋巴结细胞,制成终浓度为5×106 ml-1的细胞悬液。细胞用Click's培养基培养,培养基使用前补加5%(体积分数)胎牛血清,2mmol.L-1谷氨酰胺,100u.ml-1青霉素,100mg.L-1链霉素和5×10-5mol.L-1二巯基乙醇。细胞于96孔板培养,每孔加200 μl培养基和5×105个细胞,每个样品设3个平行孔。做T细胞的OVA特异性分析时每孔加终(质量)浓度100g.L-1的OVA。细胞培养72 h,收集前6 h参入3H-TdR,每孔参入3700 Bq 3H-TdR,3H-TdR的参入率用液闪仪(Wallac)检测。刺激指数为加抗原时的3H-TdR参入值与不加抗原时的3H-TdR参入值的比。
, 百拇医药
1.4 动物的免疫与抗体检测
动物的免疫采用腹腔免疫法,用GFP作抗原,每次每只小鼠注射0.5 ml,含100 μg抗原和50 μg的Saponin(佐剂),第2周以同样的剂量加强一次,10 d后,眼眶取血,制血清。抗体的检测用ELISA法,用质量浓度为10 mg.L-1的GFP包被酶标板,血清按体积比1∶100 000稀释,以未免疫的正常BALB/C小鼠的血清作阴性对照,二抗为辣根过氧化物酶标记的山羊抗小鼠IgG。每个样品的检测设3个平行孔,吸光度(absorbance, A)用酶标仪(Bio-Rad)读数,波长为490 nm。免疫BALB/C小鼠取淋巴结时,采用尾根部皮下免疫OVA的方法,每只免疫100μg OVA和50μg佐剂,总体积100 μl,7 d后取腹股沟和主动脉旁淋巴结细胞。
1.5 间接免疫荧光法检测抗核抗体[3]
, 百拇医药
Hep-2细胞于6孔板培养好后,用PBS洗两遍,然后用80%(体积分数)的甲醇固定10 min,洗两遍。加一抗,反应45 min,PBS洗3遍。加FITC标记的兔抗小鼠丙种球蛋白,反应30 min,洗3遍。荧光显微镜(Leica DM LB)下观察。血清和二抗都用含10%(体积分数)小牛血清的PBS稀释,小鼠血清均按体积比1∶20稀释,为对应实验组的混合血清。以5~6个月的BXSB雄性小鼠的混合血清为阳性对照,以正常BALB/C小鼠混合血清为阴性对照。
1.6 小鼠外周血中的T、B细胞的流式细胞分析(FACS)
T细胞亚类的分析:从小鼠眼眶取血,用肝素抗凝。每只Eppendorf管中加新鲜血液200 μl,离心,去血清。每管各加50 μl FITC标记的大鼠抗小鼠CD8抗体和PE标记的大鼠抗小鼠CD4抗体(按体积比1∶10稀释),以不加抗体作为阴性对照。40℃孵育30 min,PBS洗2遍。加红细胞溶解液,PBS洗3遍。离心,去上清,每管加1 ml FACS 细胞保存液。流式细胞计(becton dikinson,USA)上分析细胞表型。用Lysis Ⅱ统计软件分析数据。
, http://www.100md.com
B细胞的分析:实验步骤同T细胞的流式细胞分析。抗体用FITC标计的兔抗小鼠Ig(按体积比1∶20稀释)。
1.7 统计学分析
实验结果用 ±s表示,实验组与对照组差异性的比较采用t检测法。
±s表示,实验组与对照组差异性的比较采用t检测法。
2 结果
2.1 药物诱导BALB/C小鼠抗核抗体的产生
为了探明遗传因素对DIL动物模型的影响,我们用纯系的BALB/C小鼠(自身免疫病易感)和C57BL/6小鼠(自身免疫病抗性)进行药物诱导抗核抗体的实验。用药8个月后,每个试验组的12只小鼠的血清混合在一起,以正常BALB/C小鼠的混合血清为阴性对照,以5~6个月雄性BXSB小鼠的混合血清为阳性对照,通过间接免疫荧光法对混合血清进行抗核抗体检测。BALB/C小鼠对照血清所染Hep-2细胞为均匀的微弱绿色,Pca和Hyd组Hep-2细胞整个胞核被染成均匀弥散的绿色,而ABTS组染色结果为阴性。C57BL/6小鼠所有用药组与对照组都为阴性(图1)。
, http://www.100md.com
Hep-2 cells were stained with sera from mice treated with NaCl, Pca, Hyd
or ABTS. a, shows positive antibodies from Pca and Hyd-treated BALB/C mice;
b, shows negative control and antibodies from ABTS-treated BALB/C and
all C57BL/6 mice; c, shows Hep-2 cells under natural light.
图1 用药小鼠血清的间接免疫荧光染色
Figure 1 Indirect immunofluorescence staining using
, 百拇医药
sera from mice treated with Pca, Hyd and ABTS
2.2 用药小鼠对蛋白质抗原的体液免疫应答
为了检测用药8个月后小鼠的免疫功能是否发生改变,我们用GFP对用药的BALB/C和C57BL/6小鼠进行腹腔免疫,10 d后用ELISA法检测血清中IgG型抗绿色荧光蛋白(green fluorescent protein, GFP)抗体,结果表明两种品系小鼠用药组与对照组抗GFP抗体水平无显著差异(图2)。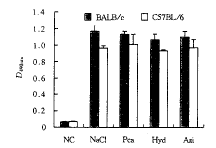
Following 8-month treatment with Pca, Hyd or ABTS, mice were primed
with purified GFP and bled 10 days later. Sera from immunized BALB/C and
, 百拇医药
C57BL/6 mice were tested using ELISA. Absorbance at 490nm was read using
an ELISA reader. NC represented negative control.
图2 Pca、Hyd和ABTS处理小鼠对绿色荧光蛋白的免疫应答
Figure 2 Antibody response against GFP in mice
treated with Pca, Hyd and ABTS
2.3 Pca处理的BALB/C小鼠对外来抗原的细胞免疫应答减弱
为了检测用药小鼠的细胞免疫功能是否发生异常变化,小鼠用卵清蛋白(OVA)免疫1周后,取淋巴结细胞,做T细胞的OVA特异性检测。用药小鼠T细胞对OVA的免疫应答减弱,刺激指数为2.05, 而对照组为2.85。
, 百拇医药
2.4 Pca处理的BALB/C小鼠外周血中T、B细胞的FACS分析
为了检测用药BALB/C小鼠外周血中CD4+与CD8+ T细胞的比例以及B细胞含量是否发生变化,从Pca处理的BALB/C小鼠和对照组小鼠眼眶取血,每组的血液混在一起,用直接免疫荧光标记法对血中的T、B细胞进行FACS分析。结果发现用药组与对照组CD4+与CD8+T细胞的比例并无差别,而用药组B细胞的含量有所增加(图3)。
B cells in 200μl peripheral blood from control(A) or Pca-treated(B)
BALB/C mice were labeled with FITC-conjugated rabbit antibodies
, http://www.100md.com
to mouse sIg of B cells, while T cell from control(C) or
Pca-treated mice(D) labeled with PE-conjugated and FITC-conjugated
CD8 antibodies. Labeled cells were analyzed by FACS analysis.
The percentage of gated cells were indicated.
图3 Pca处理BALB/C小鼠外周血中T、B细胞的FACS分析
Figure 3 FACS analysis for T and B cells from
, 百拇医药
peripheral blood of Pca-treated BALB/C mice
3 讨论
虽然关于Pca和Hyd对淋巴细胞的作用已有一些研究,但是目前它们诱导狼疮的机制还不清楚。我们用Pca、Hyd和ABTS诱导BALB/C小鼠产生抗核抗体,并对用药小鼠的免疫功能进行了分析。T、B细胞可以通过分泌细胞因子(如TGF-β、IL-10、炎症因子等)对免疫系统发挥极其重要的调节作用。如果T、B细胞的数量或功能发生异常变化,将导致疾病的产生。
T、B细胞在SLE中的作用已得到很好的证实[4,5]。我们对Pca处理的BALB/C小鼠外周血中CD4+T细胞、CD8+T细胞和B细胞进行了流式细胞分析,结果发现用药组与对照组CD4+与CD8+T细胞的比例并没有差异,而用药组B细胞的含量有所升高,对其它用药组小鼠的分析也得到类似的结果(另文发表)。
, 百拇医药
用绿色荧光蛋白对用药BALB/C和C57BL/6小鼠进行免疫,结果发现用药组与对照组的体液免疫应答均差异无显著性。
我们在研究中发现一些先天性SLE动物模型(如雄性BXSB小鼠)的淋巴细胞对外来刺激(如抗原或有丝分裂原)的免疫应答减弱(另文发表)。我们对Pca处理的BALB/C小鼠进行了类似的分析,结果发现用药小鼠淋巴结细胞对外来抗原的免疫应答减弱,这可能由于T细胞的反应性减弱,也可能由于APC 的抗原呈递功能减弱。我们进一步分析了其T细胞对ConA 的免疫应答,结果用药小鼠T细胞对ConA免疫应答减弱,同时我们用OVA特异的T细胞系分析了用药小鼠APC的抗原呈递功能,发现用药小鼠APC的抗原呈递功能亦减弱(另文发表)。尽管T细胞的免疫应答减弱,但Pca处理的BALB/C小鼠外周血中B细胞的含量增加,在一定程度上弥补了T细胞反应的不足,这种平衡可能是导致Pca处理小鼠对外来抗原的体液免疫应答无异常变化的原因。进一步的工作是对药物导致淋巴细胞对外来抗原低应答的原因进行分析以及对这种低应答与自身免疫的关系作更深入的研究。
, 百拇医药
基金项目:国家自然科学基金(39725024)资助课题。
参考文献
1,Woosley RL, Drayer DE. Effect of acetylator phenotype on the rate at which procainamide induce antinuclear antibodies and the lupus syndrome[J]. N Engl J Med,1978, 298:1157
2,Jiang XX, Khursigara G, Robert LR. Transformation of lupus-induced drugs to cytotoxic products by activated neutrophils[J]. Science, 1994, 266(4): 810-813
, 百拇医药
3,Anke KR, Steven RD, Robert LR. Autoimmunity caused by disruption of central T cell tolerance:A murine model of drug-induced lupus[J]. J Clin Invest, 1997, 99:1888-1896
4,Gleichmann EV, Elven EH, Veen JP. SLE-like disease in mice induced by abnormal T-B cell cooperation: Preferential formation of autoantibodies characteristic of SLE[J]. Eur J Immunol, 1982,12:152-159
5,Huang YP, Perrin LH, Miescher PA, et al. Correlation of T and B cell activities in vitro and serum IL-12 levels in SLE[J]. J Immunol, 1988, 41:827-833
(2000-03-31收稿), 百拇医药
单位:北京大学基础医学院免疫学系,北京 100083
关键词:狼疮诱导药物;抗体;抗核;普鲁卡因胺;药理学;肼屈嗪(肼苯哒嗪);药理学
北京医科大学学报000409 [摘 要] 目的:建立药物诱导狼疮(drug-induced lupus, DIL)的动物模型,研究狼疮诱导药物对小鼠免疫功能的影响。方法:用普鲁卡因酰胺(procainamide, Pca)、盐酸肼苯哒嗪(hydralazine, Hyd)和2,2′-偶氮-双(3-乙苯基-噻唑啉-6-硫酸)诱导DIL的动物模型。用3H-TdR参人法分析细胞增殖,流式细胞分析法分析细胞表型。结果:Pca和Hyd能诱导BALB/C小鼠而不是C57BL/6小鼠产生抗核抗体。对用药BALB/C小鼠的免疫功能(包括对外来抗原的免疫应答、外周血中淋巴细胞的分型等)的分析发现其部分免疫功能的异常。结论:狼疮诱导药物能够导致BALB/C小鼠部分免疫功能的紊乱。
, http://www.100md.com
[中图分类号] R979.5 [文献标识码] A [文章编号] 1000-1530(2000)04-0316-04
Influence of lupus-induced drugs on immune functions of mice
KANG Zi-Zhen
(Department of Immunology, Peking University, Beijing 100083, China)
LU Ping
(Department of Immunology, Peking University, Beijing 100083, China)
ZHANG Yan
, 百拇医药
(Department of Immunology, Peking University, Beijing 100083, China)
ZHU Xiao-Hui
(Department of Immunology, Peking University, Beijing 100083, China)
GUO Chang-Zhan
(Department of Immunology, Peking University, Beijing 100083, China)
ZHANG Ling
(Department of Immunology, Peking University, Beijing 100083, China)
, 百拇医药
GAO Xiao-Ming
(Department of Immunology, Peking University, Beijing 100083, China)
ABSTRACT Objective:
To investigate the mechanisms of drug-induced lupus in a mouse model. Methods: Procainamide(Pca), hydralazine(Hyd) and azino-bis(3-ethylbenz-thioline-6-sulfolic acid)(ABTS) were used to treat mice of different strains for up to 8 months. Serum anti-nuclear antibody levels were assesed by ELISA and immuno-fluorescence staining. Cell proliferation was measured by 3H-TdR incorporation. Results: Pca and Hyd could induce production of anti-nuclear antibodies in BALB/C mice but not C57BL/6 mice. Assays of immune functions of drug-treated BALB/C mice found part of immune functions abnormal, including immune response to protein antigen, assays for phenotype of T and B cells from peripheral blood et al. Conclusion: Lupus-inducing drugs can induce functional changes of the immune function in BALB/C mice, leading to production of ANA.
, 百拇医药
KEY WORDS Drug-induced lupus; Antibodies anti-nuclear; Procainamide/pharmacol; Hydralazine/pharmacol
(J Beijing Med Univ, 2000,32:316-319)
已知至少有40多种药物由于长期使用而诱导患者产生红斑狼疮(systemic lupus erythematosus, SLE)样症状,即药物诱导的狼疮(drug-induced lupus, DIL)。DIL具有停药后症状缓解或消失的特征,而且临床上DIL的诱发率较低,因此直接研究人DIL致病机制的材料和标本来源比较困难。建立DIL的动物模型不但有利于更深入地研究狼疮诱导药物对免疫系统功能的影响,而且对研究SLE等自身免疫病的致病机制具有重要意义。在狼疮诱导药物中普鲁卡因胺(procainamide, Pca)的危险性最大,治疗过的病人中约20%的发病率[1],而肼屈嗪(盐酸肼苯哒嗪,hydralazine, Hyd)次之,诱发率约10%[2]。我们用Pca,Hyd和2,2′-偶氮-双(3-乙苯基-噻唑啉-6-硫酸 )[azino-bis(3-ethylbenz-thioline-6-sulfolic acid), ABTS] ABTS对BALB/C小鼠和C57BL/6小鼠进行了长时间的处理,并分析用药小鼠的免疫功能。
, 百拇医药
1 材料与方法
1.1 动物及其处理
BALB/C小鼠(H-2d),C57BL/6(H-2b)小鼠,两种品系小鼠均为雌性,开始试验年龄为6~8周。小鼠购于中国科学院遗传研究所。动物都在无病原体的环境下培养。BALB/C、C57BL/6小鼠各分成4组,每组12只,每一品系的小鼠设一对照组,注射生理盐水,其它各组分别用3种药物处理,药物质量浓度均为1g.L-1,每只每次腹腔注射1 ml,每周3次。血清的制备采用眼眶取血。
1.2 试剂
Pca、Hyd和ABTS购于Sigma公司,Saponin(佐剂),胎牛血清(hyclone),Click's培养基(gibco BRL),绿色荧光蛋白[green fluorescent protein, GFP,本实验室自制,纯度(质量分数)在95%以上],3H-TdR(北京原子能研究所)。卵清蛋白(ovalbumin,OVA) ,FITC标记的兔抗小鼠丙球(自制),FITC标记的大鼠抗小鼠CD8抗体和PE标记的大鼠抗小鼠CD4抗体(殷金珠教授惠赠)。
, 百拇医药
1.3 细胞的制备,培养与增殖分析
小鼠引颈处死后,取淋巴结细胞,制成终浓度为5×106 ml-1的细胞悬液。细胞用Click's培养基培养,培养基使用前补加5%(体积分数)胎牛血清,2mmol.L-1谷氨酰胺,100u.ml-1青霉素,100mg.L-1链霉素和5×10-5mol.L-1二巯基乙醇。细胞于96孔板培养,每孔加200 μl培养基和5×105个细胞,每个样品设3个平行孔。做T细胞的OVA特异性分析时每孔加终(质量)浓度100g.L-1的OVA。细胞培养72 h,收集前6 h参入3H-TdR,每孔参入3700 Bq 3H-TdR,3H-TdR的参入率用液闪仪(Wallac)检测。刺激指数为加抗原时的3H-TdR参入值与不加抗原时的3H-TdR参入值的比。
, 百拇医药
1.4 动物的免疫与抗体检测
动物的免疫采用腹腔免疫法,用GFP作抗原,每次每只小鼠注射0.5 ml,含100 μg抗原和50 μg的Saponin(佐剂),第2周以同样的剂量加强一次,10 d后,眼眶取血,制血清。抗体的检测用ELISA法,用质量浓度为10 mg.L-1的GFP包被酶标板,血清按体积比1∶100 000稀释,以未免疫的正常BALB/C小鼠的血清作阴性对照,二抗为辣根过氧化物酶标记的山羊抗小鼠IgG。每个样品的检测设3个平行孔,吸光度(absorbance, A)用酶标仪(Bio-Rad)读数,波长为490 nm。免疫BALB/C小鼠取淋巴结时,采用尾根部皮下免疫OVA的方法,每只免疫100μg OVA和50μg佐剂,总体积100 μl,7 d后取腹股沟和主动脉旁淋巴结细胞。
1.5 间接免疫荧光法检测抗核抗体[3]
, 百拇医药
Hep-2细胞于6孔板培养好后,用PBS洗两遍,然后用80%(体积分数)的甲醇固定10 min,洗两遍。加一抗,反应45 min,PBS洗3遍。加FITC标记的兔抗小鼠丙种球蛋白,反应30 min,洗3遍。荧光显微镜(Leica DM LB)下观察。血清和二抗都用含10%(体积分数)小牛血清的PBS稀释,小鼠血清均按体积比1∶20稀释,为对应实验组的混合血清。以5~6个月的BXSB雄性小鼠的混合血清为阳性对照,以正常BALB/C小鼠混合血清为阴性对照。
1.6 小鼠外周血中的T、B细胞的流式细胞分析(FACS)
T细胞亚类的分析:从小鼠眼眶取血,用肝素抗凝。每只Eppendorf管中加新鲜血液200 μl,离心,去血清。每管各加50 μl FITC标记的大鼠抗小鼠CD8抗体和PE标记的大鼠抗小鼠CD4抗体(按体积比1∶10稀释),以不加抗体作为阴性对照。40℃孵育30 min,PBS洗2遍。加红细胞溶解液,PBS洗3遍。离心,去上清,每管加1 ml FACS 细胞保存液。流式细胞计(becton dikinson,USA)上分析细胞表型。用Lysis Ⅱ统计软件分析数据。
, http://www.100md.com
B细胞的分析:实验步骤同T细胞的流式细胞分析。抗体用FITC标计的兔抗小鼠Ig(按体积比1∶20稀释)。
1.7 统计学分析
实验结果用
 ±s表示,实验组与对照组差异性的比较采用t检测法。
±s表示,实验组与对照组差异性的比较采用t检测法。2 结果
2.1 药物诱导BALB/C小鼠抗核抗体的产生
为了探明遗传因素对DIL动物模型的影响,我们用纯系的BALB/C小鼠(自身免疫病易感)和C57BL/6小鼠(自身免疫病抗性)进行药物诱导抗核抗体的实验。用药8个月后,每个试验组的12只小鼠的血清混合在一起,以正常BALB/C小鼠的混合血清为阴性对照,以5~6个月雄性BXSB小鼠的混合血清为阳性对照,通过间接免疫荧光法对混合血清进行抗核抗体检测。BALB/C小鼠对照血清所染Hep-2细胞为均匀的微弱绿色,Pca和Hyd组Hep-2细胞整个胞核被染成均匀弥散的绿色,而ABTS组染色结果为阴性。C57BL/6小鼠所有用药组与对照组都为阴性(图1)。

, http://www.100md.com
Hep-2 cells were stained with sera from mice treated with NaCl, Pca, Hyd
or ABTS. a, shows positive antibodies from Pca and Hyd-treated BALB/C mice;
b, shows negative control and antibodies from ABTS-treated BALB/C and
all C57BL/6 mice; c, shows Hep-2 cells under natural light.
图1 用药小鼠血清的间接免疫荧光染色
Figure 1 Indirect immunofluorescence staining using
, 百拇医药
sera from mice treated with Pca, Hyd and ABTS
2.2 用药小鼠对蛋白质抗原的体液免疫应答
为了检测用药8个月后小鼠的免疫功能是否发生改变,我们用GFP对用药的BALB/C和C57BL/6小鼠进行腹腔免疫,10 d后用ELISA法检测血清中IgG型抗绿色荧光蛋白(green fluorescent protein, GFP)抗体,结果表明两种品系小鼠用药组与对照组抗GFP抗体水平无显著差异(图2)。

Following 8-month treatment with Pca, Hyd or ABTS, mice were primed
with purified GFP and bled 10 days later. Sera from immunized BALB/C and
, 百拇医药
C57BL/6 mice were tested using ELISA. Absorbance at 490nm was read using
an ELISA reader. NC represented negative control.
图2 Pca、Hyd和ABTS处理小鼠对绿色荧光蛋白的免疫应答
Figure 2 Antibody response against GFP in mice
treated with Pca, Hyd and ABTS
2.3 Pca处理的BALB/C小鼠对外来抗原的细胞免疫应答减弱
为了检测用药小鼠的细胞免疫功能是否发生异常变化,小鼠用卵清蛋白(OVA)免疫1周后,取淋巴结细胞,做T细胞的OVA特异性检测。用药小鼠T细胞对OVA的免疫应答减弱,刺激指数为2.05, 而对照组为2.85。
, 百拇医药
2.4 Pca处理的BALB/C小鼠外周血中T、B细胞的FACS分析
为了检测用药BALB/C小鼠外周血中CD4+与CD8+ T细胞的比例以及B细胞含量是否发生变化,从Pca处理的BALB/C小鼠和对照组小鼠眼眶取血,每组的血液混在一起,用直接免疫荧光标记法对血中的T、B细胞进行FACS分析。结果发现用药组与对照组CD4+与CD8+T细胞的比例并无差别,而用药组B细胞的含量有所增加(图3)。

B cells in 200μl peripheral blood from control(A) or Pca-treated(B)
BALB/C mice were labeled with FITC-conjugated rabbit antibodies
, http://www.100md.com
to mouse sIg of B cells, while T cell from control(C) or
Pca-treated mice(D) labeled with PE-conjugated and FITC-conjugated
CD8 antibodies. Labeled cells were analyzed by FACS analysis.
The percentage of gated cells were indicated.
图3 Pca处理BALB/C小鼠外周血中T、B细胞的FACS分析
Figure 3 FACS analysis for T and B cells from
, 百拇医药
peripheral blood of Pca-treated BALB/C mice
3 讨论
虽然关于Pca和Hyd对淋巴细胞的作用已有一些研究,但是目前它们诱导狼疮的机制还不清楚。我们用Pca、Hyd和ABTS诱导BALB/C小鼠产生抗核抗体,并对用药小鼠的免疫功能进行了分析。T、B细胞可以通过分泌细胞因子(如TGF-β、IL-10、炎症因子等)对免疫系统发挥极其重要的调节作用。如果T、B细胞的数量或功能发生异常变化,将导致疾病的产生。
T、B细胞在SLE中的作用已得到很好的证实[4,5]。我们对Pca处理的BALB/C小鼠外周血中CD4+T细胞、CD8+T细胞和B细胞进行了流式细胞分析,结果发现用药组与对照组CD4+与CD8+T细胞的比例并没有差异,而用药组B细胞的含量有所升高,对其它用药组小鼠的分析也得到类似的结果(另文发表)。
, 百拇医药
用绿色荧光蛋白对用药BALB/C和C57BL/6小鼠进行免疫,结果发现用药组与对照组的体液免疫应答均差异无显著性。
我们在研究中发现一些先天性SLE动物模型(如雄性BXSB小鼠)的淋巴细胞对外来刺激(如抗原或有丝分裂原)的免疫应答减弱(另文发表)。我们对Pca处理的BALB/C小鼠进行了类似的分析,结果发现用药小鼠淋巴结细胞对外来抗原的免疫应答减弱,这可能由于T细胞的反应性减弱,也可能由于APC 的抗原呈递功能减弱。我们进一步分析了其T细胞对ConA 的免疫应答,结果用药小鼠T细胞对ConA免疫应答减弱,同时我们用OVA特异的T细胞系分析了用药小鼠APC的抗原呈递功能,发现用药小鼠APC的抗原呈递功能亦减弱(另文发表)。尽管T细胞的免疫应答减弱,但Pca处理的BALB/C小鼠外周血中B细胞的含量增加,在一定程度上弥补了T细胞反应的不足,这种平衡可能是导致Pca处理小鼠对外来抗原的体液免疫应答无异常变化的原因。进一步的工作是对药物导致淋巴细胞对外来抗原低应答的原因进行分析以及对这种低应答与自身免疫的关系作更深入的研究。
, 百拇医药
基金项目:国家自然科学基金(39725024)资助课题。
参考文献
1,Woosley RL, Drayer DE. Effect of acetylator phenotype on the rate at which procainamide induce antinuclear antibodies and the lupus syndrome[J]. N Engl J Med,1978, 298:1157
2,Jiang XX, Khursigara G, Robert LR. Transformation of lupus-induced drugs to cytotoxic products by activated neutrophils[J]. Science, 1994, 266(4): 810-813
, 百拇医药
3,Anke KR, Steven RD, Robert LR. Autoimmunity caused by disruption of central T cell tolerance:A murine model of drug-induced lupus[J]. J Clin Invest, 1997, 99:1888-1896
4,Gleichmann EV, Elven EH, Veen JP. SLE-like disease in mice induced by abnormal T-B cell cooperation: Preferential formation of autoantibodies characteristic of SLE[J]. Eur J Immunol, 1982,12:152-159
5,Huang YP, Perrin LH, Miescher PA, et al. Correlation of T and B cell activities in vitro and serum IL-12 levels in SLE[J]. J Immunol, 1988, 41:827-833
(2000-03-31收稿), 百拇医药