胰岛素对卵巢卵泡膜细胞黄体生成素/人绒毛膜促性腺激素受体表达的影响
作者:武秀峰 郑淑蓉 范正红 李红真
单位:北京大学第一医院妇产科,北京 100034
关键词:促性腺激素类;绒毛膜;代谢;胰岛素;药理学;受体;LH;代谢;泡膜细胞;药物作用
北京医科大学学报000609 [摘 要]目的:研究胰岛素对猪卵巢卵泡膜细胞黄体生成素/人绒毛膜促性腺激素(luteinizing hormone/human chorionic gonadotropin ,LH /hCG)受体表达的影响。方法:采用细胞免疫组化及Western blot 法分别检测LH /hCG受体的蛋白表达水平。
结果:细胞免疫组化结果显示促卵泡激素(follicle-stimulating hormone,FSH)+黄体生成素(luteinizing hormone,LH)处理的细胞淡黄色着色且阳性细胞数少;而FSH+LH+胰岛素(insulin,INS)处理的细胞为深黄色着色,阳性细胞数多,FSH+LH+INS组光密度(0.353±0.013)与FSH+LH组(0.287±0.009)相比LH/hCG 受体表达明显增强,差异有显著性,P<0.01。Western blot结果显示FSH+LH+INS组(6598±388)LH/hCG 受体蛋白分别在6×103、5×103、3.5×103出现条带,而FSH+LH组(2237±395)仅在6×103处出现条带,两组比较,差异有显著性,P<0.01。结论:胰岛素可以增强卵泡膜细胞LH /hCG 受体的表达,这可能是PCOS合并高胰岛素血症患者卵泡发育停滞的原因之一。
, http://www.100md.com
[中图分类号]R977.15 [文献标识码]A
[文章编号]1000-1530(2000)06-0512-03
Effect of insulin on the expression of luteinizing hormone-human chorionic gonadotropin receptor in cultured porcine theca cells
WU Xiu-Feng,ZHENG Shu-Rong,FAN Zheng-Hong,LI Hong-Zhen
(Department of Gynecology and Obstetrics,Peking University First Hospital,Beijing 100034,China)
, 百拇医药
ABSTRACT Objective:To study the effect of insulin on the expression of luteinizing hormone-human chorionic gonadotropin receptor(LH/hCG receptor) of cultured porcine theca cells and look into the possible mechanism of the arrest of follicular growth in polycystic ovary syndrome(POS).Methods:The primary model of cultured porcine theca cells in vitro was established and the cells were treated differently.The level of LH/hCG receptor in the cells was checked by Western blot and cell immuno-
, 百拇医药
histochemistry methods.Results:The level of LH/hCG receptor in the cells of group FSH+LH+INS(6598±388)(0.353±0.013) was significantly higher than that of group FSH+LH(2237±395)(0.287±0.009),P<0.01 by Western blot and cell immunohistochemistry.The expression of LH/hCG receptor in the cells of group FSH+LH+INS showed 6×103,5×103,3.5×103 while group FSH+LH showed only 6×103.Conclusion:Insulin enhanced the expression of LH/hCG receptor of cultured porcine theca cells.Hyperinsulinemia may enhance the expression of LH/hCG receptor so as to lose the regularing during menstrical period and probably the arrest of follicular growth in patients with PCOS implicated with hyperinsulinemia.
, 百拇医药
KEY WORDS Gonadotropins,chorionic/metab;Insulin/pharmacol;
Receptors,LH/metab;Theca cells/metab
卵泡膜细胞在维持卵泡的完整性及其功能中起着十分重要的作用,并且是正常卵巢来源雄激素的主要生成部位,黄体生成素通过其受体——黄体生成素/人绒毛膜促性腺激素(luteinizing hormone/human chorionic gonadotropin,LH /hCG)作用于卵泡膜细胞,影响着雄激素的合成。约有30%~70%的多囊卵巢综合征(polycystic ovary syndrome,PCOS)患者常常合并高胰岛素血症,并认为它可能在PCOS的高雄激素血症中起作用[1]。卵泡膜细胞LH/hCG受体的数量反映着其对LH的敏感性。关于胰岛素(insulin,INS)是否增强卵泡膜细胞LH/hCG 受体表达的研究报道很少。由于人的卵巢不仅来源有限而且处在同一个发育阶段的卵泡很少,限制了对人卵巢的分子生物学的研究,而猪在解剖及生理方面与人是最相似的,因此我们采用猪卵巢的卵泡膜细胞,在体外建立无血清原代细胞培养模型来研究INS对卵泡膜细胞LH/hCG受体表达的影响。
, http://www.100md.com
1 材料与方法
1.1 材料
本实验所用的猪卵巢由北京清河屠宰厂提供。 LH/hCG 受体抗体由美国Mayor Clinic Patrick Roche博士惠赠 。 Trizol试剂由生命科技公司生产,免疫组化试剂盒(Sp kit)及Western blot所用二抗购自中山公司(美国ZYMED公司生产)。硝酸纤维膜购自天象人(Whatman公司)。
1.2 方法
猪卵泡膜细胞(theca cell,TC)原代培养:按Magoffi等[2]的方法进行,即将取回的卵巢清洗数遍,在超净台选取直径约6mm的健康卵泡(卵泡液为草黄色),在盛有培养液的平皿中,半剖开卵泡,剥离出卵泡内膜(呈帽状),刮除附着在其表面的颗粒细胞并反复洗数次,用2.5 g*L-1胶原酶及0.5 g*L-1透明质酸酶及0.5 g*L-1蛋白酶37 ℃摇床孵育,每10 min吹打一次,共孵育50 min后终止消化,洗涤离心除去酶进行细胞计数及台盼蓝活细胞计数(98%以上)。按每毫升105个细胞接种于24孔培养板(内置1 cm×1 cm大小的干净玻璃片,为细胞免疫组化用)及25 ml培养瓶,用含10%(体积分数)胎牛血请(fetal calf serum,FCS),0.2 mol*L-1谷氨酰胺,链霉素100 g*L-1,青霉素100 IU*ml-1的培养液37 ℃,5%(体积分数)CO2培养48 h,使细胞充分贴壁,然后弃去培养液,更换为无血清培养液,并分为促卵泡激素(follicle-stimulating hormone,FSH)+LH和FSH+LH+INS两组加药,作用48 h(为最适反应时间)后停止反应,提取细胞蛋白。其中各药终(质量)浓度分别为FSH 25 μg*L-1,LH 50 μg*L-1,INS 25 μg*L-1(正常的INS质量浓度<10 μg*L-1)。培养板中爬满单层卵泡膜细胞的玻璃片采用95%(体积分数)的无水乙醇,1%(体积分数)的醋酸及少许氯仿固定10 min,磷酸盐缓冲溶液(phosphate buffered solution,PBS)洗涤后,-20 ℃保存备用;培养瓶中培养的细胞用于提取蛋白。
, http://www.100md.com
细胞免疫组化:将固定处理的含单层细胞的玻璃片,3%(体积分数)过氧化氢及10%(体积分数)羊血清封闭,1∶850(体积比)一抗37 ℃ 1 h,PBST[0.01 mol*L-1PBS+0.5%(体积分数)Triton X-100]洗涤,二抗及三抗采用链酶菌抗生物素蛋白-过氧化物酶试剂盒中的二抗及三抗各37 ℃ 30 min,DAB显色5 min,镜下观察,用德国LEICA Q550IW型图像分析仪测灰度值进行分析。
卵泡膜细胞蛋白的提取:此实验所提取的蛋白是采用美国Life Technology公司Trizol RNA一步提取法提取RNA后的有机相提取的。裂解细胞,氯仿抽提,水相用于提取RNA,异丙醇沉淀,75%(体积分数)乙醇洗涤RNA,干燥,DEPC水溶解(用于RT-PCR)。水相下面的有机相用于提取蛋白:0.3 ml无水乙醇,4000×g,离心5 min,取上清加入异丙醇,离心弃上清,0.3 mol*L-1盐酸胍反复处理3次,加入无水乙醇常温静置20 min,离心弃上清干燥,加入10 g*L-1 SDS 50 μl,50 ℃孵育数分钟,离心留取上清,-20 ℃保存备用(Western blot用)。
, 百拇医药
蛋白免疫印迹:将提取到的蛋白定量每孔上样0.5 μg,加β-巯基乙醇4 μl煮沸变性3 min,用5%(体积分数)浓缩胶100 V及10%(体积分数)分离胶150 V电泳约4 h,然后用Bio-Rad湿式电转仪将蛋白转至硝酸纤维膜(80 V, 5 h),用50 g*L-1丽春红染膜检测蛋白转膜情况,50 g*L-1脱脂奶粉封闭过夜,PBST [0.01 mol*L-1PBS +0.1%(体积分数)Tween-20]10 min洗3次,一抗1∶1 000(体积比),RT全方位摇床置1 h,PBST 10 min洗3次,依次1∶1 000(体积比)加入二抗及三抗,洗膜同前,Boehringer mannheim 发光试剂盒,压片,照相,Bio-Rad Molecular Analysis图像分析仪测灰度值进行分析。
1.3 统计学处理
采用SPSS软件包进行统计分析,实验结果以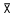 ±s表示,用ANOVA及LSD进行比较。
±s表示,用ANOVA及LSD进行比较。
, http://www.100md.com
2 结果
卵泡膜细胞培养48 h,使细胞充分贴壁后分别分为FSH+LH组及FSH+LH+INS组,加药后无血清继续培养48 h,然后对玻璃片上的单层卵泡膜细胞进行细胞免疫组化,看到黄色颗粒在细胞膜及细胞浆[3]。FSH+ LH处理的细胞为梭形,膜浆淡黄色着色,阳性细胞数少,而FSH+LH+INS处理的细胞 变圆变短,膜浆深黄色着色,阳性细胞数多,每次实验设置平行孔3个,实验重复10次,经图像分析处理,FSH+LH组的平均光密度值为0.287±0.009,FSH+LH+INS组的平均光密度值为0.353±0.013,统计学分析FSH+LH+INS组与FSH+LH组相比,LH/hCG 受体表达明显增强,P<0.01(图1)。
卵泡膜细胞培养48 h使充分贴壁后分别分为FSH+ LH组及FSH+LH+INS组加药,然后无血清培养48 h,提取细胞蛋白,进行SDS-PAGE 电泳,转膜,杂交。结果显示FSH+LH+INS组,LH/hCG 受体蛋白分别在6×103,5×103,3.5×103出现条带,而FSH+LH组仅在6×103处出现条带,实验重复6次,两组平均光密度值分别2237±395,6598±388,两组比较有显著统计学意义,P<0.01(图2)。
, http://www.100md.com
图2 卵泡膜细胞不同处理组作用48 h后
LH/hCG受体蛋白免疫印迹结果
Figure 2 Western immunoblotting for LH/hCG receptors expression
3 讨论
从本研究可以看出:当卵泡膜细胞处于类似PCOS 的LH/FSH 比值倒置的环境(本实验的比值为2)中时,FSH+LH+INS组与FSH+ LH组相比,加用INS组不仅会增强LH/hCG 受体的表达,而且除在6×103处LH/HCG 受体表达增强外,还在5×103,3.5×103处有明显的蛋白表达。推测后两个蛋白可能是INS作用于卵泡膜细胞后产生的同工蛋白。Lin等[3]在研究子宫内膜癌时发现,正常子宫内膜也同时表达6×103、5×103、3.5×103,而子宫内膜癌患者则在此基础上还表达8×103。LH/hCG 受体是具有多个同工蛋白的复杂受体,主要表达在卵巢的卵泡膜细胞、颗粒细胞、间质细胞及黄体细胞,在整个生殖生理过程中起着十分重要的作用。
, 百拇医药
有研究表明LH 的作用可能受到许多诸如旁分泌及自分泌生长因子的调节[4],其生物学效应由其自身的量及其受体的数量来决定。有学者认为PCOS体内的高INS可能促进垂体LH分泌脉冲幅度增大,上述二者的观点认为INS是通过影响性腺轴中卵巢的上位垂体来增强LH的生物学效应的。而Willis等[5]的研究认为INS可以增强PCOS卵巢颗粒细胞对LH的反应使雌激素及孕酮的合成增加,但它对LH/hCG受体表达的研究报道很少。本实验结果说明,INS作为一种内分泌生长调节因子,可能是通过增强卵泡膜细胞LH/hCG受体表达来增强其对垂体分泌的LH 的敏感性的,而且由于PCOS患者体内高胰岛素血症不是其仅有的激素异常,当与其体内的高LH血症及异常的LH/FSH 比值协同作用时,影响着卵泡膜细胞LH/hCG受体的表达。
此外,一些研究表明小鼠的LH/hCG受体持续存在于卵泡膜细胞,当排卵时LH峰值的出现会使LH/hCG受体消失,当黄体形成后LH/hCG受体又出现[6],表明在整个月经(发情)周期中LH/hCG受体表达是有一定规律的。本文研究表明INS可以增强猪卵泡膜细胞LH/hCG 受体表达,提示合并高INS血症的PCOS 患者卵泡发育停滞的原因,可能是由于体内异常的INS影响了卵泡膜细胞 LH/hCG受体的表达,而使其失去了在正常月经周期中LH/hCG受体表达的规律性,进而影响卵泡膜细胞及卵巢的正常功能所致。
, 百拇医药
本文的研究结果将为揭示PCOS卵泡发育停滞的发病机制奠定实验基础。
参考文献
1,曹泽毅主编.中华妇产科学[M].北京:人民卫生出版社,1999.2181-2185
2,Magoffin DA,Erickson GF.An improved methods for primary culture of ovarian androgen-producing cells in serum-free medium:effect of lipoprotein,insulin and insulin-like growth factor-I[J].In Vitro Cell Dev Biol Anim,1988,24:862-870
3,Lin J,Lei Z H,Lojun S,et al.Increased expression of luteinizing hormone/human chorionic gonadotropin receptor gene in human endometrial carcinomas[J].J Clin Endocrinol Metab,1994,79(5):1483-1491
, 百拇医药
4,Saez JM.Leydig cells:endocrine paracrine regulation[J].Endocr Rev,1994,15:574-626
5,Willis D,Mason H,Gilling-Smith C,et al.Moleculation by insulin of follicle-stimulating hormone and luteinizing hormone actions in human granulosa cells of normal and polycystic ovaries[J].J Clin Endocrinol Metab,1996,81(1):302-309
6,Whitelaw PF,Smyth CD,Howles CM,et al.Cell-specific expression of aromatase and LH receptor mRNAs in rat ovary[J].J Mol Endocrinol,1992,9:309-312
收稿日期:2000-06-28, http://www.100md.com
单位:北京大学第一医院妇产科,北京 100034
关键词:促性腺激素类;绒毛膜;代谢;胰岛素;药理学;受体;LH;代谢;泡膜细胞;药物作用
北京医科大学学报000609 [摘 要]目的:研究胰岛素对猪卵巢卵泡膜细胞黄体生成素/人绒毛膜促性腺激素(luteinizing hormone/human chorionic gonadotropin ,LH /hCG)受体表达的影响。方法:采用细胞免疫组化及Western blot 法分别检测LH /hCG受体的蛋白表达水平。
结果:细胞免疫组化结果显示促卵泡激素(follicle-stimulating hormone,FSH)+黄体生成素(luteinizing hormone,LH)处理的细胞淡黄色着色且阳性细胞数少;而FSH+LH+胰岛素(insulin,INS)处理的细胞为深黄色着色,阳性细胞数多,FSH+LH+INS组光密度(0.353±0.013)与FSH+LH组(0.287±0.009)相比LH/hCG 受体表达明显增强,差异有显著性,P<0.01。Western blot结果显示FSH+LH+INS组(6598±388)LH/hCG 受体蛋白分别在6×103、5×103、3.5×103出现条带,而FSH+LH组(2237±395)仅在6×103处出现条带,两组比较,差异有显著性,P<0.01。结论:胰岛素可以增强卵泡膜细胞LH /hCG 受体的表达,这可能是PCOS合并高胰岛素血症患者卵泡发育停滞的原因之一。
, http://www.100md.com
[中图分类号]R977.15 [文献标识码]A
[文章编号]1000-1530(2000)06-0512-03
Effect of insulin on the expression of luteinizing hormone-human chorionic gonadotropin receptor in cultured porcine theca cells
WU Xiu-Feng,ZHENG Shu-Rong,FAN Zheng-Hong,LI Hong-Zhen
(Department of Gynecology and Obstetrics,Peking University First Hospital,Beijing 100034,China)
, 百拇医药
ABSTRACT Objective:To study the effect of insulin on the expression of luteinizing hormone-human chorionic gonadotropin receptor(LH/hCG receptor) of cultured porcine theca cells and look into the possible mechanism of the arrest of follicular growth in polycystic ovary syndrome(POS).Methods:The primary model of cultured porcine theca cells in vitro was established and the cells were treated differently.The level of LH/hCG receptor in the cells was checked by Western blot and cell immuno-
, 百拇医药
histochemistry methods.Results:The level of LH/hCG receptor in the cells of group FSH+LH+INS(6598±388)(0.353±0.013) was significantly higher than that of group FSH+LH(2237±395)(0.287±0.009),P<0.01 by Western blot and cell immunohistochemistry.The expression of LH/hCG receptor in the cells of group FSH+LH+INS showed 6×103,5×103,3.5×103 while group FSH+LH showed only 6×103.Conclusion:Insulin enhanced the expression of LH/hCG receptor of cultured porcine theca cells.Hyperinsulinemia may enhance the expression of LH/hCG receptor so as to lose the regularing during menstrical period and probably the arrest of follicular growth in patients with PCOS implicated with hyperinsulinemia.
, 百拇医药
KEY WORDS Gonadotropins,chorionic/metab;Insulin/pharmacol;
Receptors,LH/metab;Theca cells/metab
卵泡膜细胞在维持卵泡的完整性及其功能中起着十分重要的作用,并且是正常卵巢来源雄激素的主要生成部位,黄体生成素通过其受体——黄体生成素/人绒毛膜促性腺激素(luteinizing hormone/human chorionic gonadotropin,LH /hCG)作用于卵泡膜细胞,影响着雄激素的合成。约有30%~70%的多囊卵巢综合征(polycystic ovary syndrome,PCOS)患者常常合并高胰岛素血症,并认为它可能在PCOS的高雄激素血症中起作用[1]。卵泡膜细胞LH/hCG受体的数量反映着其对LH的敏感性。关于胰岛素(insulin,INS)是否增强卵泡膜细胞LH/hCG 受体表达的研究报道很少。由于人的卵巢不仅来源有限而且处在同一个发育阶段的卵泡很少,限制了对人卵巢的分子生物学的研究,而猪在解剖及生理方面与人是最相似的,因此我们采用猪卵巢的卵泡膜细胞,在体外建立无血清原代细胞培养模型来研究INS对卵泡膜细胞LH/hCG受体表达的影响。
, http://www.100md.com
1 材料与方法
1.1 材料
本实验所用的猪卵巢由北京清河屠宰厂提供。 LH/hCG 受体抗体由美国Mayor Clinic Patrick Roche博士惠赠 。 Trizol试剂由生命科技公司生产,免疫组化试剂盒(Sp kit)及Western blot所用二抗购自中山公司(美国ZYMED公司生产)。硝酸纤维膜购自天象人(Whatman公司)。
1.2 方法
猪卵泡膜细胞(theca cell,TC)原代培养:按Magoffi等[2]的方法进行,即将取回的卵巢清洗数遍,在超净台选取直径约6mm的健康卵泡(卵泡液为草黄色),在盛有培养液的平皿中,半剖开卵泡,剥离出卵泡内膜(呈帽状),刮除附着在其表面的颗粒细胞并反复洗数次,用2.5 g*L-1胶原酶及0.5 g*L-1透明质酸酶及0.5 g*L-1蛋白酶37 ℃摇床孵育,每10 min吹打一次,共孵育50 min后终止消化,洗涤离心除去酶进行细胞计数及台盼蓝活细胞计数(98%以上)。按每毫升105个细胞接种于24孔培养板(内置1 cm×1 cm大小的干净玻璃片,为细胞免疫组化用)及25 ml培养瓶,用含10%(体积分数)胎牛血请(fetal calf serum,FCS),0.2 mol*L-1谷氨酰胺,链霉素100 g*L-1,青霉素100 IU*ml-1的培养液37 ℃,5%(体积分数)CO2培养48 h,使细胞充分贴壁,然后弃去培养液,更换为无血清培养液,并分为促卵泡激素(follicle-stimulating hormone,FSH)+LH和FSH+LH+INS两组加药,作用48 h(为最适反应时间)后停止反应,提取细胞蛋白。其中各药终(质量)浓度分别为FSH 25 μg*L-1,LH 50 μg*L-1,INS 25 μg*L-1(正常的INS质量浓度<10 μg*L-1)。培养板中爬满单层卵泡膜细胞的玻璃片采用95%(体积分数)的无水乙醇,1%(体积分数)的醋酸及少许氯仿固定10 min,磷酸盐缓冲溶液(phosphate buffered solution,PBS)洗涤后,-20 ℃保存备用;培养瓶中培养的细胞用于提取蛋白。
, http://www.100md.com
细胞免疫组化:将固定处理的含单层细胞的玻璃片,3%(体积分数)过氧化氢及10%(体积分数)羊血清封闭,1∶850(体积比)一抗37 ℃ 1 h,PBST[0.01 mol*L-1PBS+0.5%(体积分数)Triton X-100]洗涤,二抗及三抗采用链酶菌抗生物素蛋白-过氧化物酶试剂盒中的二抗及三抗各37 ℃ 30 min,DAB显色5 min,镜下观察,用德国LEICA Q550IW型图像分析仪测灰度值进行分析。
卵泡膜细胞蛋白的提取:此实验所提取的蛋白是采用美国Life Technology公司Trizol RNA一步提取法提取RNA后的有机相提取的。裂解细胞,氯仿抽提,水相用于提取RNA,异丙醇沉淀,75%(体积分数)乙醇洗涤RNA,干燥,DEPC水溶解(用于RT-PCR)。水相下面的有机相用于提取蛋白:0.3 ml无水乙醇,4000×g,离心5 min,取上清加入异丙醇,离心弃上清,0.3 mol*L-1盐酸胍反复处理3次,加入无水乙醇常温静置20 min,离心弃上清干燥,加入10 g*L-1 SDS 50 μl,50 ℃孵育数分钟,离心留取上清,-20 ℃保存备用(Western blot用)。
, 百拇医药
蛋白免疫印迹:将提取到的蛋白定量每孔上样0.5 μg,加β-巯基乙醇4 μl煮沸变性3 min,用5%(体积分数)浓缩胶100 V及10%(体积分数)分离胶150 V电泳约4 h,然后用Bio-Rad湿式电转仪将蛋白转至硝酸纤维膜(80 V, 5 h),用50 g*L-1丽春红染膜检测蛋白转膜情况,50 g*L-1脱脂奶粉封闭过夜,PBST [0.01 mol*L-1PBS +0.1%(体积分数)Tween-20]10 min洗3次,一抗1∶1 000(体积比),RT全方位摇床置1 h,PBST 10 min洗3次,依次1∶1 000(体积比)加入二抗及三抗,洗膜同前,Boehringer mannheim 发光试剂盒,压片,照相,Bio-Rad Molecular Analysis图像分析仪测灰度值进行分析。
1.3 统计学处理
采用SPSS软件包进行统计分析,实验结果以
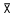 ±s表示,用ANOVA及LSD进行比较。
±s表示,用ANOVA及LSD进行比较。, http://www.100md.com
2 结果
卵泡膜细胞培养48 h,使细胞充分贴壁后分别分为FSH+LH组及FSH+LH+INS组,加药后无血清继续培养48 h,然后对玻璃片上的单层卵泡膜细胞进行细胞免疫组化,看到黄色颗粒在细胞膜及细胞浆[3]。FSH+ LH处理的细胞为梭形,膜浆淡黄色着色,阳性细胞数少,而FSH+LH+INS处理的细胞 变圆变短,膜浆深黄色着色,阳性细胞数多,每次实验设置平行孔3个,实验重复10次,经图像分析处理,FSH+LH组的平均光密度值为0.287±0.009,FSH+LH+INS组的平均光密度值为0.353±0.013,统计学分析FSH+LH+INS组与FSH+LH组相比,LH/hCG 受体表达明显增强,P<0.01(图1)。
卵泡膜细胞培养48 h使充分贴壁后分别分为FSH+ LH组及FSH+LH+INS组加药,然后无血清培养48 h,提取细胞蛋白,进行SDS-PAGE 电泳,转膜,杂交。结果显示FSH+LH+INS组,LH/hCG 受体蛋白分别在6×103,5×103,3.5×103出现条带,而FSH+LH组仅在6×103处出现条带,实验重复6次,两组平均光密度值分别2237±395,6598±388,两组比较有显著统计学意义,P<0.01(图2)。

, http://www.100md.com
图2 卵泡膜细胞不同处理组作用48 h后
LH/hCG受体蛋白免疫印迹结果
Figure 2 Western immunoblotting for LH/hCG receptors expression
3 讨论
从本研究可以看出:当卵泡膜细胞处于类似PCOS 的LH/FSH 比值倒置的环境(本实验的比值为2)中时,FSH+LH+INS组与FSH+ LH组相比,加用INS组不仅会增强LH/hCG 受体的表达,而且除在6×103处LH/HCG 受体表达增强外,还在5×103,3.5×103处有明显的蛋白表达。推测后两个蛋白可能是INS作用于卵泡膜细胞后产生的同工蛋白。Lin等[3]在研究子宫内膜癌时发现,正常子宫内膜也同时表达6×103、5×103、3.5×103,而子宫内膜癌患者则在此基础上还表达8×103。LH/hCG 受体是具有多个同工蛋白的复杂受体,主要表达在卵巢的卵泡膜细胞、颗粒细胞、间质细胞及黄体细胞,在整个生殖生理过程中起着十分重要的作用。
, 百拇医药
有研究表明LH 的作用可能受到许多诸如旁分泌及自分泌生长因子的调节[4],其生物学效应由其自身的量及其受体的数量来决定。有学者认为PCOS体内的高INS可能促进垂体LH分泌脉冲幅度增大,上述二者的观点认为INS是通过影响性腺轴中卵巢的上位垂体来增强LH的生物学效应的。而Willis等[5]的研究认为INS可以增强PCOS卵巢颗粒细胞对LH的反应使雌激素及孕酮的合成增加,但它对LH/hCG受体表达的研究报道很少。本实验结果说明,INS作为一种内分泌生长调节因子,可能是通过增强卵泡膜细胞LH/hCG受体表达来增强其对垂体分泌的LH 的敏感性的,而且由于PCOS患者体内高胰岛素血症不是其仅有的激素异常,当与其体内的高LH血症及异常的LH/FSH 比值协同作用时,影响着卵泡膜细胞LH/hCG受体的表达。
此外,一些研究表明小鼠的LH/hCG受体持续存在于卵泡膜细胞,当排卵时LH峰值的出现会使LH/hCG受体消失,当黄体形成后LH/hCG受体又出现[6],表明在整个月经(发情)周期中LH/hCG受体表达是有一定规律的。本文研究表明INS可以增强猪卵泡膜细胞LH/hCG 受体表达,提示合并高INS血症的PCOS 患者卵泡发育停滞的原因,可能是由于体内异常的INS影响了卵泡膜细胞 LH/hCG受体的表达,而使其失去了在正常月经周期中LH/hCG受体表达的规律性,进而影响卵泡膜细胞及卵巢的正常功能所致。
, 百拇医药
本文的研究结果将为揭示PCOS卵泡发育停滞的发病机制奠定实验基础。
参考文献
1,曹泽毅主编.中华妇产科学[M].北京:人民卫生出版社,1999.2181-2185
2,Magoffin DA,Erickson GF.An improved methods for primary culture of ovarian androgen-producing cells in serum-free medium:effect of lipoprotein,insulin and insulin-like growth factor-I[J].In Vitro Cell Dev Biol Anim,1988,24:862-870
3,Lin J,Lei Z H,Lojun S,et al.Increased expression of luteinizing hormone/human chorionic gonadotropin receptor gene in human endometrial carcinomas[J].J Clin Endocrinol Metab,1994,79(5):1483-1491
, 百拇医药
4,Saez JM.Leydig cells:endocrine paracrine regulation[J].Endocr Rev,1994,15:574-626
5,Willis D,Mason H,Gilling-Smith C,et al.Moleculation by insulin of follicle-stimulating hormone and luteinizing hormone actions in human granulosa cells of normal and polycystic ovaries[J].J Clin Endocrinol Metab,1996,81(1):302-309
6,Whitelaw PF,Smyth CD,Howles CM,et al.Cell-specific expression of aromatase and LH receptor mRNAs in rat ovary[J].J Mol Endocrinol,1992,9:309-312
收稿日期:2000-06-28, http://www.100md.com