克劳斯法测定纤维蛋白原及其影响因素
作者:程烽 王丹 朱晓辉 徐元斌 陈敏 朱忠勇
单位:南京军区福州总医院全军医学检验中心 福州 ,350025
关键词:纤维蛋白原;凝血酶;血浆
中华检验医学杂志000608 【摘要】 目的 探讨克劳斯法的影响因素,以推荐在我国临床实验室应用克劳斯法测定纤维蛋白原。方法 分别采用进口试剂盒和国产试剂,建立各自的纤维蛋白原标准曲线,并通过对标准品的测定进行比较,探讨缓冲液pH、凝血酶浓度和测定温度对测定结果的影响。结果 应用国产试剂,建立的克劳斯法,重复性良好,日内CV=0.039 1,日间CV=0.049 7。对标准品分别用进口试剂盒和国产试剂进行测定,相对误差分别为+3.17%、+4.76%和-6.03%。对1份冻干血浆测定,两者结果相近。结论 完全可用国产试剂代替价格昂贵的进口试剂盒,有利于克劳斯法在国内的推广应用。
, 百拇医药 The von Clauss method for fibrinogen assay and its influential factors
CHENG Feng WANG Dan ZHU Xiaohui
(Center for Medical Laboratory, Fuzhou General Hospital, Fuzhou 350025, China)
【Abstract】 Objectives To study the influential factors of the von Clauss method and to promote the method for fibrinogen assay in clinical laboratories in China. Methods Kits of foreign and domestic products were used. Calibration curves for fibrinogen determination were established, and calibration plasma was used for comparison. Effects of pH value, thrombin activity, and temperature on the measurement were studied.ResultsThe reproducibility of the von Clauss method using domestic thrombin and related reagents was excellent, the within-day CV being 0.039 1, and the between-day CV 0.049 7. The percentage variations of calibration plasma determination, with the foreign fibrinogen assay kits using domestic reagents, were +3.17% , +4.76%, and -6.03%, respectively. Determination of a lyophilized plasma using the two sources reagents showed similar results.Conclusions Thrombin and relevant reagents produced in China could be used as a substitute for kits purchased abroad, which would promote the use of von Clauss method in clinical laboratories of China.
, 百拇医药
【Key words】 Fibrinogen;Thrombin;Plasma
冯*克劳斯法( von Clauss法)是美国国家临床检验标准委员会(NCCLS)推荐的纤维蛋白原(Fib)常规测定方法[1]。该法在国外已广泛应用,在我国目前只有少数实验室采用,大部分单位仍采用盐析法、热浊度法和加钙(或凝血酶)形成纤维蛋白原后的双缩脲比色法。究其原因,主要是克劳斯法中所用的主要试剂为高质量的凝血酶和纤维蛋白原标准品,国内尚未能大量供应。为了在我国尽快推广准确、快捷和实用的克劳斯法,并与国际接轨,我们对该法进行了系统的实验观察,并试图全部用国产试剂进行测定。
材料与方法
一、材料
1.试剂:(1)Stago 公司的Fibri-Prest试剂盒;(2)国产凝血酶(100 IU/ml):由本中心自行提取纯化和湖北省某公司生产的供外用的凝血酶;(3)咪唑 (imidazole) 缓冲液:咪唑3.4 g,氯化钠5.85 g,加入约500 ml水中,再加入0.1 mol/L盐酸186 ml,调至pH 7.3~7.4,最后加蒸溜水至1L[2] 。
, 百拇医药
2.血浆:(1)Fib标准冻干标准品:由Stago公司提供(Cat. No.00625);(2)自制冻干血浆:由本中心提供。
二、克劳斯法操作方法
方法一:采用Stago 公司的Fibri-Prest试剂盒(Cat. No. 00608),操作严格按说明书进行。
方法二:由于进口试剂盒价格昂贵,不利于克劳斯法在国内的推广。我们采用国产凝血酶和以进口Fib标准品校准的自制血浆标准品进行克劳斯法测定。
1.用咪唑缓冲液按1∶10稀释血浆。
2.将测定管放置37 ℃,加入测定样品(标准或稀释好的血浆)0.2 ml,37 ℃温育2 min,再加入已预温的0.2 ml凝血酶,立即启动秒表。
, 百拇医药 3.约6 s后,用一带钩的小棒于试管中间有规律地上下挑动(每0.5~1 s挑动1次),直到纤维丝出现,记录凝固时间(s)。重复测定两次(两次结果相差应小于1 s),取其平均值。
3.若凝固时间在8~25 s之间,可从标准曲线直接查出相应的Fib值。若Fib含量过高,凝固时间少于8 s ,则按1∶20或1∶30稀释血浆,重新测定,结果乘以2或3。若Fib浓度过低,凝固时间大于25 s,则按1∶5或1∶2稀释血浆,结果除以2或5。
三、标准曲线的制作
1.采用Stago公司的Fibri-Prest试剂盒制作标准曲线:(1)将Stago公司的冻干标准血浆(Cat.No.00625,Fib值为3.15 g/L,该产品说明书说明是按暂用的国际标准品89/644定值)用1ml蒸馏水溶解,30 min后,分别取8、12、16、20、24、28、32 μl,加入相应体积的缓冲液,使稀释血浆总体积为200 μl。(2) 按Fibri-Prest试剂盒说明书操作,记录各管凝固时间。(3)以凝固时间为横坐标,对应的Fib浓度(g/L)为纵坐标,制作标准曲线。实际应用时,可将凝固时间与Fib含量列成对照表,使用更为方便。
, 百拇医药
2.国产试剂的标准曲线制作:以Stago公司的冻干Fib标准品(Cat.No.00625)作标准,或用该公司标准品,校准自制的新鲜和冻干血浆作为标准品,用国产凝血酶和自配的咪唑缓冲液,按方法二进行Fib测定,并制作标准曲线。
结果
一、标准曲线
1.以 Stago公司提供的标准品及Fibri-Prest试剂盒,建立凝固时间(s)与Fib含量的标准曲线及其双对数标准曲线1(图1)。
2.以Stago公司的冻干标准品为标准血浆,用国产凝血酶和自配的咪唑缓冲液,按方法二进行Fib测定,并制作标准曲线2(图2)。
3.以自制冻干标准品(标准曲线1定值,Fib=2.40 g/L),用国产凝血酶和自配的咪唑缓冲液,按方法二进行Fib测定,并制作标准曲线3(图3)。
, 百拇医药
二、 重复性实验
克劳斯法所用的是经过稀释的血浆,其中纤维蛋白原的含量较凝血酶原时间(PT)测定低10倍左右,故在判断结果时较PT试验困难。为了检验技术操作的重复性,我们分别用原装进口试剂和国产凝血酶测定了日内和日间变异系数(CV),结果见表1。
图1 von Clauss法标准曲线1(Stago公司试剂盒
图2 von Clauss法标准曲线2(Stago公司标准和国产凝血酶试剂)
图3 von Clauss法标准曲线3(自制血浆标准品和凝血酶)
, 百拇医药
由表1可见,本法如按正规操作,重复性尚好。
三、Fibri-Prest试剂盒和国产试剂的比较
1.将Fib定值为3.15 g/L的Stago公司的冻干标准品,分别用Fibri-Prest试剂盒和国产凝血酶进行测定,Fib含量分别为3.25 g/L(标准曲线1)、3.30 g/L(标准曲线2)和2.96 g/L(标准曲线3),相对误差分别为+3.17%、+4.76%和-6.03%。
表1 克劳斯法重复性实验结果(n=20) 项目
进口试剂盒
国产试剂*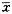 (g/L)
(g/L)
, 百拇医药 s
CV(%)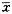 (g/L)
(g/L)
s
CV(%)
日内
2.53
0.093
3.68
2.59
1.014
3.91
日间
, http://www.100md.com
2.60
1.134
4.36
2.70
1.343
4.97
*由标准曲线2得出的结果
2.将自制冻干血浆A 分别用Fibri-Prest试剂盒和国产凝血酶(标准曲线2)进行测定,Fib结果分别为2.40 g/L 和2.38 g/L,两者结果相近。
以上实验结果表明,完全可用国产凝血酶及配套试剂代替价格昂贵的进口试剂盒,有利于克劳斯法在国内的推广应用。
, 百拇医药
四、克劳斯法的影响因素
1.缓冲液pH对凝固时间的影响:将正常参比血浆用5种不同pH的缓冲液,进行克劳斯法测定,记录凝固时间。对每一种缓冲液,取6次测定平均值。结果表明,当pH在7.2~7.4 之间时,对凝固时间影响很小;而当pH<7时,凝固时间明显延长,对测定结果影响很大。如pH7.24,其凝固时间为14.4 s,而在pH6.2 时,凝固时间长达42 s。由此可见,克劳斯法测定,对pH有较严格要求。一般缓冲液pH应在7.2~7.4之间。
2.凝血酶来源和浓度对凝固时间的影响:相同浓度的进口凝血酶与两种国产凝血酶进行比较,结果完全一致。另取正常参比血浆,分别用50、100、150、200和250单位(IU/ml)的凝血酶,进行克劳斯法测定,记录时间。对每一种浓度,均进行6次测定,取平均数,绘制凝血酶浓度对凝固时间的曲线图(图4)。从图4可见,随着凝血酶浓度的增加 ,凝固时间缩短。但凝血酶在100~200单位时,曲线相对较平坦;如低于100单位,凝固时间明显延长。故在实际工作中,采用100单位的凝血酶,使Fib在正常范围的血浆凝固时间在8~25 s,结果易于判断。
, 百拇医药
3.测定温度对凝固时间的影响:分别在35℃、37℃、39℃和42℃ 进行测定,结果表明,在短暂的测定时间内,上述范围内的温度对凝固时间的影响不明显。据报道,凝血酶溶解后,其稳定性37℃为4 h、20℃为8 h、28℃为24 h,-20℃为1个月。随着温度的降低,酶的稳定期延长。考虑到工作便利,采用实验室常用的37℃水浴温度为宜。至于冻干凝血酶试剂溶解后(贮于塑料试管中)的允许保存时间,在4℃冰箱中,最好不超过24 h。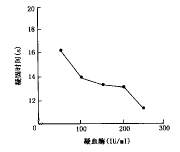
图4 凝血酶的活性对凝固时间的影响
讨论
文献中查到和临床实验室使用过的Fib检测方法达数10种,按其原理大致可分为三类:理化方法(热/盐沉淀法)、可凝固蛋白法和免疫学方法。 热/盐沉淀法,在我国应用最广,此类方法特异性不高,血浆中其他蛋白影响其测定,所得结果往往偏高。可凝固蛋白法能反映Fib的凝血功能,属于功能测定,有Jocobsson法[为WHO和英国国家生物标准及控制研究所(NIBSC)推荐的参考方法]、PT-衍生法(简称PT-der法,即应用血凝仪,由凝血酶原时间直接推算Fib含量)和克劳斯法几种。Jocobsson法结果相对准确,但此法比较繁琐和费时,仅适用于建立参考方法时使用[3]。PT-der法精确度较高,但对其准确度仍有争议[4]。免疫学方法如免疫浊度法多采用Fib多克隆抗体与Fib起免疫反应。此法特异性不强。因为这些方法所针对的抗原决定簇也存在于纤维蛋白单体、纤维蛋白(原)降解产物(FDPs)和异常Fib中。免疫学方法最大的用处是用于鉴别诊断异常纤维蛋白原血症,由于异常Fib与正常Fib往往具有相似的抗原决定簇,异常纤维蛋白原血症用功能法测定时,结果往往明显偏低,而用免疫法测定,结果可能正常甚至升高[5]。
, http://www.100md.com
克劳斯法是最常用的可凝固法,其原理是将足量的凝血酶加到稀释血浆中,记录出现纤维蛋白(凝固)的时间,该时间与纤维蛋白原含量呈负相关。该法快速、简便,与Jocobsson法相比,相关性良好。目前欧美国家绝大部分采用这种方法,并已由厂家开发出配套的试剂盒(kit)。但Fib的异质性、FDPs,以及存在肝素等抗凝物时均影响测定结果。克劳斯法比较简单,易于掌握,但也应该注意以下事项:(1)用0.109 mol/L 枸橼酸钠溶液按1:9比例抗凝全血,两者的比例要准确;(2)血浆必需是乏血小板血浆,即以2 500 r/min常温离心15 min,除去血小板。否则,血小板中的凝血因子将影响测定结果;(3)用缓冲液稀释血浆时要准确。Fib在正常范围时,稀释倍数为1∶10; Fib在异常范围时,可适当增加或减少稀释倍数,使凝固时间落在8~25 s之间;(4)测定终点观察要准确,手工操作时,操作者要事先加以训练;(5)凝血酶活性不足或消失,凝固时间将延长。此外应注意,凝血酶应贮藏于聚乙烯管中,玻璃管对凝血酶有吸附作用;(6 )各个实验室要建立自己的标准曲线,并定时检查,当条件改变时,应重新绘制。
, http://www.100md.com
克劳斯法测定,除凝血酶外,Fib的标准品也是一个关键。目前国内外的Fib标准品的定值十分混乱,相互之间有的可相差1倍,严重影响了Fib测定结果的准确性。1992年,NIBSC组织9个国家的22个实验室协作,研究完成了一个Fib标准品,编号为89/644。目前虽然还未正式公布89/644为国际标准品,但事实上,最近几年国外发表的文章和厂商生产的试剂已将其作为共同的标准使用,但在我国至今尚未引进。为了与国际接轨,国内急需引进国际标准品以标定本国的次级标准品。我们用自制冻干正常人混合血浆,以Stago公司的标准品为标准,经多次测定校准,结果与原试剂盒测定结果基本一致。
参考文献
1,National Committee for Clinical Laboratory Standards. H30-A Procedure for the determination of fibrinogen in plasma; Approved Guideline. Pennsylvania: NCCLS,1999. 99.
, http://www.100md.com
2,Hall R, Malia RG. Measurement of plasma fibrinogen .In: Hall R, Malia RG, eds. Medical Laboratory Haematology. London: Butterworth & co(publisher) Ltd,1984.594-597.
3,Gaffney PJ, Wong MY. Collaborative study of a proposed international standard for plasma fibrinogen measurement. Thromb Haemost,1992, 68:428-432.
4,Lawrie AS, McDonald SJ, Purdy G, et al. Prothrombin time derived fibrinogen determination on Sysmex CA-6000TM. J Clin Pathol,1998, 51:462-466.
5,Gralnick HR. Congenital abnormalities of fibrinogen. Williams WJ, Beutler E, Erslev AJ, eds. Hematology. 4tht ed. New York: Mcgrawhill, inc. 1990. 1474-1486.
(收稿日期:2000-02-18), http://www.100md.com
单位:南京军区福州总医院全军医学检验中心 福州 ,350025
关键词:纤维蛋白原;凝血酶;血浆
中华检验医学杂志000608 【摘要】 目的 探讨克劳斯法的影响因素,以推荐在我国临床实验室应用克劳斯法测定纤维蛋白原。方法 分别采用进口试剂盒和国产试剂,建立各自的纤维蛋白原标准曲线,并通过对标准品的测定进行比较,探讨缓冲液pH、凝血酶浓度和测定温度对测定结果的影响。结果 应用国产试剂,建立的克劳斯法,重复性良好,日内CV=0.039 1,日间CV=0.049 7。对标准品分别用进口试剂盒和国产试剂进行测定,相对误差分别为+3.17%、+4.76%和-6.03%。对1份冻干血浆测定,两者结果相近。结论 完全可用国产试剂代替价格昂贵的进口试剂盒,有利于克劳斯法在国内的推广应用。
, 百拇医药 The von Clauss method for fibrinogen assay and its influential factors
CHENG Feng WANG Dan ZHU Xiaohui
(Center for Medical Laboratory, Fuzhou General Hospital, Fuzhou 350025, China)
【Abstract】 Objectives To study the influential factors of the von Clauss method and to promote the method for fibrinogen assay in clinical laboratories in China. Methods Kits of foreign and domestic products were used. Calibration curves for fibrinogen determination were established, and calibration plasma was used for comparison. Effects of pH value, thrombin activity, and temperature on the measurement were studied.ResultsThe reproducibility of the von Clauss method using domestic thrombin and related reagents was excellent, the within-day CV being 0.039 1, and the between-day CV 0.049 7. The percentage variations of calibration plasma determination, with the foreign fibrinogen assay kits using domestic reagents, were +3.17% , +4.76%, and -6.03%, respectively. Determination of a lyophilized plasma using the two sources reagents showed similar results.Conclusions Thrombin and relevant reagents produced in China could be used as a substitute for kits purchased abroad, which would promote the use of von Clauss method in clinical laboratories of China.
, 百拇医药
【Key words】 Fibrinogen;Thrombin;Plasma
冯*克劳斯法( von Clauss法)是美国国家临床检验标准委员会(NCCLS)推荐的纤维蛋白原(Fib)常规测定方法[1]。该法在国外已广泛应用,在我国目前只有少数实验室采用,大部分单位仍采用盐析法、热浊度法和加钙(或凝血酶)形成纤维蛋白原后的双缩脲比色法。究其原因,主要是克劳斯法中所用的主要试剂为高质量的凝血酶和纤维蛋白原标准品,国内尚未能大量供应。为了在我国尽快推广准确、快捷和实用的克劳斯法,并与国际接轨,我们对该法进行了系统的实验观察,并试图全部用国产试剂进行测定。
材料与方法
一、材料
1.试剂:(1)Stago 公司的Fibri-Prest试剂盒;(2)国产凝血酶(100 IU/ml):由本中心自行提取纯化和湖北省某公司生产的供外用的凝血酶;(3)咪唑 (imidazole) 缓冲液:咪唑3.4 g,氯化钠5.85 g,加入约500 ml水中,再加入0.1 mol/L盐酸186 ml,调至pH 7.3~7.4,最后加蒸溜水至1L[2] 。
, 百拇医药
2.血浆:(1)Fib标准冻干标准品:由Stago公司提供(Cat. No.00625);(2)自制冻干血浆:由本中心提供。
二、克劳斯法操作方法
方法一:采用Stago 公司的Fibri-Prest试剂盒(Cat. No. 00608),操作严格按说明书进行。
方法二:由于进口试剂盒价格昂贵,不利于克劳斯法在国内的推广。我们采用国产凝血酶和以进口Fib标准品校准的自制血浆标准品进行克劳斯法测定。
1.用咪唑缓冲液按1∶10稀释血浆。
2.将测定管放置37 ℃,加入测定样品(标准或稀释好的血浆)0.2 ml,37 ℃温育2 min,再加入已预温的0.2 ml凝血酶,立即启动秒表。
, 百拇医药 3.约6 s后,用一带钩的小棒于试管中间有规律地上下挑动(每0.5~1 s挑动1次),直到纤维丝出现,记录凝固时间(s)。重复测定两次(两次结果相差应小于1 s),取其平均值。
3.若凝固时间在8~25 s之间,可从标准曲线直接查出相应的Fib值。若Fib含量过高,凝固时间少于8 s ,则按1∶20或1∶30稀释血浆,重新测定,结果乘以2或3。若Fib浓度过低,凝固时间大于25 s,则按1∶5或1∶2稀释血浆,结果除以2或5。
三、标准曲线的制作
1.采用Stago公司的Fibri-Prest试剂盒制作标准曲线:(1)将Stago公司的冻干标准血浆(Cat.No.00625,Fib值为3.15 g/L,该产品说明书说明是按暂用的国际标准品89/644定值)用1ml蒸馏水溶解,30 min后,分别取8、12、16、20、24、28、32 μl,加入相应体积的缓冲液,使稀释血浆总体积为200 μl。(2) 按Fibri-Prest试剂盒说明书操作,记录各管凝固时间。(3)以凝固时间为横坐标,对应的Fib浓度(g/L)为纵坐标,制作标准曲线。实际应用时,可将凝固时间与Fib含量列成对照表,使用更为方便。
, 百拇医药
2.国产试剂的标准曲线制作:以Stago公司的冻干Fib标准品(Cat.No.00625)作标准,或用该公司标准品,校准自制的新鲜和冻干血浆作为标准品,用国产凝血酶和自配的咪唑缓冲液,按方法二进行Fib测定,并制作标准曲线。
结果
一、标准曲线
1.以 Stago公司提供的标准品及Fibri-Prest试剂盒,建立凝固时间(s)与Fib含量的标准曲线及其双对数标准曲线1(图1)。
2.以Stago公司的冻干标准品为标准血浆,用国产凝血酶和自配的咪唑缓冲液,按方法二进行Fib测定,并制作标准曲线2(图2)。
3.以自制冻干标准品(标准曲线1定值,Fib=2.40 g/L),用国产凝血酶和自配的咪唑缓冲液,按方法二进行Fib测定,并制作标准曲线3(图3)。
, 百拇医药
二、 重复性实验
克劳斯法所用的是经过稀释的血浆,其中纤维蛋白原的含量较凝血酶原时间(PT)测定低10倍左右,故在判断结果时较PT试验困难。为了检验技术操作的重复性,我们分别用原装进口试剂和国产凝血酶测定了日内和日间变异系数(CV),结果见表1。

图1 von Clauss法标准曲线1(Stago公司试剂盒

图2 von Clauss法标准曲线2(Stago公司标准和国产凝血酶试剂)

图3 von Clauss法标准曲线3(自制血浆标准品和凝血酶)
, 百拇医药
由表1可见,本法如按正规操作,重复性尚好。
三、Fibri-Prest试剂盒和国产试剂的比较
1.将Fib定值为3.15 g/L的Stago公司的冻干标准品,分别用Fibri-Prest试剂盒和国产凝血酶进行测定,Fib含量分别为3.25 g/L(标准曲线1)、3.30 g/L(标准曲线2)和2.96 g/L(标准曲线3),相对误差分别为+3.17%、+4.76%和-6.03%。
表1 克劳斯法重复性实验结果(n=20) 项目
进口试剂盒
国产试剂*
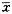 (g/L)
(g/L), 百拇医药 s
CV(%)
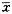 (g/L)
(g/L)s
CV(%)
日内
2.53
0.093
3.68
2.59
1.014
3.91
日间
, http://www.100md.com
2.60
1.134
4.36
2.70
1.343
4.97
*由标准曲线2得出的结果
2.将自制冻干血浆A 分别用Fibri-Prest试剂盒和国产凝血酶(标准曲线2)进行测定,Fib结果分别为2.40 g/L 和2.38 g/L,两者结果相近。
以上实验结果表明,完全可用国产凝血酶及配套试剂代替价格昂贵的进口试剂盒,有利于克劳斯法在国内的推广应用。
, 百拇医药
四、克劳斯法的影响因素
1.缓冲液pH对凝固时间的影响:将正常参比血浆用5种不同pH的缓冲液,进行克劳斯法测定,记录凝固时间。对每一种缓冲液,取6次测定平均值。结果表明,当pH在7.2~7.4 之间时,对凝固时间影响很小;而当pH<7时,凝固时间明显延长,对测定结果影响很大。如pH7.24,其凝固时间为14.4 s,而在pH6.2 时,凝固时间长达42 s。由此可见,克劳斯法测定,对pH有较严格要求。一般缓冲液pH应在7.2~7.4之间。
2.凝血酶来源和浓度对凝固时间的影响:相同浓度的进口凝血酶与两种国产凝血酶进行比较,结果完全一致。另取正常参比血浆,分别用50、100、150、200和250单位(IU/ml)的凝血酶,进行克劳斯法测定,记录时间。对每一种浓度,均进行6次测定,取平均数,绘制凝血酶浓度对凝固时间的曲线图(图4)。从图4可见,随着凝血酶浓度的增加 ,凝固时间缩短。但凝血酶在100~200单位时,曲线相对较平坦;如低于100单位,凝固时间明显延长。故在实际工作中,采用100单位的凝血酶,使Fib在正常范围的血浆凝固时间在8~25 s,结果易于判断。
, 百拇医药
3.测定温度对凝固时间的影响:分别在35℃、37℃、39℃和42℃ 进行测定,结果表明,在短暂的测定时间内,上述范围内的温度对凝固时间的影响不明显。据报道,凝血酶溶解后,其稳定性37℃为4 h、20℃为8 h、28℃为24 h,-20℃为1个月。随着温度的降低,酶的稳定期延长。考虑到工作便利,采用实验室常用的37℃水浴温度为宜。至于冻干凝血酶试剂溶解后(贮于塑料试管中)的允许保存时间,在4℃冰箱中,最好不超过24 h。

图4 凝血酶的活性对凝固时间的影响
讨论
文献中查到和临床实验室使用过的Fib检测方法达数10种,按其原理大致可分为三类:理化方法(热/盐沉淀法)、可凝固蛋白法和免疫学方法。 热/盐沉淀法,在我国应用最广,此类方法特异性不高,血浆中其他蛋白影响其测定,所得结果往往偏高。可凝固蛋白法能反映Fib的凝血功能,属于功能测定,有Jocobsson法[为WHO和英国国家生物标准及控制研究所(NIBSC)推荐的参考方法]、PT-衍生法(简称PT-der法,即应用血凝仪,由凝血酶原时间直接推算Fib含量)和克劳斯法几种。Jocobsson法结果相对准确,但此法比较繁琐和费时,仅适用于建立参考方法时使用[3]。PT-der法精确度较高,但对其准确度仍有争议[4]。免疫学方法如免疫浊度法多采用Fib多克隆抗体与Fib起免疫反应。此法特异性不强。因为这些方法所针对的抗原决定簇也存在于纤维蛋白单体、纤维蛋白(原)降解产物(FDPs)和异常Fib中。免疫学方法最大的用处是用于鉴别诊断异常纤维蛋白原血症,由于异常Fib与正常Fib往往具有相似的抗原决定簇,异常纤维蛋白原血症用功能法测定时,结果往往明显偏低,而用免疫法测定,结果可能正常甚至升高[5]。
, http://www.100md.com
克劳斯法是最常用的可凝固法,其原理是将足量的凝血酶加到稀释血浆中,记录出现纤维蛋白(凝固)的时间,该时间与纤维蛋白原含量呈负相关。该法快速、简便,与Jocobsson法相比,相关性良好。目前欧美国家绝大部分采用这种方法,并已由厂家开发出配套的试剂盒(kit)。但Fib的异质性、FDPs,以及存在肝素等抗凝物时均影响测定结果。克劳斯法比较简单,易于掌握,但也应该注意以下事项:(1)用0.109 mol/L 枸橼酸钠溶液按1:9比例抗凝全血,两者的比例要准确;(2)血浆必需是乏血小板血浆,即以2 500 r/min常温离心15 min,除去血小板。否则,血小板中的凝血因子将影响测定结果;(3)用缓冲液稀释血浆时要准确。Fib在正常范围时,稀释倍数为1∶10; Fib在异常范围时,可适当增加或减少稀释倍数,使凝固时间落在8~25 s之间;(4)测定终点观察要准确,手工操作时,操作者要事先加以训练;(5)凝血酶活性不足或消失,凝固时间将延长。此外应注意,凝血酶应贮藏于聚乙烯管中,玻璃管对凝血酶有吸附作用;(6 )各个实验室要建立自己的标准曲线,并定时检查,当条件改变时,应重新绘制。
, http://www.100md.com
克劳斯法测定,除凝血酶外,Fib的标准品也是一个关键。目前国内外的Fib标准品的定值十分混乱,相互之间有的可相差1倍,严重影响了Fib测定结果的准确性。1992年,NIBSC组织9个国家的22个实验室协作,研究完成了一个Fib标准品,编号为89/644。目前虽然还未正式公布89/644为国际标准品,但事实上,最近几年国外发表的文章和厂商生产的试剂已将其作为共同的标准使用,但在我国至今尚未引进。为了与国际接轨,国内急需引进国际标准品以标定本国的次级标准品。我们用自制冻干正常人混合血浆,以Stago公司的标准品为标准,经多次测定校准,结果与原试剂盒测定结果基本一致。
参考文献
1,National Committee for Clinical Laboratory Standards. H30-A Procedure for the determination of fibrinogen in plasma; Approved Guideline. Pennsylvania: NCCLS,1999. 99.
, http://www.100md.com
2,Hall R, Malia RG. Measurement of plasma fibrinogen .In: Hall R, Malia RG, eds. Medical Laboratory Haematology. London: Butterworth & co(publisher) Ltd,1984.594-597.
3,Gaffney PJ, Wong MY. Collaborative study of a proposed international standard for plasma fibrinogen measurement. Thromb Haemost,1992, 68:428-432.
4,Lawrie AS, McDonald SJ, Purdy G, et al. Prothrombin time derived fibrinogen determination on Sysmex CA-6000TM. J Clin Pathol,1998, 51:462-466.
5,Gralnick HR. Congenital abnormalities of fibrinogen. Williams WJ, Beutler E, Erslev AJ, eds. Hematology. 4tht ed. New York: Mcgrawhill, inc. 1990. 1474-1486.
(收稿日期:2000-02-18), http://www.100md.com