染色体原位杂交技术在组织病理学中的应用
作者:沈丹华 张雅贤
单位:100044 北京医科大学人民医院病理科(沈丹华);香港大学病理学系(张雅贤)
关键词:
已经有大量的研究表明细胞遗传学的改变与肿瘤病理诊断及临床预后有着密切的关系 已经有大量的研究表明细胞遗传学的改变与肿瘤病理诊断及临床预后有着密切的关系。通过流式细胞仪及图像分析仪可以较快速的从新鲜组织或石蜡包埋组织中分析肿瘤的总体DNA含量[1],然而这种方法却不能给予我们有关某条染色体数量及结构变化的信息。常规细胞遗传学应用的核型分析(karyotype)法,使我们能更为精确的了解肿瘤细胞的染色体改变[2]。但这一方法必须使用新鲜组织进行细胞培养,使细胞进入分裂中期,因而也称为中期细胞遗传学(metaphase cytogenetics)。由于它不能进行大量回顾性研究,且费时费力,从而使其在常规组织病理学中的应用受到限制。染色体原位杂交(chromosome in situ hybridization)技术使用染色体特异性的DNA探针,可以检测非分裂期即间期细胞核的染色体的数量及结构异常,因而也称为间期细胞遗传学(interphase cytogenetics)[3]。早期的染色体原位杂交技术采用的多是放射性探针[4]。然而,它的缺点是在检测时需长时间曝光且放射性探针易造成环境的污染。为克服这些不足,近年来多采用非放射性物质标记探针,如荧光素、酶及胶体金等,并且应用不同的免疫细胞化学检测系统还可以同时检测2个、3个或更多的不同染色体的靶DNA[5]。
, 百拇医药
在这篇文章中,我们重点介绍非放射性染色体原位杂交的技术方法及其在病理学中的应用。
一、技术与方法
1.DNA探针的选择与标记:DNA探针识别的高度重复性序列(长度可以在几千个kb)最常见于着丝点和端粒区。它可以用于检测肿瘤及非肿瘤细胞染色体的数量及结构异常。此外还有一些针对染色体长臂或短臂DNA序列的探针。DNA探针常用的标记方法是采用缺口平移或随机引物法将与酶结合的荧光素、生物素、地高辛及BrdU等标记于探针上。
2.固定及杂交前的预处理:染色体原位杂交技术可以用于正常组织和肿瘤的单细胞悬液、石蜡切片及冰冻切片中。对上述材料可采用甲醛固定, 细胞及组织切片置于2% aminopropyltriethoxy-silane (Tespa) 处理的玻片上。为了使DNA探针能更好的渗透和穿透到细胞核内,细胞和组织需采用酶进行消化(常用的有蛋白酶K及胃蛋白酶)以及其他试剂处理(如Triton X 100)。消化处理的时间、温度、以及酶的浓度依据不同的病例及组织而定。
, 百拇医药
3.杂交与清洗:将标记的探针与杂交液按一定比例混合后,加在细胞组织片上,经过一定温度变性后进行杂交。杂交后,应用50%的甲酰胺及枸橼酸盐(SSC)溶液在相应的温度下对组织片进行洗涤,以除去未连接的探针成分。枸橼酸盐溶液的浓度及温度可以依据探针的不同做调整。为去除检测系统中的非特异性交叉反应,可预先使用牛血清白蛋白或动物血清封闭切片。
4.检测染色体原位杂交信号:应用下列方法检测染色体原位杂交信号。(1)间接免疫细胞化学方法使用抗生物素(anti-biotin), 抗地高辛(anti-digoxigenin), 以及第二抗体连接的荧光物质。(2)酶联的间接免疫化学方法:使用过氧化物酶或碱性磷酸酶连接的抗体。(3)直接法:使用连接的抗卵白素或直接与第一抗体连接。(4)卵白素-生物素连接的抗卵白素检测系统。此外可以使用不同的荧光物质确定两个或更多的染色体原位杂交信号。
5.染色体原位杂交信号的评估:
, 百拇医药
评估时注意以下几点:a.重叠的细胞核不予计数。b.信号应该大小一致且容易分辨,相连的一对或裂开的点作为一个点计数。c.非特异性的信号,如太小的信号不能计数。d.如果在一个区域有超过15%~20%的细胞没有染色体原位杂交信号,表明杂交不充分,应重新进行染色体原位杂交。每1例样本中至少计数200个以上细胞核的特异性染色体原位杂交信号的数量。正常组织细胞可以作为2倍体参照值加以计数(图1)。
图1 反应性增生的淋巴组织应用16号染色体DNA特异性探针原位杂交后,多数细胞内可见两个杂交点,原位杂交×200
目前有关染色体原位杂交信号评估的标准尚未统一。较为常用的是以正常细胞为标准,计数分析细胞核中的各种信号的百分值。如果分析细胞核中显示3个或更多的信号点百分值超过正常参照细胞的平均百分值+3个标准差(mean+3s),则可诊断为3体型(trisomy)染色体或非整倍体型(aneusomy)染色体(图2,3); 而如果按上述方法计算,肿瘤细胞核中显示1个信号点的百分值超过正常参照细胞者,则可诊断为单体型(monosomy)染色体[6]。我们的实验中多采用这种方法评估染色体原位杂交信号[4,7]。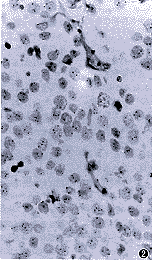
, 百拇医药
图2 卵巢生殖细胞肿瘤,16号染色体的非整倍体型,细胞
内3个以上杂交点 原位杂交×200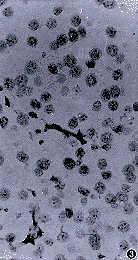
图3 卵巢生殖细胞肿瘤(无性细胞瘤),12号染色体的3体型,多数细胞内有3个杂交点 原位杂交×200
二、染色体原位杂交技术在病理学中的应用潜能
1.在妊娠滋养叶细胞病变诊断中的应用:常规核型分析显示完全性葡萄胎为2倍体核型:46XX或46XY,而部分性葡萄胎多为3体型核型:69XXX,69XXY或69XYY。应用染色体原位杂交技术可以很容易的确定2倍体及3体型细胞,从而区别完全性与不完全性葡萄胎。此外应用染色体原位杂交技术还可区别绒毛水肿与部分性葡萄胎[8]。
, 百拇医药
2.黑色素性病变的鉴别诊断:Spitz痣(又称为幼年性黑色素瘤)有时在临床及组织学上很难与皮肤的恶性黑色素瘤相区别。文献报道应用染色体原位杂交技术确定在恶性黑色素瘤中有1号和17号染色体的变异,而在Spitz痣中未发现这种染色体的变异[9],因而可作为两者的鉴别点。
3.在乳腺癌病变中的应用:已有大量研究表明乳腺癌中常出现复合或单一型的核型改变。最常见的染色体数量上的异常是出现7、8、18和20号染色体的3体型,而非随机性的染色体结构异常包括del(1q)、del(3p)、del(6q)等[10]。具有这些复合染色体改变的乳腺癌患者其预后较差。Devilee等[11]应用染色体原位杂交技术对经流式细胞仪进行分析、其DNA倍体值为2倍体型的7例乳腺癌进行检测,发现了1号和18号染色体数量上的改变。表明染色体原位杂交技术能更为精确地检测出肿瘤染色体的变异。
4.前列腺癌中的染色体变异:前列腺癌中最常见的染色体改变是Y染色体的丢失及7号染色体的3体型[12]。Van Dekken[13]应用染色体原位杂交对前列腺癌进行分析,还发现了10号染色体的单体型。研究还发现Y染色体的丢失与病人的年龄有关,而10号染色体单体型与肿瘤的转移有关。
, 百拇医药
5.子宫内膜间质肉瘤的恶性度与染色体变异的关系:我们曾应用染色体原位杂交技术分析研究了11例子宫内膜间质肉瘤,发现多数低度恶性的间质肉瘤染色体保持正常的2倍体形式,而高度恶性的间质肉瘤常有多条染色体的变异[14]。
6.生殖细胞肿瘤中染色体的变异:已经有大量研究确定在80%以上的睾丸生殖细胞肿瘤中有12号染色体短臂的等臂染色体[isochromosome, i(12p)][15]。我们在对24例卵巢恶性生殖细胞肿瘤的染色体原位杂交分析时,也发现了i(12p)[7]。这一异常染色体的出现对于生殖细胞肿瘤是具有特异性的,因而可以用于确定性腺外及转移中的生殖细胞肿瘤。此外,在生殖细胞肿瘤中另1个较常见的染色体异常是12号染色体长臂的丢失[deletion of 12q, del(12q)][15]。我们还对13例卵巢畸胎瘤发生癌变的病例进行了分析,发现染色体1,11,12及X的非整倍体出现[16]。特别是在一些形态学良性区的细胞中已经出现了染色体的异常。这一发现提示细胞遗传学的改变可能先于形态学的变化。
, 百拇医药
7.胃粘膜相关淋巴瘤中的染色体改变:近年来的细胞遗传学研究显示3号染色体的3体型是粘膜相关淋巴瘤中最常见的染色体异常[17]。应用染色体原位杂交技术,我们对13例胃粘膜相关淋巴瘤进行分析,发现有9例(69%)肿瘤中有3号染色体的3体型(trisomy 3)[4]。而在作为对照的5例慢性胃炎中没有发现这一染色体的改变。因此3号染色体的3体型很有可能成为这一肿瘤的有用的克隆性标记。
8.软组织肿瘤的鉴别:已经发现在小圆细胞肿瘤中,Ewing肉瘤和神经外胚叶肿瘤中有染色体11与12 的移位[translocation t(11,12)]。 此外还发现滑膜肉瘤中有染色体X与18的移位[translocation t(X,18)][18]。这些染色体的异常可以有助于确定软组织肿瘤的来源。
9.1号染色体短臂的丢失[del(1p)]与肿瘤预后的关系:已经确定在染色体1p36区存在着肿瘤抑制基因[19]。染色体1p的丢失与肿瘤的分化,进展及预后有关[15]。研究还发现在儿童神经母细胞瘤中具有N-myc的放大和del(1p),通过检测del(1p),有助于筛选对早期治疗反应较好的病例[20,21]。我们在对卵巢恶性生殖细胞肿瘤的研究中发现:卵黄囊瘤中1p的丢失要较无性细胞瘤更为常见[7]。而卵黄囊瘤是一个恶性度较高的卵巢肿瘤,其转移率及死亡率都要较无性细胞瘤高。
, http://www.100md.com
10.检测Y染色体特异性序列:1例接受肾移植(捐献者为男性)的女性病人在移植肾中发现淋巴瘤,经染色体原位杂交技术检测发现有Y染色体,确定肿瘤来源于捐献者[22]。
总之,染色体原位杂交技术是近10余年开展的新技术。该项技术对仪器设备的要求并不高且操作方法也不复杂,是一种较为快捷及实用的细胞遗传学方法。特别是它可以与组织形态学相结合,在病理学诊断及研究中具有良好的应用前景。当然这项新技术还有待进一步完善和改进。此外,在肿瘤研究中,染色体的改变常常是复杂多样的,细胞遗传学的变化在病理诊断中也只能作为参考,作为病理工作者,我们不能脱离组织形态学。参考文献
1 沈丹华, 阚秀. DNA图像分析的技术标准及其在肿瘤病理诊断中的应用. 中国肿瘤临床, 1996, 23:898-901.
2 Mitelman F, Johansson B, Mandahl N, et al. Clinical significance of cytogenetic findings in solid tumors. Cancer Genet Cytogenet, 1997, 95:1-8.
, 百拇医药
3 Hopman AN, Poddighe P, Moesker O, et al. Interphase cytogenetics: an approach to the detection of genetic aberrations in tumours. In Herringto CS, McGee JO, eds. Diagnostic molecular pathology:a practical approach. Vol.1. London:Oxford University Press, 1992. 141-167.
4 Zhang Y, Cheung ANY, Chan ACL, et al. Detection of trisomy 3 in primary gastric B-cell lymphoma by using chromosome in situ hybridization on paraffin sections. Am J Clin Pathol, 1998,110:347-353.
, http://www.100md.com
5 Raap AK, Hopman AHN, Van der Ploeg M. Hapten labeling of nucleic acid probes for DNA in situ hybridization. In: Bullock GR, Petrusz P eds. Techniques in Immunocytochemistry. Cambridge: Cambridge University Press, 1989,165:186-195.
6 Hopman AH, Ramaekers FC, Raap AK, et al. In situ hybridization as a tool to study numerical chromosome aberrations in solid bladder tumours. Histochemistry, 1988, 89:307-316.
7 Shen DH, Khoo US, Zhang Y, et al. Cytogenetic study of malignant ovarian germ cell tumors by chromosome in situ hybridization. Int J Gynecol Cancer, 1998, 8:222-232.
, 百拇医药
8 Van de Kaa CA, Nelson KAM, Ramaekers FCS , et al. Interphase cytogenetics in paraffin sections of rountinely processed hydatidiform moles and hydropic abortions. J Pathol, 1991, 165:281-287.
9 de Wit PEJ, Kerstens HMJ, Poddighe PJ, et al. DNA in situ hybridization as a diagnostic tool in the discrimination of melanoma and Spitz naevus. J Pathol, 1994, 173:227-233.
10 Heim S, Mitelman F. Tumors of the breast. In Heim S, Mitelman F, eds. Cancer Cytogenetics,2nd ed. New York: John Wiley & Sons,1995. 369-387.
, http://www.100md.com
11 Devilee P, Thierry RF, Kievits T, et al. Detection of chromosome aneuploidy in interphase nuclei from human primary breast tumours using chromosome specific repetitive DNA probes. Cancer Res, 1988, 48:5825-5830.
12 Heim S, Mitelman F. Tumors of the male genital organs. In Heim S, Mitelman F, eds. Cancer Cytogenetics,2nd ed. New York: John Wiley & Sons,1995. 408-421.
13 Van Dekken, Pizzolo JG, Reuter VE, et al. Cytogenetic analysis of human solid tumors by in situ hybridization with a set of 12 chromosome-specific DNA probes. Cytogenet Cell Genet , 1990, 54 : 103-107.
, http://www.100md.com
14 Cheung ANY, Tin VPC, Ngan HYS, et al. Interphase cytogenetic study of endometrial stromal sarcoma by chromosome in situ hybridization. Mod Pathol, 1996, 9:910-918.
15 Rodriguez E, Mathew S, Reuter V, et al. Cytogenetic analysis of 124 prospectively ascertained male germ cell tumors. Cancer Res, 1992, 52:2285-2291.
16 Shen DH, Khoo US, Xue WC, et al. Ovarian mature cystic teratoma with malignant transformation An interphase cytogenetic study. Int J Gynecol Pathol, 1998,17:351-357.
, http://www.100md.com
17 Wotherspoon AC, Finn TM, Isaacson PG. Trisomy 3 in low-grade B-cell of mucosa-associated lymphoid tissue. Blood,1995,85:2000-2004.
18 Dei Tos AP, Dal Cin P. The role of cytogenetics in the calssification of soft tissue tumours. Virchows Arch, 1997, 431: 83-94.
19 Lahti JM, Valentine M, Xaing J, et al. Alterations in the PITSLRE protein kinase gene complex on chromosome 1p36 in childhood neuroblastoma. Nat Genet, 1994, 7:370-375.
, http://www.100md.com
20 Leong PK, Thorner P, Yeger H, et al. Detection MYCN gene amplification and deletions of chromosome 1p in neuroblastoma by in situ hybridization using routine histologic sections. Lab Invest, 1993 ,69:43-50.
21 Caron H, van-Sluis P, de Kraker J, et al. Allelic loss of chromosome 1p as a predictor of unfavorable outcome in patients with neuroblastoma. N Engl J Med, 1996, 334:225-230.
22 Cheung ANY, Chan ACL, Chung LP, et al. Post-transplantation lymphoproliferative disorder of donor origin in a sex-mismatched renal allograft as proven by chromosome in situ hybridization. Mod Pathol,1998, 11:99-102.
(收稿:1998-06-30 修回:1999-01-28), 百拇医药
单位:100044 北京医科大学人民医院病理科(沈丹华);香港大学病理学系(张雅贤)
关键词:
已经有大量的研究表明细胞遗传学的改变与肿瘤病理诊断及临床预后有着密切的关系 已经有大量的研究表明细胞遗传学的改变与肿瘤病理诊断及临床预后有着密切的关系。通过流式细胞仪及图像分析仪可以较快速的从新鲜组织或石蜡包埋组织中分析肿瘤的总体DNA含量[1],然而这种方法却不能给予我们有关某条染色体数量及结构变化的信息。常规细胞遗传学应用的核型分析(karyotype)法,使我们能更为精确的了解肿瘤细胞的染色体改变[2]。但这一方法必须使用新鲜组织进行细胞培养,使细胞进入分裂中期,因而也称为中期细胞遗传学(metaphase cytogenetics)。由于它不能进行大量回顾性研究,且费时费力,从而使其在常规组织病理学中的应用受到限制。染色体原位杂交(chromosome in situ hybridization)技术使用染色体特异性的DNA探针,可以检测非分裂期即间期细胞核的染色体的数量及结构异常,因而也称为间期细胞遗传学(interphase cytogenetics)[3]。早期的染色体原位杂交技术采用的多是放射性探针[4]。然而,它的缺点是在检测时需长时间曝光且放射性探针易造成环境的污染。为克服这些不足,近年来多采用非放射性物质标记探针,如荧光素、酶及胶体金等,并且应用不同的免疫细胞化学检测系统还可以同时检测2个、3个或更多的不同染色体的靶DNA[5]。
, 百拇医药
在这篇文章中,我们重点介绍非放射性染色体原位杂交的技术方法及其在病理学中的应用。
一、技术与方法
1.DNA探针的选择与标记:DNA探针识别的高度重复性序列(长度可以在几千个kb)最常见于着丝点和端粒区。它可以用于检测肿瘤及非肿瘤细胞染色体的数量及结构异常。此外还有一些针对染色体长臂或短臂DNA序列的探针。DNA探针常用的标记方法是采用缺口平移或随机引物法将与酶结合的荧光素、生物素、地高辛及BrdU等标记于探针上。
2.固定及杂交前的预处理:染色体原位杂交技术可以用于正常组织和肿瘤的单细胞悬液、石蜡切片及冰冻切片中。对上述材料可采用甲醛固定, 细胞及组织切片置于2% aminopropyltriethoxy-silane (Tespa) 处理的玻片上。为了使DNA探针能更好的渗透和穿透到细胞核内,细胞和组织需采用酶进行消化(常用的有蛋白酶K及胃蛋白酶)以及其他试剂处理(如Triton X 100)。消化处理的时间、温度、以及酶的浓度依据不同的病例及组织而定。
, 百拇医药
3.杂交与清洗:将标记的探针与杂交液按一定比例混合后,加在细胞组织片上,经过一定温度变性后进行杂交。杂交后,应用50%的甲酰胺及枸橼酸盐(SSC)溶液在相应的温度下对组织片进行洗涤,以除去未连接的探针成分。枸橼酸盐溶液的浓度及温度可以依据探针的不同做调整。为去除检测系统中的非特异性交叉反应,可预先使用牛血清白蛋白或动物血清封闭切片。
4.检测染色体原位杂交信号:应用下列方法检测染色体原位杂交信号。(1)间接免疫细胞化学方法使用抗生物素(anti-biotin), 抗地高辛(anti-digoxigenin), 以及第二抗体连接的荧光物质。(2)酶联的间接免疫化学方法:使用过氧化物酶或碱性磷酸酶连接的抗体。(3)直接法:使用连接的抗卵白素或直接与第一抗体连接。(4)卵白素-生物素连接的抗卵白素检测系统。此外可以使用不同的荧光物质确定两个或更多的染色体原位杂交信号。
5.染色体原位杂交信号的评估:
, 百拇医药
评估时注意以下几点:a.重叠的细胞核不予计数。b.信号应该大小一致且容易分辨,相连的一对或裂开的点作为一个点计数。c.非特异性的信号,如太小的信号不能计数。d.如果在一个区域有超过15%~20%的细胞没有染色体原位杂交信号,表明杂交不充分,应重新进行染色体原位杂交。每1例样本中至少计数200个以上细胞核的特异性染色体原位杂交信号的数量。正常组织细胞可以作为2倍体参照值加以计数(图1)。

图1 反应性增生的淋巴组织应用16号染色体DNA特异性探针原位杂交后,多数细胞内可见两个杂交点,原位杂交×200
目前有关染色体原位杂交信号评估的标准尚未统一。较为常用的是以正常细胞为标准,计数分析细胞核中的各种信号的百分值。如果分析细胞核中显示3个或更多的信号点百分值超过正常参照细胞的平均百分值+3个标准差(mean+3s),则可诊断为3体型(trisomy)染色体或非整倍体型(aneusomy)染色体(图2,3); 而如果按上述方法计算,肿瘤细胞核中显示1个信号点的百分值超过正常参照细胞者,则可诊断为单体型(monosomy)染色体[6]。我们的实验中多采用这种方法评估染色体原位杂交信号[4,7]。

, 百拇医药
图2 卵巢生殖细胞肿瘤,16号染色体的非整倍体型,细胞
内3个以上杂交点 原位杂交×200

图3 卵巢生殖细胞肿瘤(无性细胞瘤),12号染色体的3体型,多数细胞内有3个杂交点 原位杂交×200
二、染色体原位杂交技术在病理学中的应用潜能
1.在妊娠滋养叶细胞病变诊断中的应用:常规核型分析显示完全性葡萄胎为2倍体核型:46XX或46XY,而部分性葡萄胎多为3体型核型:69XXX,69XXY或69XYY。应用染色体原位杂交技术可以很容易的确定2倍体及3体型细胞,从而区别完全性与不完全性葡萄胎。此外应用染色体原位杂交技术还可区别绒毛水肿与部分性葡萄胎[8]。
, 百拇医药
2.黑色素性病变的鉴别诊断:Spitz痣(又称为幼年性黑色素瘤)有时在临床及组织学上很难与皮肤的恶性黑色素瘤相区别。文献报道应用染色体原位杂交技术确定在恶性黑色素瘤中有1号和17号染色体的变异,而在Spitz痣中未发现这种染色体的变异[9],因而可作为两者的鉴别点。
3.在乳腺癌病变中的应用:已有大量研究表明乳腺癌中常出现复合或单一型的核型改变。最常见的染色体数量上的异常是出现7、8、18和20号染色体的3体型,而非随机性的染色体结构异常包括del(1q)、del(3p)、del(6q)等[10]。具有这些复合染色体改变的乳腺癌患者其预后较差。Devilee等[11]应用染色体原位杂交技术对经流式细胞仪进行分析、其DNA倍体值为2倍体型的7例乳腺癌进行检测,发现了1号和18号染色体数量上的改变。表明染色体原位杂交技术能更为精确地检测出肿瘤染色体的变异。
4.前列腺癌中的染色体变异:前列腺癌中最常见的染色体改变是Y染色体的丢失及7号染色体的3体型[12]。Van Dekken[13]应用染色体原位杂交对前列腺癌进行分析,还发现了10号染色体的单体型。研究还发现Y染色体的丢失与病人的年龄有关,而10号染色体单体型与肿瘤的转移有关。
, 百拇医药
5.子宫内膜间质肉瘤的恶性度与染色体变异的关系:我们曾应用染色体原位杂交技术分析研究了11例子宫内膜间质肉瘤,发现多数低度恶性的间质肉瘤染色体保持正常的2倍体形式,而高度恶性的间质肉瘤常有多条染色体的变异[14]。
6.生殖细胞肿瘤中染色体的变异:已经有大量研究确定在80%以上的睾丸生殖细胞肿瘤中有12号染色体短臂的等臂染色体[isochromosome, i(12p)][15]。我们在对24例卵巢恶性生殖细胞肿瘤的染色体原位杂交分析时,也发现了i(12p)[7]。这一异常染色体的出现对于生殖细胞肿瘤是具有特异性的,因而可以用于确定性腺外及转移中的生殖细胞肿瘤。此外,在生殖细胞肿瘤中另1个较常见的染色体异常是12号染色体长臂的丢失[deletion of 12q, del(12q)][15]。我们还对13例卵巢畸胎瘤发生癌变的病例进行了分析,发现染色体1,11,12及X的非整倍体出现[16]。特别是在一些形态学良性区的细胞中已经出现了染色体的异常。这一发现提示细胞遗传学的改变可能先于形态学的变化。
, 百拇医药
7.胃粘膜相关淋巴瘤中的染色体改变:近年来的细胞遗传学研究显示3号染色体的3体型是粘膜相关淋巴瘤中最常见的染色体异常[17]。应用染色体原位杂交技术,我们对13例胃粘膜相关淋巴瘤进行分析,发现有9例(69%)肿瘤中有3号染色体的3体型(trisomy 3)[4]。而在作为对照的5例慢性胃炎中没有发现这一染色体的改变。因此3号染色体的3体型很有可能成为这一肿瘤的有用的克隆性标记。
8.软组织肿瘤的鉴别:已经发现在小圆细胞肿瘤中,Ewing肉瘤和神经外胚叶肿瘤中有染色体11与12 的移位[translocation t(11,12)]。 此外还发现滑膜肉瘤中有染色体X与18的移位[translocation t(X,18)][18]。这些染色体的异常可以有助于确定软组织肿瘤的来源。
9.1号染色体短臂的丢失[del(1p)]与肿瘤预后的关系:已经确定在染色体1p36区存在着肿瘤抑制基因[19]。染色体1p的丢失与肿瘤的分化,进展及预后有关[15]。研究还发现在儿童神经母细胞瘤中具有N-myc的放大和del(1p),通过检测del(1p),有助于筛选对早期治疗反应较好的病例[20,21]。我们在对卵巢恶性生殖细胞肿瘤的研究中发现:卵黄囊瘤中1p的丢失要较无性细胞瘤更为常见[7]。而卵黄囊瘤是一个恶性度较高的卵巢肿瘤,其转移率及死亡率都要较无性细胞瘤高。
, http://www.100md.com
10.检测Y染色体特异性序列:1例接受肾移植(捐献者为男性)的女性病人在移植肾中发现淋巴瘤,经染色体原位杂交技术检测发现有Y染色体,确定肿瘤来源于捐献者[22]。
总之,染色体原位杂交技术是近10余年开展的新技术。该项技术对仪器设备的要求并不高且操作方法也不复杂,是一种较为快捷及实用的细胞遗传学方法。特别是它可以与组织形态学相结合,在病理学诊断及研究中具有良好的应用前景。当然这项新技术还有待进一步完善和改进。此外,在肿瘤研究中,染色体的改变常常是复杂多样的,细胞遗传学的变化在病理诊断中也只能作为参考,作为病理工作者,我们不能脱离组织形态学。参考文献
1 沈丹华, 阚秀. DNA图像分析的技术标准及其在肿瘤病理诊断中的应用. 中国肿瘤临床, 1996, 23:898-901.
2 Mitelman F, Johansson B, Mandahl N, et al. Clinical significance of cytogenetic findings in solid tumors. Cancer Genet Cytogenet, 1997, 95:1-8.
, 百拇医药
3 Hopman AN, Poddighe P, Moesker O, et al. Interphase cytogenetics: an approach to the detection of genetic aberrations in tumours. In Herringto CS, McGee JO, eds. Diagnostic molecular pathology:a practical approach. Vol.1. London:Oxford University Press, 1992. 141-167.
4 Zhang Y, Cheung ANY, Chan ACL, et al. Detection of trisomy 3 in primary gastric B-cell lymphoma by using chromosome in situ hybridization on paraffin sections. Am J Clin Pathol, 1998,110:347-353.
, http://www.100md.com
5 Raap AK, Hopman AHN, Van der Ploeg M. Hapten labeling of nucleic acid probes for DNA in situ hybridization. In: Bullock GR, Petrusz P eds. Techniques in Immunocytochemistry. Cambridge: Cambridge University Press, 1989,165:186-195.
6 Hopman AH, Ramaekers FC, Raap AK, et al. In situ hybridization as a tool to study numerical chromosome aberrations in solid bladder tumours. Histochemistry, 1988, 89:307-316.
7 Shen DH, Khoo US, Zhang Y, et al. Cytogenetic study of malignant ovarian germ cell tumors by chromosome in situ hybridization. Int J Gynecol Cancer, 1998, 8:222-232.
, 百拇医药
8 Van de Kaa CA, Nelson KAM, Ramaekers FCS , et al. Interphase cytogenetics in paraffin sections of rountinely processed hydatidiform moles and hydropic abortions. J Pathol, 1991, 165:281-287.
9 de Wit PEJ, Kerstens HMJ, Poddighe PJ, et al. DNA in situ hybridization as a diagnostic tool in the discrimination of melanoma and Spitz naevus. J Pathol, 1994, 173:227-233.
10 Heim S, Mitelman F. Tumors of the breast. In Heim S, Mitelman F, eds. Cancer Cytogenetics,2nd ed. New York: John Wiley & Sons,1995. 369-387.
, http://www.100md.com
11 Devilee P, Thierry RF, Kievits T, et al. Detection of chromosome aneuploidy in interphase nuclei from human primary breast tumours using chromosome specific repetitive DNA probes. Cancer Res, 1988, 48:5825-5830.
12 Heim S, Mitelman F. Tumors of the male genital organs. In Heim S, Mitelman F, eds. Cancer Cytogenetics,2nd ed. New York: John Wiley & Sons,1995. 408-421.
13 Van Dekken, Pizzolo JG, Reuter VE, et al. Cytogenetic analysis of human solid tumors by in situ hybridization with a set of 12 chromosome-specific DNA probes. Cytogenet Cell Genet , 1990, 54 : 103-107.
, http://www.100md.com
14 Cheung ANY, Tin VPC, Ngan HYS, et al. Interphase cytogenetic study of endometrial stromal sarcoma by chromosome in situ hybridization. Mod Pathol, 1996, 9:910-918.
15 Rodriguez E, Mathew S, Reuter V, et al. Cytogenetic analysis of 124 prospectively ascertained male germ cell tumors. Cancer Res, 1992, 52:2285-2291.
16 Shen DH, Khoo US, Xue WC, et al. Ovarian mature cystic teratoma with malignant transformation An interphase cytogenetic study. Int J Gynecol Pathol, 1998,17:351-357.
, http://www.100md.com
17 Wotherspoon AC, Finn TM, Isaacson PG. Trisomy 3 in low-grade B-cell of mucosa-associated lymphoid tissue. Blood,1995,85:2000-2004.
18 Dei Tos AP, Dal Cin P. The role of cytogenetics in the calssification of soft tissue tumours. Virchows Arch, 1997, 431: 83-94.
19 Lahti JM, Valentine M, Xaing J, et al. Alterations in the PITSLRE protein kinase gene complex on chromosome 1p36 in childhood neuroblastoma. Nat Genet, 1994, 7:370-375.
, http://www.100md.com
20 Leong PK, Thorner P, Yeger H, et al. Detection MYCN gene amplification and deletions of chromosome 1p in neuroblastoma by in situ hybridization using routine histologic sections. Lab Invest, 1993 ,69:43-50.
21 Caron H, van-Sluis P, de Kraker J, et al. Allelic loss of chromosome 1p as a predictor of unfavorable outcome in patients with neuroblastoma. N Engl J Med, 1996, 334:225-230.
22 Cheung ANY, Chan ACL, Chung LP, et al. Post-transplantation lymphoproliferative disorder of donor origin in a sex-mismatched renal allograft as proven by chromosome in situ hybridization. Mod Pathol,1998, 11:99-102.
(收稿:1998-06-30 修回:1999-01-28), 百拇医药