hTRT催化功能区基因克隆及其在肿瘤中的表达
作者:应建明 金燕燕 王衡 侯琳 马长青 张波
单位:100083 北京医科大学病理学系(应建明、侯琳、马长青、张波);浙江省绍兴市人民医院(金燕燕);福建省肿瘤医院放射生物研究室(王衡)
关键词:端粒酶;原位杂交;基因表达
中华病理学杂志/990201 【摘要】 目的 研究端粒酶蛋白hTRT基因在肿瘤中的表达及其意义。方法 用RT-PCR法检测HeLa细胞与PG细胞的hTRT表达水平;将HeLa细胞的hTRT催化功能区克隆,并进行测序比较;应用原位杂交技术对肿瘤组织中的hTRT和hTR(端粒酶RNA组分)基因进行检测。结果 HeLa细胞与PG细胞均有hTRT表达,HeLa细胞hTRT催化功能区cDNA序列与文献报道一致。原位杂交结果显示hTRT与hTR的协同表达率为92.6%(50/54例),hTRT和hTR在恶性肿瘤中的阳性率分别为82.6%(38/46例)87.0%(40/46例),hTRT和hTR在良性肿瘤中均呈阴性。结论 HeLa细胞与PG细胞均有hTRT表达,hTRT的催化功能区具有高度保守性,hTRT与hTR在肿瘤中均为高表达,且hTRT与hTR有很大相关性(P<0.01),原位杂交技术检测hTR与hTRT对恶性肿瘤的诊断具有重要意义。
, http://www.100md.com
Molecular cloning of hTRT catalytic domain and its expression in tumors YING Jianming*, JIN Yanyan, WANG Heng, HOU Lin, MA Changqing, ZHANG Bo. * Departemtn of Pathology, Beijing Medical University, Beijing, 100083
【Abstract】 Objective To study the expression of hTRT gene in tumors and its significance in cancer diagnosis. Methods The expression of hTRT in HeLa cells and PG cells was estimated by RT-PCR and the hTRT cDNA encoding the catalytic domain from HeLa cells were cloned and sequenced. Using in situ hybridization (ISH) techniques, the expression of hTRT mRNA in 54 human tumors were observed and compared with the expression of hTR. Results hTRT was detected in both HeLa and PG cells. Sequencing showed that the cloned hTRT catalytic domain cDNA was identical with that reported in the literature. hTRT and hTR expressions were detected in 38/46 and 40/46 malignant tumors respectively, while both hTRT and hTR were not detected in 8 benign tumors. Conclusion hTRT was detected in both HeLa and PG cancer cells. hTRT catalytic domains were highly conservative. The expression of hTRT and hTR were both high in malignant tumors and they were strongly correlated. Our results suggest that detection of hTRT was valuable to clinical oncology diagnosis.
, 百拇医药
【Key words】 Telomerase In sita hybridzation Gene expression
端粒酶是维持端粒长度的逆转录酶,由RNA和蛋白质两部分组成,为核酸蛋白酶,在大多数正常人体细胞中无端粒酶活性,而在永生化细胞和90%的人癌细胞中具有端粒活性。这提示通过对端粒酶的研究将对肿瘤的诊断与治疗具有重要的意义。hTRT(human telomerase reverse transcriptase)是最近克隆的被认为最有可能是端粒酶的蛋白亚单位,hTRT与细胞端粒酶的活性密切相关[1,2]。我们检测了两种细胞(PG细胞和HeLa细胞)的hTRT表达水平,并从HeLa细胞克隆了hTRT催化功能区基因,测序后与从293细胞和淋巴瘤细胞分离的hTRT序列进行比较。对hTRT在肿瘤细胞中的基因表达情况及与hTR(端粒酶RNA组分)表达的相关性运用原位杂交技术进行了初步研究。
材料与方法
, http://www.100md.com
1.标本来源:54例肿瘤组织均取自1997年北京医科大学病理系的外检标本,其中包括恶性肿瘤46例:大肠癌8例,乳腺癌7例,鳞癌6例,前列腺癌4例,胃癌4例,结肠癌4例,肺癌2例,肾透明细胞癌2例,子宫内膜癌2例,淋巴结转移癌2例,卵巢浆液性囊腺癌2例,汗腺肌上皮癌1例,肛门基底上皮瘤1例,脊索瘤1例;良性肿瘤8例:乳腺纤维腺瘤4例,内翻性乳头状瘤3例,涎腺多形性腺瘤1例。
2.细胞培养:PG人肺巨癌细胞系为我系建立,RPMI 1640培养基(Sigma公司),加10%小牛血清,37℃,5% CO2培养,HeLa细胞系为DMEM培养基(Sigma公司)。
3.引物设计与制备:根据Nakamura等[1]人报道的hTRT mRNA序列,在开放阅读框架的上下游设计一对引物,预期的最终扩增产物含开放阅读框架序列,长度为626 bp。为方便随后对PCR产物进行克隆,在两引物的5′端分别引入SalⅠ和BamHⅠ酶切位点,并保留4个额外的碱基,以保证限制性内切酶进行有效的切割。引物由赛百盛公司合成:5′-引物5′-TATA GTCGACGTGGAAGATGAGCGTGCGG3′;3′-引物5′ACAC GGATCCACCTTGACAAAGTACAGCTC3′
, 百拇医药
4.细胞总RNA制备和cDNA第一链合成:用异硫氰酸胍一步法分别制备PG细胞和HeLa细胞的细胞总RNA,以总RNA为模板,以3′引物为逆转录引物,加入AMV逆转录酶合成cDNA第一链,采用50 μl逆转录反应体系,按Promega公司逆转录反应试剂盒使用说明加入各组分,42℃孵育60分钟,95℃5分钟灭活逆转录酶,逆转录产物直接用于PCR或冻存备用。
5.PCR扩增:在100 μl反应体系中,含200 μmol/L dNTPs,1.5 mmol/L MgCl2,1 μmol/L两种引物和1×PCR缓冲液,加入5~10 μl上述逆转录产物和2.5 UTaqDNA聚合酶,反应管中覆盖石蜡油,95℃预变性1分钟,94℃变性50秒,58 ℃退火50秒,72℃延伸30秒,循环30次,最后72℃延伸10分钟结束。取10 μl样品,1.2%琼脂糖凝胶电泳观察。
6.PCR产物的酶切鉴定:选择+275PvuⅡ和+449XhoⅠ(Promega公司)两个酶切位点,用上述两种内切酶对PCR产物进行酶切鉴定。
, 百拇医药
7.PCR产物的克隆:采用定向克隆策略,用SalⅠ和BamHⅠ(Gibco-BRL)双酶切PCR扩增产物和pBluescriptSK+载体,回收纯化后,按Gibco-BRL公司T4连接酶推荐步骤,26~28℃连接反应2小时,连接混合物转化感受态大肠杆菌JM109菌株,铺于含Amp的琼脂平板,37℃培养过夜,挑取单个菌落培养,碱裂解法小量制备质粒DNA,用SalⅠ和BamHⅠ进行酶切鉴定,筛选出阳性克隆。
8.DNA测序:用碱裂解法大量制备阳性克隆质粒DNA,PEG沉淀纯化质粒,用荧光标记双脱氧链终止法测定序列试剂盒(Perkin-Elmer公司)以T3和T7通用引物对插入片段进行双向自动DNA序列分析(自动荧光DNA序列分析仪/ABI公司),用DNA分析软件分析测定结果。
9.探针的制备:用相应的内切酶将质粒线性化,用体外转录法制备生物素标记的hTR-cRNA和hTRT-cRNA探针。
, http://www.100md.com 10.原位杂交:常规石蜡切片,脱蜡,水化后用0.3%H2O2封闭,0.1 mol/L HCl处理,100 μg/ml蛋白酶K消化,4%多聚甲醛固定,90%乙醇脱水,每片组织滴加杂20 μl杂交液(含1 ng/μl cRNA探针,200 μg/ml鲑精DNA,1 mg/ml DTT,50%甲酰胺,2×denhardt液,1 mg/ml葡聚糖,6×SSC),放入含50%甲酰胺湿盒中42℃杂交16~20小时,于2×SSC洗3次,1∶100马血清封闭后用Avidin+Biotin-HRP孵育,最后DNA显色。常规设立阴性对照
11.统计学处理:χ2检验。
结果
1.HeLa、PG细胞与hTRT:用PG肺癌细胞、HeLa细胞来源的RNA分别进行RT-PCR均得到约620 bp的扩增产物,与预计626 bp基本一致,并且2个细胞系产物浓度接近(图1)。用限制性内切酶PvuⅡ、XhoⅠ分别对PCR扩增产物进行酶切,结果表明与预期的完全相符(图2)。
, http://www.100md.com
M:标准分子量(pGEM-7Z/HaeⅢ)
1:HeLa细胞 2:PG细胞
图1 HeLa和PG细胞hTRT RT-PCR扩增产物
M:标准分子量(pGEM-7Z/HaeⅢ) 1. hTRTcDNA;2:hTRT/PvuⅡ;3:hTRT/XhoⅠ
图2 hTRTcDNA扩增产物酶切鉴定结果
2.hTRTcDNA的克隆:将从HeLa细胞扩增的cDNA片段克隆于pBluescriptSK+载体的BamHⅠ和SalⅠ位点,重组质粒DNA经BamHⅠ和SalⅠ双酶切消化鉴定(图3),得到4个阳性克隆,分别命名为pBSTRT1,pBSTRT2,pBSTRT3,pBSTRT4。图4为hTRTcDNA插入pBluescriptSK+载体的示意图。
, http://www.100md.com
M:标准分子量(λDNA/EcoRⅠ+HindⅢ),1:pBluescript SK/BamHI+SalⅠ;2:hTRTcDNA;3:pBSTRT;4:pBSTRT/BamHⅠ+SalⅠ
图3 重组质粒pBSTRT酶切鉴定结果
图4 hTRT插入pBluescriptSK+载体示意图
3.pBSTRT的序列分析:序列分析结果表明,HeLa细胞的hTRT序列与文献报道一致,并已插入至pBluescriptSK(+)的SalⅠ和BamHⅠ酶切位点之间。
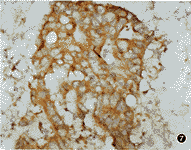
4.原位杂交检测结果:应用生物素标记的hTRT探针对54例肿瘤组织进行原位杂交(图5~8),hTRT阳性信号主要分布在肿瘤细胞的胞质中,46例恶性肿瘤中38例呈阳性,阳性率为82.6%,并同时对54例肿瘤组织作了端粒酶RNA组分hTR基因表达的检测,hTR阳性信号分布在肿瘤细胞的胞核和胞质中,46例恶性肿瘤中40例呈阳性,阳性率为87.0%,8例良性肿瘤中hTRT和hTR均未见阳性结果。阴性对照片均为阴性 。hTRT和hTR相关性分析:54例肿瘤组织中,hTR和hTRT具相关性的(即同为阳性或同为阴性)为50例,占92.6%。

, http://www.100md.com
图5~8均为ABC法,原位杂交,阳性信号为深棕黄色颗粒:
图5 大肠癌细胞中hTRTmRNA杂交阳性细胞,细胞浆内×100
图6 大肠癌细胞中hTRTmRNA杂交阳性细胞,细胞浆内×250
图7 乳腺癌细胞中hTR杂交阳性细胞,细胞浆内苏木素复染,原位杂交×250
图8 结肠癌细胞中hTR杂交阳性细胞,细胞核内×250
讨论
1995年,人端粒酶的RNA组分hTR的基因被克隆[3],最近,与端粒酶活性相关的两个蛋白组分TP-1[4]和hTRT的基因被克隆。研究表明,hTRT与细胞端粒酶的活性高低密切相关。在体外将hTRT转录翻译后和hTR重组表现出端粒酶活性[5,6],改变hTRT中氨基酸,端粒酶活性将减低或消失[5]。将hTRT导入人体正常细胞,端粒酶活性被诱导激活[7,8]。这些均表明,hTRT为细胞端粒酶活性的限制组分,hTRT的表达水平与端粒酶活性直接相关。
, http://www.100md.com
我们从PG与HeLa 2种细胞系分别扩增了hTRT cDNA功能基因片段,文献报道HeLa细胞内hTRT mRNA水平很低[1],从本研究结果看来,HeLa细胞内hTRT mRNA的丰度足以用RT-PCR检测出来,且其RT-PCR结果与PG细胞相当。克隆的hTRT cDNA经测序比较,与报道的hTRT(293细胞)、hEST(淋巴瘤细胞)序列相符[1,2],说明hTRT功能序列区段在细胞中具有高度保守性。
我们运用原位杂交技术对54例肿瘤组织进行了hTRT mRNA和hTR的检测,结果显示,46例恶性肿瘤中hTRT阳性率为82.6%(其中2例肾透明细胞癌因其特殊性呈阴性,5例低度恶性肿瘤3例呈阴性),hTR在恶性肿瘤中的阳性率为87.0%,与文献中所报道的85%~90%癌细胞具有端粒酶活性相一致[9]。54例肿瘤组织中,hTRT和hTR具有表达的相关性(即同为阳性或同为阴性)为50例,占92.6%,但在分布上具有一些差异,hTRT均位于细胞的胞质中,而hTRT可出现在部分细胞胞核中,这与hTRT、hTR的生化特征和功能呈一致的。hTRT比hTR的阳性率稍低,可能hTRT检测的是mRNA,比hTR的RNA更易降解的原因。hTRT和hTR的表达分布在肿瘤的不同区域,在血管区周围和细胞密集的区域阳性信号高,恶性度高的肿瘤表现为明显的强阳性,坏死区、癌旁细胞及正常组织细胞呈阴性,这表明hTRT和hTR一样在恶性肿瘤中具有高表达,其检测结果对于鉴别肿瘤的良恶性具有重要意义。
, 百拇医药
从上述结果可以看出,运用原位杂交技术通过对hTRT和hTR的检测,可以在原位间接反映端粒酶活性,因此,hTRT与hTR将成为组织学中新的肿瘤标记物,对恶性肿瘤的诊断具有重要意义。
参考文献
1 Nakamura TM, Linger J, Cech TR, et al. Telomerase catalytic subunit homologs from fission yeast and human. Science, 1997, 277:955-959.
2 Meyerson M, Counter CM, Eaton EN, et al. hEST2, the putative human telomerase catalytic subunit gene, is up-regulated in tumor cells and during immortalization. Cell, 1997, 90:785-795.
, 百拇医药
3 Feng J, Funk WD, Wang SS, et al. The RNA component of human telomerase. Science, 1997, 269:1236-1241.
4 Harrington L, Oulton R, Arruda I, et al. A mammalian telomerase-associatied protein. Science, 1997, 275:973-977.
5 Weinrich SL, Pruzan R, Ma L, et al. Reconstitution of human telomerase with the template RNA component hTR and the catalytic protein subunit hTRT. Nat Genet, 1997, 17:498-502.
, http://www.100md.com 6 Beattie TL, Zhou W, Robinse MO, et al. Reconstitution of human telomerase activity in vitro. Curr Biol, 1998, 8:177-180.
7 Ramakrishman S, Eppenberger U, Shinkai H, et al. Expression profile of the putative catalytic subunit of the telomerase gene. Cancer Res, 1998, 58:622-625.
8 Nakayama J, Tahara H, Tahara E, et al. Telomerase activation by hTRT in human normal fibroblasts and hepatocellular carcinomas. Nat Genet, 1998, 18:65-68.
9 Shang JW, Bacchetti S. A survey of telomerase activity in human cancer. Eur J Cancer, 1997, 33:787-791.
(收稿:1998-03-30 修回:1998-09-07), 百拇医药
单位:100083 北京医科大学病理学系(应建明、侯琳、马长青、张波);浙江省绍兴市人民医院(金燕燕);福建省肿瘤医院放射生物研究室(王衡)
关键词:端粒酶;原位杂交;基因表达
中华病理学杂志/990201 【摘要】 目的 研究端粒酶蛋白hTRT基因在肿瘤中的表达及其意义。方法 用RT-PCR法检测HeLa细胞与PG细胞的hTRT表达水平;将HeLa细胞的hTRT催化功能区克隆,并进行测序比较;应用原位杂交技术对肿瘤组织中的hTRT和hTR(端粒酶RNA组分)基因进行检测。结果 HeLa细胞与PG细胞均有hTRT表达,HeLa细胞hTRT催化功能区cDNA序列与文献报道一致。原位杂交结果显示hTRT与hTR的协同表达率为92.6%(50/54例),hTRT和hTR在恶性肿瘤中的阳性率分别为82.6%(38/46例)87.0%(40/46例),hTRT和hTR在良性肿瘤中均呈阴性。结论 HeLa细胞与PG细胞均有hTRT表达,hTRT的催化功能区具有高度保守性,hTRT与hTR在肿瘤中均为高表达,且hTRT与hTR有很大相关性(P<0.01),原位杂交技术检测hTR与hTRT对恶性肿瘤的诊断具有重要意义。
, http://www.100md.com
Molecular cloning of hTRT catalytic domain and its expression in tumors YING Jianming*, JIN Yanyan, WANG Heng, HOU Lin, MA Changqing, ZHANG Bo. * Departemtn of Pathology, Beijing Medical University, Beijing, 100083
【Abstract】 Objective To study the expression of hTRT gene in tumors and its significance in cancer diagnosis. Methods The expression of hTRT in HeLa cells and PG cells was estimated by RT-PCR and the hTRT cDNA encoding the catalytic domain from HeLa cells were cloned and sequenced. Using in situ hybridization (ISH) techniques, the expression of hTRT mRNA in 54 human tumors were observed and compared with the expression of hTR. Results hTRT was detected in both HeLa and PG cells. Sequencing showed that the cloned hTRT catalytic domain cDNA was identical with that reported in the literature. hTRT and hTR expressions were detected in 38/46 and 40/46 malignant tumors respectively, while both hTRT and hTR were not detected in 8 benign tumors. Conclusion hTRT was detected in both HeLa and PG cancer cells. hTRT catalytic domains were highly conservative. The expression of hTRT and hTR were both high in malignant tumors and they were strongly correlated. Our results suggest that detection of hTRT was valuable to clinical oncology diagnosis.
, 百拇医药
【Key words】 Telomerase In sita hybridzation Gene expression
端粒酶是维持端粒长度的逆转录酶,由RNA和蛋白质两部分组成,为核酸蛋白酶,在大多数正常人体细胞中无端粒酶活性,而在永生化细胞和90%的人癌细胞中具有端粒活性。这提示通过对端粒酶的研究将对肿瘤的诊断与治疗具有重要的意义。hTRT(human telomerase reverse transcriptase)是最近克隆的被认为最有可能是端粒酶的蛋白亚单位,hTRT与细胞端粒酶的活性密切相关[1,2]。我们检测了两种细胞(PG细胞和HeLa细胞)的hTRT表达水平,并从HeLa细胞克隆了hTRT催化功能区基因,测序后与从293细胞和淋巴瘤细胞分离的hTRT序列进行比较。对hTRT在肿瘤细胞中的基因表达情况及与hTR(端粒酶RNA组分)表达的相关性运用原位杂交技术进行了初步研究。
材料与方法
, http://www.100md.com
1.标本来源:54例肿瘤组织均取自1997年北京医科大学病理系的外检标本,其中包括恶性肿瘤46例:大肠癌8例,乳腺癌7例,鳞癌6例,前列腺癌4例,胃癌4例,结肠癌4例,肺癌2例,肾透明细胞癌2例,子宫内膜癌2例,淋巴结转移癌2例,卵巢浆液性囊腺癌2例,汗腺肌上皮癌1例,肛门基底上皮瘤1例,脊索瘤1例;良性肿瘤8例:乳腺纤维腺瘤4例,内翻性乳头状瘤3例,涎腺多形性腺瘤1例。
2.细胞培养:PG人肺巨癌细胞系为我系建立,RPMI 1640培养基(Sigma公司),加10%小牛血清,37℃,5% CO2培养,HeLa细胞系为DMEM培养基(Sigma公司)。
3.引物设计与制备:根据Nakamura等[1]人报道的hTRT mRNA序列,在开放阅读框架的上下游设计一对引物,预期的最终扩增产物含开放阅读框架序列,长度为626 bp。为方便随后对PCR产物进行克隆,在两引物的5′端分别引入SalⅠ和BamHⅠ酶切位点,并保留4个额外的碱基,以保证限制性内切酶进行有效的切割。引物由赛百盛公司合成:5′-引物5′-TATA GTCGACGTGGAAGATGAGCGTGCGG3′;3′-引物5′ACAC GGATCCACCTTGACAAAGTACAGCTC3′
, 百拇医药
4.细胞总RNA制备和cDNA第一链合成:用异硫氰酸胍一步法分别制备PG细胞和HeLa细胞的细胞总RNA,以总RNA为模板,以3′引物为逆转录引物,加入AMV逆转录酶合成cDNA第一链,采用50 μl逆转录反应体系,按Promega公司逆转录反应试剂盒使用说明加入各组分,42℃孵育60分钟,95℃5分钟灭活逆转录酶,逆转录产物直接用于PCR或冻存备用。
5.PCR扩增:在100 μl反应体系中,含200 μmol/L dNTPs,1.5 mmol/L MgCl2,1 μmol/L两种引物和1×PCR缓冲液,加入5~10 μl上述逆转录产物和2.5 UTaqDNA聚合酶,反应管中覆盖石蜡油,95℃预变性1分钟,94℃变性50秒,58 ℃退火50秒,72℃延伸30秒,循环30次,最后72℃延伸10分钟结束。取10 μl样品,1.2%琼脂糖凝胶电泳观察。
6.PCR产物的酶切鉴定:选择+275PvuⅡ和+449XhoⅠ(Promega公司)两个酶切位点,用上述两种内切酶对PCR产物进行酶切鉴定。
, 百拇医药
7.PCR产物的克隆:采用定向克隆策略,用SalⅠ和BamHⅠ(Gibco-BRL)双酶切PCR扩增产物和pBluescriptSK+载体,回收纯化后,按Gibco-BRL公司T4连接酶推荐步骤,26~28℃连接反应2小时,连接混合物转化感受态大肠杆菌JM109菌株,铺于含Amp的琼脂平板,37℃培养过夜,挑取单个菌落培养,碱裂解法小量制备质粒DNA,用SalⅠ和BamHⅠ进行酶切鉴定,筛选出阳性克隆。
8.DNA测序:用碱裂解法大量制备阳性克隆质粒DNA,PEG沉淀纯化质粒,用荧光标记双脱氧链终止法测定序列试剂盒(Perkin-Elmer公司)以T3和T7通用引物对插入片段进行双向自动DNA序列分析(自动荧光DNA序列分析仪/ABI公司),用DNA分析软件分析测定结果。
9.探针的制备:用相应的内切酶将质粒线性化,用体外转录法制备生物素标记的hTR-cRNA和hTRT-cRNA探针。
, http://www.100md.com 10.原位杂交:常规石蜡切片,脱蜡,水化后用0.3%H2O2封闭,0.1 mol/L HCl处理,100 μg/ml蛋白酶K消化,4%多聚甲醛固定,90%乙醇脱水,每片组织滴加杂20 μl杂交液(含1 ng/μl cRNA探针,200 μg/ml鲑精DNA,1 mg/ml DTT,50%甲酰胺,2×denhardt液,1 mg/ml葡聚糖,6×SSC),放入含50%甲酰胺湿盒中42℃杂交16~20小时,于2×SSC洗3次,1∶100马血清封闭后用Avidin+Biotin-HRP孵育,最后DNA显色。常规设立阴性对照
11.统计学处理:χ2检验。
结果
1.HeLa、PG细胞与hTRT:用PG肺癌细胞、HeLa细胞来源的RNA分别进行RT-PCR均得到约620 bp的扩增产物,与预计626 bp基本一致,并且2个细胞系产物浓度接近(图1)。用限制性内切酶PvuⅡ、XhoⅠ分别对PCR扩增产物进行酶切,结果表明与预期的完全相符(图2)。

, http://www.100md.com
M:标准分子量(pGEM-7Z/HaeⅢ)
1:HeLa细胞 2:PG细胞
图1 HeLa和PG细胞hTRT RT-PCR扩增产物

M:标准分子量(pGEM-7Z/HaeⅢ) 1. hTRTcDNA;2:hTRT/PvuⅡ;3:hTRT/XhoⅠ
图2 hTRTcDNA扩增产物酶切鉴定结果
2.hTRTcDNA的克隆:将从HeLa细胞扩增的cDNA片段克隆于pBluescriptSK+载体的BamHⅠ和SalⅠ位点,重组质粒DNA经BamHⅠ和SalⅠ双酶切消化鉴定(图3),得到4个阳性克隆,分别命名为pBSTRT1,pBSTRT2,pBSTRT3,pBSTRT4。图4为hTRTcDNA插入pBluescriptSK+载体的示意图。

, http://www.100md.com
M:标准分子量(λDNA/EcoRⅠ+HindⅢ),1:pBluescript SK/BamHI+SalⅠ;2:hTRTcDNA;3:pBSTRT;4:pBSTRT/BamHⅠ+SalⅠ
图3 重组质粒pBSTRT酶切鉴定结果

图4 hTRT插入pBluescriptSK+载体示意图
3.pBSTRT的序列分析:序列分析结果表明,HeLa细胞的hTRT序列与文献报道一致,并已插入至pBluescriptSK(+)的SalⅠ和BamHⅠ酶切位点之间。
4.原位杂交检测结果:应用生物素标记的hTRT探针对54例肿瘤组织进行原位杂交(图5~8),hTRT阳性信号主要分布在肿瘤细胞的胞质中,46例恶性肿瘤中38例呈阳性,阳性率为82.6%,并同时对54例肿瘤组织作了端粒酶RNA组分hTR基因表达的检测,hTR阳性信号分布在肿瘤细胞的胞核和胞质中,46例恶性肿瘤中40例呈阳性,阳性率为87.0%,8例良性肿瘤中hTRT和hTR均未见阳性结果。阴性对照片均为阴性 。hTRT和hTR相关性分析:54例肿瘤组织中,hTR和hTRT具相关性的(即同为阳性或同为阴性)为50例,占92.6%。



, http://www.100md.com
图5~8均为ABC法,原位杂交,阳性信号为深棕黄色颗粒:
图5 大肠癌细胞中hTRTmRNA杂交阳性细胞,细胞浆内×100
图6 大肠癌细胞中hTRTmRNA杂交阳性细胞,细胞浆内×250
图7 乳腺癌细胞中hTR杂交阳性细胞,细胞浆内苏木素复染,原位杂交×250
图8 结肠癌细胞中hTR杂交阳性细胞,细胞核内×250
讨论
1995年,人端粒酶的RNA组分hTR的基因被克隆[3],最近,与端粒酶活性相关的两个蛋白组分TP-1[4]和hTRT的基因被克隆。研究表明,hTRT与细胞端粒酶的活性高低密切相关。在体外将hTRT转录翻译后和hTR重组表现出端粒酶活性[5,6],改变hTRT中氨基酸,端粒酶活性将减低或消失[5]。将hTRT导入人体正常细胞,端粒酶活性被诱导激活[7,8]。这些均表明,hTRT为细胞端粒酶活性的限制组分,hTRT的表达水平与端粒酶活性直接相关。
, http://www.100md.com
我们从PG与HeLa 2种细胞系分别扩增了hTRT cDNA功能基因片段,文献报道HeLa细胞内hTRT mRNA水平很低[1],从本研究结果看来,HeLa细胞内hTRT mRNA的丰度足以用RT-PCR检测出来,且其RT-PCR结果与PG细胞相当。克隆的hTRT cDNA经测序比较,与报道的hTRT(293细胞)、hEST(淋巴瘤细胞)序列相符[1,2],说明hTRT功能序列区段在细胞中具有高度保守性。
我们运用原位杂交技术对54例肿瘤组织进行了hTRT mRNA和hTR的检测,结果显示,46例恶性肿瘤中hTRT阳性率为82.6%(其中2例肾透明细胞癌因其特殊性呈阴性,5例低度恶性肿瘤3例呈阴性),hTR在恶性肿瘤中的阳性率为87.0%,与文献中所报道的85%~90%癌细胞具有端粒酶活性相一致[9]。54例肿瘤组织中,hTRT和hTR具有表达的相关性(即同为阳性或同为阴性)为50例,占92.6%,但在分布上具有一些差异,hTRT均位于细胞的胞质中,而hTRT可出现在部分细胞胞核中,这与hTRT、hTR的生化特征和功能呈一致的。hTRT比hTR的阳性率稍低,可能hTRT检测的是mRNA,比hTR的RNA更易降解的原因。hTRT和hTR的表达分布在肿瘤的不同区域,在血管区周围和细胞密集的区域阳性信号高,恶性度高的肿瘤表现为明显的强阳性,坏死区、癌旁细胞及正常组织细胞呈阴性,这表明hTRT和hTR一样在恶性肿瘤中具有高表达,其检测结果对于鉴别肿瘤的良恶性具有重要意义。
, 百拇医药
从上述结果可以看出,运用原位杂交技术通过对hTRT和hTR的检测,可以在原位间接反映端粒酶活性,因此,hTRT与hTR将成为组织学中新的肿瘤标记物,对恶性肿瘤的诊断具有重要意义。
参考文献
1 Nakamura TM, Linger J, Cech TR, et al. Telomerase catalytic subunit homologs from fission yeast and human. Science, 1997, 277:955-959.
2 Meyerson M, Counter CM, Eaton EN, et al. hEST2, the putative human telomerase catalytic subunit gene, is up-regulated in tumor cells and during immortalization. Cell, 1997, 90:785-795.
, 百拇医药
3 Feng J, Funk WD, Wang SS, et al. The RNA component of human telomerase. Science, 1997, 269:1236-1241.
4 Harrington L, Oulton R, Arruda I, et al. A mammalian telomerase-associatied protein. Science, 1997, 275:973-977.
5 Weinrich SL, Pruzan R, Ma L, et al. Reconstitution of human telomerase with the template RNA component hTR and the catalytic protein subunit hTRT. Nat Genet, 1997, 17:498-502.
, http://www.100md.com 6 Beattie TL, Zhou W, Robinse MO, et al. Reconstitution of human telomerase activity in vitro. Curr Biol, 1998, 8:177-180.
7 Ramakrishman S, Eppenberger U, Shinkai H, et al. Expression profile of the putative catalytic subunit of the telomerase gene. Cancer Res, 1998, 58:622-625.
8 Nakayama J, Tahara H, Tahara E, et al. Telomerase activation by hTRT in human normal fibroblasts and hepatocellular carcinomas. Nat Genet, 1998, 18:65-68.
9 Shang JW, Bacchetti S. A survey of telomerase activity in human cancer. Eur J Cancer, 1997, 33:787-791.
(收稿:1998-03-30 修回:1998-09-07), 百拇医药