骨巨细胞瘤中多核巨细胞的分离提纯及原代培养
作者:吴惠茜 谢丹 张萌 文剑明
单位:
吴惠茜(中山医科大学病理教研室,广州 510089);谢丹(中山医科大学病理教研室,广州 510089);张萌(中山医科大学病理教研室,广州 510089);文剑明(中山医科大学病理教研室,广州 510089)
关键词:
中华病理学杂志000124 骨巨细胞瘤是一种以溶骨为主要特征的常见骨肿瘤,在病理形态上是由较多的多核巨细胞和大量的单核基质细胞组成。有学者认为骨巨细胞瘤中的多核巨细胞是破骨细胞的肿瘤性变异,故该肿瘤曾被命名为“破骨细胞瘤”[1]。近年来,越来越多的资料显示,骨巨细胞瘤中的多核巨细胞具有许多破骨细胞的特征[2];而且它们能有效地吸收骨质[3,4]。Zambonin等[5]提出,骨巨细胞瘤中的多核巨细胞可以作为一种研究破骨细胞生物学特征和骨质吸收的新手段。然而,如何有效地从骨巨细胞瘤中提取高纯度的破骨细胞样多核巨细胞,文献报道较少[6]。我们采用一种简便而实用的不锈钢网过滤分离法,成功地从11例骨巨细胞瘤组织中分离出极高纯度的多核巨细胞,同时对其进行原代培养和观察,并探讨这种方法的应用价值。
, http://www.100md.com
一、材料与方法
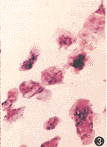
1.标本来源:11份骨巨细胞瘤手术标本取自中山医科大学第一附属医院骨科 (图1)。
2.分离用品和细胞培养试剂:50 μm孔径的不锈钢网(河北筛网厂),RPMI 1640培养基(Gibco 公司),Eagle基础培养基(Gibco公司),小牛血清(广州畜牧场)、胰蛋白酶(Difco公司),胶原酶(Sigma公司),塑料培养瓶(Sigma公司)。
3.骨巨细胞瘤瘤细胞悬液制备:在无菌条件下,用剪刀将3~5 g的瘤组织剪成0.2~0.3 mm3大小碎块,用5倍浓度双抗(500 IU/ml青霉素和500 μg/ml链霉素)的Hanks液反复洗涤、除去血液,将瘤组织置三角烧杯中,加0.1%胶原酶10 ml,在36℃水浴箱中反复振荡,消化30 min,弃去沉渣,取悬液离心(1 000 r/min)5 min,用Hanks液洗涤沉淀物2次,最后加入培养液配制成106/ml细胞悬液。
, http://www.100md.com
4.骨巨细胞瘤中多核巨细胞的分离与原代培养:将骨巨细胞瘤瘤细胞悬液小心地用50 μm孔径的不锈钢网过滤,然后用Hanks液将隔在网上的多核巨细胞冲洗在小烧杯上,再用不锈钢网过滤一次,将洗脱下来的多核巨细胞全部接种在塑料培养瓶中,加入含10%小牛血清的新鲜培养液(RPMI 1640培养基+Eagle基础培养基),置37℃培养箱中过夜,次日更换培养液,之后每2 d换液1次,共培养和观察21 d,并观察和记录多核巨细胞的生长情况。整个实验过程必需在无菌条件下进行。所用的不锈钢网一定要用洗洁精清洗,再用自来水冲干净,经蒸馏水反复冲洗后高压消毒备用。
二、结果
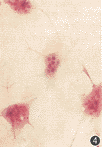
1.骨巨细胞瘤中多核巨细胞的产量与纯度:3~5 g的骨巨细胞瘤组织碎块经胶原酶消化后,可得到含有多核巨细胞和单核基质细胞的瘤细胞悬液(106/ml,图2);将悬液经50 μm孔径的不锈钢网过滤洗涤2次后,可从网膜上收取多核巨细胞(8.69±1.27)×104个(11例骨巨细胞瘤标本),多核巨细胞的平均纯度为(96.7±3.1)%,见图3。
, http://www.100md.com
2.多核巨细胞的原代培养:纯净的多核巨细胞原代培养18~24 h,约 30%~50%的细胞贴壁成活,细胞质伸展变平。36~48 h,成活的细胞生长良好,细胞平展呈不规则形,第3~4 d全部细胞呈多角形贴壁生长,并伸出伪足样胞质突起,部分细胞质内可见少量吞噬空泡(图4)。第6~7 d,约10%~20%的细胞脱壁死亡,第12~14 d,约70%~80%的细胞死亡,而生存的细胞主要为胞体小、核数目较少的小多核巨细胞,呈半球形贴壁生长,第18~21 d,细胞几乎全部消失,瓶底偶见个别的小多核巨细胞,呈椭圆形贴壁存活。多核巨细胞生长在原代培养第36~72 h出于最佳状态,此时较适合作体外实验研究。

, http://www.100md.com
图1 多核巨细胞和单核基质细胞瘤组成的骨巨细胞瘤 HE×100 图2 胶原酶消化后的骨巨细胞瘤悬液 HE×200 图3 骨巨细胞瘤悬液过网后获得的纯净多核巨细胞 HE×100 图4 培养72 h的多核巨细胞,细胞呈多角形并伸出伪足样胞质突起贴壁生长,部分细胞质内可见少量吞噬空泡 HE×100
三、讨论
骨巨细胞瘤组织中存在着较丰富的多核巨细胞。从这些巨细胞所制备的单克隆抗体与骨髓中的破骨细胞有交叉反应,而且具有破骨细胞特征性的降钙素(calcitomin)受体[2]。这些细胞能在体外溶骨实验中直接导致骨质的吸收[3,7]。鉴于目前国内外学者在破骨细胞的提取中,主要通过骨髓洗涤从新生的大鼠或鸡的长骨中获取,但产量较低。因此,有人提出了将骨巨细胞瘤中的破骨细胞样多核巨细胞作为今后破骨细胞研究中的一种新细胞资源的设想[5]。 我们采用了这种经济而实用的50 μm孔径的不锈钢网,从骨巨细胞瘤组织中分离提纯出较高产量和相当高纯度的多核巨细胞,而且约有30%~50%的分离细胞能够在培养中存活且生长良好(培养36~72 h)。这种方法操作简便,稳定可靠,而且十分经济,确为一种有效地从骨巨细胞瘤组织中提取多核巨细胞的分离提纯方法,并可为今后研究破骨细胞提供更为丰富的细胞来源。
, 百拇医药
基金项目:霍英东教育基金资助项目(9304)
Email: pathol@gzsums.edu.cn)
参考文献:
[1]Burmester GR, Winchest RJ, Dimitriu-Bona A, et al. Delineation of four cell types comprising the giant cell tumor of bone.Expression of Ⅰa and monocyte-macrophage lineage antigens. J Clin Invest, 1983, 71:1633-1648.
[2]Chambers TJ, Fuller K, McSheehy PM, et al. The effects of calcium regulating hormones on bone resorption by isolated human osteoclastoma cells. J Pathol, 1985, 145:297-305.
, http://www.100md.com
[3]Kaneshisa J, Izumo T, Takeuchi M, et al. In vitro bone resorption by isolated multinucleated giant cells from giant cell tumuor of bone: light and electron microscopic study. Virchows Arch A Pathol Anat Histopathol, 1991, 419:327-338.
[4]Rathod H, Malcolm AJ, Gillespie JI, et al. Characterization of a subtype of primary osteoclastoma: extracellular calcium but not calcitomin inhibits aggressive HLA-DR-positive osteoclastoma possessing “functional” calcitomin receptors. J Pathol, 1994, 174:293-299.
, http://www.100md.com
[5]Zambonin Zallone A, Grano M, Colucci S, et al. Human osteoclast-like cells from giant cell tumors of bone: a new tool for investigating bone resorption and osteoclast biology. Calcif Tissue Int, 1995, 56 suppl 1:S24-28.
[6]赵宁侠,于世凤,庞淑珍. IL-1 a 促进骨巨细胞瘤中破骨样细胞体外骨吸收研究 .北京医科大学学报, 1998,30:246-248.
[7]文剑明,谢丹,姚俊霞,等.TNF-α和M-CSF对骨巨细胞瘤溶骨的促进作用.中华病理学杂志,1997,26:273-276.
收稿日期:1999-02-10, 百拇医药
单位:
吴惠茜(中山医科大学病理教研室,广州 510089);谢丹(中山医科大学病理教研室,广州 510089);张萌(中山医科大学病理教研室,广州 510089);文剑明(中山医科大学病理教研室,广州 510089)
关键词:
中华病理学杂志000124 骨巨细胞瘤是一种以溶骨为主要特征的常见骨肿瘤,在病理形态上是由较多的多核巨细胞和大量的单核基质细胞组成。有学者认为骨巨细胞瘤中的多核巨细胞是破骨细胞的肿瘤性变异,故该肿瘤曾被命名为“破骨细胞瘤”[1]。近年来,越来越多的资料显示,骨巨细胞瘤中的多核巨细胞具有许多破骨细胞的特征[2];而且它们能有效地吸收骨质[3,4]。Zambonin等[5]提出,骨巨细胞瘤中的多核巨细胞可以作为一种研究破骨细胞生物学特征和骨质吸收的新手段。然而,如何有效地从骨巨细胞瘤中提取高纯度的破骨细胞样多核巨细胞,文献报道较少[6]。我们采用一种简便而实用的不锈钢网过滤分离法,成功地从11例骨巨细胞瘤组织中分离出极高纯度的多核巨细胞,同时对其进行原代培养和观察,并探讨这种方法的应用价值。
, http://www.100md.com
一、材料与方法
1.标本来源:11份骨巨细胞瘤手术标本取自中山医科大学第一附属医院骨科 (图1)。
2.分离用品和细胞培养试剂:50 μm孔径的不锈钢网(河北筛网厂),RPMI 1640培养基(Gibco 公司),Eagle基础培养基(Gibco公司),小牛血清(广州畜牧场)、胰蛋白酶(Difco公司),胶原酶(Sigma公司),塑料培养瓶(Sigma公司)。
3.骨巨细胞瘤瘤细胞悬液制备:在无菌条件下,用剪刀将3~5 g的瘤组织剪成0.2~0.3 mm3大小碎块,用5倍浓度双抗(500 IU/ml青霉素和500 μg/ml链霉素)的Hanks液反复洗涤、除去血液,将瘤组织置三角烧杯中,加0.1%胶原酶10 ml,在36℃水浴箱中反复振荡,消化30 min,弃去沉渣,取悬液离心(1 000 r/min)5 min,用Hanks液洗涤沉淀物2次,最后加入培养液配制成106/ml细胞悬液。
, http://www.100md.com
4.骨巨细胞瘤中多核巨细胞的分离与原代培养:将骨巨细胞瘤瘤细胞悬液小心地用50 μm孔径的不锈钢网过滤,然后用Hanks液将隔在网上的多核巨细胞冲洗在小烧杯上,再用不锈钢网过滤一次,将洗脱下来的多核巨细胞全部接种在塑料培养瓶中,加入含10%小牛血清的新鲜培养液(RPMI 1640培养基+Eagle基础培养基),置37℃培养箱中过夜,次日更换培养液,之后每2 d换液1次,共培养和观察21 d,并观察和记录多核巨细胞的生长情况。整个实验过程必需在无菌条件下进行。所用的不锈钢网一定要用洗洁精清洗,再用自来水冲干净,经蒸馏水反复冲洗后高压消毒备用。
二、结果
1.骨巨细胞瘤中多核巨细胞的产量与纯度:3~5 g的骨巨细胞瘤组织碎块经胶原酶消化后,可得到含有多核巨细胞和单核基质细胞的瘤细胞悬液(106/ml,图2);将悬液经50 μm孔径的不锈钢网过滤洗涤2次后,可从网膜上收取多核巨细胞(8.69±1.27)×104个(11例骨巨细胞瘤标本),多核巨细胞的平均纯度为(96.7±3.1)%,见图3。
, http://www.100md.com
2.多核巨细胞的原代培养:纯净的多核巨细胞原代培养18~24 h,约 30%~50%的细胞贴壁成活,细胞质伸展变平。36~48 h,成活的细胞生长良好,细胞平展呈不规则形,第3~4 d全部细胞呈多角形贴壁生长,并伸出伪足样胞质突起,部分细胞质内可见少量吞噬空泡(图4)。第6~7 d,约10%~20%的细胞脱壁死亡,第12~14 d,约70%~80%的细胞死亡,而生存的细胞主要为胞体小、核数目较少的小多核巨细胞,呈半球形贴壁生长,第18~21 d,细胞几乎全部消失,瓶底偶见个别的小多核巨细胞,呈椭圆形贴壁存活。多核巨细胞生长在原代培养第36~72 h出于最佳状态,此时较适合作体外实验研究。




, http://www.100md.com
图1 多核巨细胞和单核基质细胞瘤组成的骨巨细胞瘤 HE×100 图2 胶原酶消化后的骨巨细胞瘤悬液 HE×200 图3 骨巨细胞瘤悬液过网后获得的纯净多核巨细胞 HE×100 图4 培养72 h的多核巨细胞,细胞呈多角形并伸出伪足样胞质突起贴壁生长,部分细胞质内可见少量吞噬空泡 HE×100
三、讨论
骨巨细胞瘤组织中存在着较丰富的多核巨细胞。从这些巨细胞所制备的单克隆抗体与骨髓中的破骨细胞有交叉反应,而且具有破骨细胞特征性的降钙素(calcitomin)受体[2]。这些细胞能在体外溶骨实验中直接导致骨质的吸收[3,7]。鉴于目前国内外学者在破骨细胞的提取中,主要通过骨髓洗涤从新生的大鼠或鸡的长骨中获取,但产量较低。因此,有人提出了将骨巨细胞瘤中的破骨细胞样多核巨细胞作为今后破骨细胞研究中的一种新细胞资源的设想[5]。 我们采用了这种经济而实用的50 μm孔径的不锈钢网,从骨巨细胞瘤组织中分离提纯出较高产量和相当高纯度的多核巨细胞,而且约有30%~50%的分离细胞能够在培养中存活且生长良好(培养36~72 h)。这种方法操作简便,稳定可靠,而且十分经济,确为一种有效地从骨巨细胞瘤组织中提取多核巨细胞的分离提纯方法,并可为今后研究破骨细胞提供更为丰富的细胞来源。
, 百拇医药
基金项目:霍英东教育基金资助项目(9304)
Email: pathol@gzsums.edu.cn)
参考文献:
[1]Burmester GR, Winchest RJ, Dimitriu-Bona A, et al. Delineation of four cell types comprising the giant cell tumor of bone.Expression of Ⅰa and monocyte-macrophage lineage antigens. J Clin Invest, 1983, 71:1633-1648.
[2]Chambers TJ, Fuller K, McSheehy PM, et al. The effects of calcium regulating hormones on bone resorption by isolated human osteoclastoma cells. J Pathol, 1985, 145:297-305.
, http://www.100md.com
[3]Kaneshisa J, Izumo T, Takeuchi M, et al. In vitro bone resorption by isolated multinucleated giant cells from giant cell tumuor of bone: light and electron microscopic study. Virchows Arch A Pathol Anat Histopathol, 1991, 419:327-338.
[4]Rathod H, Malcolm AJ, Gillespie JI, et al. Characterization of a subtype of primary osteoclastoma: extracellular calcium but not calcitomin inhibits aggressive HLA-DR-positive osteoclastoma possessing “functional” calcitomin receptors. J Pathol, 1994, 174:293-299.
, http://www.100md.com
[5]Zambonin Zallone A, Grano M, Colucci S, et al. Human osteoclast-like cells from giant cell tumors of bone: a new tool for investigating bone resorption and osteoclast biology. Calcif Tissue Int, 1995, 56 suppl 1:S24-28.
[6]赵宁侠,于世凤,庞淑珍. IL-1 a 促进骨巨细胞瘤中破骨样细胞体外骨吸收研究 .北京医科大学学报, 1998,30:246-248.
[7]文剑明,谢丹,姚俊霞,等.TNF-α和M-CSF对骨巨细胞瘤溶骨的促进作用.中华病理学杂志,1997,26:273-276.
收稿日期:1999-02-10, 百拇医药