辐射诱发WI-38细胞遗传不稳定性中的mRNA差异显示分析
作者:刘炳辰 吴红英 岳井银 穆传杰 周继文
单位:刘炳辰 吴红英 岳井银 穆传杰 周继文 天津,中国医学科学院中国协和医科大学放射医学研究所 300192
关键词:遗传不稳定性;mRNA差异显示
中华放射医学与防护杂志990313 【摘要】 目的 利用mRNA差异显示技术分析在遗传不稳 定性产生和传递过程中,是否有一些特异的基因表达的变化,并在此基础上了解哪些基因在 此过程中起关键作用。方法 人胚胎成纤维细胞WI-38经γ射线0.5、1 . 0、3.0、5.0、7.0 Gy照射后8小时及3 Gy照射后4、8、24、48、120小时,提取细胞RN A ,进行mRNA-DD PCR,并将差异表达片段进行再扩增。结果 PCR扩增产物 经电泳后,有14条表达差异的带型出现,所有差异表达片段均获得了再扩增。结论 结果说明,某些特异的基因变化参与到了这一过程中,根据我们以前的实验推测 ,很可能是修复基因的改变。目前正在对这些未知片段进行克隆和序列分析。
, 百拇医药
A mRNA-DD assay in the studies of genetic instability in WI- 38 cells induced by radiation.
LIU Bingchen, WU Hongying, YUE Jingyin, et al.Chinese Academy of Medical Sciences,Peking Union Medical College,Institute of Radiation Medicine,Tianjin 300192,China.
【Abstract】 Objective To study the changes in expression of some specific genes in the process of formation and of genetic instability and to det ermine which genes play a critical role in this process. Methods The total RNA from human fetal fibroblast cell WI-38 was extracted 8 hours after i rradiation with 0.5、 1.0、 3.0、 5.0、 7.0 Gy γ-rays and at 4, 8, 24, 48, 120 hours after irradiation with 3.0 Gy γ-rays. The mRNA-DD PCR technique was used to a na lyze gene expression. Results The gel electrophoresis results showed that 14 differential expression bands appeared as compared with the control.All these differential fragments could be reamplified. Conclusion The r esults show that some specific genes participate in this proces.They might belon g to repair genes according to our results observed before.We are going to clone and sequence these unknown fragments in further studies.
, 百拇医药
【Key words】 Genetic instability mRNA-DD PCR
137Cs-γ射线可诱发细胞遗传不稳定性(Genetic Instability) 的产生,且这种不稳定性可以由父代细胞传给其子代并在子代以各种形式如染色体畸变、基 因突变及突变高敏感性等表现出来,它们即可表现在体内,也可表现在体外[1,2] 。这说明,辐射对DNA的作用除直接攻击外,所引起的遗传不稳定性也是非常普遍的。从 某种意义上说,由于这种遗传不稳定性的产生和传递而形成的DNA复制保真度的下降,对机 体的远后效应影响更大。
在研究137Cs-γ射线诱发的遗传不稳定性传递过程中染色体畸变、微核、HGPRT位点 突变等工作的基础上,我们利用mRNA差异显示(Differential Display,mRNA-DD)技术,分 析了不同剂 量γ射线照射及用同一剂量照射后不同时间的WI-38细胞的mRNA表达差异,希望能在此基础 上,分离在遗传不稳定性传递过程中有表达差异的基因,为阐述这一现象的本质找到新的突破口。
, http://www.100md.com
材料和方法
1.细胞培养:人胚胎成纤维细胞WI-38,购自上海中国科学院细胞库,培养于含胎牛血清体积分数为20%、青霉素200 U/ml、链霉素100 μg/ml的RPMI 1640(GIBCO)培养基中,贴壁生长。
2.γ射线照射细胞:不同剂量(0.5、1.0、3.0、7.0 Gy)γ射线(137Cs源,加 拿 大产)照射后8小时及3.0 Gy照射后4、8、24、48、120小时,收获细胞。每一观察点照射5 瓶细胞(100 ml培养瓶)。
3.总RNA的提取:用TRizol(GIBCO)试剂盒的厂家说明书中的方法提取细胞总RNA。
4.逆转录反应:首先用无RNase的DNase I(Promege)处理总RNA,以去除DNA污染。按照cDNA 反转录试剂盒(GIBCO)说明书进行。反应条件为2.1 μg RNA,2.5 mmol/L MgCl2,0.5 m mol/L dNTP,10 μmol/L DTT,0.5 μmmol/L 3′端单锚定引物(5′-AAGCT11C/G /A -3′),42℃,5分钟,加入1 ml(200 U) Superscript Ⅱ RT,42℃,50分钟,70℃,15分 钟 终止反应;再加入1 μl RNase H,37℃,20分钟。3倍ddH2O稀释,分装,-20℃保存。
, 百拇医药
5.PCR反应:参照Liang P的方法[3]。3′端单锚定引物(anchored primer)为上海 生工生物工程公司合成,5′端任意引物(arbitrary primer)(P1:5′-TGGATTGGAG-3′;P 2:5′-GGAACCAATG-3′;P3:5′-TGGATTAGGC-3′;P4:5′-GATCAAGTGC-3′;P5 :5′-CTTTCTAGGC-3′;P6:5′-GATCACGTTC-3′;P7:5′-TCCAGTTCAG-3′;P8:5′-G ACATCCTGT-3′;P9:5′-CGATGCTATC-3′;P10:5′-CTTGTAGCCA-3′;P11:5′-ACCTTGG ACA-3′;P12:5′-CTTGATTGCC-3′)为北京微生物所合成。
反应条件为1.5 mmol/L MgCl2, 3.0 μmol/L dNTP,0.2 μmol/L arbitrary prime r,0.2 μmol/L anchored primer,0.2 μl α-32P dATP(北京亚辉公司,1 0 μC i/μl),5 U Taq聚合酶、1 μl cDNA,终体积为10 μl。94℃30秒,40℃2分钟,72℃30秒 ,40循环;72℃延伸5分钟。在PTC-100 Thermal Cycle Controller上反应。
, 百拇医药
6.凝胶电泳:取2 ml 95℃变性的PCR产物在6%聚丙烯酰胺序列分析胶中电泳,恒压1 800 V (Bio-rad, Model 3 000X)5小时。在Gel dryer 583(Bio-rad)干胶仪上干胶,压片曝光。 洗片后根据条带差异回收相应片段所在的凝胶,以进一步纯化、克隆及测序用。
7.差异PCR产物的回收:按照自显影结果,用手术刀将表达差异的带型切下,加200 μl dd H2O浸泡,95℃2分钟。上清移至另一管中,加10 μl糖元(10mg/ml,Serve),混匀,再加入450 μl无水乙醇,-30℃过夜。4℃12 000 r.min-1离心15分钟,85%乙醇洗 涤、抽干。沉淀溶于10 μl ddH2O中备用。
8.差异PCR产物的再扩增:取2 μl的差示模板进行PCR再扩增,扩增条件同前。进行1.5% 琼脂糖凝胶电泳鉴定。
, http://www.100md.com
结 果
在50 cm的胶板上显示了约100条带的图谱,图1所示。不同剂量照射组及照射后不同时间组 与对照组相比,绝大多数带型无差异。具有表达差异的带型有14条,其中B1(Band1,...)、B 4 、B5、B8、B9、B10、B11在照射组表达而在正常对照组中不表达;B2、B3、B13、B14在照射 3 Gy后120小时不表达而在正常对照组中表达;B12在正常对照中表达而在照射组不表达;B6、B7 在照射组高表达而在对照中低表达。mRNA的差异表达与照射剂量之间无量效关系。利用提取 的mRNA进行再次反转录和扩增,差异表达图谱相同。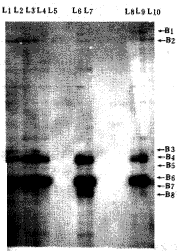

图1 各组细胞的mRNA-DD结果(L1-5 为3 Gy照射后4、8、24、48、120小时电泳图谱;L6-9为照射0.5、1.0、5.0、7.0 Gy 后 8小时电泳图谱,L10为对照;B1-14为差异表达常型)
, http://www.100md.com
表达差异的带型PCR再扩增结果表明扩增片段大小在200~600 bp之间,14条表达差异的带型 均获得了再扩增。
讨 论
可导致遗传不稳定的因素有多种,包括物理、化学、生物等因素。其表现形式多种多样, 它 可以是基因扩增、基因突变、基因重组及出现重组热点、卫星DNA多态性等,也可以是染色 体畸变及异常核型、受照细胞后代的突变高敏感性、细胞转化等。遗传不稳定性是可以传递 的,即父代细胞获得的遗传不稳定性可以在子代表现出来,而且子代表现可能比父代更加突 出,也是遗传不稳定性的延迟表达。遗传不稳定性的传递过程,意味着在DNA受损伤后,未 损伤部位存在着碱基发生突变或DNA链断裂的机制。在其中起主要作用的可能是修复机制(包 括错配修复、切除修复、链断裂重接等)或细胞周期调控机制的失衡[4]。在γ射 线照射CHL细胞后,其后代的HGPRT自发突变率异常升高、非稳定性染色体畸变、微核、细胞 凋亡等[12],表明了其受照祖细胞存在着严重的修复缺陷,而不能使DNA损伤纠 正;或者是由于细胞周期调控机制失衡,而不能使出现DNA损伤的细胞在分裂过程中停止在G 1/S点或G2/M点,也就没有足够的时间使受损伤DNA得以修复。这两种机制的异常均可导 致其细胞后代遗传不稳定性的产生。
, http://www.100md.com
在我们的实验中所表现的mRNA表达的差异,特别是那些受照射后所丢失的带型,可能就是发 生了某些基因的激活或突变,它是其他遗传不稳定性表型表达的根源。根据以前的实验推测 [2],很可能是修复基因的改变。mRNA的差异表达提示,0.5~7.0 Gy辐照 均 能诱发遗传不稳定性的产生和传递,染色体的分析结果也说明了这一点[1]。 照 射3 Gy后120小时所表现的4条带型的丢失,可能意味着已有某些未知基因的失活,而使细胞 稳定地获得了遗传不稳定性。有报道证明在用MNNG诱发猴肾Vero细胞的非定标性突变中,运 用DD-PCR技术分离到的数个片段与许多基因有高同源性,其中包括一些参与信号传导的基 因[5]。本实验中的mRNA差异表达是否也属于此类基因尚有待进一步证实。为了降 低差异显示的假阳性,本实验主要对扩增体系进行了改进,并采用了单碱基锚定oligo-dT 引物,在引物的5′端引入Hind Ⅲ酶切位点,使锚定引物为16个碱基,在一定程度上降低了 假阳性。
, http://www.100md.com 本课题受国家自然科学基金资助(项目号:39470182)
参考文献
1 刘炳辰,董连锴,金虎林,等.γ射线诱发鼠骨髓干细胞梁色体不稳定性传递 及时相分析.癌变.畸变.突变,1998,10:15-18.
2 岳井银,刘炳辰,董连锴,等.γ射线诱发CHL细胞遗传不稳定性传递过程中的HGPRT突 变、微核及细胞凋亡分析.中国学术期刊文摘,1998,4:511.
3 Liang P,Pardee AB. Differential display of eukaryotic messenger RNA by means of polymerase chain reaction.Science,1992,257:967-969.
4 刘炳辰.辐射诱发的遗传不稳定性传递及分子机制.国外医学放射医学核医学分册,199 7,21:33-37.
5 胡文蔚,余应年,张小山,等.MNNG引起猴肾Vero细胞基因表达改变及其有关cDNA片段 的克隆和初步鉴定.癌变*畸变*突变,1997,9:348-349.
(收稿:1998-06-21 修回:1998-11-01), 百拇医药
单位:刘炳辰 吴红英 岳井银 穆传杰 周继文 天津,中国医学科学院中国协和医科大学放射医学研究所 300192
关键词:遗传不稳定性;mRNA差异显示
中华放射医学与防护杂志990313 【摘要】 目的 利用mRNA差异显示技术分析在遗传不稳 定性产生和传递过程中,是否有一些特异的基因表达的变化,并在此基础上了解哪些基因在 此过程中起关键作用。方法 人胚胎成纤维细胞WI-38经γ射线0.5、1 . 0、3.0、5.0、7.0 Gy照射后8小时及3 Gy照射后4、8、24、48、120小时,提取细胞RN A ,进行mRNA-DD PCR,并将差异表达片段进行再扩增。结果 PCR扩增产物 经电泳后,有14条表达差异的带型出现,所有差异表达片段均获得了再扩增。结论 结果说明,某些特异的基因变化参与到了这一过程中,根据我们以前的实验推测 ,很可能是修复基因的改变。目前正在对这些未知片段进行克隆和序列分析。
, 百拇医药
A mRNA-DD assay in the studies of genetic instability in WI- 38 cells induced by radiation.
LIU Bingchen, WU Hongying, YUE Jingyin, et al.Chinese Academy of Medical Sciences,Peking Union Medical College,Institute of Radiation Medicine,Tianjin 300192,China.
【Abstract】 Objective To study the changes in expression of some specific genes in the process of formation and of genetic instability and to det ermine which genes play a critical role in this process. Methods The total RNA from human fetal fibroblast cell WI-38 was extracted 8 hours after i rradiation with 0.5、 1.0、 3.0、 5.0、 7.0 Gy γ-rays and at 4, 8, 24, 48, 120 hours after irradiation with 3.0 Gy γ-rays. The mRNA-DD PCR technique was used to a na lyze gene expression. Results The gel electrophoresis results showed that 14 differential expression bands appeared as compared with the control.All these differential fragments could be reamplified. Conclusion The r esults show that some specific genes participate in this proces.They might belon g to repair genes according to our results observed before.We are going to clone and sequence these unknown fragments in further studies.
, 百拇医药
【Key words】 Genetic instability mRNA-DD PCR
137Cs-γ射线可诱发细胞遗传不稳定性(Genetic Instability) 的产生,且这种不稳定性可以由父代细胞传给其子代并在子代以各种形式如染色体畸变、基 因突变及突变高敏感性等表现出来,它们即可表现在体内,也可表现在体外[1,2] 。这说明,辐射对DNA的作用除直接攻击外,所引起的遗传不稳定性也是非常普遍的。从 某种意义上说,由于这种遗传不稳定性的产生和传递而形成的DNA复制保真度的下降,对机 体的远后效应影响更大。
在研究137Cs-γ射线诱发的遗传不稳定性传递过程中染色体畸变、微核、HGPRT位点 突变等工作的基础上,我们利用mRNA差异显示(Differential Display,mRNA-DD)技术,分 析了不同剂 量γ射线照射及用同一剂量照射后不同时间的WI-38细胞的mRNA表达差异,希望能在此基础 上,分离在遗传不稳定性传递过程中有表达差异的基因,为阐述这一现象的本质找到新的突破口。
, http://www.100md.com
材料和方法
1.细胞培养:人胚胎成纤维细胞WI-38,购自上海中国科学院细胞库,培养于含胎牛血清体积分数为20%、青霉素200 U/ml、链霉素100 μg/ml的RPMI 1640(GIBCO)培养基中,贴壁生长。
2.γ射线照射细胞:不同剂量(0.5、1.0、3.0、7.0 Gy)γ射线(137Cs源,加 拿 大产)照射后8小时及3.0 Gy照射后4、8、24、48、120小时,收获细胞。每一观察点照射5 瓶细胞(100 ml培养瓶)。
3.总RNA的提取:用TRizol(GIBCO)试剂盒的厂家说明书中的方法提取细胞总RNA。
4.逆转录反应:首先用无RNase的DNase I(Promege)处理总RNA,以去除DNA污染。按照cDNA 反转录试剂盒(GIBCO)说明书进行。反应条件为2.1 μg RNA,2.5 mmol/L MgCl2,0.5 m mol/L dNTP,10 μmol/L DTT,0.5 μmmol/L 3′端单锚定引物(5′-AAGCT11C/G /A -3′),42℃,5分钟,加入1 ml(200 U) Superscript Ⅱ RT,42℃,50分钟,70℃,15分 钟 终止反应;再加入1 μl RNase H,37℃,20分钟。3倍ddH2O稀释,分装,-20℃保存。
, 百拇医药
5.PCR反应:参照Liang P的方法[3]。3′端单锚定引物(anchored primer)为上海 生工生物工程公司合成,5′端任意引物(arbitrary primer)(P1:5′-TGGATTGGAG-3′;P 2:5′-GGAACCAATG-3′;P3:5′-TGGATTAGGC-3′;P4:5′-GATCAAGTGC-3′;P5 :5′-CTTTCTAGGC-3′;P6:5′-GATCACGTTC-3′;P7:5′-TCCAGTTCAG-3′;P8:5′-G ACATCCTGT-3′;P9:5′-CGATGCTATC-3′;P10:5′-CTTGTAGCCA-3′;P11:5′-ACCTTGG ACA-3′;P12:5′-CTTGATTGCC-3′)为北京微生物所合成。
反应条件为1.5 mmol/L MgCl2, 3.0 μmol/L dNTP,0.2 μmol/L arbitrary prime r,0.2 μmol/L anchored primer,0.2 μl α-32P dATP(北京亚辉公司,1 0 μC i/μl),5 U Taq聚合酶、1 μl cDNA,终体积为10 μl。94℃30秒,40℃2分钟,72℃30秒 ,40循环;72℃延伸5分钟。在PTC-100 Thermal Cycle Controller上反应。
, 百拇医药
6.凝胶电泳:取2 ml 95℃变性的PCR产物在6%聚丙烯酰胺序列分析胶中电泳,恒压1 800 V (Bio-rad, Model 3 000X)5小时。在Gel dryer 583(Bio-rad)干胶仪上干胶,压片曝光。 洗片后根据条带差异回收相应片段所在的凝胶,以进一步纯化、克隆及测序用。
7.差异PCR产物的回收:按照自显影结果,用手术刀将表达差异的带型切下,加200 μl dd H2O浸泡,95℃2分钟。上清移至另一管中,加10 μl糖元(10mg/ml,Serve),混匀,再加入450 μl无水乙醇,-30℃过夜。4℃12 000 r.min-1离心15分钟,85%乙醇洗 涤、抽干。沉淀溶于10 μl ddH2O中备用。
8.差异PCR产物的再扩增:取2 μl的差示模板进行PCR再扩增,扩增条件同前。进行1.5% 琼脂糖凝胶电泳鉴定。
, http://www.100md.com
结 果
在50 cm的胶板上显示了约100条带的图谱,图1所示。不同剂量照射组及照射后不同时间组 与对照组相比,绝大多数带型无差异。具有表达差异的带型有14条,其中B1(Band1,...)、B 4 、B5、B8、B9、B10、B11在照射组表达而在正常对照组中不表达;B2、B3、B13、B14在照射 3 Gy后120小时不表达而在正常对照组中表达;B12在正常对照中表达而在照射组不表达;B6、B7 在照射组高表达而在对照中低表达。mRNA的差异表达与照射剂量之间无量效关系。利用提取 的mRNA进行再次反转录和扩增,差异表达图谱相同。


图1 各组细胞的mRNA-DD结果(L1-5 为3 Gy照射后4、8、24、48、120小时电泳图谱;L6-9为照射0.5、1.0、5.0、7.0 Gy 后 8小时电泳图谱,L10为对照;B1-14为差异表达常型)
, http://www.100md.com
表达差异的带型PCR再扩增结果表明扩增片段大小在200~600 bp之间,14条表达差异的带型 均获得了再扩增。
讨 论
可导致遗传不稳定的因素有多种,包括物理、化学、生物等因素。其表现形式多种多样, 它 可以是基因扩增、基因突变、基因重组及出现重组热点、卫星DNA多态性等,也可以是染色 体畸变及异常核型、受照细胞后代的突变高敏感性、细胞转化等。遗传不稳定性是可以传递 的,即父代细胞获得的遗传不稳定性可以在子代表现出来,而且子代表现可能比父代更加突 出,也是遗传不稳定性的延迟表达。遗传不稳定性的传递过程,意味着在DNA受损伤后,未 损伤部位存在着碱基发生突变或DNA链断裂的机制。在其中起主要作用的可能是修复机制(包 括错配修复、切除修复、链断裂重接等)或细胞周期调控机制的失衡[4]。在γ射 线照射CHL细胞后,其后代的HGPRT自发突变率异常升高、非稳定性染色体畸变、微核、细胞 凋亡等[12],表明了其受照祖细胞存在着严重的修复缺陷,而不能使DNA损伤纠 正;或者是由于细胞周期调控机制失衡,而不能使出现DNA损伤的细胞在分裂过程中停止在G 1/S点或G2/M点,也就没有足够的时间使受损伤DNA得以修复。这两种机制的异常均可导 致其细胞后代遗传不稳定性的产生。
, http://www.100md.com
在我们的实验中所表现的mRNA表达的差异,特别是那些受照射后所丢失的带型,可能就是发 生了某些基因的激活或突变,它是其他遗传不稳定性表型表达的根源。根据以前的实验推测 [2],很可能是修复基因的改变。mRNA的差异表达提示,0.5~7.0 Gy辐照 均 能诱发遗传不稳定性的产生和传递,染色体的分析结果也说明了这一点[1]。 照 射3 Gy后120小时所表现的4条带型的丢失,可能意味着已有某些未知基因的失活,而使细胞 稳定地获得了遗传不稳定性。有报道证明在用MNNG诱发猴肾Vero细胞的非定标性突变中,运 用DD-PCR技术分离到的数个片段与许多基因有高同源性,其中包括一些参与信号传导的基 因[5]。本实验中的mRNA差异表达是否也属于此类基因尚有待进一步证实。为了降 低差异显示的假阳性,本实验主要对扩增体系进行了改进,并采用了单碱基锚定oligo-dT 引物,在引物的5′端引入Hind Ⅲ酶切位点,使锚定引物为16个碱基,在一定程度上降低了 假阳性。
, http://www.100md.com 本课题受国家自然科学基金资助(项目号:39470182)
参考文献
1 刘炳辰,董连锴,金虎林,等.γ射线诱发鼠骨髓干细胞梁色体不稳定性传递 及时相分析.癌变.畸变.突变,1998,10:15-18.
2 岳井银,刘炳辰,董连锴,等.γ射线诱发CHL细胞遗传不稳定性传递过程中的HGPRT突 变、微核及细胞凋亡分析.中国学术期刊文摘,1998,4:511.
3 Liang P,Pardee AB. Differential display of eukaryotic messenger RNA by means of polymerase chain reaction.Science,1992,257:967-969.
4 刘炳辰.辐射诱发的遗传不稳定性传递及分子机制.国外医学放射医学核医学分册,199 7,21:33-37.
5 胡文蔚,余应年,张小山,等.MNNG引起猴肾Vero细胞基因表达改变及其有关cDNA片段 的克隆和初步鉴定.癌变*畸变*突变,1997,9:348-349.
(收稿:1998-06-21 修回:1998-11-01), 百拇医药