晚期混合裂变产物内照射诱发大鼠外周血淋巴细胞HPRT基因位点突变与微核的比较研究
作者:徐永忠 赵经涌 劳勤华
单位:215007 江苏,苏州医学院放射医学系
关键词:混合裂变产物;HPRT基因突变;微核;剂量效应;剂量率效应
中华放射医学与防护杂志/990515 【摘要】 目的 探索HPRT基因位点突变检测作为辐射生物剂量计的可行性。方法 运用多核细胞法及胞质分裂阻断微核(CBMN)法研究大鼠外周血淋巴细胞的HPRT基因位点突变及微核与累积剂量、剂量率之间关系。结果 静注晚期混合裂变产物后第1天(累积剂量1.73 cSv),与对照组相比,HPRT位点变异频率(Vf)、微核细胞(MNC)率、微核(MN)率均已显著增加(P<0.01)。HPRT Vf,MNC率、MN率与累积剂量间均可拟合成对数回归方程:Y=a+blnX。在总累积剂量近似相等条件下,HPRT Vf,MN率与剂量率之间的关系均可用函数Y=a+blnX表示。HPRT Vf与MN率间存在线性相关。结论 HPRT基因位点对晚期混合裂变产物内照射非常敏感,有明显的剂量效应关系。HPRT基因突变检测可望成为评估电离辐射损伤的生物剂量计。
, http://www.100md.com
Mutations at HPRT loci and micronuclei induced by late fission products in peripheral blood lymphocytes of rats
XU Yongzhong,ZHAO Jingyong,LAO Qinhua.
Faculty of Radiation Medicine,Suzhou Medical College,Suzhou 215007,China
【Abstract】 Objective The probability of mutations at HPRT loci used as a biological dosimeter was studied. Methods With the technique of multinuclear cell and cytokinesis-block micronucleus (CBMN) method,the relationships between mutations at HPRT loci,micronucleus and accmulative doses and dose-rates were studied. Results On the first day after intravenous injection of late fission products(accumulative dose 1.73cSv),by comparison with the control group,the HPRT variant frequencies,micronucleate cell frequencies and micronucleus frequencies increased significantly(P<0.01).There existed relationships between variant frequencies at HPRT locus,micronuclear cell frequencies,micronucleus frequencies and accumulative doses,which could be described by the following regression equation:Y=a+blnX,respectively.At the same accumulative dose,both the relationships between HPRT variant frequencies,micronucleus frequencies and dose-rates could be expressed by the logarithmic regression equation:Y=a+blnX.A good linear relationship between HPRT variant frequencies and micronucleus frequencies was observed. Conclusion HPRT gene locus is an endpoint very sensitive to injurious effects resulting from late fission products and has a good dose-response relationship.
, 百拇医药
【Key words】 Late fission products HPRT gene mutation Micronucleus Dose effects Dose-rate effects
国内外研究表明,体细胞次黄嘌呤鸟嘌呤磷酸核糖转移酶(HPRT)基因位点突变对电离辐射和化学诱变剂非常敏感,电离辐射引起的HPRT基因突变是不可逆的。由于这种不可逆性,使得HPRT基因突变长期存在于体内,可用于急性及慢性小剂量长期照射的剂量估算[1]。尤其在小剂量情况下,其作为生物剂量计比染色体畸变和微核更为敏感。但目前的研究主要集中在外照射,而内照射的研究极为少见。
在体细胞HPRT位点突变体外测试方法中,Norman等建立的多核细胞法具有简单、快速、灵敏、检出率高等特点[2]。本文作者运用多核细胞法及胞质分裂阻断微核法,探讨给大鼠注射晚期混合裂变产物后,其外周血淋巴细胞HPRT Vf与累积剂量和剂量率之间的关系。并与目前广泛应用、行之有效的生物剂量计——MNC率、MN率进行比较。
, 百拇医药
材料和方法
1.材料
晚期混合裂变产物原液放射性浓度为1.82×107 Bq/ml,其组分及比例分别为:90Sr为26.82%,137Cs为73.15%,144Ce-144Pr为0.002%,106Ru-106Rh为0.02%,95Zr-95Nb极微量。细胞松驰素-B(Cyt-B)和6-巯基鸟嘌呤(6-TG)系美国Sigma化学公司产品;RPMI 1640培养基为美国GIBCO公司产品;小牛血清和植物血凝素(PHA)分别为华美生物工程公司、广州医药工业研究所产品。
2.方法
(1)实验动物的处理:实验动物为健康雄性Wistar大鼠,体重(146±19)克,共48只。随机分成1个对照组,4个不同累积剂量组和4个不同剂量率组(其中1个组与不同累积剂量组重叠),每组6只。①对照组:大鼠尾静脉注入pH 3.0生理盐水,注射量为0.5 ml/100 g体重。注入后间隔1天心脏穿刺取血。②不同累积剂量组:大鼠尾静脉注入pH 3.0、放射性浓度为(3.64×105) Bq/ml的混合裂变产物,注射量同①,注入后间隔1、3、6、9天心脏穿刺取血。③不同剂量率组:大鼠尾静脉分别注入pH 3.0、放射性浓度为0.455×105 Bq/ml,0.91×105 Bq/ml,1.82×105及3.64×105 Bq/ml的混合裂变产物,注射量同①,注入后第42、17、6,7和3天(累积剂量近于相等)心脏穿刺取血。每鼠在注射前、取血前各称重1次,并记下体重。
, 百拇医药
(2)培养、收获并制片:大鼠外周血淋巴细胞HPRT基因突变检测的细胞培养、最佳培养条件、收获与制片见文献[3]。每个样本培养2瓶,一瓶加6-TG,另一瓶不加。
(3)阅片:盲法阅片。每个样本计数6 000个转化淋巴细胞数(加6-TG和不加6-TG各3 000个),记录在同一胞浆内具有完整核膜的双核或多核淋巴细胞数(包括相压、相切和分离的双核或多核细胞)。不加6-TG的那份同时计数1 000个双核淋巴细胞中的MNC数及MN数。
(4)HPRT Vf,MNC率和MN率的计算:培养液中含6-TG的1 000个淋巴细胞中双核或多核细胞数除以不含6-TG的1 000个淋巴细胞中双核或多核细胞数,所得结果为HPRT Vf(‰)。1 000个双核淋巴细胞中所含的MNC数、MN数即为MNC率(‰)、MN率(‰)。
(5)内照射累积剂量及剂量率(注射后第1天)估算[4,5]。
, 百拇医药
累积剂量按下式估算: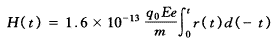
剂量率按下式估算: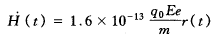
式中:q0为初始注射浓度,Bq;Ee为有效能量,MeV;m为大鼠体重,kg;r(t)为有效滞留函数。
3.统计学处理:HPRT Vf之间的比较用秩和检验(是一种非参数统计,应用时可不考虑被研究的对象为何种分布及分布是否已知,有广泛的适用性),MNC率、MN率之间的比较用χ2检验,HPRT Vf,MNC率、MN率与累积剂量或剂量率之间以及HPRT Vf与MN率之间用计算机进行曲线拟合并绘图。
结果
, 百拇医药
1.HPRT Vf,MNC率及MN率与累积剂量关系见表1。随着累积剂量的增加,HPRT Vf,MNC率和MN率都随之增加,对照组HPRT Vf为1.0311‰、MNC率及MN率均为4.00‰,而受照后第1天,累积剂量达1.73 cSv时,HPRT Vf、MNC率、MN率分别增加到1.2037‰、8.67‰和9.00‰,经统计检验,与对照组比差异都有非常显著性(P<0.01)。HPRT Vf、MNC率及MN率与累积剂量之间可拟合成对数回归方程Y=1.1498+0.1199lnX(R2=0.9706)、Y=6.1102+5.3351lnX(R2=0.9825)和Y=6.1578+5.7512lnX(R2=0.9907)表示,其中X代表累积剂量,Y代表Vf,MNC率及MN率,如图1所示。
表1 HPRT位点变异频率、微核细胞率及微核率与累积剂量关系( ±s) 注入后
±s) 注入后
, 百拇医药
时间(d)
累积剂量
(cSv)
HPRT Vf
(‰)
MNC率
(‰)
MN率
(‰)
对照
0
1.0311±0.0404
4.00±1.03
, 百拇医药
4.00±1.03
1
1.73±0.01
1.2037±0.0377
8.67±1.26*
9.00±1.41*
3
4.76±0.07
1.3623±0.0316*
15.33±1.43*
, http://www.100md.com 15.83±1.74*
6
8.49±0.17
1.4046±0.0264*
17.17±1.66*
18.33±1.91*
9
11.96±0.37
1.4353±0.0274*
19.17±1.68*
, 百拇医药
20.17±1.85*
注:与对照组相比,*P<0.01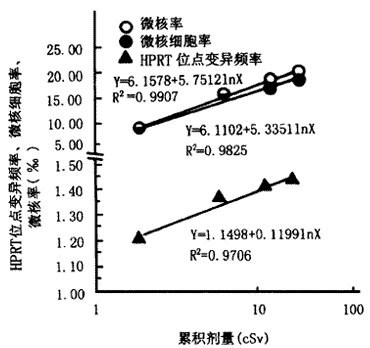
图1 HPRT位点变异频率、微核细胞率、微核率与累积剂量关系
2.在总累积剂量近似相等条件下(约4.68 cSv),HPRT Vf,MNC率及MN率与剂量率之间的关系见表2。HPRT Vf,MNC率与MN率与剂量率之间均呈正相关。经统计检验,4个剂量率点间HPRT Vf,MNC率、MN率总体上差异都有非常显著性(P<0.01),最小剂量率点(2.36 mSv/d),与对照组相比,HPRT Vf差异有显著性(P<0.05),而MNC率及MN率差异无显著性(P>0.05)。经曲线拟合,HPRT Vf和剂量率间可用方程Y=1.0442+0.1124lnX(R2=0.9815)表示、MN率和剂量率之间可用方程Y=2.1244+4.8071lnX(R2=0.9855)表示,其中X代表剂量率,Y代表Vf和MN率。如图2所示。
, 百拇医药
表2 HPRT位点变异频率、微核细胞率及微核率与剂量率关系(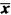 ±s) 累积剂量
±s) 累积剂量
(cSv)
剂量率
(mSv/d)
HPRT Vf
(‰)
MNC率
(‰)
MN率
(‰)
0
, http://www.100md.com
0
1.0311±0.0404
4.00±1.03
4.00±1.03
4.60±0.22
2.26
1.1363±0.0244
6.00±0.82
6.17±0.95
4.71±0.16
4.72
1.2154±0.0241
, http://www.100md.com
9.33±0.88*
9.33±0.88*
4.65±0.10
9.44
1.3164±0.0392**
13.33±1.28**
13.67±1.26**
4.77±0.07
18.88
1.3623±0.0316**
, 百拇医药
15.33±1.43**
15.83±1.74**
注:与2.36 mSv/d剂量率点相比,*P<0.05,**P<0.01
图2 HPRT位点变异频率、微核率与剂量率关系
3.从表1、2可见,HPRT Vf与MN率间存在线性相关,对累积剂量而言,其关系式为Y=0.9548+0.0247X,r=0.9841,P<0.01;对不同剂量率而言,其关系式为Y=0.9500+0.0268X,r=0.9792,P<0.01,X代表MN率,Y代表Vf,见图3。
, 百拇医药
图3 HPRT位点变异频率与微核率相关关系
讨论
国内外研究表明,外照射诱发的HPRT基因突变频率在一定剂量范围内随照射剂量的增加而增加,两者存在剂量-效应关系,大多符合线性平方模型[6,7]。有关内照射诱发HPRT基因突变的报道不多。Nicklas等[8]研究发现癌症病人经131I标记抗体放射免疫治疗后,其HPRT基因平均突变频率同治疗前病人相比显著增加(P<0.01),并且突变频率与总剂量间呈正剂量-效应关系。Seifert等[9]用克隆法检测了10名病人在放射性核素99mTc诊断前后的HPRT基因突变频率,发现突变频率从2.09×10-6上升到7.62×10-6。我们的研究结果与上述报道一致,即随累积剂量增加,HPRT Vf也增加,两者间呈正的剂量-效应关系。但与外照射相比有两个方面的差别:一是我们所使用的内照射剂量要比文献报道的外照射剂量低1~2数量级,这种差别的主要原因是由于内照射是一种持续性照射,而外照射是一次性照射;二是HPRT Vf开始数天升高较快,随后较慢,其主要原因是由于体内放射性核素不断衰变与排除,随时间延长,剂量率不断减少所致。 我们所用的晚期混合裂变产物主要含90Sr和137Cs,分别占26.82%和73.15%,90Sr是β辐射源,137Cs是γ辐射源,均属于低LET辐射。文献报道,低LET辐射诱发的淋巴细胞染色体畸变率、MN率存在明显的剂量率效应[10,11]。本实验结果表明,不仅MN率存在剂量率效应,而且HPRT Vf同样也有剂量率效应,随剂量率增加而增高。
, 百拇医药
外周血淋巴细胞染色体畸变率、MN率是公认的辐射生物剂量计,尤其是近年来发展起来的胞质分裂阻断微核法灵敏度更高,结果更趋于真实性。本文研究结果表明,核素内照射诱发的HPRT Vf与MN率间存在线性相关(见图3)。这与Hakoda、史纪兰等[1,12]报道的HPRT位点突变频率与染色体畸变率的关系相一致。
此外,我们研究发现,在最低剂量率点(2.36 mSv/d),混合裂变产物诱发的HPRT Vf高于对照组,而诱发的MN率与对照组无差异,这表明HPRT基因对电离辐射的敏感性高于微核。
参考文献
1 Hakoda M,Akiyama M,Kyoizumi S,et al.Increased somatic cell mutant frequency in atomic bomb survivors.Mutat Res,1988,201:39-48.
, 百拇医药
2 Norman A,Mitchell JC,Iwamoto KS.A sensitive assay for 6-thioguanine-resistant lymphocytes.Mutat Res,1988,208:17-19.
3 徐永忠,劳勤华,赵经涌.大鼠外周血淋巴细胞HPRT基因突变检测的方法学探讨.苏州医学院学报,1988,18:6-8.
4 朱寿彭,李章.放射毒理学.第二版.北京:原子能出版社,1992.141、429、462.
5 ICRP第30号出版物.工作人员的放射性核素摄入量限值.董柳灿译.北京:原子能出版社,1984.157.
6 曹毅,徐洪兰,吴启庆,等.辐射和化学诱变剂体外诱发的人外周血T-淋巴细胞HGPRT位点突变频率的检测.中华放射医学与防护杂志,1996,16:43-46.
, 百拇医药
7 Vijayalaxmi,Evans HJ.Measurement of spontaneous and X-irradiation-induced 6-thioguanine-resistant human lymphocytes using a T-cell coloning technique.Mutat Res,1984,125:87-94.
8 Nicklas JA,O'Neill RJ,Hunter TC,et al.In vivo ionizing irradiations produce deletions in the hprt gene of human T-lymphocytes.Mutat Res,1991,250:383-396.
9 Seifert AM,Bradley WEC,Messing K.Exposure of nuclear medicine patients to ionizing radiation is associated with rise in hprt-mutant frequency in peripheral T-lymphocytes.Mutat Res,1987,191:57-63.
, 百拇医药
10 Bauchinger M,Schmid E,Streng S,et al.Calculation of the dose-rate dependence of the decentric yield after 60Coγ-irradiation of human lymphocytes.Int J Radiat Biol,1979,35:229-235.
11 白玉书,黄绮龙,关树荣,等.用CB法研究低LET辐射诱发微核的剂量率效应.中华放射医学与防护杂志,1992,12:273-275.
12 史纪兰,商希梅,李志荣,等.低剂量X射线诱发人体细胞HPRT基因位点突变的剂量效应关系的研究.中国辐射卫生,1993,2:181-182.
(收稿:1998-08-12 修回1998-11-17), 百拇医药
单位:215007 江苏,苏州医学院放射医学系
关键词:混合裂变产物;HPRT基因突变;微核;剂量效应;剂量率效应
中华放射医学与防护杂志/990515 【摘要】 目的 探索HPRT基因位点突变检测作为辐射生物剂量计的可行性。方法 运用多核细胞法及胞质分裂阻断微核(CBMN)法研究大鼠外周血淋巴细胞的HPRT基因位点突变及微核与累积剂量、剂量率之间关系。结果 静注晚期混合裂变产物后第1天(累积剂量1.73 cSv),与对照组相比,HPRT位点变异频率(Vf)、微核细胞(MNC)率、微核(MN)率均已显著增加(P<0.01)。HPRT Vf,MNC率、MN率与累积剂量间均可拟合成对数回归方程:Y=a+blnX。在总累积剂量近似相等条件下,HPRT Vf,MN率与剂量率之间的关系均可用函数Y=a+blnX表示。HPRT Vf与MN率间存在线性相关。结论 HPRT基因位点对晚期混合裂变产物内照射非常敏感,有明显的剂量效应关系。HPRT基因突变检测可望成为评估电离辐射损伤的生物剂量计。
, http://www.100md.com
Mutations at HPRT loci and micronuclei induced by late fission products in peripheral blood lymphocytes of rats
XU Yongzhong,ZHAO Jingyong,LAO Qinhua.
Faculty of Radiation Medicine,Suzhou Medical College,Suzhou 215007,China
【Abstract】 Objective The probability of mutations at HPRT loci used as a biological dosimeter was studied. Methods With the technique of multinuclear cell and cytokinesis-block micronucleus (CBMN) method,the relationships between mutations at HPRT loci,micronucleus and accmulative doses and dose-rates were studied. Results On the first day after intravenous injection of late fission products(accumulative dose 1.73cSv),by comparison with the control group,the HPRT variant frequencies,micronucleate cell frequencies and micronucleus frequencies increased significantly(P<0.01).There existed relationships between variant frequencies at HPRT locus,micronuclear cell frequencies,micronucleus frequencies and accumulative doses,which could be described by the following regression equation:Y=a+blnX,respectively.At the same accumulative dose,both the relationships between HPRT variant frequencies,micronucleus frequencies and dose-rates could be expressed by the logarithmic regression equation:Y=a+blnX.A good linear relationship between HPRT variant frequencies and micronucleus frequencies was observed. Conclusion HPRT gene locus is an endpoint very sensitive to injurious effects resulting from late fission products and has a good dose-response relationship.
, 百拇医药
【Key words】 Late fission products HPRT gene mutation Micronucleus Dose effects Dose-rate effects
国内外研究表明,体细胞次黄嘌呤鸟嘌呤磷酸核糖转移酶(HPRT)基因位点突变对电离辐射和化学诱变剂非常敏感,电离辐射引起的HPRT基因突变是不可逆的。由于这种不可逆性,使得HPRT基因突变长期存在于体内,可用于急性及慢性小剂量长期照射的剂量估算[1]。尤其在小剂量情况下,其作为生物剂量计比染色体畸变和微核更为敏感。但目前的研究主要集中在外照射,而内照射的研究极为少见。
在体细胞HPRT位点突变体外测试方法中,Norman等建立的多核细胞法具有简单、快速、灵敏、检出率高等特点[2]。本文作者运用多核细胞法及胞质分裂阻断微核法,探讨给大鼠注射晚期混合裂变产物后,其外周血淋巴细胞HPRT Vf与累积剂量和剂量率之间的关系。并与目前广泛应用、行之有效的生物剂量计——MNC率、MN率进行比较。
, 百拇医药
材料和方法
1.材料
晚期混合裂变产物原液放射性浓度为1.82×107 Bq/ml,其组分及比例分别为:90Sr为26.82%,137Cs为73.15%,144Ce-144Pr为0.002%,106Ru-106Rh为0.02%,95Zr-95Nb极微量。细胞松驰素-B(Cyt-B)和6-巯基鸟嘌呤(6-TG)系美国Sigma化学公司产品;RPMI 1640培养基为美国GIBCO公司产品;小牛血清和植物血凝素(PHA)分别为华美生物工程公司、广州医药工业研究所产品。
2.方法
(1)实验动物的处理:实验动物为健康雄性Wistar大鼠,体重(146±19)克,共48只。随机分成1个对照组,4个不同累积剂量组和4个不同剂量率组(其中1个组与不同累积剂量组重叠),每组6只。①对照组:大鼠尾静脉注入pH 3.0生理盐水,注射量为0.5 ml/100 g体重。注入后间隔1天心脏穿刺取血。②不同累积剂量组:大鼠尾静脉注入pH 3.0、放射性浓度为(3.64×105) Bq/ml的混合裂变产物,注射量同①,注入后间隔1、3、6、9天心脏穿刺取血。③不同剂量率组:大鼠尾静脉分别注入pH 3.0、放射性浓度为0.455×105 Bq/ml,0.91×105 Bq/ml,1.82×105及3.64×105 Bq/ml的混合裂变产物,注射量同①,注入后第42、17、6,7和3天(累积剂量近于相等)心脏穿刺取血。每鼠在注射前、取血前各称重1次,并记下体重。
, 百拇医药
(2)培养、收获并制片:大鼠外周血淋巴细胞HPRT基因突变检测的细胞培养、最佳培养条件、收获与制片见文献[3]。每个样本培养2瓶,一瓶加6-TG,另一瓶不加。
(3)阅片:盲法阅片。每个样本计数6 000个转化淋巴细胞数(加6-TG和不加6-TG各3 000个),记录在同一胞浆内具有完整核膜的双核或多核淋巴细胞数(包括相压、相切和分离的双核或多核细胞)。不加6-TG的那份同时计数1 000个双核淋巴细胞中的MNC数及MN数。
(4)HPRT Vf,MNC率和MN率的计算:培养液中含6-TG的1 000个淋巴细胞中双核或多核细胞数除以不含6-TG的1 000个淋巴细胞中双核或多核细胞数,所得结果为HPRT Vf(‰)。1 000个双核淋巴细胞中所含的MNC数、MN数即为MNC率(‰)、MN率(‰)。
(5)内照射累积剂量及剂量率(注射后第1天)估算[4,5]。
, 百拇医药
累积剂量按下式估算:
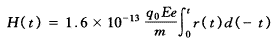
剂量率按下式估算:
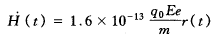
式中:q0为初始注射浓度,Bq;Ee为有效能量,MeV;m为大鼠体重,kg;r(t)为有效滞留函数。
3.统计学处理:HPRT Vf之间的比较用秩和检验(是一种非参数统计,应用时可不考虑被研究的对象为何种分布及分布是否已知,有广泛的适用性),MNC率、MN率之间的比较用χ2检验,HPRT Vf,MNC率、MN率与累积剂量或剂量率之间以及HPRT Vf与MN率之间用计算机进行曲线拟合并绘图。
结果
, 百拇医药
1.HPRT Vf,MNC率及MN率与累积剂量关系见表1。随着累积剂量的增加,HPRT Vf,MNC率和MN率都随之增加,对照组HPRT Vf为1.0311‰、MNC率及MN率均为4.00‰,而受照后第1天,累积剂量达1.73 cSv时,HPRT Vf、MNC率、MN率分别增加到1.2037‰、8.67‰和9.00‰,经统计检验,与对照组比差异都有非常显著性(P<0.01)。HPRT Vf、MNC率及MN率与累积剂量之间可拟合成对数回归方程Y=1.1498+0.1199lnX(R2=0.9706)、Y=6.1102+5.3351lnX(R2=0.9825)和Y=6.1578+5.7512lnX(R2=0.9907)表示,其中X代表累积剂量,Y代表Vf,MNC率及MN率,如图1所示。
表1 HPRT位点变异频率、微核细胞率及微核率与累积剂量关系(
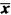 ±s) 注入后
±s) 注入后, 百拇医药
时间(d)
累积剂量
(cSv)
HPRT Vf
(‰)
MNC率
(‰)
MN率
(‰)
对照
0
1.0311±0.0404
4.00±1.03
, 百拇医药
4.00±1.03
1
1.73±0.01
1.2037±0.0377
8.67±1.26*
9.00±1.41*
3
4.76±0.07
1.3623±0.0316*
15.33±1.43*
, http://www.100md.com 15.83±1.74*
6
8.49±0.17
1.4046±0.0264*
17.17±1.66*
18.33±1.91*
9
11.96±0.37
1.4353±0.0274*
19.17±1.68*
, 百拇医药
20.17±1.85*
注:与对照组相比,*P<0.01

图1 HPRT位点变异频率、微核细胞率、微核率与累积剂量关系
2.在总累积剂量近似相等条件下(约4.68 cSv),HPRT Vf,MNC率及MN率与剂量率之间的关系见表2。HPRT Vf,MNC率与MN率与剂量率之间均呈正相关。经统计检验,4个剂量率点间HPRT Vf,MNC率、MN率总体上差异都有非常显著性(P<0.01),最小剂量率点(2.36 mSv/d),与对照组相比,HPRT Vf差异有显著性(P<0.05),而MNC率及MN率差异无显著性(P>0.05)。经曲线拟合,HPRT Vf和剂量率间可用方程Y=1.0442+0.1124lnX(R2=0.9815)表示、MN率和剂量率之间可用方程Y=2.1244+4.8071lnX(R2=0.9855)表示,其中X代表剂量率,Y代表Vf和MN率。如图2所示。
, 百拇医药
表2 HPRT位点变异频率、微核细胞率及微核率与剂量率关系(
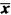 ±s) 累积剂量
±s) 累积剂量(cSv)
剂量率
(mSv/d)
HPRT Vf
(‰)
MNC率
(‰)
MN率
(‰)
0
, http://www.100md.com
0
1.0311±0.0404
4.00±1.03
4.00±1.03
4.60±0.22
2.26
1.1363±0.0244
6.00±0.82
6.17±0.95
4.71±0.16
4.72
1.2154±0.0241
, http://www.100md.com
9.33±0.88*
9.33±0.88*
4.65±0.10
9.44
1.3164±0.0392**
13.33±1.28**
13.67±1.26**
4.77±0.07
18.88
1.3623±0.0316**
, 百拇医药
15.33±1.43**
15.83±1.74**
注:与2.36 mSv/d剂量率点相比,*P<0.05,**P<0.01

图2 HPRT位点变异频率、微核率与剂量率关系
3.从表1、2可见,HPRT Vf与MN率间存在线性相关,对累积剂量而言,其关系式为Y=0.9548+0.0247X,r=0.9841,P<0.01;对不同剂量率而言,其关系式为Y=0.9500+0.0268X,r=0.9792,P<0.01,X代表MN率,Y代表Vf,见图3。

, 百拇医药
图3 HPRT位点变异频率与微核率相关关系
讨论
国内外研究表明,外照射诱发的HPRT基因突变频率在一定剂量范围内随照射剂量的增加而增加,两者存在剂量-效应关系,大多符合线性平方模型[6,7]。有关内照射诱发HPRT基因突变的报道不多。Nicklas等[8]研究发现癌症病人经131I标记抗体放射免疫治疗后,其HPRT基因平均突变频率同治疗前病人相比显著增加(P<0.01),并且突变频率与总剂量间呈正剂量-效应关系。Seifert等[9]用克隆法检测了10名病人在放射性核素99mTc诊断前后的HPRT基因突变频率,发现突变频率从2.09×10-6上升到7.62×10-6。我们的研究结果与上述报道一致,即随累积剂量增加,HPRT Vf也增加,两者间呈正的剂量-效应关系。但与外照射相比有两个方面的差别:一是我们所使用的内照射剂量要比文献报道的外照射剂量低1~2数量级,这种差别的主要原因是由于内照射是一种持续性照射,而外照射是一次性照射;二是HPRT Vf开始数天升高较快,随后较慢,其主要原因是由于体内放射性核素不断衰变与排除,随时间延长,剂量率不断减少所致。 我们所用的晚期混合裂变产物主要含90Sr和137Cs,分别占26.82%和73.15%,90Sr是β辐射源,137Cs是γ辐射源,均属于低LET辐射。文献报道,低LET辐射诱发的淋巴细胞染色体畸变率、MN率存在明显的剂量率效应[10,11]。本实验结果表明,不仅MN率存在剂量率效应,而且HPRT Vf同样也有剂量率效应,随剂量率增加而增高。
, 百拇医药
外周血淋巴细胞染色体畸变率、MN率是公认的辐射生物剂量计,尤其是近年来发展起来的胞质分裂阻断微核法灵敏度更高,结果更趋于真实性。本文研究结果表明,核素内照射诱发的HPRT Vf与MN率间存在线性相关(见图3)。这与Hakoda、史纪兰等[1,12]报道的HPRT位点突变频率与染色体畸变率的关系相一致。
此外,我们研究发现,在最低剂量率点(2.36 mSv/d),混合裂变产物诱发的HPRT Vf高于对照组,而诱发的MN率与对照组无差异,这表明HPRT基因对电离辐射的敏感性高于微核。
参考文献
1 Hakoda M,Akiyama M,Kyoizumi S,et al.Increased somatic cell mutant frequency in atomic bomb survivors.Mutat Res,1988,201:39-48.
, 百拇医药
2 Norman A,Mitchell JC,Iwamoto KS.A sensitive assay for 6-thioguanine-resistant lymphocytes.Mutat Res,1988,208:17-19.
3 徐永忠,劳勤华,赵经涌.大鼠外周血淋巴细胞HPRT基因突变检测的方法学探讨.苏州医学院学报,1988,18:6-8.
4 朱寿彭,李章.放射毒理学.第二版.北京:原子能出版社,1992.141、429、462.
5 ICRP第30号出版物.工作人员的放射性核素摄入量限值.董柳灿译.北京:原子能出版社,1984.157.
6 曹毅,徐洪兰,吴启庆,等.辐射和化学诱变剂体外诱发的人外周血T-淋巴细胞HGPRT位点突变频率的检测.中华放射医学与防护杂志,1996,16:43-46.
, 百拇医药
7 Vijayalaxmi,Evans HJ.Measurement of spontaneous and X-irradiation-induced 6-thioguanine-resistant human lymphocytes using a T-cell coloning technique.Mutat Res,1984,125:87-94.
8 Nicklas JA,O'Neill RJ,Hunter TC,et al.In vivo ionizing irradiations produce deletions in the hprt gene of human T-lymphocytes.Mutat Res,1991,250:383-396.
9 Seifert AM,Bradley WEC,Messing K.Exposure of nuclear medicine patients to ionizing radiation is associated with rise in hprt-mutant frequency in peripheral T-lymphocytes.Mutat Res,1987,191:57-63.
, 百拇医药
10 Bauchinger M,Schmid E,Streng S,et al.Calculation of the dose-rate dependence of the decentric yield after 60Coγ-irradiation of human lymphocytes.Int J Radiat Biol,1979,35:229-235.
11 白玉书,黄绮龙,关树荣,等.用CB法研究低LET辐射诱发微核的剂量率效应.中华放射医学与防护杂志,1992,12:273-275.
12 史纪兰,商希梅,李志荣,等.低剂量X射线诱发人体细胞HPRT基因位点突变的剂量效应关系的研究.中国辐射卫生,1993,2:181-182.
(收稿:1998-08-12 修回1998-11-17), 百拇医药