60Co γ射线对BEP2D细胞氧化损伤的研究
作者:朱茂祥 杨陟华 龚诒芬 徐勇
单位:朱茂祥(100850 北京放射医学研究所);杨陟华(100850 北京放射医学研究所);龚诒芬(100850 北京放射医学研究所);徐勇(美国印第安那大学医学院药理毒理研究室)
关键词:60Co;γ射线照射;BEP2D细胞;活性氧;8-羟基脱氧鸟嘌呤;硒
中华放射医学与防护杂志000408 【摘要】 目的 研究60Co γ射线照射人乳头状病毒永生化的人支气管上皮细胞(BEP2D)产生的活性氧(ROS)及其对DNA的氧化损伤,以及纳米硒的保护作用。方法 细胞上清中过氧化氢(H2O2)、超氧阴离子( )以及羟自由基(.OH)含量分别用辣根过氧化物酶介导的酚红氧化法、细胞色素C还原法和番红花红退色法进行测定;细胞内H2O2和
)以及羟自由基(.OH)含量分别用辣根过氧化物酶介导的酚红氧化法、细胞色素C还原法和番红花红退色法进行测定;细胞内H2O2和 分别用2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)和氢化乙锭(HE)标记,用流式细胞法测定荧光产物2’,7’-二氯荧光黄(DCF)和溴乙锭(EB)荧光强度;8-羟基脱氧鸟嘌呤(OH8dG)含量用高压液相色谱结合电化学方法(HPLC-ECD)测定。结果 BEP2D细胞经不同剂量的60Co γ射线照射后,细胞内及细胞上清中产生的ROS以及OH8dG含量均显著增加,并有较好的剂量效应关系。1 μmol/L的纳米硒能明显减少60Co γ射线照射后BEP2D细胞产生的ROS及OH8dG水平。结论 60Co γ射线照射能造成细胞的氧化损伤,纳米硒对60Co γ射线照射所致细胞的氧化损伤有保护作用。
分别用2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)和氢化乙锭(HE)标记,用流式细胞法测定荧光产物2’,7’-二氯荧光黄(DCF)和溴乙锭(EB)荧光强度;8-羟基脱氧鸟嘌呤(OH8dG)含量用高压液相色谱结合电化学方法(HPLC-ECD)测定。结果 BEP2D细胞经不同剂量的60Co γ射线照射后,细胞内及细胞上清中产生的ROS以及OH8dG含量均显著增加,并有较好的剂量效应关系。1 μmol/L的纳米硒能明显减少60Co γ射线照射后BEP2D细胞产生的ROS及OH8dG水平。结论 60Co γ射线照射能造成细胞的氧化损伤,纳米硒对60Co γ射线照射所致细胞的氧化损伤有保护作用。
, 百拇医药
Oxidative damage of BEP2D cells irradiated 60Co γ-rays
ZHU Maoxiang,YANG Zhihua,GONG Yifen,et al.
(Institute of Radiation Medicine,Beijing 100850,China)
【Abstract】 Objective To study reactive oxygen species (ROS) productions and oxidative DNA damage in HPV-16 immortalized human bronchial epithelial cells(BEP2D) irradiated with 60Co γ-rays. Methods The measurement of extracellular superoxide anions ( ) was based on the reduction of ferricytochrome C as assayed by the increase in its absorbance at 550 nm.Quantitation of extracellular hydrogen peroxides (H2O2) was based on the horseradish peroxidase-dependent oxidation of phenol red which is assayed by its increased absorbance at 620 nm.The determination of extracellular hydroxyl radicals (.OH) was based on decoloration of safranine T as assayed by the decrease in its absorbance at 520 nm.Ethidium bromide and 2',7'-dichlorofluorescein,fluorescent products of the membrane-permeable dyes-hydroethine and 2',7'-dichloroflurescin diacetate,were used to monitor the intracellular production of H2O2 and
) was based on the reduction of ferricytochrome C as assayed by the increase in its absorbance at 550 nm.Quantitation of extracellular hydrogen peroxides (H2O2) was based on the horseradish peroxidase-dependent oxidation of phenol red which is assayed by its increased absorbance at 620 nm.The determination of extracellular hydroxyl radicals (.OH) was based on decoloration of safranine T as assayed by the decrease in its absorbance at 520 nm.Ethidium bromide and 2',7'-dichlorofluorescein,fluorescent products of the membrane-permeable dyes-hydroethine and 2',7'-dichloroflurescin diacetate,were used to monitor the intracellular production of H2O2 and  respectively by flow cytometry.8-hydroxydeoxygunosine (OH8dG) was examined with HPLC-ECD from extracted DNA. Results The ROS production including H2O2,
respectively by flow cytometry.8-hydroxydeoxygunosine (OH8dG) was examined with HPLC-ECD from extracted DNA. Results The ROS production including H2O2, and *.OH,and DNA adduct OH8dG in 60Co γ-rays-irradiated BEP2D cells increased remarkably,and these increments could be inhibited effectively by 1 μmol/L of selenium. Conclusion 60Co γ-irradiation causes oxidative damage to BEP2D cells,which can be protected by selenium.
and *.OH,and DNA adduct OH8dG in 60Co γ-rays-irradiated BEP2D cells increased remarkably,and these increments could be inhibited effectively by 1 μmol/L of selenium. Conclusion 60Co γ-irradiation causes oxidative damage to BEP2D cells,which can be protected by selenium.
, 百拇医药
【Key words】 60Co γ-ray irradiation; HPV-16 immortalized human bronchial epithelial cell; Reactive oxygen species; 8-Hydroxydeoxygunosine; Selenium
业已证实,辐射能引起人类和动物的多种肿瘤发生以及细胞的恶性转化[1,2]。电离辐射除通过能量传递的直接作用外,还能通过水的辐解反应大量产生包括活性氧(ROS)在内的多种自由基的间接作用对生物体造成损伤[3,4]。自由基对生物大分子,特别是对DNA的氧化损伤被认为是启动和促进肿瘤发生发展的最重要因素[5,6]。近年来的研究表明,ROS作用DNA形成的多种形式的碱基加合物可能是致DNA氧化损伤并引发肿瘤的关键因素[7],其中8-羟基脱氧鸟嘌呤(OH8dG)被认为是氧化DNA损伤的标志产物[8]。
, http://www.100md.com
本研究用HVP-16病毒永生化的人支气管上皮细胞(BEP2D)为靶,研究60Co γ射线照射诱发产生的ROS及其对DNA氧化损伤,并观察抗氧化剂硒对60Co γ射线照射诱发BEP2D细胞产生ROS的抑制作用和对DNA氧化损伤的保护效果。目前国内外尚少见相关的研究报道。
材料和方法
1.试剂:纳米硒(合肥纳米保健品有限公司)用LHC-8完全培养液(Biofluids Inc.)配成1 μmol/L培养细胞;2’,7’-二氯荧光黄双乙酸盐(DCFH-DA,Molecular Probes,Eugene,OR)用无水乙醇溶解(20 mmol/L);氢化乙锭(HE,Molecular Probes,Eugene,OR)用DMSO(Sigma)溶解(10 mmol/L);过氧化氢(H2O2,30% W/V)用去离子水稀释(10 mmol/L);辣根过氧化物酶(HRP,VI-A型,RZ>3,1 000 U/mg,Sigma)、细胞色素C(Ⅲ型,马心,Sigma)、酚红(Sigma)和番红花红T(北京东环联合化工厂)在使用前用Hank's液配制;蛋白酶K(19 U/mg,Sigma)配成20 mg/ml贮液;RNase(8 600 U/mg,Sigma)和细胞裂解缓冲液一起配制;其他普通生物化学试剂均为市售商品。
, http://www.100md.com
2.细胞培养和收集:人乳头状病毒永生化的人支气管上皮细胞系(BEP2D,美国国立癌症研究所Harris教授提供,美国哥伦比亚大学放射生物研究中心Dr.Hei TK处引进)用LHC-8完全培养液(或含1 μmol/L纳米硒)在37℃、体积分数为5%的CO2和95%湿度条件下培养。细胞收集时,用含0.05%胰酶(Sigma)和0.02% EDTA-4Na 的d-Hank's液消化。
3.细胞照射:细胞在本所钴源室进行照射,照射量率为2.50~2.70 C.kg-1.min-1,照射距离4 m,细胞吸收剂量(照射时间)分别为:0.25 Gy(5.9~5.2 s)、0.50 Gy(15.5~14.1 s)、1.00 Gy(34.7~31.8 s)和2.00 Gy(73.0~67.4 s)。
4.细胞上清ROS测定:指数生长的BEP2D或BEP2D+Se细胞按1.0×105/孔接种96孔板培养过夜。倒掉培养液,细胞用Hank's液洗涤1~2次,加入活性氧的捕获剂,并用Hank's液补充至100 μl/孔,经60Co γ射线照射后于37℃培养2 h。用酶联仪(Multiskan MS)测定细胞上清ROS。其中,超氧阴离子( )用终浓度为50 μmol/L的细胞色素C捕获,通过测定550 nm吸收值的增加进行定量[9];羟自由基(.OH)用终浓度为50 μmol/L的番红花红T捕获,通过测定520 nm吸收值的减少进行定量[10];H2O2用终浓度20 U/ml的HRP和10 μg/ml的酚红捕获,通过测定620 nm吸收值增加,并用H2O2的标准曲线进行定量[11]。
)用终浓度为50 μmol/L的细胞色素C捕获,通过测定550 nm吸收值的增加进行定量[9];羟自由基(.OH)用终浓度为50 μmol/L的番红花红T捕获,通过测定520 nm吸收值的减少进行定量[10];H2O2用终浓度20 U/ml的HRP和10 μg/ml的酚红捕获,通过测定620 nm吸收值增加,并用H2O2的标准曲线进行定量[11]。
, http://www.100md.com
5.细胞内ROS探测[12]:指数生长的BEP2D或BEP2D+Se细胞分别用DCFH-DA(终浓度为20 μmol/L)和/或HE(终浓度为10 μmol/L)标记,37℃保温5 min后行60Co γ射线照射,继续保温2 h后,置冰浴冷却,立即用流式细胞仪(FACS 440,Becton Dickinson)进行分析测定。在细胞中,DCFH-DA被H2O2氧化2’,7’-二氯荧光黄(DCF),HE被O2转化为溴乙锭(EB),DCF和EB能分别产生绿色和红色荧光,测定细胞内DCF和/或EB的荧光强度,即可相对定量细胞内H2O2和 水平。
水平。
6.DNA加合物测定[13]:指数生长的BEP2D或BEP2D+Se细胞(3×106)经60Co γ射线照射后2 h收集细胞,用蛋白酶K和RNase消化,并用非酚法提取DNA,用高压液相色谱结合电化学方法测量OH8dG含量。
, 百拇医药
7.统计学处理:采用t检验。
结 果
1.60Co γ射线照射诱发BEP2D细胞上清产生的ROS增高及纳米硒的抑制作用
BEP2D和BEP2D+Se细胞经不同剂量的60Co γ射线照射后,细胞上清中ROS测定结果如表1所示。可以看出,BEP2D细胞上清中H2O2和.OH自由基含量与60Co γ射线在0.25~1.00 Gy范围内有明确的剂量反应关系, 含量随60 Co γ射线剂量的增高也明显增高。1 μmol/L纳米硒对60Co γ射线照射诱发BEP2D细胞上清中ROS水平的增高有明显抑制作用。
含量随60 Co γ射线剂量的增高也明显增高。1 μmol/L纳米硒对60Co γ射线照射诱发BEP2D细胞上清中ROS水平的增高有明显抑制作用。
, 百拇医药
表1 60Co γ射线照射后BEP2D细胞上清中活性氧测定结果( ±s) 吸收剂量(Gy)
±s) 吸收剂量(Gy)
H2O2(nmol/106细胞)
O2(pmol/106细胞)
.OH(pmol/106细胞)
BEP2D
BEP2D+Se
BEP2D
, http://www.100md.com
BEP2D+Se
BEP2D
BEP2D+Se
0.25
0.088±0.018
0.042±0.003**
0.95±0.14
0.34±0.06
0.494±0.092
0.265±0.089
0.50
, 百拇医药
0.151±0.036
0.054±0.008**
1.15±0.21
0.53±0.08**
0.714±0.209
0.358±0.109*
1.00
0.239±0.078
0.094±0.022*
1.31±0.24
, 百拇医药
0.65±0.14**
1.020±0.280
0.479±0.102*
2.00
0.194±0.053
0.052±0.006**
1.56±0.33
0.65±0.17**
1.023±0.185
0.614±0.176*
, 百拇医药
注:与相应对照BEP2D细胞比较,*P<0.05,**P<0.01
2.60Co γ射线照射诱发BEP2D细胞内产生的ROS增高及纳米硒的抑制作用
BEP2D和BEP2D+Se细胞经不同剂量的60Co γ射线照射后,细胞内ROS测定结果如图1所示。可以看出,60Co γ射线照射可诱发BEP2D细胞内H2O2和O2自由基水平显著增高,并有良好的剂量反应关系。1 μmol/L纳米硒对60Co γ射线照射诱发BEP2D细胞内ROS水平的增高有明显抑制作用。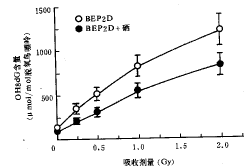
图1 60Co γ射线照射诱发BEP2D细胞内H2O2和O2自由基水平增高及纳米硒的抑制作用
, http://www.100md.com
以未受60Co γ射线照射的BEP2D+Se细胞作为对照,将其细胞内DCF或EB荧光强度定为0
3.60Co γ射线照射诱发BEP2D细胞OH8dG含量增高及纳米硒的抑制
BEP2D和BEP2D+Se细胞经不同剂量60Co γ射线照射后,细胞DNA加合物——OH8dG含量测定结果如图2所示。可见,60Co γ射线照射可诱发BEP2D细胞OH8dG含量显著增高,并有较好的剂量效应关系。1 μmol/L的纳米硒对60Co γ射线照射诱发BEP2D细胞OH8dG含量的增高有明显的抑制作用。
图2 60Co γ射线照射诱发BEP2D细胞DNA
, 百拇医药
加合物OH8dG含量增高及纳米硒的抑制作用
以上结果表明,60Co γ射线照射可诱发BEP2D细胞产生大量的ROS,并导致DNA加合物OH8dG含量急剧增高,提示60Co γ射线照射可造成BEP2D细胞的氧化损伤,1 μmol/L的纳米硒对60Co γ射线照射所致BEP2D细胞的氧化损伤有明显的保护效果。
讨 论
流行病学的研究结果表明,在辐射诱发的人类肿瘤中,除白血病外,肺癌的发生率和死亡率都占很高的比例[14]。支气管上皮细胞是肺癌发生的主要细胞来源,BEP2D是目前唯一由人类病毒永生化的人来源的支气管上皮细胞,为近二倍体核型,在裸鼠体内8月内无致瘤性[15]。用此细胞研究的结果,在一定程度上模拟了辐射诱发人类肺癌致癌病毒感染后接触化学致癌剂的条件。
, http://www.100md.com
活性氧等自由基不但可以造成DNA发生断裂和交换等多种损伤,还可以和DNA分子反应产生多种DNA加合物[16]。此外,过氧化氢还能导致多种细胞中癌基因c-fos、c-jun、c-myc和c-Ha-ras的表达发生改变[17]。本研究结果表明,60Co γ射线照射BEP2D细胞后,细胞内H2O2、 以及细胞上清中H2O2、
以及细胞上清中H2O2、 和.OH水平均明显增高,并在一定浓度范围内有较好的剂量效应关系。提示60Co γ射线照射产生的活性氧等自由基与细胞氧化损伤可能密切相关。值得一提的是,高剂量的60Co γ射线(如2.00 Gy)可能对细胞有杀伤作用,导致产生的过氧化氢和羟自由基反而减少。细胞内活性氧的测定结果也证实了这一点,由于流式细胞分析只记录活细胞中的荧光强度,随60Co γ射线照射剂量的增高,细胞内活性氧也进一步增高。
和.OH水平均明显增高,并在一定浓度范围内有较好的剂量效应关系。提示60Co γ射线照射产生的活性氧等自由基与细胞氧化损伤可能密切相关。值得一提的是,高剂量的60Co γ射线(如2.00 Gy)可能对细胞有杀伤作用,导致产生的过氧化氢和羟自由基反而减少。细胞内活性氧的测定结果也证实了这一点,由于流式细胞分析只记录活细胞中的荧光强度,随60Co γ射线照射剂量的增高,细胞内活性氧也进一步增高。
, 百拇医药
活性氧等自由基与细胞中大分子如脂质、蛋白质、DNA作用形成一系列加合物是其造成细胞氧化损伤的主要原因之一。特别是与DNA作用产生的DNA加合物很容易引起DNA复制时发生碱基错配,从而引起DNA的点突变[18]。OH8dG是活性氧等自由基与DNA作用后所形成的多种加合物中最重要的一种,被认为是DNA氧化损伤的标志产物,并能导致基因的G-C→T-A突变[19]。本研究结果表明,60Co γ射线照射的剂量与BEP2D细胞中OH8dG水平以及活性氧含量呈正相关,证实60Co γ射线照射可造成细胞特别是DNA的氧化损伤。
硒是细胞中谷胱甘肽过氧化物酶的重要组成成分,能有效抑制或清除细胞中多种自由基,具有广谱的抗氧化功能[20]。纳米硒是纳米级的元素硒,与一般无机硒或有机硒相比,具有高效低毒的特点,已被卫生部批准为营养保健食品。本研究用纳米硒作为抗氧化剂,观察它对60Co γ射线诱发BEP2D细胞产生的活性氧的DNA氧化损伤的保护效果,结果表明,1 μmol/L的纳米硒对60Co γ射线诱发BEP2D细胞活性氧和OH8dG含量的增高均有明显的抑制作用。正是由于纳米硒对活性氧产生的抑制或清除作用,从而降低了细胞中DNA加合物(OH8dG)的水平,这也从另一方面佐证了60Co γ射线诱发BEP2D细胞产生的活性氧对DNA的氧化损伤作用。
, http://www.100md.com
基金项目:国家自然科学青年基金资助项目(39700030)
参考文献
1, UNSCEAR.Sources,effects and risks of ionizing radiation.1988 report to the general assembly,with annexes.United Nations sales publication E.88.IX.7.New York:United Nations,1988.
2, 龚诒芬,朱茂祥.辐射致体外细胞转化及其机理.夏寿萱主编.放射生物学.北京:军事医学科学出版社,1998.353-412.
3, Tubiana M,Dutreix J,Wambersia A.Introduction to radiobiology.London:Burgess Science Press,1990.22-33.
, http://www.100md.com
4, Glass WA,Varma MN.Physical and chemical mechanisms in molecular radiation biology.New York:Plenum Press,1991.231-256.
5, 陈瑗,周玫主编.自由基医学.北京:人民军医出版社,1991.258-296.
6, Floyd R.Role of oxygen free radicals in carcinogenesis and brain ischemia.FASEB J.1990,4:2587-2597.
7, Tokeuchi T,Nakajima M,Morimoto K.Relationship between the intracellular reactive oxygen species and the induction of oxidative DNA damage in human neutrophil-like cells.Carcinogenesis,1996,17:1543-1548.
, 百拇医药
8, Lunec J,Herbert K.8-Hydroxy-deoxyguanosine.A marker of oxidative DNA damage in systemic lupus erythrocytes.FEBS Letts,1994,348:131-138.
9, Pick E,Mizel D.Rapid microassays for the measurement of superoxide and hydrogen peroxide production by macrophages in culture using an automatic enzyme immunoassay reacted.J Immunol Methods,1981,46:211-226.
10, 王巨存,邢国胜,胡文铎,等.有机锗Ge-132对氧自由基和羟自由基诱导的脂质过氧化的影响.中国药学杂志,1994,29:23-25.
, 百拇医药
11, Pick E,Keisari Y.A simple colorimetric method for the measurement of hydrogen peroxide produced by cells in culture.J Immunol Methods,1980,38:161-170.
12, Rothe G,Valet G.Flow cytometic analysis of respiratory burst activity in phagocytes with hydroethidine and 2',7'-dichlorofluorescin.J Leukocyte Biol,1990,47:440-448.
13, Takeuchi T,Nakajima M,Ohta Y,et al.Evaluation of 8-hydroxydeoxyguanosine,a typical oxidative DNA damage,in human leukocytes.Carcinogenesis,1994,15:1519-1523.
, 百拇医药
14, Land CE.Temporal distributions of risk for radiation-induced cancers.J Chron Dis,1987,40(Suppl 2):45s-57s.
15, Willey JC,Broussoud A,Sleemi A,et al.Immortalization of normal human bronchial epithelial cells by human papillomaviruses 16 or 18.Cancer Res,1991,51:5370-5377.
16, 方允中,李文杰主编.自由基与酶.北京:科学出版社,1989.261-271.
17, 宋元宗,祝其锋,莫丽儿.H2O2与癌基因表达.自由基生命科学进展,1996,4:115-118.
, http://www.100md.com
18, Loechler EL.The role of adduct site-specific mutagenesis in understanding how carcinogen-DNA adducts cause mutation:perspective,prospects and problem.Carcinogenesis,1996,17:895-902.
19, Cheng KC,Cahill DS,Kasai H,et al.8-Hydroxy-deoxyguanine,an abundant form of oxidative DNA damage,causes G-T and A-C substitutions.J Biol Chem,1992,267:166-172.
20, Bronzetti G,della Croce C.Selenium:its important roles in life and contrasting aspects.JE PTO,1993,12:59-71.
(收稿日期:1999-09-26), 百拇医药
单位:朱茂祥(100850 北京放射医学研究所);杨陟华(100850 北京放射医学研究所);龚诒芬(100850 北京放射医学研究所);徐勇(美国印第安那大学医学院药理毒理研究室)
关键词:60Co;γ射线照射;BEP2D细胞;活性氧;8-羟基脱氧鸟嘌呤;硒
中华放射医学与防护杂志000408 【摘要】 目的 研究60Co γ射线照射人乳头状病毒永生化的人支气管上皮细胞(BEP2D)产生的活性氧(ROS)及其对DNA的氧化损伤,以及纳米硒的保护作用。方法 细胞上清中过氧化氢(H2O2)、超氧阴离子(
 )以及羟自由基(.OH)含量分别用辣根过氧化物酶介导的酚红氧化法、细胞色素C还原法和番红花红退色法进行测定;细胞内H2O2和
)以及羟自由基(.OH)含量分别用辣根过氧化物酶介导的酚红氧化法、细胞色素C还原法和番红花红退色法进行测定;细胞内H2O2和 分别用2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)和氢化乙锭(HE)标记,用流式细胞法测定荧光产物2’,7’-二氯荧光黄(DCF)和溴乙锭(EB)荧光强度;8-羟基脱氧鸟嘌呤(OH8dG)含量用高压液相色谱结合电化学方法(HPLC-ECD)测定。结果 BEP2D细胞经不同剂量的60Co γ射线照射后,细胞内及细胞上清中产生的ROS以及OH8dG含量均显著增加,并有较好的剂量效应关系。1 μmol/L的纳米硒能明显减少60Co γ射线照射后BEP2D细胞产生的ROS及OH8dG水平。结论 60Co γ射线照射能造成细胞的氧化损伤,纳米硒对60Co γ射线照射所致细胞的氧化损伤有保护作用。
分别用2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)和氢化乙锭(HE)标记,用流式细胞法测定荧光产物2’,7’-二氯荧光黄(DCF)和溴乙锭(EB)荧光强度;8-羟基脱氧鸟嘌呤(OH8dG)含量用高压液相色谱结合电化学方法(HPLC-ECD)测定。结果 BEP2D细胞经不同剂量的60Co γ射线照射后,细胞内及细胞上清中产生的ROS以及OH8dG含量均显著增加,并有较好的剂量效应关系。1 μmol/L的纳米硒能明显减少60Co γ射线照射后BEP2D细胞产生的ROS及OH8dG水平。结论 60Co γ射线照射能造成细胞的氧化损伤,纳米硒对60Co γ射线照射所致细胞的氧化损伤有保护作用。, 百拇医药
Oxidative damage of BEP2D cells irradiated 60Co γ-rays
ZHU Maoxiang,YANG Zhihua,GONG Yifen,et al.
(Institute of Radiation Medicine,Beijing 100850,China)
【Abstract】 Objective To study reactive oxygen species (ROS) productions and oxidative DNA damage in HPV-16 immortalized human bronchial epithelial cells(BEP2D) irradiated with 60Co γ-rays. Methods The measurement of extracellular superoxide anions (
 ) was based on the reduction of ferricytochrome C as assayed by the increase in its absorbance at 550 nm.Quantitation of extracellular hydrogen peroxides (H2O2) was based on the horseradish peroxidase-dependent oxidation of phenol red which is assayed by its increased absorbance at 620 nm.The determination of extracellular hydroxyl radicals (.OH) was based on decoloration of safranine T as assayed by the decrease in its absorbance at 520 nm.Ethidium bromide and 2',7'-dichlorofluorescein,fluorescent products of the membrane-permeable dyes-hydroethine and 2',7'-dichloroflurescin diacetate,were used to monitor the intracellular production of H2O2 and
) was based on the reduction of ferricytochrome C as assayed by the increase in its absorbance at 550 nm.Quantitation of extracellular hydrogen peroxides (H2O2) was based on the horseradish peroxidase-dependent oxidation of phenol red which is assayed by its increased absorbance at 620 nm.The determination of extracellular hydroxyl radicals (.OH) was based on decoloration of safranine T as assayed by the decrease in its absorbance at 520 nm.Ethidium bromide and 2',7'-dichlorofluorescein,fluorescent products of the membrane-permeable dyes-hydroethine and 2',7'-dichloroflurescin diacetate,were used to monitor the intracellular production of H2O2 and  respectively by flow cytometry.8-hydroxydeoxygunosine (OH8dG) was examined with HPLC-ECD from extracted DNA. Results The ROS production including H2O2,
respectively by flow cytometry.8-hydroxydeoxygunosine (OH8dG) was examined with HPLC-ECD from extracted DNA. Results The ROS production including H2O2, and *.OH,and DNA adduct OH8dG in 60Co γ-rays-irradiated BEP2D cells increased remarkably,and these increments could be inhibited effectively by 1 μmol/L of selenium. Conclusion 60Co γ-irradiation causes oxidative damage to BEP2D cells,which can be protected by selenium.
and *.OH,and DNA adduct OH8dG in 60Co γ-rays-irradiated BEP2D cells increased remarkably,and these increments could be inhibited effectively by 1 μmol/L of selenium. Conclusion 60Co γ-irradiation causes oxidative damage to BEP2D cells,which can be protected by selenium., 百拇医药
【Key words】 60Co γ-ray irradiation; HPV-16 immortalized human bronchial epithelial cell; Reactive oxygen species; 8-Hydroxydeoxygunosine; Selenium
业已证实,辐射能引起人类和动物的多种肿瘤发生以及细胞的恶性转化[1,2]。电离辐射除通过能量传递的直接作用外,还能通过水的辐解反应大量产生包括活性氧(ROS)在内的多种自由基的间接作用对生物体造成损伤[3,4]。自由基对生物大分子,特别是对DNA的氧化损伤被认为是启动和促进肿瘤发生发展的最重要因素[5,6]。近年来的研究表明,ROS作用DNA形成的多种形式的碱基加合物可能是致DNA氧化损伤并引发肿瘤的关键因素[7],其中8-羟基脱氧鸟嘌呤(OH8dG)被认为是氧化DNA损伤的标志产物[8]。
, http://www.100md.com
本研究用HVP-16病毒永生化的人支气管上皮细胞(BEP2D)为靶,研究60Co γ射线照射诱发产生的ROS及其对DNA氧化损伤,并观察抗氧化剂硒对60Co γ射线照射诱发BEP2D细胞产生ROS的抑制作用和对DNA氧化损伤的保护效果。目前国内外尚少见相关的研究报道。
材料和方法
1.试剂:纳米硒(合肥纳米保健品有限公司)用LHC-8完全培养液(Biofluids Inc.)配成1 μmol/L培养细胞;2’,7’-二氯荧光黄双乙酸盐(DCFH-DA,Molecular Probes,Eugene,OR)用无水乙醇溶解(20 mmol/L);氢化乙锭(HE,Molecular Probes,Eugene,OR)用DMSO(Sigma)溶解(10 mmol/L);过氧化氢(H2O2,30% W/V)用去离子水稀释(10 mmol/L);辣根过氧化物酶(HRP,VI-A型,RZ>3,1 000 U/mg,Sigma)、细胞色素C(Ⅲ型,马心,Sigma)、酚红(Sigma)和番红花红T(北京东环联合化工厂)在使用前用Hank's液配制;蛋白酶K(19 U/mg,Sigma)配成20 mg/ml贮液;RNase(8 600 U/mg,Sigma)和细胞裂解缓冲液一起配制;其他普通生物化学试剂均为市售商品。
, http://www.100md.com
2.细胞培养和收集:人乳头状病毒永生化的人支气管上皮细胞系(BEP2D,美国国立癌症研究所Harris教授提供,美国哥伦比亚大学放射生物研究中心Dr.Hei TK处引进)用LHC-8完全培养液(或含1 μmol/L纳米硒)在37℃、体积分数为5%的CO2和95%湿度条件下培养。细胞收集时,用含0.05%胰酶(Sigma)和0.02% EDTA-4Na 的d-Hank's液消化。
3.细胞照射:细胞在本所钴源室进行照射,照射量率为2.50~2.70 C.kg-1.min-1,照射距离4 m,细胞吸收剂量(照射时间)分别为:0.25 Gy(5.9~5.2 s)、0.50 Gy(15.5~14.1 s)、1.00 Gy(34.7~31.8 s)和2.00 Gy(73.0~67.4 s)。
4.细胞上清ROS测定:指数生长的BEP2D或BEP2D+Se细胞按1.0×105/孔接种96孔板培养过夜。倒掉培养液,细胞用Hank's液洗涤1~2次,加入活性氧的捕获剂,并用Hank's液补充至100 μl/孔,经60Co γ射线照射后于37℃培养2 h。用酶联仪(Multiskan MS)测定细胞上清ROS。其中,超氧阴离子(
 )用终浓度为50 μmol/L的细胞色素C捕获,通过测定550 nm吸收值的增加进行定量[9];羟自由基(.OH)用终浓度为50 μmol/L的番红花红T捕获,通过测定520 nm吸收值的减少进行定量[10];H2O2用终浓度20 U/ml的HRP和10 μg/ml的酚红捕获,通过测定620 nm吸收值增加,并用H2O2的标准曲线进行定量[11]。
)用终浓度为50 μmol/L的细胞色素C捕获,通过测定550 nm吸收值的增加进行定量[9];羟自由基(.OH)用终浓度为50 μmol/L的番红花红T捕获,通过测定520 nm吸收值的减少进行定量[10];H2O2用终浓度20 U/ml的HRP和10 μg/ml的酚红捕获,通过测定620 nm吸收值增加,并用H2O2的标准曲线进行定量[11]。, http://www.100md.com
5.细胞内ROS探测[12]:指数生长的BEP2D或BEP2D+Se细胞分别用DCFH-DA(终浓度为20 μmol/L)和/或HE(终浓度为10 μmol/L)标记,37℃保温5 min后行60Co γ射线照射,继续保温2 h后,置冰浴冷却,立即用流式细胞仪(FACS 440,Becton Dickinson)进行分析测定。在细胞中,DCFH-DA被H2O2氧化2’,7’-二氯荧光黄(DCF),HE被O2转化为溴乙锭(EB),DCF和EB能分别产生绿色和红色荧光,测定细胞内DCF和/或EB的荧光强度,即可相对定量细胞内H2O2和
 水平。
水平。6.DNA加合物测定[13]:指数生长的BEP2D或BEP2D+Se细胞(3×106)经60Co γ射线照射后2 h收集细胞,用蛋白酶K和RNase消化,并用非酚法提取DNA,用高压液相色谱结合电化学方法测量OH8dG含量。
, 百拇医药
7.统计学处理:采用t检验。
结 果
1.60Co γ射线照射诱发BEP2D细胞上清产生的ROS增高及纳米硒的抑制作用
BEP2D和BEP2D+Se细胞经不同剂量的60Co γ射线照射后,细胞上清中ROS测定结果如表1所示。可以看出,BEP2D细胞上清中H2O2和.OH自由基含量与60Co γ射线在0.25~1.00 Gy范围内有明确的剂量反应关系,
 含量随60 Co γ射线剂量的增高也明显增高。1 μmol/L纳米硒对60Co γ射线照射诱发BEP2D细胞上清中ROS水平的增高有明显抑制作用。
含量随60 Co γ射线剂量的增高也明显增高。1 μmol/L纳米硒对60Co γ射线照射诱发BEP2D细胞上清中ROS水平的增高有明显抑制作用。, 百拇医药
表1 60Co γ射线照射后BEP2D细胞上清中活性氧测定结果(
 ±s) 吸收剂量(Gy)
±s) 吸收剂量(Gy)H2O2(nmol/106细胞)
O2(pmol/106细胞)
.OH(pmol/106细胞)
BEP2D
BEP2D+Se
BEP2D
, http://www.100md.com
BEP2D+Se
BEP2D
BEP2D+Se
0.25
0.088±0.018
0.042±0.003**
0.95±0.14
0.34±0.06
0.494±0.092
0.265±0.089
0.50
, 百拇医药
0.151±0.036
0.054±0.008**
1.15±0.21
0.53±0.08**
0.714±0.209
0.358±0.109*
1.00
0.239±0.078
0.094±0.022*
1.31±0.24
, 百拇医药
0.65±0.14**
1.020±0.280
0.479±0.102*
2.00
0.194±0.053
0.052±0.006**
1.56±0.33
0.65±0.17**
1.023±0.185
0.614±0.176*
, 百拇医药
注:与相应对照BEP2D细胞比较,*P<0.05,**P<0.01
2.60Co γ射线照射诱发BEP2D细胞内产生的ROS增高及纳米硒的抑制作用
BEP2D和BEP2D+Se细胞经不同剂量的60Co γ射线照射后,细胞内ROS测定结果如图1所示。可以看出,60Co γ射线照射可诱发BEP2D细胞内H2O2和O2自由基水平显著增高,并有良好的剂量反应关系。1 μmol/L纳米硒对60Co γ射线照射诱发BEP2D细胞内ROS水平的增高有明显抑制作用。

图1 60Co γ射线照射诱发BEP2D细胞内H2O2和O2自由基水平增高及纳米硒的抑制作用
, http://www.100md.com
以未受60Co γ射线照射的BEP2D+Se细胞作为对照,将其细胞内DCF或EB荧光强度定为0
3.60Co γ射线照射诱发BEP2D细胞OH8dG含量增高及纳米硒的抑制
BEP2D和BEP2D+Se细胞经不同剂量60Co γ射线照射后,细胞DNA加合物——OH8dG含量测定结果如图2所示。可见,60Co γ射线照射可诱发BEP2D细胞OH8dG含量显著增高,并有较好的剂量效应关系。1 μmol/L的纳米硒对60Co γ射线照射诱发BEP2D细胞OH8dG含量的增高有明显的抑制作用。

图2 60Co γ射线照射诱发BEP2D细胞DNA
, 百拇医药
加合物OH8dG含量增高及纳米硒的抑制作用
以上结果表明,60Co γ射线照射可诱发BEP2D细胞产生大量的ROS,并导致DNA加合物OH8dG含量急剧增高,提示60Co γ射线照射可造成BEP2D细胞的氧化损伤,1 μmol/L的纳米硒对60Co γ射线照射所致BEP2D细胞的氧化损伤有明显的保护效果。
讨 论
流行病学的研究结果表明,在辐射诱发的人类肿瘤中,除白血病外,肺癌的发生率和死亡率都占很高的比例[14]。支气管上皮细胞是肺癌发生的主要细胞来源,BEP2D是目前唯一由人类病毒永生化的人来源的支气管上皮细胞,为近二倍体核型,在裸鼠体内8月内无致瘤性[15]。用此细胞研究的结果,在一定程度上模拟了辐射诱发人类肺癌致癌病毒感染后接触化学致癌剂的条件。
, http://www.100md.com
活性氧等自由基不但可以造成DNA发生断裂和交换等多种损伤,还可以和DNA分子反应产生多种DNA加合物[16]。此外,过氧化氢还能导致多种细胞中癌基因c-fos、c-jun、c-myc和c-Ha-ras的表达发生改变[17]。本研究结果表明,60Co γ射线照射BEP2D细胞后,细胞内H2O2、
 以及细胞上清中H2O2、
以及细胞上清中H2O2、 和.OH水平均明显增高,并在一定浓度范围内有较好的剂量效应关系。提示60Co γ射线照射产生的活性氧等自由基与细胞氧化损伤可能密切相关。值得一提的是,高剂量的60Co γ射线(如2.00 Gy)可能对细胞有杀伤作用,导致产生的过氧化氢和羟自由基反而减少。细胞内活性氧的测定结果也证实了这一点,由于流式细胞分析只记录活细胞中的荧光强度,随60Co γ射线照射剂量的增高,细胞内活性氧也进一步增高。
和.OH水平均明显增高,并在一定浓度范围内有较好的剂量效应关系。提示60Co γ射线照射产生的活性氧等自由基与细胞氧化损伤可能密切相关。值得一提的是,高剂量的60Co γ射线(如2.00 Gy)可能对细胞有杀伤作用,导致产生的过氧化氢和羟自由基反而减少。细胞内活性氧的测定结果也证实了这一点,由于流式细胞分析只记录活细胞中的荧光强度,随60Co γ射线照射剂量的增高,细胞内活性氧也进一步增高。, 百拇医药
活性氧等自由基与细胞中大分子如脂质、蛋白质、DNA作用形成一系列加合物是其造成细胞氧化损伤的主要原因之一。特别是与DNA作用产生的DNA加合物很容易引起DNA复制时发生碱基错配,从而引起DNA的点突变[18]。OH8dG是活性氧等自由基与DNA作用后所形成的多种加合物中最重要的一种,被认为是DNA氧化损伤的标志产物,并能导致基因的G-C→T-A突变[19]。本研究结果表明,60Co γ射线照射的剂量与BEP2D细胞中OH8dG水平以及活性氧含量呈正相关,证实60Co γ射线照射可造成细胞特别是DNA的氧化损伤。
硒是细胞中谷胱甘肽过氧化物酶的重要组成成分,能有效抑制或清除细胞中多种自由基,具有广谱的抗氧化功能[20]。纳米硒是纳米级的元素硒,与一般无机硒或有机硒相比,具有高效低毒的特点,已被卫生部批准为营养保健食品。本研究用纳米硒作为抗氧化剂,观察它对60Co γ射线诱发BEP2D细胞产生的活性氧的DNA氧化损伤的保护效果,结果表明,1 μmol/L的纳米硒对60Co γ射线诱发BEP2D细胞活性氧和OH8dG含量的增高均有明显的抑制作用。正是由于纳米硒对活性氧产生的抑制或清除作用,从而降低了细胞中DNA加合物(OH8dG)的水平,这也从另一方面佐证了60Co γ射线诱发BEP2D细胞产生的活性氧对DNA的氧化损伤作用。
, http://www.100md.com
基金项目:国家自然科学青年基金资助项目(39700030)
参考文献
1, UNSCEAR.Sources,effects and risks of ionizing radiation.1988 report to the general assembly,with annexes.United Nations sales publication E.88.IX.7.New York:United Nations,1988.
2, 龚诒芬,朱茂祥.辐射致体外细胞转化及其机理.夏寿萱主编.放射生物学.北京:军事医学科学出版社,1998.353-412.
3, Tubiana M,Dutreix J,Wambersia A.Introduction to radiobiology.London:Burgess Science Press,1990.22-33.
, http://www.100md.com
4, Glass WA,Varma MN.Physical and chemical mechanisms in molecular radiation biology.New York:Plenum Press,1991.231-256.
5, 陈瑗,周玫主编.自由基医学.北京:人民军医出版社,1991.258-296.
6, Floyd R.Role of oxygen free radicals in carcinogenesis and brain ischemia.FASEB J.1990,4:2587-2597.
7, Tokeuchi T,Nakajima M,Morimoto K.Relationship between the intracellular reactive oxygen species and the induction of oxidative DNA damage in human neutrophil-like cells.Carcinogenesis,1996,17:1543-1548.
, 百拇医药
8, Lunec J,Herbert K.8-Hydroxy-deoxyguanosine.A marker of oxidative DNA damage in systemic lupus erythrocytes.FEBS Letts,1994,348:131-138.
9, Pick E,Mizel D.Rapid microassays for the measurement of superoxide and hydrogen peroxide production by macrophages in culture using an automatic enzyme immunoassay reacted.J Immunol Methods,1981,46:211-226.
10, 王巨存,邢国胜,胡文铎,等.有机锗Ge-132对氧自由基和羟自由基诱导的脂质过氧化的影响.中国药学杂志,1994,29:23-25.
, 百拇医药
11, Pick E,Keisari Y.A simple colorimetric method for the measurement of hydrogen peroxide produced by cells in culture.J Immunol Methods,1980,38:161-170.
12, Rothe G,Valet G.Flow cytometic analysis of respiratory burst activity in phagocytes with hydroethidine and 2',7'-dichlorofluorescin.J Leukocyte Biol,1990,47:440-448.
13, Takeuchi T,Nakajima M,Ohta Y,et al.Evaluation of 8-hydroxydeoxyguanosine,a typical oxidative DNA damage,in human leukocytes.Carcinogenesis,1994,15:1519-1523.
, 百拇医药
14, Land CE.Temporal distributions of risk for radiation-induced cancers.J Chron Dis,1987,40(Suppl 2):45s-57s.
15, Willey JC,Broussoud A,Sleemi A,et al.Immortalization of normal human bronchial epithelial cells by human papillomaviruses 16 or 18.Cancer Res,1991,51:5370-5377.
16, 方允中,李文杰主编.自由基与酶.北京:科学出版社,1989.261-271.
17, 宋元宗,祝其锋,莫丽儿.H2O2与癌基因表达.自由基生命科学进展,1996,4:115-118.
, http://www.100md.com
18, Loechler EL.The role of adduct site-specific mutagenesis in understanding how carcinogen-DNA adducts cause mutation:perspective,prospects and problem.Carcinogenesis,1996,17:895-902.
19, Cheng KC,Cahill DS,Kasai H,et al.8-Hydroxy-deoxyguanine,an abundant form of oxidative DNA damage,causes G-T and A-C substitutions.J Biol Chem,1992,267:166-172.
20, Bronzetti G,della Croce C.Selenium:its important roles in life and contrasting aspects.JE PTO,1993,12:59-71.
(收稿日期:1999-09-26), 百拇医药