雌激素对去卵巢大鼠骨丢失的骨形态计量学及组织学的影响
作者:贠红岩 程云英
单位:210006 南京医科大学附属南京第一医院妇产科(红岩);南京铁道医学院附属医院妇产科(程云英)
关键词:阉割;骨质疏松;雌激素类;骨密度
中华妇产科杂志990207
【摘要】 目的 了解大鼠卵巢性激素缺乏致骨丢失的组织学改变以及四种不同雌激素制剂对其的影响。方法 将50只SD大鼠随机分为6组,去势组(9只)在去势手术后3周处死大鼠;对照组(9只)开腹后关腹;去势+利维爱组、去势+盖福润组、去势+倍美力组、去势+维尼安组(各8只)在去势手术后3周予相应的药物治疗,术后6周(药物治疗后3周)处死各组大鼠,进行骨形态计量学、骨密度(BMD)测定,并行病理及电镜下观察。结果 (1)去势后3周大鼠骨量参数较对照组显著减少(P<0.05);而骨小梁表面破骨细胞数、骨矿化沉积率、矿化缘长度较对照组显著增加(P<0.05)。去势后大鼠BMD较对照组显著减少(P<0.01),骨小梁变细,骨的三维结构破坏。(2)各治疗组中,去势+利维爱组和去势+盖福润组骨吸收及转换参数中除骨矿化率仍减少外,其余参数与对照组相似(P>0.05)。去势+倍美力组和去势+维尼安组骨小梁的体积与去势组相似。BMD在各治疗组均有增加,以去势+利维爱和去势+盖福润组增加较多(P<0.05)。结论 (1)去势后大鼠骨丢失是由于卵巢分泌的性激素减少,破骨细胞活性增强,骨的力学强度降低所致。(2)卵巢切除后3周大鼠即出现高转换型快速骨丢失。(3)雌、孕、雄激素联合应用具有降低骨转换、阻止骨丢失、促进骨形成,增加骨量的作用。
, http://www.100md.com
The Impacts of Sex Hormones on Histomorphometric and Histological Appearances of Bone in Ovariectomized Rats YONG Hongyan*, CHENG Yunying.* Nanjing Medical University No1 Affiliated Hospital, Nanjing 210006
【Abstract】 Objectives To demonstrate the histomorphometric and histological changes of bone 3 weeks after bilateral ovariectomy in rats and to investigate the impacts of 4 different hormone replacement therapies on the bone histomorphometric, hostological appearances. Methods Bilateral ovariectomies were done on 41 female rats and sham operations on other 9 (sham group ) respectively . After 3 weeks , 4 different treatments : ie Livial , Gevrine , Premarin , Weinian were initiated separately on each 8 ovariectomized rats for another 3 weeks . The remaining 9 were served as controls (OVX group ) . All rats were sacrified either 3 weeks after ovariectomy / sham operation or at the end of hormone therapies . Their femoral bone mineral density (BMD) were measured by dual energy X-ray absorptiometry ( DEXA ) . Specimens of proximal femur were embedded undecacifide for histomorphometric analysis and of distal femoral metaphysics were procured for scanning electron miroscope (SEM) and pathologic examinations. Results (1) Three weeks after OVX , the femoral BMD, mean cortical thickness decreased significantly while the number of osteoclast increased significantly as compared with sham group. The trabecular became thinner and irregular which changed the bone microstructure in three dimension. (2) After treatment of 4 different preparations, the above parameters restored to various extents to the sham operation levels. Among them, there was greater increase of femoral BMD on the Livial and Gevrine group as compared with Premarin and Weinian group (P<0.05). Conclusions Bilateral ovariectomy induced increased osteoclast activity and bone turnover , therefore caused accelerated bone loss. Treatment with combined sex hormones preparation could inhibit bone absorption and stimulate bone formation , especially those containing androgenic activity could increase the BMD.
, 百拇医药
【Key words】 Castration Osteoporosis Estrogens Bone density
近年来的研究表明,卵巢性激素缺乏引起的骨丢失与成骨细胞、破骨细胞及骨小梁的显微结构有关。激素替代治疗(HRT)是防治绝经后骨质疏松症的关键措施。目前临床常用的雌激素制剂有利维爱(Livial)、盖福润(Gevrine)、倍美力(Premarin)和维尼安(Weinian)。
本研究通过对去势后大鼠骨密度(BMD)的测定、骨吸收及骨转换参数的定量分析,骨小梁的结构观察,探讨卵巢性激素缺乏导致骨丢失的组织学改变,综合评估上述4种雌激素制剂的疗效。
材料和方法
一、动物分组及模型制备
选取3月龄未经产雌性SD大鼠50只[平均体重(200±10) g],随机分为6组,去势组9只,对照组9只,去势+利维爱组、去势+盖福润组、去势+倍美力组与去势+维尼安组各8只,组间大鼠体重无统计学差异。所有大鼠均以3%的戊巴比妥钠(40 mg/kg)腹腔内注射麻醉,除对照组行单纯开腹之外,其余5组均行双侧卵巢切除术,术后置大鼠于室温下分笼饲养,自由摄水,每天每只予标准饲料18 g[1]。
, http://www.100md.com
二、方法
(一)药物治疗
术后3周开始给各治疗组大鼠用药,所有药物均以无菌生理盐水配成混悬液,以灌胃法每天每只2 ml给药。动物用量剂量(mg/kg)=6.25×人的剂量(mg/kg)[2],即给药剂量:去势+利维爱组每天利维爱0.033 mg/kg;去势+盖福润组每天盖福润0.8 mg/kg;去势+倍美力组每天倍美力0.003 mg/kg;去势+维尼安组每周维尼安0.003 mg/kg。连续给药3周,在处死前第10和第3天,每日以20 mg/kg四环素(上海华美公司)腹腔内注射。术后3周处死去势组,术后6周(给药3周后)处死其他各组。
(二)骨组织形态计量学分析
1.不脱钙切片取材及制作:截取双侧股骨远端1/3处骨,丙酮脱水、脱脂,24小时内每隔6小时换液1次。低温塑料(甲基丙烯酸甲酯,甲基丙烯酸羟乙酯,丙烯酸羟乙酯)包埋,4℃冰箱聚合。包埋标本用德国JUNG型硬切骨机沿股骨矢状面切片,每只鼠切片4张,切片厚度为5 μm,其中2张切片采用1%的甲苯胺蓝染色,另外2张切片不染色作为荧光观察用。
, 百拇医药
2.参数测量:采用德国ZEISS公司VIDAS型计算机全自动图像分析系统,每只鼠观察荧光染色切片各2张,观察甲苯胺蓝染色切片各2张,每个参数测量取高倍视野,测定区域限定在距骺板下1 cm外的干骺端,每个标本测定面积为16 mm2,所有参数均参照Wronski等[3]和Malluche等[4]的标准,骨量参数:(1)骨小梁体积(%):(骨小梁面积/髓腔及骨小梁面积)×100%;(2)骨小梁平均厚度(μm);(3)皮质骨平均厚度(μm);骨吸收参数:骨小梁表面破骨细胞数(×103/μm);骨转化及骨形成参数:(1)骨小梁骨矿化率(μm/d):两条荧光标记线间距/两次注射四环素间隔天数(图1);(2)骨小梁矿化缘长度(%):四环素标记线长度/骨小梁边缘长度。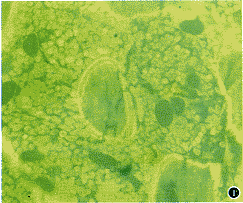
图1 四环素荧光双标线。荧光双标 ×100
, 百拇医药
(三)扫描电镜观察
取股骨干骺端,沿矢状面剖开,以浓度为4%的戊二醛固定,磷酸缓冲液清洗3次;以浓度为10%的次氯酸钠浸泡6小时,超声清洗15分钟,乙醇逐级脱水,乙醚浸泡。室温下空气干燥;真空喷金。在日本产明石SX-40型电镜下观察(放大倍数700倍)。
(四)组织形态学观察
取大鼠股骨干骺端,以浓度为10%的甲醛液常规固定,脱钙处理后石蜡制片。HE染色,光镜下观察。
(五)BMD测量
将大鼠经乙醚麻醉后称重,四肢展开平置于美国Lunar公司生产的双能X线吸收测量仪平台上,通过计算机系统中小动物软件测股骨BMD,精确度1.2%,准确度90%。
三、统计学方法
, http://www.100md.com
采用本校统计中心CCSTAT软件包进行统计运算,所有参数均以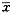 ±s表示,组间差异采用方差分析、显著性t检验。
±s表示,组间差异采用方差分析、显著性t检验。
结 果
一、实验后大鼠体重变化
术后3周,各组大鼠体重均有所增加。实验结束时除去势组与去势+利维爱组体重增加较明显外,其余各组大鼠体重均维持在给药前水平。见表1。
表1 各组大鼠实验前后体重比较(g,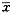 ±s) 组别
±s) 组别
只数
实验前体重
, http://www.100md.com
实验后体重
去势组
9
210.3±7.0
242.0±9.5*
对照组
9
207.2±6.9
228.0±4.1
去势+利维爱组
8
204.5±7.1
, http://www.100md.com
238.0±5.5*
去势+盖福润组
8
207.3±9.5
226.0±5.3
去势+倍美力组
8
209.8±3.0
221.0±7.0
去势+维尼安组
8
209.3±7.0
, http://www.100md.com
226.0±8.7
* 与对照组相比,P<0.05
二、BMD的变化
术后3周,去势组与对照组相比,BMD明显降低(P<0.01);给药后3周(术后6周),各治疗组BMD较术后3周均有所增加,与去势组相比,去势+利维爱组BMD增加15.2%(P<0.05),去势+盖福润组增加17.8%(P<0.05),去势+倍美力组增加10.4%,去势+维尼安组增加9.1%。见表2。
表2 各组大鼠术后BMD的变化(g/cm2,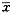 ±s) 组别
±s) 组别
只数
术后3周
, http://www.100md.com
术后6周
去势组
9
0.199±0.02
0.189±0.02**
对照组
9
0.240±0.03
0.237±0.03
去势+利维爱组
8
0.196±0.02
, 百拇医药
0.223±0.03
去势+盖福润组
8
0.201±0.03
0.228±0.04
去势+倍美力组
8
0.193±0.02
0.211±0.03**
去势+维尼安组
8
0.198±0.03
, 百拇医药
0.208±0.02**
* 与对照组相比,P<0.01 **与去势组相比,P<0.05
三、骨形态计量学参数变化
与对照组相比,去势组骨小梁体积减少24.1%(P<0.01),骨小梁平均厚度减少20.0%(P<0.01),皮质骨平均厚度减少47.8%(P<0.01),骨矿化率增加28.5%(P<0.05),骨小梁表面破骨细胞数增加60.0%(P<0.01),矿化缘长度增加20.9%(P<0.05)。见表3。
表3 各组大鼠骨组织形态计量学参数比较 组别
只
数
, http://www.100md.com
骨小梁
体积(%)
骨小梁平均
厚度(μm)
皮质骨平均
厚度(μm)
骨小梁表面破骨
细胞数(×103/μm)
骨小梁骨
矿化率(μm/d)
骨小梁矿化缘
长度(%)
, 百拇医药
去势组
9
27.4±4.2*
40.7±8.9*
185±25*
1.5±0.5*
1.65±0.40**
54.0±12.6**
对照组
9
36.1±3.7
, 百拇医药
50.9±7.3
354±71
0.6±0.3
1.18±0.30
42.7±4.4
去势+利
维爱组
8
35.3±4.2***
47.9±5.1***
349±58***
, 百拇医药
0.6±0.1△
0.88±0.33△
40.1±3.7△
去势+盖
福润组
8
34.0±4.1***
48.4±8.5***
354± 6***
0.8±0.3△
, http://www.100md.com
0.86±0.23△
38.8±4.2△
去势+倍
美力组
8
28.6±3.1
44.0±3.9
321±47***
0.9±0.4***
1.16±0.41***
42.0±3.5***
, 百拇医药
去势+维
尼安组
8
27.7±3.3
42.3±6.4
280±27***
1.0±0.3***
1.21±0.21***
43.4±4.6***
* 与对照组相比,P<0.01 **与对照组相比,P<0.05 ***与去势组相比,P<0.05 △与去势组相比,P<0.01 各治疗组与去势组比较,皮质骨厚度均显著增加;而骨小梁体积、骨小梁平均厚度除去势+倍美力组和去势+维尼安组外,其余两组较去势组显著增加(P<0.05);骨矿化率、骨小梁表面破骨细胞数、骨小梁矿化缘长度均较去势组显著减少(P<0.05),尤以去势+利维爱和去势+盖福润组为明显(P<0.01);除骨矿化率仍减少外,其余各参数与对照组比较,差异无显著性(P>0.05)。
, 百拇医药
四、骨组织的形态学观察
1.HE染色切片:(1)去势组股骨干骺端骨小梁明显变稀疏,皮质骨变薄,骨髓腔相对扩大 ,部分区域骨小梁消失,沿“S”形的骨小梁边缘有众多深浅不一的吸收陷窝,有些部分由于破骨细胞的溶骨作用,小梁出现中断(图2)。(2)对照组及治疗组股骨干骺端骨小梁丰富,皮质骨致密,小梁排列以纵向为主。在皮质骨形成表面4个治疗组均可见成队状排列似上皮细胞样覆盖于新生骨表面的成骨细胞,呈立方型、柱状和豆点状,有些细胞间有裂隙相连(图3)。
2.甲苯胺蓝染色切片:(1)去势组可见小梁表面矿物质沉积较少,类骨质生成较多,皮质骨亦变薄,小梁表面骨吸收陷窝中有外形较大、淡染、胞浆分布均匀、内有多个细胞核的破骨细胞充填(图4)。(2)对照组甲苯胺蓝染色的切片中,骨小梁呈纵向排列,纵向小梁间由横向小梁相连,小梁中央有大量紫蓝色的矿物质沉积,其上有较多的骨细胞嵌于其中,矿化骨的两侧为浅染的类骨质(图5),去势+利维爱和去势+盖福润两组骨小梁的表面有大量的成骨细胞,局部骨小梁形成表面活跃,髓腔内偶见有破骨细胞及类似破骨细胞的巨噬细胞(图6)。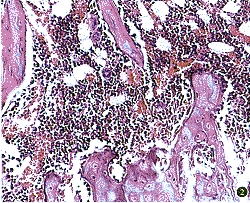
, 百拇医药
图2 骨小梁稀疏,骨髓腔相对扩大,部分区域骨小梁消失。HE染色 ×100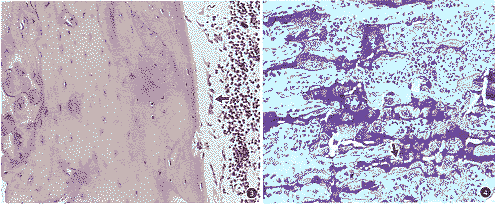
图3 皮质骨致密,表面豆点状、柱状成骨细胞(↑)。HE染色 ×100
图4 骨小梁稀疏,表面骨吸收陷窝增多(↑)。甲苯胺蓝染色 ×100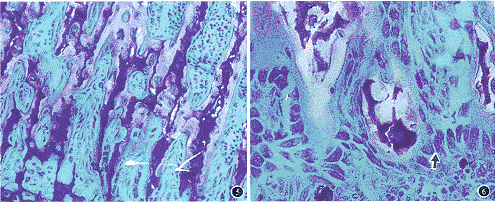
图5 骨小梁排列以纵向为主。甲苯胺蓝染色 ×100
图6 骨小梁表面矿物质沉积及大量成骨细胞(↑)。甲苯胺蓝染色 ×200
3.扫描电镜:(1)去势组小梁变细、中断,残端游离,小梁数量减少,小梁间距增宽,表面较多的骨吸收陷窝,局部骨小梁变细,有裂隙(图7)。(2)对照组及治疗组骨小梁相互连接成立体网状,小梁表面光滑,小梁间距小(图8)。
, http://www.100md.com
图7 骨小梁变细,残端游离(↑)。扫描电镜 ×700
图8 骨小梁排列整齐,表面光滑。扫描电镜 ×700
讨 论
一、实验前后大鼠体重的变化及实验时间的选择
本研究结果表明,雌激素具有维持体重的作用。利维爱对体重增加更明显,可能与其雄激素样作用有关。盖福润对体重增加不明显可能与甲基睾丸素口服后活性降低50%以上有关。卵巢切除后引起骨丢失的时间长短不一。Kimble等[1]认为,卵巢切除后2周的大鼠,骨小梁和皮质骨与对照组相比较变化不明显,而4周后骨丢失则明显增加,2周的替代治疗可以抑制骨吸收。本研究结果表明,去势后3周的大鼠骨转换即加快,骨吸收明显增加。
二、卵巢切除后大鼠BMD、骨形态计量学及组织学的改变
, http://www.100md.com
BMD是骨矿代谢中量化骨量的重要指标。本研究结果表明,去势后3周的大鼠BMD明显下降,提示大鼠卵巢切除后早期处于快速骨丢失阶段。
骨矿化率和矿化缘的长度,反映了成骨细胞生成类骨质速度的快慢。卵巢切除后两者均增加,说明成骨细胞活性增强,骨重建活跃。而3个骨量参数均降低及破骨细胞数增多,说明骨量明显丢失。推知,在去势后早期快速骨丢失阶段,骨吸收及骨形成是同时存在的。破骨细胞活性增强和高转换应是早期快速骨丢失的机理之一。本研究结果与文献报道相符合[5]。同时本研究结果提示,卵巢切除后的骨吸收主要以破骨细胞性骨吸收为主,即破骨细胞将骨组织、胶原及矿化骨不断从骨小梁表面降解、吸收,使骨小梁间隙增宽、中断。
显微骨折的修复作用降低,是骨折发生的病理学基础[6]。本研究结果提示,松质骨的力学强度下降,是造成骨显微骨折的主要原因。松质骨和密质骨的变化在卵巢切除早期是相同的。
, 百拇医药
三、各种雌激素制剂对去势大鼠BMD、骨形态计量学及组织学的改变
各给药组与去势组相比,BMD均有所增加,以去势+利维爱、去势+盖福润组增加较多(P<0.05),提示卵巢切除后早期HRT治疗可阻止骨矿含量的丢失,同时推测上述两组骨盐含量增加与利维爱的孕激素、雄激素活性,盖福润所含的雄激素、VitD、钙盐有关。本研究结果从侧面提示,绝经后单纯雌激素治疗不能使骨量增加,但可以阻止进一步的骨吸收。比较各给药组药物对改善卵巢切除后大鼠骨丢失的作用,从三个骨量参数及破骨细胞数方面分析,本所实验结果表明,雌激素具有降低骨转换、抑制骨吸收的作用,4种雌激素制剂以维尼安的作用最弱。
从骨转换参数结果还可以推知,利维爱的雄、孕激素活性,盖福润所含的雄激素同雌激素一样,具有抑制骨吸收的作用,同时在上述两组骨小梁骨量恢复至正常水平提示,雄激素、孕激素还具有刺激骨形成、增加骨小梁骨量的作用。人成骨细胞上雄激素受体mRNA的发现,说明雄激素对骨有直接刺激作用[7]。Scane等[8]认为,多毛女性能维持正常骨量是体内雄激素的参与。任芸芸等[9]的研究表明,孕激素同样具有促进骨形成的作用。防治骨质疏松的药物应具有刺激骨形成、增加骨量和维持骨结构的作用。
, 百拇医药
骨组织形态学观察发现,应用利维爱和盖福润的两组去势后大鼠骨小梁表面和皮质骨表面,均有大量的成骨细胞,提示雌、孕、雄激素联合或复合应用可持续诱导骨形成,增加骨量。而另外2个治疗组只在皮质骨表面有成骨细胞存在,也说明雌激素阻止骨矿含量下降是通过刺激皮质骨表面骨形成而起作用的。
本研究受江苏省科委社会发展基金资助
参考文献
1 Kimble RB, Matayoshi AB, Vannice JL, et al. Stimulaneous block of interluekin-1 and tumer necrosis factor is required to completely prevent bone loss in the early postovariectomy period. Endo crinology, 1995, 136:3054-3061.
, http://www.100md.com
2 施新猷.医学动物实验学.西安:陕西科学技术出版社,1989.418-420.
3 Wronski TJ, Walsh CC, Ignaszewski LA, et al. Histologic eidence for osteopenia and increased bone turnover in ovariectomized rats. Bone, 1986, 7:119-123.
4 Malluche HH, Sherman D, Meyer W, et al. A new semiautomatic method for quantitation static and dynamic bone histology. Calcif Tissue Int, 1982, 34:438-439.
5 Dempster DW, Birchman R, Xu R, et al. Temporal changes in cancelous bone structure of rats immediately after ovariectomy. Bone, 1995, 16:157-161.
, 百拇医药
6 Frost HM. The pathomechanics of osteoporosis. Clin Orthop, 1985,200: 198-225.
7 Colvard DS, Eriken EF, Keeting PE, et al. Identication of androgen receptors in normal human osteoblast-like cells. Proc Natl Sci USA, 1989, 86:854-857.
8 Scane AC, Francis RM. Risk factor for osteoporosis in men. Clin Endocrinol, 1993, 38:15-16.
9 任芸芸,朱关珍.孕激素对绝经后妇女骨质代谢的影响.中华妇产科杂志,1995,30:135-137.
(收稿:1998-01-18 修回:1998-12-11), http://www.100md.com
单位:210006 南京医科大学附属南京第一医院妇产科(红岩);南京铁道医学院附属医院妇产科(程云英)
关键词:阉割;骨质疏松;雌激素类;骨密度
中华妇产科杂志990207
【摘要】 目的 了解大鼠卵巢性激素缺乏致骨丢失的组织学改变以及四种不同雌激素制剂对其的影响。方法 将50只SD大鼠随机分为6组,去势组(9只)在去势手术后3周处死大鼠;对照组(9只)开腹后关腹;去势+利维爱组、去势+盖福润组、去势+倍美力组、去势+维尼安组(各8只)在去势手术后3周予相应的药物治疗,术后6周(药物治疗后3周)处死各组大鼠,进行骨形态计量学、骨密度(BMD)测定,并行病理及电镜下观察。结果 (1)去势后3周大鼠骨量参数较对照组显著减少(P<0.05);而骨小梁表面破骨细胞数、骨矿化沉积率、矿化缘长度较对照组显著增加(P<0.05)。去势后大鼠BMD较对照组显著减少(P<0.01),骨小梁变细,骨的三维结构破坏。(2)各治疗组中,去势+利维爱组和去势+盖福润组骨吸收及转换参数中除骨矿化率仍减少外,其余参数与对照组相似(P>0.05)。去势+倍美力组和去势+维尼安组骨小梁的体积与去势组相似。BMD在各治疗组均有增加,以去势+利维爱和去势+盖福润组增加较多(P<0.05)。结论 (1)去势后大鼠骨丢失是由于卵巢分泌的性激素减少,破骨细胞活性增强,骨的力学强度降低所致。(2)卵巢切除后3周大鼠即出现高转换型快速骨丢失。(3)雌、孕、雄激素联合应用具有降低骨转换、阻止骨丢失、促进骨形成,增加骨量的作用。
, http://www.100md.com
The Impacts of Sex Hormones on Histomorphometric and Histological Appearances of Bone in Ovariectomized Rats YONG Hongyan*, CHENG Yunying.* Nanjing Medical University No1 Affiliated Hospital, Nanjing 210006
【Abstract】 Objectives To demonstrate the histomorphometric and histological changes of bone 3 weeks after bilateral ovariectomy in rats and to investigate the impacts of 4 different hormone replacement therapies on the bone histomorphometric, hostological appearances. Methods Bilateral ovariectomies were done on 41 female rats and sham operations on other 9 (sham group ) respectively . After 3 weeks , 4 different treatments : ie Livial , Gevrine , Premarin , Weinian were initiated separately on each 8 ovariectomized rats for another 3 weeks . The remaining 9 were served as controls (OVX group ) . All rats were sacrified either 3 weeks after ovariectomy / sham operation or at the end of hormone therapies . Their femoral bone mineral density (BMD) were measured by dual energy X-ray absorptiometry ( DEXA ) . Specimens of proximal femur were embedded undecacifide for histomorphometric analysis and of distal femoral metaphysics were procured for scanning electron miroscope (SEM) and pathologic examinations. Results (1) Three weeks after OVX , the femoral BMD, mean cortical thickness decreased significantly while the number of osteoclast increased significantly as compared with sham group. The trabecular became thinner and irregular which changed the bone microstructure in three dimension. (2) After treatment of 4 different preparations, the above parameters restored to various extents to the sham operation levels. Among them, there was greater increase of femoral BMD on the Livial and Gevrine group as compared with Premarin and Weinian group (P<0.05). Conclusions Bilateral ovariectomy induced increased osteoclast activity and bone turnover , therefore caused accelerated bone loss. Treatment with combined sex hormones preparation could inhibit bone absorption and stimulate bone formation , especially those containing androgenic activity could increase the BMD.
, 百拇医药
【Key words】 Castration Osteoporosis Estrogens Bone density
近年来的研究表明,卵巢性激素缺乏引起的骨丢失与成骨细胞、破骨细胞及骨小梁的显微结构有关。激素替代治疗(HRT)是防治绝经后骨质疏松症的关键措施。目前临床常用的雌激素制剂有利维爱(Livial)、盖福润(Gevrine)、倍美力(Premarin)和维尼安(Weinian)。
本研究通过对去势后大鼠骨密度(BMD)的测定、骨吸收及骨转换参数的定量分析,骨小梁的结构观察,探讨卵巢性激素缺乏导致骨丢失的组织学改变,综合评估上述4种雌激素制剂的疗效。
材料和方法
一、动物分组及模型制备
选取3月龄未经产雌性SD大鼠50只[平均体重(200±10) g],随机分为6组,去势组9只,对照组9只,去势+利维爱组、去势+盖福润组、去势+倍美力组与去势+维尼安组各8只,组间大鼠体重无统计学差异。所有大鼠均以3%的戊巴比妥钠(40 mg/kg)腹腔内注射麻醉,除对照组行单纯开腹之外,其余5组均行双侧卵巢切除术,术后置大鼠于室温下分笼饲养,自由摄水,每天每只予标准饲料18 g[1]。
, http://www.100md.com
二、方法
(一)药物治疗
术后3周开始给各治疗组大鼠用药,所有药物均以无菌生理盐水配成混悬液,以灌胃法每天每只2 ml给药。动物用量剂量(mg/kg)=6.25×人的剂量(mg/kg)[2],即给药剂量:去势+利维爱组每天利维爱0.033 mg/kg;去势+盖福润组每天盖福润0.8 mg/kg;去势+倍美力组每天倍美力0.003 mg/kg;去势+维尼安组每周维尼安0.003 mg/kg。连续给药3周,在处死前第10和第3天,每日以20 mg/kg四环素(上海华美公司)腹腔内注射。术后3周处死去势组,术后6周(给药3周后)处死其他各组。
(二)骨组织形态计量学分析
1.不脱钙切片取材及制作:截取双侧股骨远端1/3处骨,丙酮脱水、脱脂,24小时内每隔6小时换液1次。低温塑料(甲基丙烯酸甲酯,甲基丙烯酸羟乙酯,丙烯酸羟乙酯)包埋,4℃冰箱聚合。包埋标本用德国JUNG型硬切骨机沿股骨矢状面切片,每只鼠切片4张,切片厚度为5 μm,其中2张切片采用1%的甲苯胺蓝染色,另外2张切片不染色作为荧光观察用。
, 百拇医药
2.参数测量:采用德国ZEISS公司VIDAS型计算机全自动图像分析系统,每只鼠观察荧光染色切片各2张,观察甲苯胺蓝染色切片各2张,每个参数测量取高倍视野,测定区域限定在距骺板下1 cm外的干骺端,每个标本测定面积为16 mm2,所有参数均参照Wronski等[3]和Malluche等[4]的标准,骨量参数:(1)骨小梁体积(%):(骨小梁面积/髓腔及骨小梁面积)×100%;(2)骨小梁平均厚度(μm);(3)皮质骨平均厚度(μm);骨吸收参数:骨小梁表面破骨细胞数(×103/μm);骨转化及骨形成参数:(1)骨小梁骨矿化率(μm/d):两条荧光标记线间距/两次注射四环素间隔天数(图1);(2)骨小梁矿化缘长度(%):四环素标记线长度/骨小梁边缘长度。

图1 四环素荧光双标线。荧光双标 ×100
, 百拇医药
(三)扫描电镜观察
取股骨干骺端,沿矢状面剖开,以浓度为4%的戊二醛固定,磷酸缓冲液清洗3次;以浓度为10%的次氯酸钠浸泡6小时,超声清洗15分钟,乙醇逐级脱水,乙醚浸泡。室温下空气干燥;真空喷金。在日本产明石SX-40型电镜下观察(放大倍数700倍)。
(四)组织形态学观察
取大鼠股骨干骺端,以浓度为10%的甲醛液常规固定,脱钙处理后石蜡制片。HE染色,光镜下观察。
(五)BMD测量
将大鼠经乙醚麻醉后称重,四肢展开平置于美国Lunar公司生产的双能X线吸收测量仪平台上,通过计算机系统中小动物软件测股骨BMD,精确度1.2%,准确度90%。
三、统计学方法
, http://www.100md.com
采用本校统计中心CCSTAT软件包进行统计运算,所有参数均以
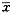 ±s表示,组间差异采用方差分析、显著性t检验。
±s表示,组间差异采用方差分析、显著性t检验。结 果
一、实验后大鼠体重变化
术后3周,各组大鼠体重均有所增加。实验结束时除去势组与去势+利维爱组体重增加较明显外,其余各组大鼠体重均维持在给药前水平。见表1。
表1 各组大鼠实验前后体重比较(g,
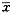 ±s) 组别
±s) 组别只数
实验前体重
, http://www.100md.com
实验后体重
去势组
9
210.3±7.0
242.0±9.5*
对照组
9
207.2±6.9
228.0±4.1
去势+利维爱组
8
204.5±7.1
, http://www.100md.com
238.0±5.5*
去势+盖福润组
8
207.3±9.5
226.0±5.3
去势+倍美力组
8
209.8±3.0
221.0±7.0
去势+维尼安组
8
209.3±7.0
, http://www.100md.com
226.0±8.7
* 与对照组相比,P<0.05
二、BMD的变化
术后3周,去势组与对照组相比,BMD明显降低(P<0.01);给药后3周(术后6周),各治疗组BMD较术后3周均有所增加,与去势组相比,去势+利维爱组BMD增加15.2%(P<0.05),去势+盖福润组增加17.8%(P<0.05),去势+倍美力组增加10.4%,去势+维尼安组增加9.1%。见表2。
表2 各组大鼠术后BMD的变化(g/cm2,
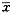 ±s) 组别
±s) 组别只数
术后3周
, http://www.100md.com
术后6周
去势组
9
0.199±0.02
0.189±0.02**
对照组
9
0.240±0.03
0.237±0.03
去势+利维爱组
8
0.196±0.02
, 百拇医药
0.223±0.03
去势+盖福润组
8
0.201±0.03
0.228±0.04
去势+倍美力组
8
0.193±0.02
0.211±0.03**
去势+维尼安组
8
0.198±0.03
, 百拇医药
0.208±0.02**
* 与对照组相比,P<0.01 **与去势组相比,P<0.05
三、骨形态计量学参数变化
与对照组相比,去势组骨小梁体积减少24.1%(P<0.01),骨小梁平均厚度减少20.0%(P<0.01),皮质骨平均厚度减少47.8%(P<0.01),骨矿化率增加28.5%(P<0.05),骨小梁表面破骨细胞数增加60.0%(P<0.01),矿化缘长度增加20.9%(P<0.05)。见表3。
表3 各组大鼠骨组织形态计量学参数比较 组别
只
数
, http://www.100md.com
骨小梁
体积(%)
骨小梁平均
厚度(μm)
皮质骨平均
厚度(μm)
骨小梁表面破骨
细胞数(×103/μm)
骨小梁骨
矿化率(μm/d)
骨小梁矿化缘
长度(%)
, 百拇医药
去势组
9
27.4±4.2*
40.7±8.9*
185±25*
1.5±0.5*
1.65±0.40**
54.0±12.6**
对照组
9
36.1±3.7
, 百拇医药
50.9±7.3
354±71
0.6±0.3
1.18±0.30
42.7±4.4
去势+利
维爱组
8
35.3±4.2***
47.9±5.1***
349±58***
, 百拇医药
0.6±0.1△
0.88±0.33△
40.1±3.7△
去势+盖
福润组
8
34.0±4.1***
48.4±8.5***
354± 6***
0.8±0.3△
, http://www.100md.com
0.86±0.23△
38.8±4.2△
去势+倍
美力组
8
28.6±3.1
44.0±3.9
321±47***
0.9±0.4***
1.16±0.41***
42.0±3.5***
, 百拇医药
去势+维
尼安组
8
27.7±3.3
42.3±6.4
280±27***
1.0±0.3***
1.21±0.21***
43.4±4.6***
* 与对照组相比,P<0.01 **与对照组相比,P<0.05 ***与去势组相比,P<0.05 △与去势组相比,P<0.01 各治疗组与去势组比较,皮质骨厚度均显著增加;而骨小梁体积、骨小梁平均厚度除去势+倍美力组和去势+维尼安组外,其余两组较去势组显著增加(P<0.05);骨矿化率、骨小梁表面破骨细胞数、骨小梁矿化缘长度均较去势组显著减少(P<0.05),尤以去势+利维爱和去势+盖福润组为明显(P<0.01);除骨矿化率仍减少外,其余各参数与对照组比较,差异无显著性(P>0.05)。
, 百拇医药
四、骨组织的形态学观察
1.HE染色切片:(1)去势组股骨干骺端骨小梁明显变稀疏,皮质骨变薄,骨髓腔相对扩大 ,部分区域骨小梁消失,沿“S”形的骨小梁边缘有众多深浅不一的吸收陷窝,有些部分由于破骨细胞的溶骨作用,小梁出现中断(图2)。(2)对照组及治疗组股骨干骺端骨小梁丰富,皮质骨致密,小梁排列以纵向为主。在皮质骨形成表面4个治疗组均可见成队状排列似上皮细胞样覆盖于新生骨表面的成骨细胞,呈立方型、柱状和豆点状,有些细胞间有裂隙相连(图3)。
2.甲苯胺蓝染色切片:(1)去势组可见小梁表面矿物质沉积较少,类骨质生成较多,皮质骨亦变薄,小梁表面骨吸收陷窝中有外形较大、淡染、胞浆分布均匀、内有多个细胞核的破骨细胞充填(图4)。(2)对照组甲苯胺蓝染色的切片中,骨小梁呈纵向排列,纵向小梁间由横向小梁相连,小梁中央有大量紫蓝色的矿物质沉积,其上有较多的骨细胞嵌于其中,矿化骨的两侧为浅染的类骨质(图5),去势+利维爱和去势+盖福润两组骨小梁的表面有大量的成骨细胞,局部骨小梁形成表面活跃,髓腔内偶见有破骨细胞及类似破骨细胞的巨噬细胞(图6)。

, 百拇医药
图2 骨小梁稀疏,骨髓腔相对扩大,部分区域骨小梁消失。HE染色 ×100

图3 皮质骨致密,表面豆点状、柱状成骨细胞(↑)。HE染色 ×100
图4 骨小梁稀疏,表面骨吸收陷窝增多(↑)。甲苯胺蓝染色 ×100

图5 骨小梁排列以纵向为主。甲苯胺蓝染色 ×100
图6 骨小梁表面矿物质沉积及大量成骨细胞(↑)。甲苯胺蓝染色 ×200
3.扫描电镜:(1)去势组小梁变细、中断,残端游离,小梁数量减少,小梁间距增宽,表面较多的骨吸收陷窝,局部骨小梁变细,有裂隙(图7)。(2)对照组及治疗组骨小梁相互连接成立体网状,小梁表面光滑,小梁间距小(图8)。

, http://www.100md.com
图7 骨小梁变细,残端游离(↑)。扫描电镜 ×700
图8 骨小梁排列整齐,表面光滑。扫描电镜 ×700
讨 论
一、实验前后大鼠体重的变化及实验时间的选择
本研究结果表明,雌激素具有维持体重的作用。利维爱对体重增加更明显,可能与其雄激素样作用有关。盖福润对体重增加不明显可能与甲基睾丸素口服后活性降低50%以上有关。卵巢切除后引起骨丢失的时间长短不一。Kimble等[1]认为,卵巢切除后2周的大鼠,骨小梁和皮质骨与对照组相比较变化不明显,而4周后骨丢失则明显增加,2周的替代治疗可以抑制骨吸收。本研究结果表明,去势后3周的大鼠骨转换即加快,骨吸收明显增加。
二、卵巢切除后大鼠BMD、骨形态计量学及组织学的改变
, http://www.100md.com
BMD是骨矿代谢中量化骨量的重要指标。本研究结果表明,去势后3周的大鼠BMD明显下降,提示大鼠卵巢切除后早期处于快速骨丢失阶段。
骨矿化率和矿化缘的长度,反映了成骨细胞生成类骨质速度的快慢。卵巢切除后两者均增加,说明成骨细胞活性增强,骨重建活跃。而3个骨量参数均降低及破骨细胞数增多,说明骨量明显丢失。推知,在去势后早期快速骨丢失阶段,骨吸收及骨形成是同时存在的。破骨细胞活性增强和高转换应是早期快速骨丢失的机理之一。本研究结果与文献报道相符合[5]。同时本研究结果提示,卵巢切除后的骨吸收主要以破骨细胞性骨吸收为主,即破骨细胞将骨组织、胶原及矿化骨不断从骨小梁表面降解、吸收,使骨小梁间隙增宽、中断。
显微骨折的修复作用降低,是骨折发生的病理学基础[6]。本研究结果提示,松质骨的力学强度下降,是造成骨显微骨折的主要原因。松质骨和密质骨的变化在卵巢切除早期是相同的。
, 百拇医药
三、各种雌激素制剂对去势大鼠BMD、骨形态计量学及组织学的改变
各给药组与去势组相比,BMD均有所增加,以去势+利维爱、去势+盖福润组增加较多(P<0.05),提示卵巢切除后早期HRT治疗可阻止骨矿含量的丢失,同时推测上述两组骨盐含量增加与利维爱的孕激素、雄激素活性,盖福润所含的雄激素、VitD、钙盐有关。本研究结果从侧面提示,绝经后单纯雌激素治疗不能使骨量增加,但可以阻止进一步的骨吸收。比较各给药组药物对改善卵巢切除后大鼠骨丢失的作用,从三个骨量参数及破骨细胞数方面分析,本所实验结果表明,雌激素具有降低骨转换、抑制骨吸收的作用,4种雌激素制剂以维尼安的作用最弱。
从骨转换参数结果还可以推知,利维爱的雄、孕激素活性,盖福润所含的雄激素同雌激素一样,具有抑制骨吸收的作用,同时在上述两组骨小梁骨量恢复至正常水平提示,雄激素、孕激素还具有刺激骨形成、增加骨小梁骨量的作用。人成骨细胞上雄激素受体mRNA的发现,说明雄激素对骨有直接刺激作用[7]。Scane等[8]认为,多毛女性能维持正常骨量是体内雄激素的参与。任芸芸等[9]的研究表明,孕激素同样具有促进骨形成的作用。防治骨质疏松的药物应具有刺激骨形成、增加骨量和维持骨结构的作用。
, 百拇医药
骨组织形态学观察发现,应用利维爱和盖福润的两组去势后大鼠骨小梁表面和皮质骨表面,均有大量的成骨细胞,提示雌、孕、雄激素联合或复合应用可持续诱导骨形成,增加骨量。而另外2个治疗组只在皮质骨表面有成骨细胞存在,也说明雌激素阻止骨矿含量下降是通过刺激皮质骨表面骨形成而起作用的。
本研究受江苏省科委社会发展基金资助
参考文献
1 Kimble RB, Matayoshi AB, Vannice JL, et al. Stimulaneous block of interluekin-1 and tumer necrosis factor is required to completely prevent bone loss in the early postovariectomy period. Endo crinology, 1995, 136:3054-3061.
, http://www.100md.com
2 施新猷.医学动物实验学.西安:陕西科学技术出版社,1989.418-420.
3 Wronski TJ, Walsh CC, Ignaszewski LA, et al. Histologic eidence for osteopenia and increased bone turnover in ovariectomized rats. Bone, 1986, 7:119-123.
4 Malluche HH, Sherman D, Meyer W, et al. A new semiautomatic method for quantitation static and dynamic bone histology. Calcif Tissue Int, 1982, 34:438-439.
5 Dempster DW, Birchman R, Xu R, et al. Temporal changes in cancelous bone structure of rats immediately after ovariectomy. Bone, 1995, 16:157-161.
, 百拇医药
6 Frost HM. The pathomechanics of osteoporosis. Clin Orthop, 1985,200: 198-225.
7 Colvard DS, Eriken EF, Keeting PE, et al. Identication of androgen receptors in normal human osteoblast-like cells. Proc Natl Sci USA, 1989, 86:854-857.
8 Scane AC, Francis RM. Risk factor for osteoporosis in men. Clin Endocrinol, 1993, 38:15-16.
9 任芸芸,朱关珍.孕激素对绝经后妇女骨质代谢的影响.中华妇产科杂志,1995,30:135-137.
(收稿:1998-01-18 修回:1998-12-11), http://www.100md.com