外周前庭器官损伤后传出性前庭神经系统降钙素基因相关肽的变化
作者:迟放鲁 王正敏 李宽孍吴琍雯
单位:200031 上海医科大学眼耳鼻喉科医院卫生部听觉医学重点实验室(迟放鲁、王正敏、吴琍雯),上海医科大学神经生物国家重点实验室(李宽孍)
关键词:前庭;降钙素基因相关肽;神经元;传出;传出通路;免疫组织化学
中华耳鼻咽喉科杂志/990103 【摘要】 目的 探讨外周前庭器官损伤后不同时间病理状态下传出性前庭神经系统降钙素基因相关肽(calcitonin gene-related peptide,CGRP )的变化。方法 制作wistar大鼠单侧外周前庭损伤模型29只,对照健康动物16只,取动物脑干切片,用ABC法作传出性前庭神经系统CGRP免疫组化反应。结果 健康动物传出性前庭神经系统CGRP呈弱阳性反应,单侧前庭损伤后双侧传出性前庭神经系统CGRP反应呈强阳性反应,其阳性反应程度在损伤后10~12 d达高峰,以后随前庭功能恢复而逐渐减弱,但5个月时阳性反应程度仍高于健康动物。结论 传出性前庭神经系统CGRP在外周前庭器官损伤后可能起一定的调节性作用。
, 百拇医药
Calcitonin gene-related peptide changes in efferent vestibular system during vestibular compensation CHI Fanglu*, WANG Zhengmin, LI Kuanyan,et al.*Hearing Laboratory of Ministry of Hygiene, Eye Ear Nose & Throat Hospital of Shanghai Medical University, Shanghai 200031
【Abstract】 Objective To investigate the calcitonin gene-related peptide (CGRP) effect on efferent vestibular system during pathological state of vestibular afferent system.Methods An animal model of vestibular compensation was made by administration of streptomycin to rat vestibular organ to destroy unilateral vestibular function . Change of CGRP in efferent vestibular neurons in all processes from vestibular disorder to vestibular compensation was observed utilizing ABC method of immnuohistochemical technique.Results Efferent vestibular neurons of normal animals showed low immunoreactivity to CGRP. The number of CGRP immunoreactivity neurons and level of CGRP immunoreactivity increased in efferent vestibular system during vestibular disorder, and these changes decreased with vestibular compensation.Conclusion Activity of CGRP in efferent vestibular system plays a regular role on accelerating vestibular compensation.
, 百拇医药
【Key words】 Vestibule Calcitonin gene-related peptide Neurons,efferent efferent pathways Immunohistochemistry
传出性前庭神经对前庭传入信息起协调作用,确认的抑制性递质为乙酰胆碱。80年代以来,发现降钙素基因相关肽(calcitonin gene-related peptide,CGRP)也是传出性前庭神经系统的递质。有关研究多集中在CGRP在传出性前庭神经系统的正常分布方面,对其功能尚不了解。本实验通过损伤大鼠外周前庭器官的方法,观察病理状态下传出性前庭神经系统CGRP的作用。
材料与方法
一、 动物分组及模型的建立
1. 动物分组:雄性wistar大鼠,体重120 g左右。A组健康动物16只,B组造模术后10~12 d大鼠15只,C组术后3个月大鼠7只,D组术后5个月大鼠7只。
, http://www.100md.com
2. 动物造模:29只大鼠10%水合氯醛腹腔麻醉,手术显微镜下经腹外侧开放左侧耳蜗底回,放出内、外淋巴,用钩针向前庭方向搅动,注入链霉素0.5 ml(0.5 g/ml)。3~7d后大鼠全部出现面部向右、头颈向左偏斜,6只动物有翻滚和行走偏斜现象。术后3个月所有动物头颈偏斜改善,术后5个月所有动物头颈偏斜消失,头位恢复正常。
二、取材与标本处理
大鼠麻醉后,固定在头颅立体定向仪上。在前囟右、后各1.5 mm交界处定位作颅骨钻孔,侧脑室注射秋水仙素20 μL(10 g/L)。48 h后经心脏灌注固定4%多聚甲醛250 ml( pH7.4, 4℃),取出脑组织后固定。脑桥横断面冰冻切片,片厚35 μm,保存后同批作免疫组化染色。
三、 免疫组织化学方法
各组动物同时取材,在第VIII对脑神经平面,隔2片取1片脑组织,飘浮法作ABC免疫反应。一抗为1∶8 000兔抗鼠CGRP抗体溶液(Sigma,美国), 二抗为1∶200羊抗兔溶液。用DAB(3,3’-diaminobenzidine)法显色,阳性反应细胞质呈棕黄色。阴性对照的脑片不加一抗,其余步骤相同。
, 百拇医药
四、 观察指标
光镜下作CGRP阳性细胞计数,每个动物取5张切片,每个核团区在1个视野下计数。用MIAS-300计算机图像系统分析细胞染色光密度,阳性细胞内平均灰度减本底平均灰度为测量值,作t检验统计学分析。
结果
正常CGRP阳性传出性前庭神经元如图1所示,主要分布在面神经膝内侧的E群神经元,为小梭形神经元沿面神经膝内侧呈弧形分布。16只大鼠标本连续切片中13只大鼠内侧E群细胞阳性(图2)。大鼠面神经膝背外侧E群神经元CGRP阳性有6只,位于第四脑室底外侧处,约4、5个小梭形细胞簇状分布,偶见紧贴于面神经膝外侧缘者。5只大鼠脑桥尾侧网状核(caudal pantine reticular nucleus, CPR)可见CGRP阳性神经元,在面神经升支或降支两侧偶见1、2个梭形细胞,在三叉神经运动核的脑干平面有多角形CGRP阳性大细胞散在分布。在相关平面上,面神经核和三叉神运动经核呈CGRP阳性,细胞呈深棕色,而传出性前庭神经元的CGRP反应相对较弱,细胞呈淡棕黄色。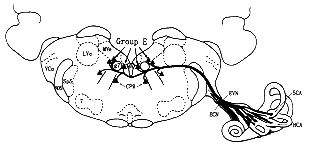
, 百拇医药
Group E:E组神经元,CPR:桥脑网状核,g7:面神经膝,MVe:前庭内侧核,4V:第四脑室,LVe:前庭外侧核,7:面神经核,Sp5、sp5:三叉神经核, VCo:耳蜗核,EVN:传出性前庭神经,ECN:传出性耳蜗神经,SCA:上半规管,HCA:水平半规管
图1 CGRP阳性传出性前庭神经元分布示意(摘自 Wackym PA,et al. Acta Otolaryngol,1993,113:607)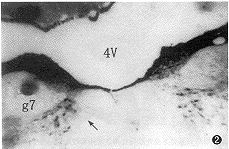
图2 正常组CGRP阳性内侧E群神经元。4V:第四脑室,g7:面神经膝,↑:CGRP阳性内侧E群神经元(下图同)。DAB染色×20
实验组CGRP阳性的传出性前庭神经元普遍双侧性增多,以内侧E群神经元增多为主。以出现阳性细胞的动物计数,A组13只大鼠阳性的内侧E群神经元细胞数平均每侧(6.08±2.43)个(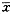 ±s,以下同);B组12只(12/15)阳性内侧E群神经元平均每侧为(12.75±4.44)个;C组6只(6/7)阳性内侧E群神经元每侧平均为(9.50 ±2.91)个;D组5只(5/7)阳性内侧E群神经元为(9.48±3.88) 个。B、C、D组分别与A组相比,差异有非常显著性(P<0.01)。各组内侧E群左右两侧CGRP阳性神经元均数见表1。B、C、D组背外侧E群及CPR区CGRP阳性神经元也明显增加,但未计数。
±s,以下同);B组12只(12/15)阳性内侧E群神经元平均每侧为(12.75±4.44)个;C组6只(6/7)阳性内侧E群神经元每侧平均为(9.50 ±2.91)个;D组5只(5/7)阳性内侧E群神经元为(9.48±3.88) 个。B、C、D组分别与A组相比,差异有非常显著性(P<0.01)。各组内侧E群左右两侧CGRP阳性神经元均数见表1。B、C、D组背外侧E群及CPR区CGRP阳性神经元也明显增加,但未计数。
, http://www.100md.com
表1 各组大鼠内侧E群神经元CGRP阳性细胞个数(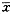 ±s) 组别
±s) 组别
动物数
左侧
右侧
P值
A组
13
6.00±2.55
6.28±2.41
>0.05
B组
, http://www.100md.com
12
12.86±4.25**
12.55±4.18**
>0.05
C组
6
9.13±3.05*
9.88±2.80*
>0.05
D组
5
, http://www.100md.com 10.07±3.73**
8.40±3.49*
<0.05
*与A组相比P<0.05,**与A组相比P<0.01
实验组传出性前庭神经元CGRP反应强度明显增加(图3)。经计算机图像系统分析,A组的CGRP阳性细胞平均灰度值为25.17±9.95,B组阳性细胞平均灰度值为39.44±6.88,两组灰度值差异有非常显著性(P<0.01)。C组和D组阳性细胞灰度值分别为30.37±4.66和33.30±3.03,与A组比较差异有显著性(P<0.01)。各组左右两侧阳性细胞灰度值差异无统计学意义 (P>0.05,图4)。
, 百拇医药
图3 B组内侧E群CGRP神经元强阳性反应,数量增多。DAB染色×20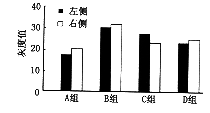
图4 各组内侧E群CGRP阳性细胞灰度值
讨论
近年来发现CGRP与乙酰胆碱共存于前庭传出系统[1]。(93.3±3.8)%的内侧E群神经元CGRP阳性反应,(77.1±5.7)%外侧E群神经元CGRP阳性反应,(61.4±19.9)%CPR区神经元CGRP阳性反应[2,3]。本实验通过连续切片观察,提示对照组和实验组大鼠传出性前庭神经系统的3组神经元均有CGRP阳性反应,主要出现在面神经膝内侧E群神经元,CGRP反应程度比相关区域的面神经核或三叉神经核弱。
本实验制作了外周前庭损伤的动物模型,前庭传出中枢CGRP阳性细胞增多。内侧E群CGRP阳性细胞从平均每侧(6.08±2.43)个增加到前庭急性损伤时B组的(12.75±4.44)个,术后数月前庭功能有恢复的C组及D组CGRP阳性细胞数仍高于正常组。前庭损伤后的CGRP反应程度也明显增加,细胞内呈一片致密棕黄色的双侧性强阳性反应。
, 百拇医药
目前尚不清楚传出性前庭神经系统的CGRP在前庭信息的传入中如何发挥作用。已发现CGRP 有二种相反的调节作用。CGRP能增加爪蛙侧线器传入神经的放电率,通过传出性前庭神经的CGRP介导可引起某些动物前庭传入兴奋作用[4]。同时CGRP对乙酰胆碱的抑制功能起协调作用。CGRP能增加乙酰胆碱对听毛细胞内钙离子浓度的调节反应。CGRP能增加细胞内cAMP浓度,从而调节cAMP依赖性乙酰胆碱受体对乙酰胆碱的反应。CGRP亦通过提高cAMP浓度促进前庭传入神经乙酰胆碱受体的合成,影响其对乙酰胆碱的敏感性[5]。乙酰胆碱酯酶活性也受CGRP调节。CGRP阳性传出性前庭神经无髓鞘末梢不仅与I型毛细胞构成直接突触联系, 也与II型毛细胞的传入神经末梢形成突触联系[6,7]。从而CGRP能够直接兴奋前庭毛细胞,也有可能通过传入神经乙酰胆碱受体起抑制作用。由于神经纤维通过第四脑室底交叉到对侧,一侧传出性前庭神经元可支配双侧外周前庭器官。本实验单侧末梢前庭器官受损后,前庭传出中枢双侧性CGRP反应增强可能是一种调节机制:可能抑制正常侧前庭信息,增强损伤侧传入信号,促进前庭功能的恢复。
, 百拇医药
《参考文献》
[1] Highstein SM. The central nervous system efferent controlof the organs of balance and equilibrium. Neurosci Res,1991,12:13-30.
[2] Wackym PA, Popper P, Micevych PE. Distribution of calcitonin gene-related peptide mRNA and immunoreactivity in the rat central and peripheral vestibular system. Acta Otolaryngol,1993,113:601-608.
[3] Marco RA, Hoffman LE, Wackym PA, et al. Distribution of calcitonin gene-related peptide immunoreactivity in vestibular efferent neurons of the chinchilla. Hear Res, 1996, 97:95-101.
, 百拇医药
[4] Tanaka M, Takeda N, Senba E, et al. Localization, origin and fine structure of calcitonin gene-related peptide-containing fibers in the vestibular end-organs of the rat. Brain Res,1989, 504: 31-35.
[5] Wackym PA, Popper P, Ward PH, et al. Cell and molecular anatomy of nicotinic acetylcholine receptor subunits and calcitonin gene-related peptide in the rat vestibular system. Otolaryngol Head Neck Surg, 1991, 105: 493-510.
[6] Wackym PA. Ultrastructural organization of calcitonin gene-related peptide immunoreactive efferent axons and terminals in the vestibular periphery. Am J Otol, 1993, 14: 41-50.
[7] Ohno K, Takeda N, Tanaka-Tsuji M, et al. Calcitonin gene-related peptide in the efferent system of the inner ear. A review. Acta Otolarygol Suppl, 1993,501:16-20.
(收稿:1998-08-14 修回:1998-11-18), 百拇医药
单位:200031 上海医科大学眼耳鼻喉科医院卫生部听觉医学重点实验室(迟放鲁、王正敏、吴琍雯),上海医科大学神经生物国家重点实验室(李宽孍)
关键词:前庭;降钙素基因相关肽;神经元;传出;传出通路;免疫组织化学
中华耳鼻咽喉科杂志/990103 【摘要】 目的 探讨外周前庭器官损伤后不同时间病理状态下传出性前庭神经系统降钙素基因相关肽(calcitonin gene-related peptide,CGRP )的变化。方法 制作wistar大鼠单侧外周前庭损伤模型29只,对照健康动物16只,取动物脑干切片,用ABC法作传出性前庭神经系统CGRP免疫组化反应。结果 健康动物传出性前庭神经系统CGRP呈弱阳性反应,单侧前庭损伤后双侧传出性前庭神经系统CGRP反应呈强阳性反应,其阳性反应程度在损伤后10~12 d达高峰,以后随前庭功能恢复而逐渐减弱,但5个月时阳性反应程度仍高于健康动物。结论 传出性前庭神经系统CGRP在外周前庭器官损伤后可能起一定的调节性作用。
, 百拇医药
Calcitonin gene-related peptide changes in efferent vestibular system during vestibular compensation CHI Fanglu*, WANG Zhengmin, LI Kuanyan,et al.*Hearing Laboratory of Ministry of Hygiene, Eye Ear Nose & Throat Hospital of Shanghai Medical University, Shanghai 200031
【Abstract】 Objective To investigate the calcitonin gene-related peptide (CGRP) effect on efferent vestibular system during pathological state of vestibular afferent system.Methods An animal model of vestibular compensation was made by administration of streptomycin to rat vestibular organ to destroy unilateral vestibular function . Change of CGRP in efferent vestibular neurons in all processes from vestibular disorder to vestibular compensation was observed utilizing ABC method of immnuohistochemical technique.Results Efferent vestibular neurons of normal animals showed low immunoreactivity to CGRP. The number of CGRP immunoreactivity neurons and level of CGRP immunoreactivity increased in efferent vestibular system during vestibular disorder, and these changes decreased with vestibular compensation.Conclusion Activity of CGRP in efferent vestibular system plays a regular role on accelerating vestibular compensation.
, 百拇医药
【Key words】 Vestibule Calcitonin gene-related peptide Neurons,efferent efferent pathways Immunohistochemistry
传出性前庭神经对前庭传入信息起协调作用,确认的抑制性递质为乙酰胆碱。80年代以来,发现降钙素基因相关肽(calcitonin gene-related peptide,CGRP)也是传出性前庭神经系统的递质。有关研究多集中在CGRP在传出性前庭神经系统的正常分布方面,对其功能尚不了解。本实验通过损伤大鼠外周前庭器官的方法,观察病理状态下传出性前庭神经系统CGRP的作用。
材料与方法
一、 动物分组及模型的建立
1. 动物分组:雄性wistar大鼠,体重120 g左右。A组健康动物16只,B组造模术后10~12 d大鼠15只,C组术后3个月大鼠7只,D组术后5个月大鼠7只。
, http://www.100md.com
2. 动物造模:29只大鼠10%水合氯醛腹腔麻醉,手术显微镜下经腹外侧开放左侧耳蜗底回,放出内、外淋巴,用钩针向前庭方向搅动,注入链霉素0.5 ml(0.5 g/ml)。3~7d后大鼠全部出现面部向右、头颈向左偏斜,6只动物有翻滚和行走偏斜现象。术后3个月所有动物头颈偏斜改善,术后5个月所有动物头颈偏斜消失,头位恢复正常。
二、取材与标本处理
大鼠麻醉后,固定在头颅立体定向仪上。在前囟右、后各1.5 mm交界处定位作颅骨钻孔,侧脑室注射秋水仙素20 μL(10 g/L)。48 h后经心脏灌注固定4%多聚甲醛250 ml( pH7.4, 4℃),取出脑组织后固定。脑桥横断面冰冻切片,片厚35 μm,保存后同批作免疫组化染色。
三、 免疫组织化学方法
各组动物同时取材,在第VIII对脑神经平面,隔2片取1片脑组织,飘浮法作ABC免疫反应。一抗为1∶8 000兔抗鼠CGRP抗体溶液(Sigma,美国), 二抗为1∶200羊抗兔溶液。用DAB(3,3’-diaminobenzidine)法显色,阳性反应细胞质呈棕黄色。阴性对照的脑片不加一抗,其余步骤相同。
, 百拇医药
四、 观察指标
光镜下作CGRP阳性细胞计数,每个动物取5张切片,每个核团区在1个视野下计数。用MIAS-300计算机图像系统分析细胞染色光密度,阳性细胞内平均灰度减本底平均灰度为测量值,作t检验统计学分析。
结果
正常CGRP阳性传出性前庭神经元如图1所示,主要分布在面神经膝内侧的E群神经元,为小梭形神经元沿面神经膝内侧呈弧形分布。16只大鼠标本连续切片中13只大鼠内侧E群细胞阳性(图2)。大鼠面神经膝背外侧E群神经元CGRP阳性有6只,位于第四脑室底外侧处,约4、5个小梭形细胞簇状分布,偶见紧贴于面神经膝外侧缘者。5只大鼠脑桥尾侧网状核(caudal pantine reticular nucleus, CPR)可见CGRP阳性神经元,在面神经升支或降支两侧偶见1、2个梭形细胞,在三叉神经运动核的脑干平面有多角形CGRP阳性大细胞散在分布。在相关平面上,面神经核和三叉神运动经核呈CGRP阳性,细胞呈深棕色,而传出性前庭神经元的CGRP反应相对较弱,细胞呈淡棕黄色。

, 百拇医药
Group E:E组神经元,CPR:桥脑网状核,g7:面神经膝,MVe:前庭内侧核,4V:第四脑室,LVe:前庭外侧核,7:面神经核,Sp5、sp5:三叉神经核, VCo:耳蜗核,EVN:传出性前庭神经,ECN:传出性耳蜗神经,SCA:上半规管,HCA:水平半规管
图1 CGRP阳性传出性前庭神经元分布示意(摘自 Wackym PA,et al. Acta Otolaryngol,1993,113:607)

图2 正常组CGRP阳性内侧E群神经元。4V:第四脑室,g7:面神经膝,↑:CGRP阳性内侧E群神经元(下图同)。DAB染色×20
实验组CGRP阳性的传出性前庭神经元普遍双侧性增多,以内侧E群神经元增多为主。以出现阳性细胞的动物计数,A组13只大鼠阳性的内侧E群神经元细胞数平均每侧(6.08±2.43)个(
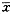 ±s,以下同);B组12只(12/15)阳性内侧E群神经元平均每侧为(12.75±4.44)个;C组6只(6/7)阳性内侧E群神经元每侧平均为(9.50 ±2.91)个;D组5只(5/7)阳性内侧E群神经元为(9.48±3.88) 个。B、C、D组分别与A组相比,差异有非常显著性(P<0.01)。各组内侧E群左右两侧CGRP阳性神经元均数见表1。B、C、D组背外侧E群及CPR区CGRP阳性神经元也明显增加,但未计数。
±s,以下同);B组12只(12/15)阳性内侧E群神经元平均每侧为(12.75±4.44)个;C组6只(6/7)阳性内侧E群神经元每侧平均为(9.50 ±2.91)个;D组5只(5/7)阳性内侧E群神经元为(9.48±3.88) 个。B、C、D组分别与A组相比,差异有非常显著性(P<0.01)。各组内侧E群左右两侧CGRP阳性神经元均数见表1。B、C、D组背外侧E群及CPR区CGRP阳性神经元也明显增加,但未计数。, http://www.100md.com
表1 各组大鼠内侧E群神经元CGRP阳性细胞个数(
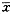 ±s) 组别
±s) 组别动物数
左侧
右侧
P值
A组
13
6.00±2.55
6.28±2.41
>0.05
B组
, http://www.100md.com
12
12.86±4.25**
12.55±4.18**
>0.05
C组
6
9.13±3.05*
9.88±2.80*
>0.05
D组
5
, http://www.100md.com 10.07±3.73**
8.40±3.49*
<0.05
*与A组相比P<0.05,**与A组相比P<0.01
实验组传出性前庭神经元CGRP反应强度明显增加(图3)。经计算机图像系统分析,A组的CGRP阳性细胞平均灰度值为25.17±9.95,B组阳性细胞平均灰度值为39.44±6.88,两组灰度值差异有非常显著性(P<0.01)。C组和D组阳性细胞灰度值分别为30.37±4.66和33.30±3.03,与A组比较差异有显著性(P<0.01)。各组左右两侧阳性细胞灰度值差异无统计学意义 (P>0.05,图4)。

, 百拇医药
图3 B组内侧E群CGRP神经元强阳性反应,数量增多。DAB染色×20

图4 各组内侧E群CGRP阳性细胞灰度值
讨论
近年来发现CGRP与乙酰胆碱共存于前庭传出系统[1]。(93.3±3.8)%的内侧E群神经元CGRP阳性反应,(77.1±5.7)%外侧E群神经元CGRP阳性反应,(61.4±19.9)%CPR区神经元CGRP阳性反应[2,3]。本实验通过连续切片观察,提示对照组和实验组大鼠传出性前庭神经系统的3组神经元均有CGRP阳性反应,主要出现在面神经膝内侧E群神经元,CGRP反应程度比相关区域的面神经核或三叉神经核弱。
本实验制作了外周前庭损伤的动物模型,前庭传出中枢CGRP阳性细胞增多。内侧E群CGRP阳性细胞从平均每侧(6.08±2.43)个增加到前庭急性损伤时B组的(12.75±4.44)个,术后数月前庭功能有恢复的C组及D组CGRP阳性细胞数仍高于正常组。前庭损伤后的CGRP反应程度也明显增加,细胞内呈一片致密棕黄色的双侧性强阳性反应。
, 百拇医药
目前尚不清楚传出性前庭神经系统的CGRP在前庭信息的传入中如何发挥作用。已发现CGRP 有二种相反的调节作用。CGRP能增加爪蛙侧线器传入神经的放电率,通过传出性前庭神经的CGRP介导可引起某些动物前庭传入兴奋作用[4]。同时CGRP对乙酰胆碱的抑制功能起协调作用。CGRP能增加乙酰胆碱对听毛细胞内钙离子浓度的调节反应。CGRP能增加细胞内cAMP浓度,从而调节cAMP依赖性乙酰胆碱受体对乙酰胆碱的反应。CGRP亦通过提高cAMP浓度促进前庭传入神经乙酰胆碱受体的合成,影响其对乙酰胆碱的敏感性[5]。乙酰胆碱酯酶活性也受CGRP调节。CGRP阳性传出性前庭神经无髓鞘末梢不仅与I型毛细胞构成直接突触联系, 也与II型毛细胞的传入神经末梢形成突触联系[6,7]。从而CGRP能够直接兴奋前庭毛细胞,也有可能通过传入神经乙酰胆碱受体起抑制作用。由于神经纤维通过第四脑室底交叉到对侧,一侧传出性前庭神经元可支配双侧外周前庭器官。本实验单侧末梢前庭器官受损后,前庭传出中枢双侧性CGRP反应增强可能是一种调节机制:可能抑制正常侧前庭信息,增强损伤侧传入信号,促进前庭功能的恢复。
, 百拇医药
《参考文献》
[1] Highstein SM. The central nervous system efferent controlof the organs of balance and equilibrium. Neurosci Res,1991,12:13-30.
[2] Wackym PA, Popper P, Micevych PE. Distribution of calcitonin gene-related peptide mRNA and immunoreactivity in the rat central and peripheral vestibular system. Acta Otolaryngol,1993,113:601-608.
[3] Marco RA, Hoffman LE, Wackym PA, et al. Distribution of calcitonin gene-related peptide immunoreactivity in vestibular efferent neurons of the chinchilla. Hear Res, 1996, 97:95-101.
, 百拇医药
[4] Tanaka M, Takeda N, Senba E, et al. Localization, origin and fine structure of calcitonin gene-related peptide-containing fibers in the vestibular end-organs of the rat. Brain Res,1989, 504: 31-35.
[5] Wackym PA, Popper P, Ward PH, et al. Cell and molecular anatomy of nicotinic acetylcholine receptor subunits and calcitonin gene-related peptide in the rat vestibular system. Otolaryngol Head Neck Surg, 1991, 105: 493-510.
[6] Wackym PA. Ultrastructural organization of calcitonin gene-related peptide immunoreactive efferent axons and terminals in the vestibular periphery. Am J Otol, 1993, 14: 41-50.
[7] Ohno K, Takeda N, Tanaka-Tsuji M, et al. Calcitonin gene-related peptide in the efferent system of the inner ear. A review. Acta Otolarygol Suppl, 1993,501:16-20.
(收稿:1998-08-14 修回:1998-11-18), 百拇医药