水杨酸钠对豚鼠单离外毛细胞外向钾电流和静息电位及膜电容影响
作者:梁勇 钟乃川
单位:430022 武汉 同济医科大学附属协和医院耳鼻咽喉科 (梁勇现在:200031 上海医科大学附属眼耳鼻喉科医院耳鼻咽喉科)
关键词:水杨酸钠;膜电位;毛细胞;外;钾通道;外向钾电流;膜电容
摘要 目的 探讨水杨酸钠对豚鼠单离外毛细胞 摘要 目的 探讨水杨酸钠对豚鼠单离外毛细胞(outer hair cell,OHC)钾电流(potassium current,IK)、静息电位(resting potential,RP)和膜电容(membrane electric capacitance,MEC)的影响,分析水杨酸钠影响毛细胞功能的细胞电生理机制。方法 应用膜片钳全细胞记录技术,测试0.1和1.0 mmol/L水杨酸钠用药前后OHC的IK、RP和MEC变化。结果 水杨酸钠对IK的影响具有时效和量效关系,即用药后有IK先增加后降低的双相作用,而高浓度水杨酸钠无论是对IK的增加作用还是降低作用都比低浓度时明显。RP平均约为-60 mV,MEC平均约为39 pF。水杨酸钠有降低RP和MEC的作用,且均存在着量效关系,即高浓度时的作用大于低浓度时。水杨酸钠对RP和MEC影响的时效关系不明显。结论 水杨酸钠具有影响OHC两侧膜的K+电导和细胞内外K+分布的作用,并通过对IK、RP和MEC的影响改变OHC的兴奋性和机械活动特性,可能是水杨酸影响毛细胞功能的耳蜗机制之一。
, http://www.100md.com
Effects of sodium salicylate on outward potassium current, resting potential and membrane electric capacitance of the outer hair cell isolated from guinea pig cochlea
LIANG Yong, ZHONG Naichuan.
Department of Otorhinolaryngology, Union Hospital, Tongji Medical University, Wuhan 430022
Abstract Objectives To study effects of sodium salicylate on the outward potassium current (IK), resting potential (RP) and membrane electric capacitance (MEC) of outer hair cells isolated from guinea pig cochleas and the cytoelectrophysiological mechanisms of effects of sodium salicylate on functions of hair cells. Methods Using the patch-clamp whole cell recording technique, IK, RP and MEC were measured before and after the administration of sodium salicylate at concentration of 0.1 or 1.0 mmol/L. The effects of sodium salicylate on IK, RP and MEC were observed.Results The effects of sodium salicylate on IK had time- and dosage-effect relations, of which the former meant IK increasing and then decreasing after administration, the later meant that the effects of sodium salicylate being much more dominant during either increasing or decreasing IK in higher concentration than in lower concentration. The mean RP was approximately -60mV and the mean MEC was approximately 39 pF. Sodium salicylate could decrease RP and MEC, which possessed a dosage-effect relation, that is, the effect was stronger in higher concentration than in lower concentration, and there was no clear evidence for time-effect relation. Conclusions The sodium salicylate might affect the K+ conduction at the lateral membrane and internal and external distribution of K+ in the outer hair cell. Sodium salicylate might affect the excitability and mechanical activity of the outer hair cell by means of affecting IK, RP and MEC, which might be one of the cochlear mechanisms of the effects of sodium salicylate on the functions of hair cells.
, 百拇医药
Key words Sodium salicylate Membrane potentials Hair cells, outer Potassium channels Outward potassium current Membrane electric capacitance
耳蜗毛细胞上的离子通道是细胞内外离子转运和离子电流形成的基础,钾通道和钾电流(potassium current,IK)对毛细胞的频率调谐、静息电位和兴奋性等生理功能起重要作用。离子通道的活性、离子的通透性和细胞内外离子的分布决定了细胞的静息电位(resting potential,RP),也称膜电位(membrane potential),生理或非生理(如药物)刺激可改变膜两侧的电化学梯度,导致膜电位改变和跨膜电流形成,引起细胞兴奋性变化。膜电容(membrane electric capacitance,MEC)是细胞膜作为绝缘层将细胞内外导电液分隔开而具有的电容器特性,其电容量等于在膜电位下从膜一侧转移到另一侧的电荷量,并与细胞的表面积有关。外毛细胞(outer hair cell,OHC)受某些因素刺激发生运动时可伴随着体积和表面积等形状的改变[1-3],这种变化可引起MEC的变化,而MEC的变化与细胞的长度变化呈对应关系,因此膜电容测试可以反映OHC的运动特性及其与OHC电流变化的关系[3]。
, http://www.100md.com
水杨酸具有导致可逆性耳聋和耳鸣的耳毒性,有人提出作用部位是在耳蜗,且可直接作用于OHC,影响毛细胞的K+、Ca2+、Cl-电导,从而影响毛细胞的机电转换和机械特性等生理功能[4],这一作用有可能对OHC的RP和兴奋性乃至MEC和运动性产生影响。我们以水杨酸钠为实验药物,采用膜片钳全细胞记录技术观察了用药前后豚鼠单离OHC的IK、RP和MEC的变化,以此探讨水杨酸钠对OHC生理功能影响的细胞电生理机制,亦为耳蜗性聋和耳鸣的发病机制研究提供依据。
材料与方法
一、毛细胞分离
健康杂色豚鼠,体重250~380 g,雌雄不限,耳廓反射灵敏。快速断头,取下颞骨,打开听泡,置于Hank液。显微镜下剥去骨性蜗壳,取下基底膜并置入含0.25 mg/ml木瓜蛋白酶的Hank液中,20℃消化10~12 min,再用无酶Hank液清洗2~3次。用含0.25 mg/ml牛血清白蛋白的Hank液孵育1~2 h。
, 百拇医药
二、溶液配制与药物
Hank细胞外液(单位:mmol/L):NaCl 137.0,KCl 5.4,MgCl2 1.0,CaCl2 1.3,羟乙基哌嗪乙胺磺酸[N-(2-hydroxyethl)piperzine-N′-(2-ethanesulfonic acid), HEPES]5.0,葡萄糖5.0,用1.0 mol/L NaOH调pH至7.3,以95%O2+5%CO2混合气体充气至饱和。
细胞内液(电极内液,单位:mmol/L):K-aspartate 85.0,KCl 45.0,Na-pyravate 5.0,MgCl2 4.0,乙二醇乙二胺四醋酸[ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-teraacetic acid, EGTA] 10.0,HEPES 10.0,K2-ATP 5.0,葡萄糖11.0,用1.0 mol/L KOH调pH至7.3。
, http://www.100md.com
水杨酸钠(Sigma公司,美国)用蒸馏水配成0.01 mol/L溶液备用。
三、微电极准备
取经预处理后的微电极玻璃毛坯(直径1.6 mm),以二步法拉制后抛光,使电极尖端电阻为3~5 MΩ。充灌电极内液并固定于操纵器的固定杆上。
四、全细胞记录
1.细胞封接:取数滴细胞混悬液滴于置于倒置显微镜载物台上的多槽玻片上,高倍镜下选定形态和活性正常的OHC,将电极末端调入槽液中,补偿液接电位至零。在显微镜直视下,用微操纵器小心调节电极末端与细胞表面轻轻接触后,施以负压,使之与细胞膜形成高达10 GΩ以上的高阻封接。再施以负压吸破细胞膜,与细胞外近似绝缘,形成全细胞记录状态。根据需要对串联电阻和电容进行补偿。
2.记录仪器、条件和参数:仪器为PC-Ⅱ型膜片钳放大器(华中理工大学)。全部记录在屏蔽防震工作台上进行,室温20~30℃。
, http://www.100md.com
IK:钳制电位为-70 mV。指令电压刺激:每秒给予一100 ms的阶梯式脉冲指令电压刺激,从-40 mV开始,以10 mV为一档逐渐升至+60 mV。为抑制钠电流,在每次指令电压刺激前先施一100 ms的-50 mV钳制电压。
RP:将电流钳制至零,在无电压刺激下记录膜两侧的电位差,即RP。
MEC:钳制电位为0,将快电容补偿调至零位,在2个连续的25 ms中分别给予-10和+10 mV的微弱电压刺激,利用相位敏感法由内设程序计算MEC。
3. 记录内容:于用药前和用药后(给药浓度为0.1和1.0 mmol/L)3、10和20 min分别作以下记录:①各指令电压下的IK电流峰值、绘出IK的电流-电压相关曲线,计算量效和时效关系;②RP;③MEC。
, 百拇医药 4.数据处理与分析:所有数据均在计算机显示、储存和读取,并以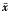 ±s表示,配对t检验作统计学处理,比较和分析用药前后数据的变化及特点。
±s表示,配对t检验作统计学处理,比较和分析用药前后数据的变化及特点。
结果
一、毛细胞分离
一般情况下,每侧耳可分离出形态和活性正常的单离毛细胞约40~120个,毛细胞形态和活性正常的判别标准参照苏振伦等[5]报道的方法。
二、水杨酸钠对IK的影响
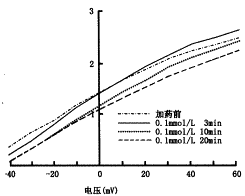
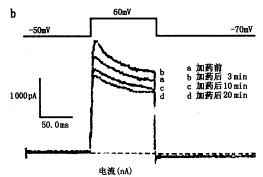
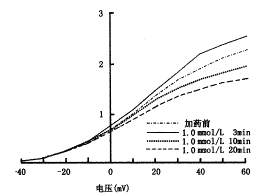
图1a、b分别为0.1和1.0 mmol/L水杨酸钠在用药前和用药3、10和20 min后的IK记录结果及其电流-电压相关曲线。IK在加药3 min后增加,10 min后开始降低,20 min时降低更为明显。表1为2种浓度药物在指令电压60 mV时对IK的影响,用水杨酸钠对IK影响的增减率表示(以下RP和MEC的表示法相同):增减率(%)=[IK(用药后)-IK(用药前)]/IK(用药前)。在用药后3、10和20 min,高浓度的影响均比低浓度明显。以上结果表明,水杨酸钠对IK的影响具有剂量效应和时间效应关系,并具有先增加后抑制的双相作用。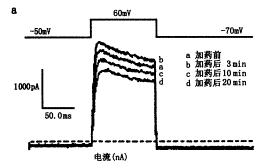
, 百拇医药
图1 0.1 mmol/L(a)和1.0 mmol/L(b)水杨酸钠对钾电流的影响及其电流-电压相关曲线的变化
三、水杨酸钠对RP的影响
图2a、b分别为0.1和1.0 mmol/L水杨酸钠在用药前和用药3、10和20 min后所记录的RP平均值。用药前RP平均约为-61 mV,用药后则降低(绝对值增加)。与用药前相比,0.1 mmol/L水杨酸钠使RP显著降低(t值分别为3.25、4.16和5.78,P值均<0.05),降低率分别为8.3%、11.1%和12.2%。1.0 mmol/L水杨酸钠这使RP极显著降低(t值分别为7.50、8.46和10.30,P值均<0.01),降低率分别为20.3%、23.3%和26.1%。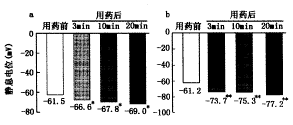
图2 应用0.1 mmol/L(a,n=4) 和1.0 mmol/L(b,n=5)水杨酸钠前后RP的平均值
, 百拇医药
四、水杨酸钠对MEC的影响
图3a、b分别为0.1和1.0 mmol/L水杨酸钠在用药前和用药3、10和20 min后记录的MEC平均值。用药前MEC平均值约为39 pF,用药后则降低。与用药前相比,0.1 mmol/L水杨酸钠使MEC显著性降低(t值分别为3.14、4.51和5.60,P值均<0.05),降低率分别为10.6%、13.2%和17.7%;1.0 mmol/L水杨酸钠使MEC极显著性降低(t值分别为14.14、15.86和13.01,P值均<0.01),降低率分别为21.2%、23.8%和34.7%。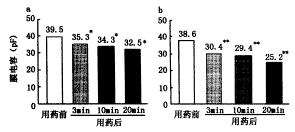
图3 应用0.1 mmol/L(a,n=4)和1.0 mmol/L(b,n=5)水杨酸钠前后MEC的平均值
讨论
, 百拇医药
有研究表明水杨酸可增加OHC侧膜的电导,引起RP的改变,蜗神经、下丘神经元的自发放电率增加[6],耳蜗微音电位的增加和蜗内电位的降低,这些作用与K+电导的增加有关,并被认为是水杨酸引起耳聋和耳鸣的机制[4,6]。本研究采用的药物浓度是根据临床平均中毒血药浓度而定的,比国外作者选用的浓度要低[3,7]。结果发现,水杨酸钠对具有门控特性的IK的作用不是一个简单的促进或抑制作用,从水杨酸钠对IK影响的量效关系看,高浓度时的影响明显大于低浓度时;从时效关系看,给药后IK的增减率表现为先增加然后趋于降低的双相作用,且在高浓度时更为明显。水杨酸钠的这种与其它某些药物类似的双相作用,可能是由于K+外流后被吸附在细胞膜表面的水杨酸负离子上[8],而使细胞内K+减少,导致IK的降低。由此提示,水杨酸钠对OHC的K+动力学影响,可能是通过直接影响K+及以化学形式引起OHC内外K+离子分布异常。
, http://www.100md.com
表1 2种浓度水杨酸钠在60 mV时对IK的影响( ±s)
±s)
水杨酸 钠浓度
(mmol/L)
n
用药前
用药后3min
用药后10min
用药后20min
峰值(nA)
增减率(%)
, 百拇医药
峰值(nA)
增减率(%)
峰值(nA)
增减率(%)
峰值(nA)
增减率(%)
0.1
4
2.53±0.39
0
2.68±0.49△
6.1
, 百拇医药
2.45±0.61△
-3.2
2.34±0.62*
- 7.4
1.0
5
2.30±0.54
0
2.54±1.12*
9.9
1.96±1.01*
, 百拇医药
-14.7
1.72±0.83**
-25.0
注:n代表细胞数,下同;同一浓度用药前后比较:*P<0.05,**P<0.01,△P>0.05
水杨酸钠对IK影响的量效特性,与临床上血药浓度与听力下降和耳鸣的发生率成正比的现象相符[8]。Ashmore[7]还发现,持续灌注水杨酸钠后,药物对OHC内向电流的作用反而消失。这些离子动力学特性有助于解释水杨酸耳毒性的可逆性和非持续性[8],但其机理不清,可能与水杨酸的药代学特性及细胞内对水杨酸的调节作用有关[3,4,7,8]。
, 百拇医药
利用膜片钳技术测试细胞RP的优点在于电极不刺入细胞,保持了良好的细胞内外导电液的分隔。本组测得的RP约为-60 mV,与在体的RP-70 mV较接近。Griguer等[9]报道离体的RP为-50 mV,Ashmore等[7]报道为-10~-40 mV。一般认为离体OHC的RP波动较大,且常低于在体细胞[10]。这与离体OHC缺乏使K+跨过顶表面进入细胞内的驱动力,致细胞内趋于失K+,而引起RP降低有关[11]。
水杨酸钠可使OHC的RP降低,并具有高浓度时的作用大于低浓度时的量效关系,水杨酸钠导致RP的改变与IK的变化有着相似的K+动力学机制。研究表明OHC的机械运动并非由电压钳制下的膜电流改变引起,而是有赖于RP[10],并影响着OHC的兴奋性,因此水杨酸钠可影响OHC的兴奋性和机械运动等生理功能。
, 百拇医药
本组测得的平均MEC约为39 pF,略高于Ashmore等[7]报道的24~32 pF。MEC在给予水杨酸后明显降低,且高浓度时的作用大于低浓度时,表现出量效关系。MEC反映了离体OHC受电、机械、化学和渗透浓度等刺激后所发生的机械特性变化,当水杨酸钠作为一种可以影响OHC离子通道的化学物质,以及可以直接以化学刺激改变OHC生理特性时,就可引起OHC的缩短和表面形状的改变,这种现象在高倍显微镜下可以清楚地观察到,Dulon等[1,2]和Tunstall等[3]也有类似报道。水杨酸可渗过OHC膜,直接作用于OHC运动蛋白,影响细胞的运动性,从而介导产生对听力的影响[3],反映了水杨酸具有影响OHC机械运动特性的作用。
水杨酸钠可通过影响离子分布和直接化学刺激作用于OHC的IK、RP和MEC,导致OHC机电转换机制和机械运动特性改变,提示水杨酸钠有可能通过影响OHC生理功能的途径产生可逆性耳毒性。
, 百拇医药
志谢 本实验工作得到同济医科大学药理教研室姚伟星教授、夏国谨主任技师、李新华和钟宁博士等的大力支持
参考文献
1 Dulon D,Aran JM, Schacht J. Potassium-depolarization induces motility in isolated outer hair cells by osmotic mechanism. Hear Res, 1988,32:123-129.
2 Dulon D, Schacht J. Motility of cochlear outer hair cells. Am J Otol, 1992,13:108-112.
3 Tunstall MJ, Gale JE, Ashmore JF. Action of salicylate on membrane capacitance of outer hair cells from the guinea-pig cochlea. J Physiol, 1995,485(Pt3):739-752.
, 百拇医药
4 Stypulkowski PH. Mechanisms of salicylate ototoxicity. Hear Res, 1990, 46:113-145.
5 苏振伦, 姜泗长, 顾瑞, 等. 豚鼠耳蜗毛细胞分离法. 中华耳鼻咽喉科杂志, 1992,27:133-135.
6 Jastreboff PJ, Sasaki CT. An animal model of tinnitus, a decade of development. Am J Otol, 1994, 15:19-27.
7 Ashmore JF. Effect of salicylate on a rapid charge movement in outer hair cell isolated from the guinea-pig cochlea. J Physiol, 1989,412: 46P.
, 百拇医药
8 Boettcher FA, Bancroft BR, Salvi RJ, et al. Effects of sodium salicylate on evoked-response measures of hearing. Hear Res, 1989,42:129-141.
9 Griguer C, Fuchs PA. Voltage-dependent potassium currents in cochlear hair cells of the embryonic chick. J Neurophysiol, 1996,75:508-513.
10 Santos-Sacchi J, Dilger JP. Whole cell currents and mechanical responses of isolated outer hair cells. Hear Res, 1988,35:143-150.
11 宋本波, 汤云贵, 谢佐平, 等. 豚鼠耳蜗离体外毛细胞的膜电位和离子电流. 生物物理学报, 1993,9:553-556.
(收稿:1998-11-06 1999-01-11 修回:1999-05-25), 百拇医药
单位:430022 武汉 同济医科大学附属协和医院耳鼻咽喉科 (梁勇现在:200031 上海医科大学附属眼耳鼻喉科医院耳鼻咽喉科)
关键词:水杨酸钠;膜电位;毛细胞;外;钾通道;外向钾电流;膜电容
摘要 目的 探讨水杨酸钠对豚鼠单离外毛细胞 摘要 目的 探讨水杨酸钠对豚鼠单离外毛细胞(outer hair cell,OHC)钾电流(potassium current,IK)、静息电位(resting potential,RP)和膜电容(membrane electric capacitance,MEC)的影响,分析水杨酸钠影响毛细胞功能的细胞电生理机制。方法 应用膜片钳全细胞记录技术,测试0.1和1.0 mmol/L水杨酸钠用药前后OHC的IK、RP和MEC变化。结果 水杨酸钠对IK的影响具有时效和量效关系,即用药后有IK先增加后降低的双相作用,而高浓度水杨酸钠无论是对IK的增加作用还是降低作用都比低浓度时明显。RP平均约为-60 mV,MEC平均约为39 pF。水杨酸钠有降低RP和MEC的作用,且均存在着量效关系,即高浓度时的作用大于低浓度时。水杨酸钠对RP和MEC影响的时效关系不明显。结论 水杨酸钠具有影响OHC两侧膜的K+电导和细胞内外K+分布的作用,并通过对IK、RP和MEC的影响改变OHC的兴奋性和机械活动特性,可能是水杨酸影响毛细胞功能的耳蜗机制之一。
, http://www.100md.com
Effects of sodium salicylate on outward potassium current, resting potential and membrane electric capacitance of the outer hair cell isolated from guinea pig cochlea
LIANG Yong, ZHONG Naichuan.
Department of Otorhinolaryngology, Union Hospital, Tongji Medical University, Wuhan 430022
Abstract Objectives To study effects of sodium salicylate on the outward potassium current (IK), resting potential (RP) and membrane electric capacitance (MEC) of outer hair cells isolated from guinea pig cochleas and the cytoelectrophysiological mechanisms of effects of sodium salicylate on functions of hair cells. Methods Using the patch-clamp whole cell recording technique, IK, RP and MEC were measured before and after the administration of sodium salicylate at concentration of 0.1 or 1.0 mmol/L. The effects of sodium salicylate on IK, RP and MEC were observed.Results The effects of sodium salicylate on IK had time- and dosage-effect relations, of which the former meant IK increasing and then decreasing after administration, the later meant that the effects of sodium salicylate being much more dominant during either increasing or decreasing IK in higher concentration than in lower concentration. The mean RP was approximately -60mV and the mean MEC was approximately 39 pF. Sodium salicylate could decrease RP and MEC, which possessed a dosage-effect relation, that is, the effect was stronger in higher concentration than in lower concentration, and there was no clear evidence for time-effect relation. Conclusions The sodium salicylate might affect the K+ conduction at the lateral membrane and internal and external distribution of K+ in the outer hair cell. Sodium salicylate might affect the excitability and mechanical activity of the outer hair cell by means of affecting IK, RP and MEC, which might be one of the cochlear mechanisms of the effects of sodium salicylate on the functions of hair cells.
, 百拇医药
Key words Sodium salicylate Membrane potentials Hair cells, outer Potassium channels Outward potassium current Membrane electric capacitance
耳蜗毛细胞上的离子通道是细胞内外离子转运和离子电流形成的基础,钾通道和钾电流(potassium current,IK)对毛细胞的频率调谐、静息电位和兴奋性等生理功能起重要作用。离子通道的活性、离子的通透性和细胞内外离子的分布决定了细胞的静息电位(resting potential,RP),也称膜电位(membrane potential),生理或非生理(如药物)刺激可改变膜两侧的电化学梯度,导致膜电位改变和跨膜电流形成,引起细胞兴奋性变化。膜电容(membrane electric capacitance,MEC)是细胞膜作为绝缘层将细胞内外导电液分隔开而具有的电容器特性,其电容量等于在膜电位下从膜一侧转移到另一侧的电荷量,并与细胞的表面积有关。外毛细胞(outer hair cell,OHC)受某些因素刺激发生运动时可伴随着体积和表面积等形状的改变[1-3],这种变化可引起MEC的变化,而MEC的变化与细胞的长度变化呈对应关系,因此膜电容测试可以反映OHC的运动特性及其与OHC电流变化的关系[3]。
, http://www.100md.com
水杨酸具有导致可逆性耳聋和耳鸣的耳毒性,有人提出作用部位是在耳蜗,且可直接作用于OHC,影响毛细胞的K+、Ca2+、Cl-电导,从而影响毛细胞的机电转换和机械特性等生理功能[4],这一作用有可能对OHC的RP和兴奋性乃至MEC和运动性产生影响。我们以水杨酸钠为实验药物,采用膜片钳全细胞记录技术观察了用药前后豚鼠单离OHC的IK、RP和MEC的变化,以此探讨水杨酸钠对OHC生理功能影响的细胞电生理机制,亦为耳蜗性聋和耳鸣的发病机制研究提供依据。
材料与方法
一、毛细胞分离
健康杂色豚鼠,体重250~380 g,雌雄不限,耳廓反射灵敏。快速断头,取下颞骨,打开听泡,置于Hank液。显微镜下剥去骨性蜗壳,取下基底膜并置入含0.25 mg/ml木瓜蛋白酶的Hank液中,20℃消化10~12 min,再用无酶Hank液清洗2~3次。用含0.25 mg/ml牛血清白蛋白的Hank液孵育1~2 h。
, 百拇医药
二、溶液配制与药物
Hank细胞外液(单位:mmol/L):NaCl 137.0,KCl 5.4,MgCl2 1.0,CaCl2 1.3,羟乙基哌嗪乙胺磺酸[N-(2-hydroxyethl)piperzine-N′-(2-ethanesulfonic acid), HEPES]5.0,葡萄糖5.0,用1.0 mol/L NaOH调pH至7.3,以95%O2+5%CO2混合气体充气至饱和。
细胞内液(电极内液,单位:mmol/L):K-aspartate 85.0,KCl 45.0,Na-pyravate 5.0,MgCl2 4.0,乙二醇乙二胺四醋酸[ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-teraacetic acid, EGTA] 10.0,HEPES 10.0,K2-ATP 5.0,葡萄糖11.0,用1.0 mol/L KOH调pH至7.3。
, http://www.100md.com
水杨酸钠(Sigma公司,美国)用蒸馏水配成0.01 mol/L溶液备用。
三、微电极准备
取经预处理后的微电极玻璃毛坯(直径1.6 mm),以二步法拉制后抛光,使电极尖端电阻为3~5 MΩ。充灌电极内液并固定于操纵器的固定杆上。
四、全细胞记录
1.细胞封接:取数滴细胞混悬液滴于置于倒置显微镜载物台上的多槽玻片上,高倍镜下选定形态和活性正常的OHC,将电极末端调入槽液中,补偿液接电位至零。在显微镜直视下,用微操纵器小心调节电极末端与细胞表面轻轻接触后,施以负压,使之与细胞膜形成高达10 GΩ以上的高阻封接。再施以负压吸破细胞膜,与细胞外近似绝缘,形成全细胞记录状态。根据需要对串联电阻和电容进行补偿。
2.记录仪器、条件和参数:仪器为PC-Ⅱ型膜片钳放大器(华中理工大学)。全部记录在屏蔽防震工作台上进行,室温20~30℃。
, http://www.100md.com
IK:钳制电位为-70 mV。指令电压刺激:每秒给予一100 ms的阶梯式脉冲指令电压刺激,从-40 mV开始,以10 mV为一档逐渐升至+60 mV。为抑制钠电流,在每次指令电压刺激前先施一100 ms的-50 mV钳制电压。
RP:将电流钳制至零,在无电压刺激下记录膜两侧的电位差,即RP。
MEC:钳制电位为0,将快电容补偿调至零位,在2个连续的25 ms中分别给予-10和+10 mV的微弱电压刺激,利用相位敏感法由内设程序计算MEC。
3. 记录内容:于用药前和用药后(给药浓度为0.1和1.0 mmol/L)3、10和20 min分别作以下记录:①各指令电压下的IK电流峰值、绘出IK的电流-电压相关曲线,计算量效和时效关系;②RP;③MEC。
, 百拇医药 4.数据处理与分析:所有数据均在计算机显示、储存和读取,并以
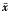 ±s表示,配对t检验作统计学处理,比较和分析用药前后数据的变化及特点。
±s表示,配对t检验作统计学处理,比较和分析用药前后数据的变化及特点。结果
一、毛细胞分离
一般情况下,每侧耳可分离出形态和活性正常的单离毛细胞约40~120个,毛细胞形态和活性正常的判别标准参照苏振伦等[5]报道的方法。
二、水杨酸钠对IK的影响
图1a、b分别为0.1和1.0 mmol/L水杨酸钠在用药前和用药3、10和20 min后的IK记录结果及其电流-电压相关曲线。IK在加药3 min后增加,10 min后开始降低,20 min时降低更为明显。表1为2种浓度药物在指令电压60 mV时对IK的影响,用水杨酸钠对IK影响的增减率表示(以下RP和MEC的表示法相同):增减率(%)=[IK(用药后)-IK(用药前)]/IK(用药前)。在用药后3、10和20 min,高浓度的影响均比低浓度明显。以上结果表明,水杨酸钠对IK的影响具有剂量效应和时间效应关系,并具有先增加后抑制的双相作用。




, 百拇医药
图1 0.1 mmol/L(a)和1.0 mmol/L(b)水杨酸钠对钾电流的影响及其电流-电压相关曲线的变化
三、水杨酸钠对RP的影响
图2a、b分别为0.1和1.0 mmol/L水杨酸钠在用药前和用药3、10和20 min后所记录的RP平均值。用药前RP平均约为-61 mV,用药后则降低(绝对值增加)。与用药前相比,0.1 mmol/L水杨酸钠使RP显著降低(t值分别为3.25、4.16和5.78,P值均<0.05),降低率分别为8.3%、11.1%和12.2%。1.0 mmol/L水杨酸钠这使RP极显著降低(t值分别为7.50、8.46和10.30,P值均<0.01),降低率分别为20.3%、23.3%和26.1%。

图2 应用0.1 mmol/L(a,n=4) 和1.0 mmol/L(b,n=5)水杨酸钠前后RP的平均值
, 百拇医药
四、水杨酸钠对MEC的影响
图3a、b分别为0.1和1.0 mmol/L水杨酸钠在用药前和用药3、10和20 min后记录的MEC平均值。用药前MEC平均值约为39 pF,用药后则降低。与用药前相比,0.1 mmol/L水杨酸钠使MEC显著性降低(t值分别为3.14、4.51和5.60,P值均<0.05),降低率分别为10.6%、13.2%和17.7%;1.0 mmol/L水杨酸钠使MEC极显著性降低(t值分别为14.14、15.86和13.01,P值均<0.01),降低率分别为21.2%、23.8%和34.7%。

图3 应用0.1 mmol/L(a,n=4)和1.0 mmol/L(b,n=5)水杨酸钠前后MEC的平均值
讨论
, 百拇医药
有研究表明水杨酸可增加OHC侧膜的电导,引起RP的改变,蜗神经、下丘神经元的自发放电率增加[6],耳蜗微音电位的增加和蜗内电位的降低,这些作用与K+电导的增加有关,并被认为是水杨酸引起耳聋和耳鸣的机制[4,6]。本研究采用的药物浓度是根据临床平均中毒血药浓度而定的,比国外作者选用的浓度要低[3,7]。结果发现,水杨酸钠对具有门控特性的IK的作用不是一个简单的促进或抑制作用,从水杨酸钠对IK影响的量效关系看,高浓度时的影响明显大于低浓度时;从时效关系看,给药后IK的增减率表现为先增加然后趋于降低的双相作用,且在高浓度时更为明显。水杨酸钠的这种与其它某些药物类似的双相作用,可能是由于K+外流后被吸附在细胞膜表面的水杨酸负离子上[8],而使细胞内K+减少,导致IK的降低。由此提示,水杨酸钠对OHC的K+动力学影响,可能是通过直接影响K+及以化学形式引起OHC内外K+离子分布异常。
, http://www.100md.com
表1 2种浓度水杨酸钠在60 mV时对IK的影响(
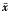 ±s)
±s)水杨酸 钠浓度
(mmol/L)
n
用药前
用药后3min
用药后10min
用药后20min
峰值(nA)
增减率(%)
, 百拇医药
峰值(nA)
增减率(%)
峰值(nA)
增减率(%)
峰值(nA)
增减率(%)
0.1
4
2.53±0.39
0
2.68±0.49△
6.1
, 百拇医药
2.45±0.61△
-3.2
2.34±0.62*
- 7.4
1.0
5
2.30±0.54
0
2.54±1.12*
9.9
1.96±1.01*
, 百拇医药
-14.7
1.72±0.83**
-25.0
注:n代表细胞数,下同;同一浓度用药前后比较:*P<0.05,**P<0.01,△P>0.05
水杨酸钠对IK影响的量效特性,与临床上血药浓度与听力下降和耳鸣的发生率成正比的现象相符[8]。Ashmore[7]还发现,持续灌注水杨酸钠后,药物对OHC内向电流的作用反而消失。这些离子动力学特性有助于解释水杨酸耳毒性的可逆性和非持续性[8],但其机理不清,可能与水杨酸的药代学特性及细胞内对水杨酸的调节作用有关[3,4,7,8]。
, 百拇医药
利用膜片钳技术测试细胞RP的优点在于电极不刺入细胞,保持了良好的细胞内外导电液的分隔。本组测得的RP约为-60 mV,与在体的RP-70 mV较接近。Griguer等[9]报道离体的RP为-50 mV,Ashmore等[7]报道为-10~-40 mV。一般认为离体OHC的RP波动较大,且常低于在体细胞[10]。这与离体OHC缺乏使K+跨过顶表面进入细胞内的驱动力,致细胞内趋于失K+,而引起RP降低有关[11]。
水杨酸钠可使OHC的RP降低,并具有高浓度时的作用大于低浓度时的量效关系,水杨酸钠导致RP的改变与IK的变化有着相似的K+动力学机制。研究表明OHC的机械运动并非由电压钳制下的膜电流改变引起,而是有赖于RP[10],并影响着OHC的兴奋性,因此水杨酸钠可影响OHC的兴奋性和机械运动等生理功能。
, 百拇医药
本组测得的平均MEC约为39 pF,略高于Ashmore等[7]报道的24~32 pF。MEC在给予水杨酸后明显降低,且高浓度时的作用大于低浓度时,表现出量效关系。MEC反映了离体OHC受电、机械、化学和渗透浓度等刺激后所发生的机械特性变化,当水杨酸钠作为一种可以影响OHC离子通道的化学物质,以及可以直接以化学刺激改变OHC生理特性时,就可引起OHC的缩短和表面形状的改变,这种现象在高倍显微镜下可以清楚地观察到,Dulon等[1,2]和Tunstall等[3]也有类似报道。水杨酸可渗过OHC膜,直接作用于OHC运动蛋白,影响细胞的运动性,从而介导产生对听力的影响[3],反映了水杨酸具有影响OHC机械运动特性的作用。
水杨酸钠可通过影响离子分布和直接化学刺激作用于OHC的IK、RP和MEC,导致OHC机电转换机制和机械运动特性改变,提示水杨酸钠有可能通过影响OHC生理功能的途径产生可逆性耳毒性。
, 百拇医药
志谢 本实验工作得到同济医科大学药理教研室姚伟星教授、夏国谨主任技师、李新华和钟宁博士等的大力支持
参考文献
1 Dulon D,Aran JM, Schacht J. Potassium-depolarization induces motility in isolated outer hair cells by osmotic mechanism. Hear Res, 1988,32:123-129.
2 Dulon D, Schacht J. Motility of cochlear outer hair cells. Am J Otol, 1992,13:108-112.
3 Tunstall MJ, Gale JE, Ashmore JF. Action of salicylate on membrane capacitance of outer hair cells from the guinea-pig cochlea. J Physiol, 1995,485(Pt3):739-752.
, 百拇医药
4 Stypulkowski PH. Mechanisms of salicylate ototoxicity. Hear Res, 1990, 46:113-145.
5 苏振伦, 姜泗长, 顾瑞, 等. 豚鼠耳蜗毛细胞分离法. 中华耳鼻咽喉科杂志, 1992,27:133-135.
6 Jastreboff PJ, Sasaki CT. An animal model of tinnitus, a decade of development. Am J Otol, 1994, 15:19-27.
7 Ashmore JF. Effect of salicylate on a rapid charge movement in outer hair cell isolated from the guinea-pig cochlea. J Physiol, 1989,412: 46P.
, 百拇医药
8 Boettcher FA, Bancroft BR, Salvi RJ, et al. Effects of sodium salicylate on evoked-response measures of hearing. Hear Res, 1989,42:129-141.
9 Griguer C, Fuchs PA. Voltage-dependent potassium currents in cochlear hair cells of the embryonic chick. J Neurophysiol, 1996,75:508-513.
10 Santos-Sacchi J, Dilger JP. Whole cell currents and mechanical responses of isolated outer hair cells. Hear Res, 1988,35:143-150.
11 宋本波, 汤云贵, 谢佐平, 等. 豚鼠耳蜗离体外毛细胞的膜电位和离子电流. 生物物理学报, 1993,9:553-556.
(收稿:1998-11-06 1999-01-11 修回:1999-05-25), 百拇医药