热休克蛋白70及其抗体与实验性自身免疫性内耳病
作者:王鹏举 吴展元 肖伯奎 邬堂春
单位:王鹏举(湖北省襄樊市中心医院耳鼻咽喉科 441021);吴展元(湖北医科大学附属第一医院耳鼻咽喉-头颈外科);肖伯奎(湖北医科大学附属第一医院耳鼻咽喉-头颈外科);邬堂春(同济医科大学高温生理研究室)
关键词:
中华耳鼻咽喉科杂志000103 摘 要:目的 了解抗原免疫对热休克蛋白70(heat shock protein 70,HSP70)在豚鼠耳蜗中表达的影响。方法 以同种异体内耳组织为抗原免疫豚鼠,用免疫组织化学方法检测豚鼠耳蜗中HSP70的表达并进行计算机图像处理;对豚鼠膜迷路组织进行免疫转印分析以测定HSP71;以纯化的人类重组HSP71为抗原,用免疫转印技术(Western blot)检测动物血浆中HSP71抗体。结果 HSP70在正常豚鼠耳蜗中呈低水平表达。抗原免疫后,实验组动物耳蜗HSP70免疫活性较对照组明显增强,两组间的吸光度值差异有显著性 (P<0.01);免疫后大多数动物(12/20)体内产生了抗HSP71抗体,实验组HSP71抗体阳性率显著高于对照组(P<0.01)。结论 同种膜迷路组织作为抗原免疫豚鼠能够诱导HSP70在耳蜗内合成增加;表明HSP70与自身免疫性内耳病有一定联系。
, 百拇医药
The role of heat shock protein 70 and its autoantibody in experimental autoimmune inner ear disease
WANG Pengju
(Department of Otorhinolaryngology, Center Hospital of Xiangfan, Hubei 441021,China)
WU Zhanyuan XIAO Baikui
Abstract:Objective To examine the effect of antigen stimulation on induction of the heat shock protein 70(HSP70) in the guinea pig cochlea and to explore the role of HSP70 and its autoantibody in the pathogenesis and diagnosis of autoimmunize inner ear disease (AIED).Methods To establish the animal model of AIED, homologous crude inner ear antigen was used to immunize the guinea pig. The expression of HSP70 was detected by immunocytochemistry and the relative staining densities were quantified with a light microscope image analysis system. The autoantibodies against HSP71 in the plasma of animals were tested by Western blot using purified recombinant human HSP71 as antigen. Results HSP70 presented in the normal guinea pig cochlea at a lower level. After immunological challenge, the levels of HSP70 immunoreactivity in the immunized animals were significantly increased as compared with control animals. Optical densities of cochleae of immunized animals were significantly greater than those of animals in the control group (P<0.01). Most of the immunized animals had developed autoantibodies against HSP71.The incidence of autoantibody in the experimental group was significantly different (P<0.01) from the control group. Conclusion Antigen stimulation could lead to an increase in the synthesis of HSP70 in the guinea pig cochlea. The detection of autoantibody against HSP71 might have significance in the diagnosis of AIED.
, 百拇医药
Key words:Heat shock proteins 70;Autoimmune diseases;Autoantibodies;Labyrinth▲
近年来热休克蛋白70(heat shock protein 70,HSP70)与自身免疫性内耳病(autoimmune inner ear disease,AIED)之间关系已成为研究的热点之一[1,2]。本研究以同种异体内耳组织为抗原免疫豚鼠,用免疫组化技术检测HSP70在豚鼠耳蜗中的表达,了解耳蜗组织细胞在抗原刺激下是否存在热休克反应,并以人类重组HSP71为抗原,用免疫转印技术(Western blot) 检测动物血浆中HSP71抗体的存在。
材料与方法
一、实验动物
选用耳廓反射正常、体重在250~400 g的健康花斑豚鼠,雌雄兼用(卫生部武汉生物制品研究所提供),共30只,随机分为实验组20只和对照组10只。分笼后适应性喂养1周。
, 百拇医药
二、抗原的制备
豚鼠60只,断头,取出听泡,分离全膜迷路。匀浆、破碎,反复冻融4次(-70 ℃~37 ℃),以2 500 r/min 离心10 min,取上清液在UV-265 型紫外分光光度计下测蛋白含量,将蛋白质的含量调到800 μg/ml。
三、免疫方法
按杨湘宁等[3]方法进行,共免疫4次。实验组前两次免疫剂量各为800 μg/ml的抗原0.5 ml+0.5 ml完全弗氏佐剂,后两次免疫剂量各为400 μg/ml的抗原0.5 ml +0.5 ml不完全弗氏佐剂。对照组在相应时间及相应部位于前后两次分别注射等量的完全弗氏佐剂或不完全弗氏佐剂。动物在第4次免疫后2周处死, 处死前心脏穿刺采血,肝素抗凝,取血浆做免疫学指标检测。
四、检测指标
, 百拇医药
1. 听性脑干反应(auditory brainstem response,ABR)测试:动物于免疫前及处死前麻醉后在静电屏蔽室内行双侧ABR 测试。短声刺激,重复率为20次/s,扫描周期10 ms,滤波带宽100~3 000 Hz,信号叠加1 000次,以ABR波Ⅲ反应阈为标准判断听阈。
2. 豚鼠耳蜗HSP70表达:动物麻醉后开胸,灌注、固定后取出听泡,开放前庭窗和圆窗。固定、脱钙、包埋,中轴切片,覆片。滴加3%过氧化氢,滴加正常血清封闭液,加入一抗:1∶1 000鼠抗人HSP70,加生物素化羊抗小鼠IgG(即用型),滴加链酶亲和素-生物素-过氧化物酶复合物,二氨基联苯胺显色,蒸馏水冲洗终止反应,封片。为使HSP70相对含量定量化,在对照组、实验组双耳ABR阈提高≥10 dB组及ABR阈无提高组中各选4个耳蜗,在每个耳蜗的切片中随机抽取2张近中轴的切片做图像分析。用同济医科大学研制的HPIAS-1000型高清晰度彩色病理图像免疫组化测量系统于400倍视野下测量Corti器和螺旋神经节细胞的吸光度。为减少误差,固定对每张切片第2、3回的以上部位的细胞进行吸光度测定。在每组中随机选择400个受检细胞做统计学处理,计算各组的平均吸光度值。用t检验(双样本等方差假设)分析各组平均吸光度值的差异。
, http://www.100md.com
3. 豚鼠膜迷路HSP71抗原的检测(Western blot):取膜迷路抗原0.75 ml,加样品处理液,100℃水浴3~5 min。用微量加样器吸取样品蛋白,总量为100 μL。经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳将蛋白质转移至硝酸纤维素膜上,取下硝酸纤维素膜,切成6 mm宽的细条,置于孵育槽中。免疫识别具体步骤参考Sambrook等[4]方法。一抗为1∶1 000兔抗人HSP71多克隆抗体(相对分子质量为71.2×103,同济医科大学高温生理室制备),二抗为1∶1 000的辣根过氧化物酶标记的羊抗兔IgG(Sigma,美国),二氨基联苯胺显色,出现棕色条带为阳性。
4. 血浆HSP71抗体的测定:将人类HSP71的cDNA和pET载体连接,转染大肠杆菌,用β-异丙基硫吡喃半乳糖特异性诱导表达而得到纯化的人类重组HSP71(相对分子质量为71.2×103)。通过十二烷基磺酸钠-聚丙烯酰胺电泳转移至硝酸纤维素膜上,制成含HSP71抗原的硝酸纤维素膜小条(5 mm×2 mm),用含5%脱脂奶粉的磷酸盐缓冲液封闭1 h。加入25 μL待测血浆(按1∶10、1∶20、1∶40用封闭液稀释)。具体步骤参考Wu等[5]方法。二抗为1∶1 000的辣根过氧化物酶标记的羊抗豚鼠IgG(Sigma,美国),二氨基联苯胺显色,其阳性结果为硝酸纤维膜小条上明显的棕褐色带。
, http://www.100md.com
结果
1.ABR阈:末次免疫后2周实验组20只动物中ABR阈提高≥10 dB者共11只(15耳),其中4 只动物为双耳,7 只动物为单耳(4只左耳,3只右耳),其中反应阈升高10 dB有 5 耳,15 dB者 8耳,20 dB者1 耳,25 dB 者1耳,免疫前后平均反应阈(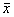 ±s)为(12.12±3.74)dB和18.16±6.37) dB,差异有显著性(t=5.1962,P<0.01)。对照组的平均反应阈在注射佐剂前后为(12.0±2.94)dB和(12.4±3.0) dB,差异无显著性(t=0.526 3,P>0.05)。
±s)为(12.12±3.74)dB和18.16±6.37) dB,差异有显著性(t=5.1962,P<0.01)。对照组的平均反应阈在注射佐剂前后为(12.0±2.94)dB和(12.4±3.0) dB,差异无显著性(t=0.526 3,P>0.05)。
2.HSP70在豚鼠耳蜗内表达:对照组豚鼠耳蜗内可见HSP70呈低水平表达,主要见于螺旋神经节细胞(图1)、Corti器(图2);实验组螺旋神经节细胞、Corti器的内外毛细胞的HSP70免疫组化染色加深(图3,4)。各组的平均吸光度值为:对照组0.178 5±0.068 4(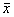 ±s,下同);实验组无ABR阈提高组0.215 2±0.116 7;双耳ABR阈提高≥10 dB组为0.315 6±0.128,统计分析表明,实验组和对照组平均吸光度值的差异有显著性(t=18.901 0,P<0.01),实验组中双耳ABR阈提高≥10 dB动物和无ABR阈提高动物平均吸光度值差异也有显著性(t=11.683 3,P<0.01)。
±s,下同);实验组无ABR阈提高组0.215 2±0.116 7;双耳ABR阈提高≥10 dB组为0.315 6±0.128,统计分析表明,实验组和对照组平均吸光度值的差异有显著性(t=18.901 0,P<0.01),实验组中双耳ABR阈提高≥10 dB动物和无ABR阈提高动物平均吸光度值差异也有显著性(t=11.683 3,P<0.01)。
, 百拇医药
图1 对照组耳蜗螺旋神经节细胞的HSP70的弱表达.SABC×200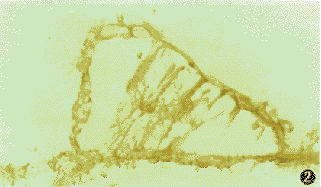
图2 对照组耳蜗Corti器HSP70的弱表达.SABC×400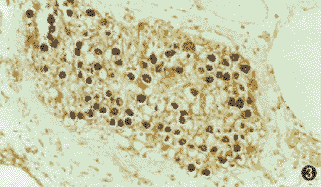
图3 实验组耳蜗螺旋神经节细胞的HSP70的强表达.SABC×200
图4 实验组耳蜗Corti器内外毛细胞HSP70的表达.SABC×400
3.膜迷路HSP71抗原测定:膜迷路组织经免疫转印后可被兔抗人HSP71多克隆抗体识别,在硝酸纤维素膜膜上表现为一条高密度的棕色带(图5)。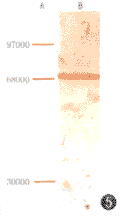
, 百拇医药
图5 豚鼠膜迷路HSP71抗原.A标准的相对分子质量,B豚鼠膜迷路组织免疫转印
4.血浆HSP71抗体测定:将实验动物分为3组:实验组ABR阈提高≥10 dB组、无ABR阈提高组及对照组HSP71抗体阴性、阳性判断见图6。实验组20只动物中有12只出现HSP71抗体阳性,阳性率为60%。ABR阈提高≥10 dB组11只动物中有9只出现1∶10阳性,阳性率为9/11,其中2只动物出现1∶40阳性;实验组无ABR阈提高的9只动物中有3只出现1∶10阳性,阳性率为3/9;对照组10动物均无HSP71抗体产生。经检验(四格表精确概率计算法),实验组HSP71抗体阳性率显著高于对照组(P<0.01),实验组ABR阈提高≥10 dB组与无ABR阈提高组之间阳性率差异也有显著性(P<0.05)。
讨论
HSP70是热休克蛋白家族主要成员之一,至少由5个相关的蛋白组成:HSP65、HSP71、HSP73、糖调节蛋白75、糖调节蛋白78。其中HSP71最为重要、诱导性最强,其生物学特点是在正常情况下呈低水平表达,而在热应激时细胞能选择性启动编码HSP71的基因,使细胞内HSP71的含量增加[6]。本实验结果显示在正常豚鼠耳蜗内HSP70呈低水平表达(图1,3);免疫转印证明在豚鼠膜迷路组织中存在HSP71抗原(图6),且与人类HSP71具有同源性。
, http://www.100md.com
图6 血浆HSP71抗体检测(westem blot).A~C动物血浆与人类重组HSP71抗原呈阳性反D动物血浆与人类重组HSP71抗原呈阳性反应
免疫后HSP70在豚鼠耳蜗螺旋神经节细胞、Corti器的内外毛细胞(图3,4)的免疫组化染色较对照组明显增强。实验组与对照组的平均吸光度值差异有显著性,且实验组ABR阈提高≥10 dB组与无ABR阈提高组之间平均吸光度值也有显著性差异(图5)。由于吸光度值代表HSP70免疫活性的相对水平,推测在同种内耳组织抗原免疫豚鼠后,机体产生了热休克反应,耳蜗组织细胞也产生了同样反应,此时细胞对作为“分子伴侣”的HSP70需求增加,导致HSP70在细胞中的合成增多。
实验组20只动物中12只动物血浆HSP71抗体阳性,抗体阳性率为12/20,而正常对照组无该抗体产生,两组之间抗体阳性率差异有显著性。表明用同种豚鼠膜迷路组织免疫豚鼠,可使大部分动物(12/20)产生HSP71抗体(可能还有其他抗体成分),说明HSP71具有很强的免疫原性,能引起豚鼠产生抗HSP71的免疫反应。本研究证实HSP71是豚鼠体内自身抗原(图5),其自身抗体产生的原因可能是HSP71作为一种隐蔽抗原因细胞损伤而释放,进入机体内(用于免疫豚鼠的膜迷路组织含有HSP71),刺激机体的免疫系统产生抗HSP71的免疫反应,产生相应的抗体。同时由于内耳并非免疫“豁免”器官,内淋巴囊在内耳受到抗原(HSP71)刺激后,具有产生全身和局部抗体(HSP71抗体)的反应能力[7]。在本实验中,有的动物体内HSP71抗体阳性而ABR阈无提高,这些动物可能处于免疫初期,或者是抗体滴度不高,尚未引起内耳明显损害。
, http://www.100md.com
实验组ABR阈提高≥10 dB动物耳蜗内HSP70呈高水平表达,且体内伴有高滴度的HSP71抗体,表明HSP70与自身免疫过程可能有一定的联系,但二者之间的确切关系尚不能肯定,即:是免疫造模导致HSP70反应性增加,还是由于HSP70的增加而诱发了AIED。免疫后HSP70表达水平的增高可能仅仅是耳蜗细胞应激的表现,是AIED发展过程的结果,但也有可能参与了自身免疫,因为在应激细胞中存在HSP70在细胞表面再分布现象,这增加了对HSP70及含HSP70细胞产生自身免疫反应的可能性[8]。细胞受到应激后其HSP合成增加,有助于组织细胞的自身保护,然而细胞内过多表达的自身HSP有可能使这些细胞变成抗HSP免疫反应的靶细胞,抗外来HSP免疫反应从保护作用可转变成致病作用[9]。推测当抗原免疫豚鼠使豚鼠产生抗HSP70自身抗体后,该抗体特异性作用于那些过度表达HSP70的耳蜗组织细胞,发生自身免疫反应,导致细胞的损伤。但由于膜迷路组织为混合性抗原,其免疫豚鼠后除产生HSP71抗体外可能还有其他抗体,本实验尚不能证明HSP70的致病作用。
, http://www.100md.com
近年来国外研究表明,HSP70抗体存在部分不明原因感音神经性聋及梅尼埃病患者血液中,且抗体阳性患者对激素治疗效果好。认为HSP70抗体的检测在AIED诊断及判断预后方面具有重要意义[1,2]。但文献报道中所使用的HSP70抗原主要来源于动物组织(如牛脑)经热休克处理后所得[1,2],除HSP71外还含用HSP70家族其他成分如HSP73,由于不同蛋白间可出现交叉反应,势必影响检测结果。本实验利用pET载体系统纯化了交叉反应更少的人类重组HSP71抗原,使检测方法更为敏感、结果更可靠。
基金项目:湖北省科委资助项目(982B33)
参考文献:
[1]Bloch DB, San Martin JE, Rauch SD ,et a1. Serum antibodies to heat shock protein 70 in sensorineural hearing loss. Arch Otolaryngol Head Neck Surg, 1995,121:1167-1171.
, 百拇医药
[2]Shin SO, Billings PB, Keithley EM, et al. Comparison of anti-heat shock protein 70 (anti-hsp70) and anti-68kDa inner ear protein in the sear of patients with Meniere's disease. Laryngoscope,1997,107:222-227.
[3]杨湘宁,钟启明,许桦,等.同种内耳抗原免疫豚鼠致感音神经性聋的实验研究.中华耳鼻咽喉科杂志, 1992,27:3-6.
[4]Sambrook J, Fritsch EF, Maniatis T. 分子克隆实验指南.金冬雁,黎孟枫,译. 第2版. 北京:北京科学出版社,1998. 880-897.
[5]Wu T, Yuan Y, Wu Y, et al. Presence of antibodies to heat stress proteins in workers exposed to benzene and in patients with benzene poisoning. Cell Stress Chaperones, 1998,3:161-167.
, 百拇医药
[6]Welch WJ. The mammalian heat shock(or stress) response:a celluar defense mechanism. Adv Exp Med Biol,1987,225:287-304.
[7]Harris JP. Experimental autoimmune sensorineural hearing loss. Laryngoscope, 1987,97:63-76.
[8]Rocchi G, Pavesi A, Ferrari C, et al. A new insight into the suggestion of a possible antigenic role of a member of the 70 kD heat shock proteins. Cell Biol Int,1993, 17: 83-92.
[9]Kaufmann SHE, Schoel B. Heat shock proteins as antigens in immunity against infection and self. In: Morimoto RI, Tissieres A, Georgopoulos C, eds. The biology of heat shock proteins and molecular chaperones. New York: Gold Spring Harbor Laboratory, 1994. 495-531.
收稿日期:1999-07-17, 百拇医药
单位:王鹏举(湖北省襄樊市中心医院耳鼻咽喉科 441021);吴展元(湖北医科大学附属第一医院耳鼻咽喉-头颈外科);肖伯奎(湖北医科大学附属第一医院耳鼻咽喉-头颈外科);邬堂春(同济医科大学高温生理研究室)
关键词:
中华耳鼻咽喉科杂志000103 摘 要:目的 了解抗原免疫对热休克蛋白70(heat shock protein 70,HSP70)在豚鼠耳蜗中表达的影响。方法 以同种异体内耳组织为抗原免疫豚鼠,用免疫组织化学方法检测豚鼠耳蜗中HSP70的表达并进行计算机图像处理;对豚鼠膜迷路组织进行免疫转印分析以测定HSP71;以纯化的人类重组HSP71为抗原,用免疫转印技术(Western blot)检测动物血浆中HSP71抗体。结果 HSP70在正常豚鼠耳蜗中呈低水平表达。抗原免疫后,实验组动物耳蜗HSP70免疫活性较对照组明显增强,两组间的吸光度值差异有显著性 (P<0.01);免疫后大多数动物(12/20)体内产生了抗HSP71抗体,实验组HSP71抗体阳性率显著高于对照组(P<0.01)。结论 同种膜迷路组织作为抗原免疫豚鼠能够诱导HSP70在耳蜗内合成增加;表明HSP70与自身免疫性内耳病有一定联系。
, 百拇医药
The role of heat shock protein 70 and its autoantibody in experimental autoimmune inner ear disease
WANG Pengju
(Department of Otorhinolaryngology, Center Hospital of Xiangfan, Hubei 441021,China)
WU Zhanyuan XIAO Baikui
Abstract:Objective To examine the effect of antigen stimulation on induction of the heat shock protein 70(HSP70) in the guinea pig cochlea and to explore the role of HSP70 and its autoantibody in the pathogenesis and diagnosis of autoimmunize inner ear disease (AIED).Methods To establish the animal model of AIED, homologous crude inner ear antigen was used to immunize the guinea pig. The expression of HSP70 was detected by immunocytochemistry and the relative staining densities were quantified with a light microscope image analysis system. The autoantibodies against HSP71 in the plasma of animals were tested by Western blot using purified recombinant human HSP71 as antigen. Results HSP70 presented in the normal guinea pig cochlea at a lower level. After immunological challenge, the levels of HSP70 immunoreactivity in the immunized animals were significantly increased as compared with control animals. Optical densities of cochleae of immunized animals were significantly greater than those of animals in the control group (P<0.01). Most of the immunized animals had developed autoantibodies against HSP71.The incidence of autoantibody in the experimental group was significantly different (P<0.01) from the control group. Conclusion Antigen stimulation could lead to an increase in the synthesis of HSP70 in the guinea pig cochlea. The detection of autoantibody against HSP71 might have significance in the diagnosis of AIED.
, 百拇医药
Key words:Heat shock proteins 70;Autoimmune diseases;Autoantibodies;Labyrinth▲
近年来热休克蛋白70(heat shock protein 70,HSP70)与自身免疫性内耳病(autoimmune inner ear disease,AIED)之间关系已成为研究的热点之一[1,2]。本研究以同种异体内耳组织为抗原免疫豚鼠,用免疫组化技术检测HSP70在豚鼠耳蜗中的表达,了解耳蜗组织细胞在抗原刺激下是否存在热休克反应,并以人类重组HSP71为抗原,用免疫转印技术(Western blot) 检测动物血浆中HSP71抗体的存在。
材料与方法
一、实验动物
选用耳廓反射正常、体重在250~400 g的健康花斑豚鼠,雌雄兼用(卫生部武汉生物制品研究所提供),共30只,随机分为实验组20只和对照组10只。分笼后适应性喂养1周。
, 百拇医药
二、抗原的制备
豚鼠60只,断头,取出听泡,分离全膜迷路。匀浆、破碎,反复冻融4次(-70 ℃~37 ℃),以2 500 r/min 离心10 min,取上清液在UV-265 型紫外分光光度计下测蛋白含量,将蛋白质的含量调到800 μg/ml。
三、免疫方法
按杨湘宁等[3]方法进行,共免疫4次。实验组前两次免疫剂量各为800 μg/ml的抗原0.5 ml+0.5 ml完全弗氏佐剂,后两次免疫剂量各为400 μg/ml的抗原0.5 ml +0.5 ml不完全弗氏佐剂。对照组在相应时间及相应部位于前后两次分别注射等量的完全弗氏佐剂或不完全弗氏佐剂。动物在第4次免疫后2周处死, 处死前心脏穿刺采血,肝素抗凝,取血浆做免疫学指标检测。
四、检测指标
, 百拇医药
1. 听性脑干反应(auditory brainstem response,ABR)测试:动物于免疫前及处死前麻醉后在静电屏蔽室内行双侧ABR 测试。短声刺激,重复率为20次/s,扫描周期10 ms,滤波带宽100~3 000 Hz,信号叠加1 000次,以ABR波Ⅲ反应阈为标准判断听阈。
2. 豚鼠耳蜗HSP70表达:动物麻醉后开胸,灌注、固定后取出听泡,开放前庭窗和圆窗。固定、脱钙、包埋,中轴切片,覆片。滴加3%过氧化氢,滴加正常血清封闭液,加入一抗:1∶1 000鼠抗人HSP70,加生物素化羊抗小鼠IgG(即用型),滴加链酶亲和素-生物素-过氧化物酶复合物,二氨基联苯胺显色,蒸馏水冲洗终止反应,封片。为使HSP70相对含量定量化,在对照组、实验组双耳ABR阈提高≥10 dB组及ABR阈无提高组中各选4个耳蜗,在每个耳蜗的切片中随机抽取2张近中轴的切片做图像分析。用同济医科大学研制的HPIAS-1000型高清晰度彩色病理图像免疫组化测量系统于400倍视野下测量Corti器和螺旋神经节细胞的吸光度。为减少误差,固定对每张切片第2、3回的以上部位的细胞进行吸光度测定。在每组中随机选择400个受检细胞做统计学处理,计算各组的平均吸光度值。用t检验(双样本等方差假设)分析各组平均吸光度值的差异。
, http://www.100md.com
3. 豚鼠膜迷路HSP71抗原的检测(Western blot):取膜迷路抗原0.75 ml,加样品处理液,100℃水浴3~5 min。用微量加样器吸取样品蛋白,总量为100 μL。经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳将蛋白质转移至硝酸纤维素膜上,取下硝酸纤维素膜,切成6 mm宽的细条,置于孵育槽中。免疫识别具体步骤参考Sambrook等[4]方法。一抗为1∶1 000兔抗人HSP71多克隆抗体(相对分子质量为71.2×103,同济医科大学高温生理室制备),二抗为1∶1 000的辣根过氧化物酶标记的羊抗兔IgG(Sigma,美国),二氨基联苯胺显色,出现棕色条带为阳性。
4. 血浆HSP71抗体的测定:将人类HSP71的cDNA和pET载体连接,转染大肠杆菌,用β-异丙基硫吡喃半乳糖特异性诱导表达而得到纯化的人类重组HSP71(相对分子质量为71.2×103)。通过十二烷基磺酸钠-聚丙烯酰胺电泳转移至硝酸纤维素膜上,制成含HSP71抗原的硝酸纤维素膜小条(5 mm×2 mm),用含5%脱脂奶粉的磷酸盐缓冲液封闭1 h。加入25 μL待测血浆(按1∶10、1∶20、1∶40用封闭液稀释)。具体步骤参考Wu等[5]方法。二抗为1∶1 000的辣根过氧化物酶标记的羊抗豚鼠IgG(Sigma,美国),二氨基联苯胺显色,其阳性结果为硝酸纤维膜小条上明显的棕褐色带。
, http://www.100md.com
结果
1.ABR阈:末次免疫后2周实验组20只动物中ABR阈提高≥10 dB者共11只(15耳),其中4 只动物为双耳,7 只动物为单耳(4只左耳,3只右耳),其中反应阈升高10 dB有 5 耳,15 dB者 8耳,20 dB者1 耳,25 dB 者1耳,免疫前后平均反应阈(
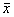 ±s)为(12.12±3.74)dB和18.16±6.37) dB,差异有显著性(t=5.1962,P<0.01)。对照组的平均反应阈在注射佐剂前后为(12.0±2.94)dB和(12.4±3.0) dB,差异无显著性(t=0.526 3,P>0.05)。
±s)为(12.12±3.74)dB和18.16±6.37) dB,差异有显著性(t=5.1962,P<0.01)。对照组的平均反应阈在注射佐剂前后为(12.0±2.94)dB和(12.4±3.0) dB,差异无显著性(t=0.526 3,P>0.05)。2.HSP70在豚鼠耳蜗内表达:对照组豚鼠耳蜗内可见HSP70呈低水平表达,主要见于螺旋神经节细胞(图1)、Corti器(图2);实验组螺旋神经节细胞、Corti器的内外毛细胞的HSP70免疫组化染色加深(图3,4)。各组的平均吸光度值为:对照组0.178 5±0.068 4(
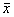 ±s,下同);实验组无ABR阈提高组0.215 2±0.116 7;双耳ABR阈提高≥10 dB组为0.315 6±0.128,统计分析表明,实验组和对照组平均吸光度值的差异有显著性(t=18.901 0,P<0.01),实验组中双耳ABR阈提高≥10 dB动物和无ABR阈提高动物平均吸光度值差异也有显著性(t=11.683 3,P<0.01)。
±s,下同);实验组无ABR阈提高组0.215 2±0.116 7;双耳ABR阈提高≥10 dB组为0.315 6±0.128,统计分析表明,实验组和对照组平均吸光度值的差异有显著性(t=18.901 0,P<0.01),实验组中双耳ABR阈提高≥10 dB动物和无ABR阈提高动物平均吸光度值差异也有显著性(t=11.683 3,P<0.01)。
, 百拇医药
图1 对照组耳蜗螺旋神经节细胞的HSP70的弱表达.SABC×200

图2 对照组耳蜗Corti器HSP70的弱表达.SABC×400

图3 实验组耳蜗螺旋神经节细胞的HSP70的强表达.SABC×200

图4 实验组耳蜗Corti器内外毛细胞HSP70的表达.SABC×400
3.膜迷路HSP71抗原测定:膜迷路组织经免疫转印后可被兔抗人HSP71多克隆抗体识别,在硝酸纤维素膜膜上表现为一条高密度的棕色带(图5)。
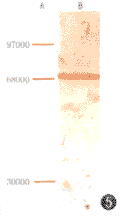
, 百拇医药
图5 豚鼠膜迷路HSP71抗原.A标准的相对分子质量,B豚鼠膜迷路组织免疫转印
4.血浆HSP71抗体测定:将实验动物分为3组:实验组ABR阈提高≥10 dB组、无ABR阈提高组及对照组HSP71抗体阴性、阳性判断见图6。实验组20只动物中有12只出现HSP71抗体阳性,阳性率为60%。ABR阈提高≥10 dB组11只动物中有9只出现1∶10阳性,阳性率为9/11,其中2只动物出现1∶40阳性;实验组无ABR阈提高的9只动物中有3只出现1∶10阳性,阳性率为3/9;对照组10动物均无HSP71抗体产生。经检验(四格表精确概率计算法),实验组HSP71抗体阳性率显著高于对照组(P<0.01),实验组ABR阈提高≥10 dB组与无ABR阈提高组之间阳性率差异也有显著性(P<0.05)。
讨论
HSP70是热休克蛋白家族主要成员之一,至少由5个相关的蛋白组成:HSP65、HSP71、HSP73、糖调节蛋白75、糖调节蛋白78。其中HSP71最为重要、诱导性最强,其生物学特点是在正常情况下呈低水平表达,而在热应激时细胞能选择性启动编码HSP71的基因,使细胞内HSP71的含量增加[6]。本实验结果显示在正常豚鼠耳蜗内HSP70呈低水平表达(图1,3);免疫转印证明在豚鼠膜迷路组织中存在HSP71抗原(图6),且与人类HSP71具有同源性。

, http://www.100md.com
图6 血浆HSP71抗体检测(westem blot).A~C动物血浆与人类重组HSP71抗原呈阳性反D动物血浆与人类重组HSP71抗原呈阳性反应
免疫后HSP70在豚鼠耳蜗螺旋神经节细胞、Corti器的内外毛细胞(图3,4)的免疫组化染色较对照组明显增强。实验组与对照组的平均吸光度值差异有显著性,且实验组ABR阈提高≥10 dB组与无ABR阈提高组之间平均吸光度值也有显著性差异(图5)。由于吸光度值代表HSP70免疫活性的相对水平,推测在同种内耳组织抗原免疫豚鼠后,机体产生了热休克反应,耳蜗组织细胞也产生了同样反应,此时细胞对作为“分子伴侣”的HSP70需求增加,导致HSP70在细胞中的合成增多。
实验组20只动物中12只动物血浆HSP71抗体阳性,抗体阳性率为12/20,而正常对照组无该抗体产生,两组之间抗体阳性率差异有显著性。表明用同种豚鼠膜迷路组织免疫豚鼠,可使大部分动物(12/20)产生HSP71抗体(可能还有其他抗体成分),说明HSP71具有很强的免疫原性,能引起豚鼠产生抗HSP71的免疫反应。本研究证实HSP71是豚鼠体内自身抗原(图5),其自身抗体产生的原因可能是HSP71作为一种隐蔽抗原因细胞损伤而释放,进入机体内(用于免疫豚鼠的膜迷路组织含有HSP71),刺激机体的免疫系统产生抗HSP71的免疫反应,产生相应的抗体。同时由于内耳并非免疫“豁免”器官,内淋巴囊在内耳受到抗原(HSP71)刺激后,具有产生全身和局部抗体(HSP71抗体)的反应能力[7]。在本实验中,有的动物体内HSP71抗体阳性而ABR阈无提高,这些动物可能处于免疫初期,或者是抗体滴度不高,尚未引起内耳明显损害。
, http://www.100md.com
实验组ABR阈提高≥10 dB动物耳蜗内HSP70呈高水平表达,且体内伴有高滴度的HSP71抗体,表明HSP70与自身免疫过程可能有一定的联系,但二者之间的确切关系尚不能肯定,即:是免疫造模导致HSP70反应性增加,还是由于HSP70的增加而诱发了AIED。免疫后HSP70表达水平的增高可能仅仅是耳蜗细胞应激的表现,是AIED发展过程的结果,但也有可能参与了自身免疫,因为在应激细胞中存在HSP70在细胞表面再分布现象,这增加了对HSP70及含HSP70细胞产生自身免疫反应的可能性[8]。细胞受到应激后其HSP合成增加,有助于组织细胞的自身保护,然而细胞内过多表达的自身HSP有可能使这些细胞变成抗HSP免疫反应的靶细胞,抗外来HSP免疫反应从保护作用可转变成致病作用[9]。推测当抗原免疫豚鼠使豚鼠产生抗HSP70自身抗体后,该抗体特异性作用于那些过度表达HSP70的耳蜗组织细胞,发生自身免疫反应,导致细胞的损伤。但由于膜迷路组织为混合性抗原,其免疫豚鼠后除产生HSP71抗体外可能还有其他抗体,本实验尚不能证明HSP70的致病作用。
, http://www.100md.com
近年来国外研究表明,HSP70抗体存在部分不明原因感音神经性聋及梅尼埃病患者血液中,且抗体阳性患者对激素治疗效果好。认为HSP70抗体的检测在AIED诊断及判断预后方面具有重要意义[1,2]。但文献报道中所使用的HSP70抗原主要来源于动物组织(如牛脑)经热休克处理后所得[1,2],除HSP71外还含用HSP70家族其他成分如HSP73,由于不同蛋白间可出现交叉反应,势必影响检测结果。本实验利用pET载体系统纯化了交叉反应更少的人类重组HSP71抗原,使检测方法更为敏感、结果更可靠。
基金项目:湖北省科委资助项目(982B33)
参考文献:
[1]Bloch DB, San Martin JE, Rauch SD ,et a1. Serum antibodies to heat shock protein 70 in sensorineural hearing loss. Arch Otolaryngol Head Neck Surg, 1995,121:1167-1171.
, 百拇医药
[2]Shin SO, Billings PB, Keithley EM, et al. Comparison of anti-heat shock protein 70 (anti-hsp70) and anti-68kDa inner ear protein in the sear of patients with Meniere's disease. Laryngoscope,1997,107:222-227.
[3]杨湘宁,钟启明,许桦,等.同种内耳抗原免疫豚鼠致感音神经性聋的实验研究.中华耳鼻咽喉科杂志, 1992,27:3-6.
[4]Sambrook J, Fritsch EF, Maniatis T. 分子克隆实验指南.金冬雁,黎孟枫,译. 第2版. 北京:北京科学出版社,1998. 880-897.
[5]Wu T, Yuan Y, Wu Y, et al. Presence of antibodies to heat stress proteins in workers exposed to benzene and in patients with benzene poisoning. Cell Stress Chaperones, 1998,3:161-167.
, 百拇医药
[6]Welch WJ. The mammalian heat shock(or stress) response:a celluar defense mechanism. Adv Exp Med Biol,1987,225:287-304.
[7]Harris JP. Experimental autoimmune sensorineural hearing loss. Laryngoscope, 1987,97:63-76.
[8]Rocchi G, Pavesi A, Ferrari C, et al. A new insight into the suggestion of a possible antigenic role of a member of the 70 kD heat shock proteins. Cell Biol Int,1993, 17: 83-92.
[9]Kaufmann SHE, Schoel B. Heat shock proteins as antigens in immunity against infection and self. In: Morimoto RI, Tissieres A, Georgopoulos C, eds. The biology of heat shock proteins and molecular chaperones. New York: Gold Spring Harbor Laboratory, 1994. 495-531.
收稿日期:1999-07-17, 百拇医药