神经生长因子减轻噪声性阈移的透射电镜观察
作者:阮芳铭 王海明 高文元 季红光 肖建平 王福俤 刘长云 潘祥福 张麟
单位:200433 上海 第二军医大学海军医学系军队卫生学教研室
关键词:神经生长因子;听觉丧失;噪声性;耳蜗;毛细胞;外
中华耳鼻咽喉科杂志000408 【摘要】 目的 探讨神经生长因子(nerve growth factor,NGF)对豚鼠噪声性听力损伤的防治作用。方法 豚鼠每天暴露115 dB(A)白噪声连续6 d (45 min/d),在暴露全部结束后不同时间(1 h、1 d、2 d、3 d和6 d)分别测试皮层反应阈,并用透射电镜观察耳蜗螺旋器细胞内变化。结果 A(每日肌内注射NGF 1 000 U/kg体重)、B(每日肌内注射NGF 2 000 U /kg体重)和C(每日肌内注射NGF 3 000 U/kg体重)3个实验组动物听反应阈偏移幅度均小于生理盐水对照组(每日肌内注射1 ml/kg体重),差异有非常显著性意义(方差分析,P值均<0.01);实验B、C两组动物在噪声暴露后3 d听反应阈已基本恢复,而对照组动物在噪声暴露后6 d仍有(16.43±6.91)dB(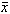 ±s)的阈移。透射电镜观察显示,对照组耳蜗病变在3排外毛细胞,以底回末段损伤最重,主要有纤毛内微丝解聚、线粒体肿大和毛细胞轻度水肿;外毛细胞表面下池和传出神经末梢也有轻度肿胀的表现。实验A组耳蜗病变程度比对照组轻,多局限在第3排外毛细胞。而实验B、C两组动物内耳损伤甚微。结论 在慢性声损伤中,外源性NGF能够减轻噪声对耳蜗毛细胞的损害,对噪声性听力损伤具有较明显的保护作用。
±s)的阈移。透射电镜观察显示,对照组耳蜗病变在3排外毛细胞,以底回末段损伤最重,主要有纤毛内微丝解聚、线粒体肿大和毛细胞轻度水肿;外毛细胞表面下池和传出神经末梢也有轻度肿胀的表现。实验A组耳蜗病变程度比对照组轻,多局限在第3排外毛细胞。而实验B、C两组动物内耳损伤甚微。结论 在慢性声损伤中,外源性NGF能够减轻噪声对耳蜗毛细胞的损害,对噪声性听力损伤具有较明显的保护作用。
, 百拇医药
Amelioration of nerve growth factor against noise-induced threshold shift: a transmission electron microscope observation
RUAN Fangming,WANG Haiming,GAO Wenyuan
(Department of Navy Hygiene, Faculty of Navy Medicine, Second Military Medical University, Shanghai 200433,China)
【Abstract】 Objective To study the protective effects of nerve growth factor(NGF) on noise-induced hearing damage in guinea pigs. Methods NGF injected Guinea pigs were consecutively exposed to white noise of 115 dB(A) for 6 days continually (45 min.d-1). Auditory thresholds were measured using auditory cortex evoked response to tone bursts in different post-exposure intervals (1 h, 1 d, 2 d, 3 d and 6 d). The ultrastructural changes within hair cells were also observed by a transmission electron microscope(TEM). Results The auditory threshold shifts in test group A(NGF:1 000 U.kg-1.d-1, im.), B(NGF:2 000 U.kg-1.d-1,im.) and C( NGF:3 000U.kg-1.d-1,im.) were significantly fewer than that in the control group(Saline:1 ml.kg-1.d-1,im). Threshold shifts almost recovered in test group B and C 3 days after the exposure; while a threshold shift of (16.43±6.91) dB was present 6 days after the exposure in the control group. TEM showed that all three rows of the outer hair cells(OHCs) of the basal turn in the control group displayed significant pathological changes. Depolymerization of actin filiaments within stereocilia, swelling of submembraneous cistern and the efferent nerve-ending and slight edema of hair cells were evident. In test group A, the hair cells display slight pathological changes, which are confined in the third row of OHCs in a local position of the basal turn. In group B and C hair cells have nearly normal appearance. Conclusion NGF is able to reduce threshold shift, and promote the recovery of auditory threshold in acoustic trauma. This factor can, to some extent, protect against noise-induced hearing damage.
, 百拇医药
【Key words】 Nerve growth factors; Hearing loss,noise-induced; Cochlea; Hair cells,outer
噪声可致人耳听力损害,连续噪声对听力的损害一般经历从可逆性病变发展到不可逆性病变的过程,在症状上表现为从可恢复的暂时性阈移(temporary threshold shift,TTS)转变为不可恢复的永久性阈移(permanent threshold shift,PTS),其实质是耳蜗内听觉感受器在噪声刺激下发生变性、坏死的结果。对于噪声性听力损伤的防治方法以往已在增加血流量、供给高能化合物及供氧、提高对噪声的耐受力等方面进行了研究[1,2]。但是,对于噪声引起的外周听觉感受器损伤迄今尚无理想的防治方法。最近有研究表明,神经营养因子(neurotrophic factors,NTF)对氨基糖甙类药物引起的听力损伤具有一定的保护作用[3,4]。我们的实验是在豚鼠每天噪声暴露前肌内注射不同剂量的神经生长因子(nerve growth factor,NGF),通过观察皮层听反应阈及耳蜗毛细胞内的变化,对NGF有无防止损伤及促进听力恢复的作用进行探讨。
, 百拇医药
材料与方法
1. 主要试剂和仪器:NGF(沉降系数2.5,相对分子质量14 000)为雄性小鼠颌下腺提取物,其生物活性为1.0×105 U/mg蛋白(第二军医大学神经生物学教研室提供);H-800透射电子显微镜(日本);便携式听觉诱发电位仪(Traveler公司,美国);B&K 1027型无规信号发生器(丹麦)。
2. 动物分组与处理:选择耳廓反射正常的健康杂色雄性豚鼠30只(第二军医大学实验动物中心提供),体重(274.64±19.9) g(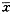 ±s);2只豚鼠作为电镜观察的正常对照标本,其余28只先按原始体重由小至大编号后,按体重平均随机分为4组,每组7只(14耳)。各组豚鼠在戊巴比妥钠(40 mg/kg体重)腹腔麻醉和无菌条件下于双侧皮层听区硬膜外手术埋植不锈钢丝慢性电极,牙科水泥固定,稳定1周后进行实验。
±s);2只豚鼠作为电镜观察的正常对照标本,其余28只先按原始体重由小至大编号后,按体重平均随机分为4组,每组7只(14耳)。各组豚鼠在戊巴比妥钠(40 mg/kg体重)腹腔麻醉和无菌条件下于双侧皮层听区硬膜外手术埋植不锈钢丝慢性电极,牙科水泥固定,稳定1周后进行实验。
, 百拇医药
3. 噪声暴露:4组动物每天用药后即行白噪声暴露。将动物置于小笼内(20 cm×20 cm×20 cm),每笼1只,放入暴露舱(26 m3)[5],由信号发生器产生20 Hz~20 kHz的白噪声,经GY型400 W扩音机放大,并由扬声器组向暴露舱播放。暴露时用B&K.2107型频率分析仪连续监测。暴露声压级为115 dB(A),动物暴露范围内声场不均匀度为±1 dB(A)。每日暴露1次,每次45 min,连续暴露6 d。
4. 听反应阈测试:动物清醒状态,半限制于测试笼中,置于隔声电屏蔽室内。用便携式听觉诱发电位仪测定皮层短声诱发电位;刺激声能量主要集中在2~4 kHz;由0.1 ms的方波输入扬声器产生,诱发生物电信号通过机内前级放大器放大10 000倍并进行信息处理。扫描时间100 ms,重复率1次/s,带通滤波10~300 Hz,叠加30次。短声以5 dB步级衰减,以刚能出现皮层电位的短声强度为皮层反应阈。扬声器正对豚鼠一侧耳,与耳相距3 cm。对侧慢性电极为记录电极,额部近中线处鼻骨旁慢性电极为参考电极,口腔上唇粘膜接地。各组动物在第一次噪声暴露前和噪声暴露全部结束后(1 h、1 d、2 d、3 d和6 d)分别测试听皮层反应阈。
, http://www.100md.com
5. 动物用药(每天在噪声暴露前15 min):对照组动物肌内注射生理盐水(1 ml/kg体重,每日1次);实验A组动物每日肌内注射NGF 1 000 U/kg体重,实验B组动物每日肌内注射NGF 2 000 U/kg体重;实验C组动物每日肌内注射NGF 3 000 U/kg体重。
6. 透射电镜标本制作及观察:4组动物全部左耳耳蜗及2只正常对照动物(不经给药及噪声暴露,听反应阈正常的动物左耳耳蜗)作为透射电镜观察对象(右耳耳蜗用于琥珀酸脱氢酶活性染色[5])。在每只动物完成最后一次噪声暴露及皮层反应阈测试后(实验开始后6 d)立即断头,提取颞骨,在解剖显微镜下打开听泡,取出全长骨螺旋板及基底膜,用2.5%戊二醛固定,10%乙二胺四乙酸二钠脱钙后,再经4%多聚甲醛固定4 h,在0.1 mol/L磷酸缓冲液中漂洗3次,每次10 min,于1%锇酸固定2 h,再经磷酸缓冲液漂洗、丙酮系列脱水和Epon812环氧树脂浸透、包埋及60℃聚合。先用半薄切片,相差显微镜观察定位,再行超薄切片,铅、铀染色后,用透射电镜观察耳蜗螺旋器细胞内的超微结构变化。
, http://www.100md.com
7. 统计学处理:实验数据以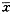 ±s表示,采用完全随机设计资料的方差分析进行显著性检验。
±s表示,采用完全随机设计资料的方差分析进行显著性检验。
结果
1. 听反应阈改变:受试动物经115 dB(A)稳态噪声连续暴露6 d后,对照组和3个实验组均有听力损失(B组动物实验期间死亡1只),表现为听反应阈上移,其中以对照组最为明显,实验A组次之。噪声暴露停止为1 h(实验开始后第6 d),对照组动物平均阈移为(35.36±9.09)dB,其中最大阈移达50 dB。按完全随机设计多个样本均数比较的方差分析表明,噪声暴露全部结束后的1 h、1 d、2 d、3 d和6 d,3个实验组阈值与对照组相比,除噪声暴露结束后1 h,A组与对照组差异无显著性外,差异均有非常显著性(P<0.01),但B组与C组间阈值则差异无显著性(P>0.05);而A组与C组之间的阈值在暴露结束后1 h、1 d和2 d差异有显著性(P<0.05),在暴露结束后3 d和6 d,实验A组与实验B、C组之间则差异有非常显著性(P<0.01)。4组动物在噪声暴露前和噪声暴露全部结束后不同时间的听反应阈见参考文献[5]。在噪声暴露结束后3 d,B、C两组听反应阈已接近正常,6 d完全恢复至暴露前水平;但A组在噪声暴露结束后3 d和6 d分别还有(11.43±6.02)dB和(8.21±5.41)dB的阈移;而对照组在噪声暴露结束后6 d仍然有(16.43±6.91)dB的阈移。
, 百拇医药
2. 耳蜗螺旋器超微结构的改变:正常对照动物耳蜗螺旋器内、外毛细胞形态正常,界限清楚,细胞膜完整。静纤毛内微丝呈纵向排列。表皮板完整、表面光滑,皮板内纤毛细根正常。皮板下区的线粒体、溶酶体、内质网及高尔基体等细胞器的形态和数目均正常。表面下池沿细胞膜内侧呈平行排列。核呈圆形,核下区、突触接触部及传入、传出神经末梢形态正常。
噪声暴露对照组动物内毛细胞形态正常,耳蜗病变主要表现在3排外毛细胞(outer hair cells,OHC),以底回末段损伤最重。听反应阈偏移最大的动物OHC显示轻微水肿,第3排OHC尤为严重。可见到静纤毛内微丝解聚呈不连续状态;伸入到表皮板内的纤毛细根长度缩短,甚至消失;线粒体轻度肿大、嵴模糊,还有少数溶酶体膜破裂(图1);细胞核形态基本正常;核下区线粒体嵴模糊,传出神经末梢有轻度肿胀的表现(图2),听反应阈偏移最小的动物位于细胞膜内侧的表面下池水肿。
实验A组动物病变程度轻于对照组,在听反应阈偏移最大的动物第3排OHC中,主要表现出位于细胞膜内侧的表面下池肿胀(图3),即使听反应阈偏移最小的动物,其第3排OHC中,仍然发现皮板下区溶酶体数量增多,并有少数溶酶体膜破裂。对照组动物OHC的细胞核、核下区及其传入、传出神经末梢形态基本正常。
, 百拇医药
实验B、C组动物听毛细胞形态结构基本正常,轻微病变多局限在第3排OHC表皮板的上下区。B组动物OHC静纤毛内微丝呈纵向排列,但可见到第3排OHC皮板下区仍有个别溶酶体膜不完整或破裂;而实验C组动物则表现为第3排OHC静纤毛内的微丝呈分散状,并有模糊阴影(图4)。实验B、C两组动物内、外毛细胞的其它区域与正常对照动物耳蜗差异不大。
讨论
本组实验动物经稳态白噪声连续暴露6 d后,动物普遍有听反应阈上移,在噪声暴露全部停止后6 d,对照组动物平均阈移仍然有(16.43±6.91) dB,可以认为该组动物已有PTS。但3个应用NGF的实验组动物,其听反应阈上移的幅度明显低于对照组(P<0.01),在噪声暴露停止后3 d,实验B、C两组动物听反应阈已基本恢复至暴露前的水平,它们所形成的阈移属于TTS。但用药量最小的实验A组动物的阈移恢复程度不及用药量较大的B、C组,直到6 d仍留有(8.21±5.41) dB的阈移。噪声所致的耳蜗感受器病变,可直接导致听力产生TTS和PTS。本实验各组动物阈移变化与耳蜗超微结构变化的结果基本一致。实验提示:肌内注射一定剂量的NGF,可以减轻噪声对耳蜗毛细胞的损害,对噪声导致的听力损伤具有较明显的保护作用。
, 百拇医药
目前认为,NGF家族成员对感觉、交感及某些中枢胆碱能神经元具有营养支持作用,对损伤神经元具有保护和修复作用[6]。本实验结果显示,3个实验组动物听毛细胞的病变程度明显轻于对照组,但是,究竟是直接对耳蜗起作用或是间接起作用,还难以肯定。由于NGF在血浆中的半衰期较短,不利于其疗效的发挥,但有文献报道,NGF在注射后1 h,血浆中仍能检测出它的活性[7]。就本实验而言,使用肌内给药途径,NGF要到达内耳淋巴液发挥作用,血-迷路屏障可能是其必经之路。因为血-迷路屏障是保证内耳特殊功能所必需的重要系统,NGF作为多肽类生长因子,正常情况下不易透过血-迷路屏障。由于本实验动物在每天用药后即暴露于115 dB(A)的强噪声中,连续噪声对内耳不断产生进行性损害,这种损害与使用氨基甙类药物所造成的内耳损害可能有相同之处,因此,可能对血-迷路屏障也造成不同程度的损伤,这将有利于NGF进入内耳淋巴液[4]。另据文献报道,NGF对神经嵴起源的耳蜗-橄榄束具有诱向和营养作用,对传出神经纤维早期发育也具有影响[8,9],而内耳发育过程中睫状神经营养因子在毛细胞及前庭都有表达[10]。但是,目前仍不清楚在耳蜗毛细胞及听神经中是否存在NGF及其受体。关于NGF对抗噪声性听力损伤的确切机理尚不清楚,本文仅作一些初步的探讨,并为NGF的开发及进一步应用NTF防治噪声性聋提供一点实验依据。
, http://www.100md.com
编后 NGF在豚鼠内耳细胞上有无特异性受体,噪声损伤后NGF能否通过被损害的血-迷路屏障均无实验证实。因此,NGF对抗噪声性听力损伤的机理仍需进一步探讨。
图1 对照组第3排OHC静纤毛内微丝(MF)解聚(↑),表皮板(CP)内的纤毛细根(RT)长度缩 短(↑),皮板下区线粒体(M)体积轻度肿大(↑),少数溶酶体(L)膜破裂(↑) ×15 000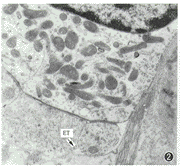
图2 对照组第3排OHC基底部传出神经末梢(ET)肿胀(↑) ×15 000
图3 实验A组第3排OHC膜内侧的表面下池(SMP)肿胀(↑) ×12 000
, http://www.100md.com
图4 实验C组第3排OHC静纤毛内的微丝(MF)模糊并呈分散状(↑) ×30 000
志谢 本研究得到第二军医大学神经生物学教研室主任路长林教授热忱指导,以及本校电镜室叶煦亭老师的热心帮助;得到海军医学研究所梁振福、史秀凤副研究员和杨玉明硕士的具体帮助与指导
通信作者:阮芳铭(Email: fdwang @ shtel.net.cn)
参考文献
1,Hatch M, Tsai M, LaRouere MJ, et al. The effects of Carbogen, carbon dioxide, and oxygen on noise-induced hearing loss. Hear Res,1991,56:265-272.
2,阮芳铭,高文元. 预先暴露低强度噪声对噪声损伤听力保护作用的观察. 声学技术, 1990,9:10-12.
, 百拇医药
3,Shah SB, Gladstone HB, Williams H, et al. An extended study: protective effects of nerve growth factor in neomycin-induced auditory neural degeneration. Am J Otol, 1995,16:310-314.
4,张志坚,施宁华,戴树宏. 神经生长因子对豚鼠庆大霉素耳毒性的保护作用. 镇江医学院学报, 1995, 5:265-266.
5,阮芳铭,高文元,王海明,等. 神经生长因子对豚鼠噪声性听力损伤的保护作用. 第二军医大学学报,2000, 21:45-49.
6,Van De Water TR, Staecker H, Ernfors P, et al. Neurotrophic factors as pharmacological agents for the treatment of injured auditory neurons. Ciba Found Symp, 1996,196:149-162.
, 百拇医药
7,Poduslo JF, Curran GL. Premeability at the blood-brain and blood-nerve barriers of the neurotrophic factor:NGF,CNTF,NT-3,BDNF.Brain Res Mol Brain Res,1996,36:280-286.
8,Crutcher KA. The role of growth factors in neuronal development and plasticity. Crit Rev Clin Neurobiol, 1986,2297-2333.
9,Despres G, Hafidi A, Romand R. Immunohistochemical localization of nerve growth factor receptor in the cochlea and in the brainstem of the perinatal rat. Hear Res,1991, 52:157-165.
10,周义德,翟所强,杨伟炎,等. 睫状神经营养因子防治强脉冲噪声对豚鼠内耳损伤的实验研究. 中华耳鼻咽喉科杂志,1999,34:150-153.
(收稿日期:2000-01-04), 百拇医药
单位:200433 上海 第二军医大学海军医学系军队卫生学教研室
关键词:神经生长因子;听觉丧失;噪声性;耳蜗;毛细胞;外
中华耳鼻咽喉科杂志000408 【摘要】 目的 探讨神经生长因子(nerve growth factor,NGF)对豚鼠噪声性听力损伤的防治作用。方法 豚鼠每天暴露115 dB(A)白噪声连续6 d (45 min/d),在暴露全部结束后不同时间(1 h、1 d、2 d、3 d和6 d)分别测试皮层反应阈,并用透射电镜观察耳蜗螺旋器细胞内变化。结果 A(每日肌内注射NGF 1 000 U/kg体重)、B(每日肌内注射NGF 2 000 U /kg体重)和C(每日肌内注射NGF 3 000 U/kg体重)3个实验组动物听反应阈偏移幅度均小于生理盐水对照组(每日肌内注射1 ml/kg体重),差异有非常显著性意义(方差分析,P值均<0.01);实验B、C两组动物在噪声暴露后3 d听反应阈已基本恢复,而对照组动物在噪声暴露后6 d仍有(16.43±6.91)dB(
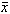 ±s)的阈移。透射电镜观察显示,对照组耳蜗病变在3排外毛细胞,以底回末段损伤最重,主要有纤毛内微丝解聚、线粒体肿大和毛细胞轻度水肿;外毛细胞表面下池和传出神经末梢也有轻度肿胀的表现。实验A组耳蜗病变程度比对照组轻,多局限在第3排外毛细胞。而实验B、C两组动物内耳损伤甚微。结论 在慢性声损伤中,外源性NGF能够减轻噪声对耳蜗毛细胞的损害,对噪声性听力损伤具有较明显的保护作用。
±s)的阈移。透射电镜观察显示,对照组耳蜗病变在3排外毛细胞,以底回末段损伤最重,主要有纤毛内微丝解聚、线粒体肿大和毛细胞轻度水肿;外毛细胞表面下池和传出神经末梢也有轻度肿胀的表现。实验A组耳蜗病变程度比对照组轻,多局限在第3排外毛细胞。而实验B、C两组动物内耳损伤甚微。结论 在慢性声损伤中,外源性NGF能够减轻噪声对耳蜗毛细胞的损害,对噪声性听力损伤具有较明显的保护作用。, 百拇医药
Amelioration of nerve growth factor against noise-induced threshold shift: a transmission electron microscope observation
RUAN Fangming,WANG Haiming,GAO Wenyuan
(Department of Navy Hygiene, Faculty of Navy Medicine, Second Military Medical University, Shanghai 200433,China)
【Abstract】 Objective To study the protective effects of nerve growth factor(NGF) on noise-induced hearing damage in guinea pigs. Methods NGF injected Guinea pigs were consecutively exposed to white noise of 115 dB(A) for 6 days continually (45 min.d-1). Auditory thresholds were measured using auditory cortex evoked response to tone bursts in different post-exposure intervals (1 h, 1 d, 2 d, 3 d and 6 d). The ultrastructural changes within hair cells were also observed by a transmission electron microscope(TEM). Results The auditory threshold shifts in test group A(NGF:1 000 U.kg-1.d-1, im.), B(NGF:2 000 U.kg-1.d-1,im.) and C( NGF:3 000U.kg-1.d-1,im.) were significantly fewer than that in the control group(Saline:1 ml.kg-1.d-1,im). Threshold shifts almost recovered in test group B and C 3 days after the exposure; while a threshold shift of (16.43±6.91) dB was present 6 days after the exposure in the control group. TEM showed that all three rows of the outer hair cells(OHCs) of the basal turn in the control group displayed significant pathological changes. Depolymerization of actin filiaments within stereocilia, swelling of submembraneous cistern and the efferent nerve-ending and slight edema of hair cells were evident. In test group A, the hair cells display slight pathological changes, which are confined in the third row of OHCs in a local position of the basal turn. In group B and C hair cells have nearly normal appearance. Conclusion NGF is able to reduce threshold shift, and promote the recovery of auditory threshold in acoustic trauma. This factor can, to some extent, protect against noise-induced hearing damage.
, 百拇医药
【Key words】 Nerve growth factors; Hearing loss,noise-induced; Cochlea; Hair cells,outer
噪声可致人耳听力损害,连续噪声对听力的损害一般经历从可逆性病变发展到不可逆性病变的过程,在症状上表现为从可恢复的暂时性阈移(temporary threshold shift,TTS)转变为不可恢复的永久性阈移(permanent threshold shift,PTS),其实质是耳蜗内听觉感受器在噪声刺激下发生变性、坏死的结果。对于噪声性听力损伤的防治方法以往已在增加血流量、供给高能化合物及供氧、提高对噪声的耐受力等方面进行了研究[1,2]。但是,对于噪声引起的外周听觉感受器损伤迄今尚无理想的防治方法。最近有研究表明,神经营养因子(neurotrophic factors,NTF)对氨基糖甙类药物引起的听力损伤具有一定的保护作用[3,4]。我们的实验是在豚鼠每天噪声暴露前肌内注射不同剂量的神经生长因子(nerve growth factor,NGF),通过观察皮层听反应阈及耳蜗毛细胞内的变化,对NGF有无防止损伤及促进听力恢复的作用进行探讨。
, 百拇医药
材料与方法
1. 主要试剂和仪器:NGF(沉降系数2.5,相对分子质量14 000)为雄性小鼠颌下腺提取物,其生物活性为1.0×105 U/mg蛋白(第二军医大学神经生物学教研室提供);H-800透射电子显微镜(日本);便携式听觉诱发电位仪(Traveler公司,美国);B&K 1027型无规信号发生器(丹麦)。
2. 动物分组与处理:选择耳廓反射正常的健康杂色雄性豚鼠30只(第二军医大学实验动物中心提供),体重(274.64±19.9) g(
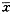 ±s);2只豚鼠作为电镜观察的正常对照标本,其余28只先按原始体重由小至大编号后,按体重平均随机分为4组,每组7只(14耳)。各组豚鼠在戊巴比妥钠(40 mg/kg体重)腹腔麻醉和无菌条件下于双侧皮层听区硬膜外手术埋植不锈钢丝慢性电极,牙科水泥固定,稳定1周后进行实验。
±s);2只豚鼠作为电镜观察的正常对照标本,其余28只先按原始体重由小至大编号后,按体重平均随机分为4组,每组7只(14耳)。各组豚鼠在戊巴比妥钠(40 mg/kg体重)腹腔麻醉和无菌条件下于双侧皮层听区硬膜外手术埋植不锈钢丝慢性电极,牙科水泥固定,稳定1周后进行实验。, 百拇医药
3. 噪声暴露:4组动物每天用药后即行白噪声暴露。将动物置于小笼内(20 cm×20 cm×20 cm),每笼1只,放入暴露舱(26 m3)[5],由信号发生器产生20 Hz~20 kHz的白噪声,经GY型400 W扩音机放大,并由扬声器组向暴露舱播放。暴露时用B&K.2107型频率分析仪连续监测。暴露声压级为115 dB(A),动物暴露范围内声场不均匀度为±1 dB(A)。每日暴露1次,每次45 min,连续暴露6 d。
4. 听反应阈测试:动物清醒状态,半限制于测试笼中,置于隔声电屏蔽室内。用便携式听觉诱发电位仪测定皮层短声诱发电位;刺激声能量主要集中在2~4 kHz;由0.1 ms的方波输入扬声器产生,诱发生物电信号通过机内前级放大器放大10 000倍并进行信息处理。扫描时间100 ms,重复率1次/s,带通滤波10~300 Hz,叠加30次。短声以5 dB步级衰减,以刚能出现皮层电位的短声强度为皮层反应阈。扬声器正对豚鼠一侧耳,与耳相距3 cm。对侧慢性电极为记录电极,额部近中线处鼻骨旁慢性电极为参考电极,口腔上唇粘膜接地。各组动物在第一次噪声暴露前和噪声暴露全部结束后(1 h、1 d、2 d、3 d和6 d)分别测试听皮层反应阈。
, http://www.100md.com
5. 动物用药(每天在噪声暴露前15 min):对照组动物肌内注射生理盐水(1 ml/kg体重,每日1次);实验A组动物每日肌内注射NGF 1 000 U/kg体重,实验B组动物每日肌内注射NGF 2 000 U/kg体重;实验C组动物每日肌内注射NGF 3 000 U/kg体重。
6. 透射电镜标本制作及观察:4组动物全部左耳耳蜗及2只正常对照动物(不经给药及噪声暴露,听反应阈正常的动物左耳耳蜗)作为透射电镜观察对象(右耳耳蜗用于琥珀酸脱氢酶活性染色[5])。在每只动物完成最后一次噪声暴露及皮层反应阈测试后(实验开始后6 d)立即断头,提取颞骨,在解剖显微镜下打开听泡,取出全长骨螺旋板及基底膜,用2.5%戊二醛固定,10%乙二胺四乙酸二钠脱钙后,再经4%多聚甲醛固定4 h,在0.1 mol/L磷酸缓冲液中漂洗3次,每次10 min,于1%锇酸固定2 h,再经磷酸缓冲液漂洗、丙酮系列脱水和Epon812环氧树脂浸透、包埋及60℃聚合。先用半薄切片,相差显微镜观察定位,再行超薄切片,铅、铀染色后,用透射电镜观察耳蜗螺旋器细胞内的超微结构变化。
, http://www.100md.com
7. 统计学处理:实验数据以
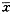 ±s表示,采用完全随机设计资料的方差分析进行显著性检验。
±s表示,采用完全随机设计资料的方差分析进行显著性检验。结果
1. 听反应阈改变:受试动物经115 dB(A)稳态噪声连续暴露6 d后,对照组和3个实验组均有听力损失(B组动物实验期间死亡1只),表现为听反应阈上移,其中以对照组最为明显,实验A组次之。噪声暴露停止为1 h(实验开始后第6 d),对照组动物平均阈移为(35.36±9.09)dB,其中最大阈移达50 dB。按完全随机设计多个样本均数比较的方差分析表明,噪声暴露全部结束后的1 h、1 d、2 d、3 d和6 d,3个实验组阈值与对照组相比,除噪声暴露结束后1 h,A组与对照组差异无显著性外,差异均有非常显著性(P<0.01),但B组与C组间阈值则差异无显著性(P>0.05);而A组与C组之间的阈值在暴露结束后1 h、1 d和2 d差异有显著性(P<0.05),在暴露结束后3 d和6 d,实验A组与实验B、C组之间则差异有非常显著性(P<0.01)。4组动物在噪声暴露前和噪声暴露全部结束后不同时间的听反应阈见参考文献[5]。在噪声暴露结束后3 d,B、C两组听反应阈已接近正常,6 d完全恢复至暴露前水平;但A组在噪声暴露结束后3 d和6 d分别还有(11.43±6.02)dB和(8.21±5.41)dB的阈移;而对照组在噪声暴露结束后6 d仍然有(16.43±6.91)dB的阈移。
, 百拇医药
2. 耳蜗螺旋器超微结构的改变:正常对照动物耳蜗螺旋器内、外毛细胞形态正常,界限清楚,细胞膜完整。静纤毛内微丝呈纵向排列。表皮板完整、表面光滑,皮板内纤毛细根正常。皮板下区的线粒体、溶酶体、内质网及高尔基体等细胞器的形态和数目均正常。表面下池沿细胞膜内侧呈平行排列。核呈圆形,核下区、突触接触部及传入、传出神经末梢形态正常。
噪声暴露对照组动物内毛细胞形态正常,耳蜗病变主要表现在3排外毛细胞(outer hair cells,OHC),以底回末段损伤最重。听反应阈偏移最大的动物OHC显示轻微水肿,第3排OHC尤为严重。可见到静纤毛内微丝解聚呈不连续状态;伸入到表皮板内的纤毛细根长度缩短,甚至消失;线粒体轻度肿大、嵴模糊,还有少数溶酶体膜破裂(图1);细胞核形态基本正常;核下区线粒体嵴模糊,传出神经末梢有轻度肿胀的表现(图2),听反应阈偏移最小的动物位于细胞膜内侧的表面下池水肿。
实验A组动物病变程度轻于对照组,在听反应阈偏移最大的动物第3排OHC中,主要表现出位于细胞膜内侧的表面下池肿胀(图3),即使听反应阈偏移最小的动物,其第3排OHC中,仍然发现皮板下区溶酶体数量增多,并有少数溶酶体膜破裂。对照组动物OHC的细胞核、核下区及其传入、传出神经末梢形态基本正常。
, 百拇医药
实验B、C组动物听毛细胞形态结构基本正常,轻微病变多局限在第3排OHC表皮板的上下区。B组动物OHC静纤毛内微丝呈纵向排列,但可见到第3排OHC皮板下区仍有个别溶酶体膜不完整或破裂;而实验C组动物则表现为第3排OHC静纤毛内的微丝呈分散状,并有模糊阴影(图4)。实验B、C两组动物内、外毛细胞的其它区域与正常对照动物耳蜗差异不大。
讨论
本组实验动物经稳态白噪声连续暴露6 d后,动物普遍有听反应阈上移,在噪声暴露全部停止后6 d,对照组动物平均阈移仍然有(16.43±6.91) dB,可以认为该组动物已有PTS。但3个应用NGF的实验组动物,其听反应阈上移的幅度明显低于对照组(P<0.01),在噪声暴露停止后3 d,实验B、C两组动物听反应阈已基本恢复至暴露前的水平,它们所形成的阈移属于TTS。但用药量最小的实验A组动物的阈移恢复程度不及用药量较大的B、C组,直到6 d仍留有(8.21±5.41) dB的阈移。噪声所致的耳蜗感受器病变,可直接导致听力产生TTS和PTS。本实验各组动物阈移变化与耳蜗超微结构变化的结果基本一致。实验提示:肌内注射一定剂量的NGF,可以减轻噪声对耳蜗毛细胞的损害,对噪声导致的听力损伤具有较明显的保护作用。
, 百拇医药
目前认为,NGF家族成员对感觉、交感及某些中枢胆碱能神经元具有营养支持作用,对损伤神经元具有保护和修复作用[6]。本实验结果显示,3个实验组动物听毛细胞的病变程度明显轻于对照组,但是,究竟是直接对耳蜗起作用或是间接起作用,还难以肯定。由于NGF在血浆中的半衰期较短,不利于其疗效的发挥,但有文献报道,NGF在注射后1 h,血浆中仍能检测出它的活性[7]。就本实验而言,使用肌内给药途径,NGF要到达内耳淋巴液发挥作用,血-迷路屏障可能是其必经之路。因为血-迷路屏障是保证内耳特殊功能所必需的重要系统,NGF作为多肽类生长因子,正常情况下不易透过血-迷路屏障。由于本实验动物在每天用药后即暴露于115 dB(A)的强噪声中,连续噪声对内耳不断产生进行性损害,这种损害与使用氨基甙类药物所造成的内耳损害可能有相同之处,因此,可能对血-迷路屏障也造成不同程度的损伤,这将有利于NGF进入内耳淋巴液[4]。另据文献报道,NGF对神经嵴起源的耳蜗-橄榄束具有诱向和营养作用,对传出神经纤维早期发育也具有影响[8,9],而内耳发育过程中睫状神经营养因子在毛细胞及前庭都有表达[10]。但是,目前仍不清楚在耳蜗毛细胞及听神经中是否存在NGF及其受体。关于NGF对抗噪声性听力损伤的确切机理尚不清楚,本文仅作一些初步的探讨,并为NGF的开发及进一步应用NTF防治噪声性聋提供一点实验依据。
, http://www.100md.com
编后 NGF在豚鼠内耳细胞上有无特异性受体,噪声损伤后NGF能否通过被损害的血-迷路屏障均无实验证实。因此,NGF对抗噪声性听力损伤的机理仍需进一步探讨。

图1 对照组第3排OHC静纤毛内微丝(MF)解聚(↑),表皮板(CP)内的纤毛细根(RT)长度缩 短(↑),皮板下区线粒体(M)体积轻度肿大(↑),少数溶酶体(L)膜破裂(↑) ×15 000

图2 对照组第3排OHC基底部传出神经末梢(ET)肿胀(↑) ×15 000

图3 实验A组第3排OHC膜内侧的表面下池(SMP)肿胀(↑) ×12 000

, http://www.100md.com
图4 实验C组第3排OHC静纤毛内的微丝(MF)模糊并呈分散状(↑) ×30 000
志谢 本研究得到第二军医大学神经生物学教研室主任路长林教授热忱指导,以及本校电镜室叶煦亭老师的热心帮助;得到海军医学研究所梁振福、史秀凤副研究员和杨玉明硕士的具体帮助与指导
通信作者:阮芳铭(Email: fdwang @ shtel.net.cn)
参考文献
1,Hatch M, Tsai M, LaRouere MJ, et al. The effects of Carbogen, carbon dioxide, and oxygen on noise-induced hearing loss. Hear Res,1991,56:265-272.
2,阮芳铭,高文元. 预先暴露低强度噪声对噪声损伤听力保护作用的观察. 声学技术, 1990,9:10-12.
, 百拇医药
3,Shah SB, Gladstone HB, Williams H, et al. An extended study: protective effects of nerve growth factor in neomycin-induced auditory neural degeneration. Am J Otol, 1995,16:310-314.
4,张志坚,施宁华,戴树宏. 神经生长因子对豚鼠庆大霉素耳毒性的保护作用. 镇江医学院学报, 1995, 5:265-266.
5,阮芳铭,高文元,王海明,等. 神经生长因子对豚鼠噪声性听力损伤的保护作用. 第二军医大学学报,2000, 21:45-49.
6,Van De Water TR, Staecker H, Ernfors P, et al. Neurotrophic factors as pharmacological agents for the treatment of injured auditory neurons. Ciba Found Symp, 1996,196:149-162.
, 百拇医药
7,Poduslo JF, Curran GL. Premeability at the blood-brain and blood-nerve barriers of the neurotrophic factor:NGF,CNTF,NT-3,BDNF.Brain Res Mol Brain Res,1996,36:280-286.
8,Crutcher KA. The role of growth factors in neuronal development and plasticity. Crit Rev Clin Neurobiol, 1986,2297-2333.
9,Despres G, Hafidi A, Romand R. Immunohistochemical localization of nerve growth factor receptor in the cochlea and in the brainstem of the perinatal rat. Hear Res,1991, 52:157-165.
10,周义德,翟所强,杨伟炎,等. 睫状神经营养因子防治强脉冲噪声对豚鼠内耳损伤的实验研究. 中华耳鼻咽喉科杂志,1999,34:150-153.
(收稿日期:2000-01-04), 百拇医药