水杨酸钠对豚鼠耳蜗单离外毛细胞游离钙浓度影响及其调控机制研究
作者:李树华 韩东一 杨伟炎 姜泗长
单位:100853 北京 解放军总医院耳鼻咽喉-头颈外科
关键词:耳蜗;毛细胞;外;钙;水杨酸钠;利多卡因;氟桂嗪;尼莫地平
中华耳鼻咽喉科杂志000407 【摘要】 目的 观察水杨酸钠对豚鼠耳蜗外毛细胞(outer hair cells,OHC)内游离钙浓度 [Ca2+]i的影响,并对钙通道调控药物的拮抗作用进行观察,以深入探讨水杨酸钠耳毒性的分子生物学机制。方法 豚鼠全身麻醉后断头活杀,酶-机械法分离获得耳蜗单离OHC。10 μmol/L的 Fluo-3/AM负载30 min后用ACAS Ultima 型激光扫描共聚焦显微镜观察不同药物灌流下OHC[Ca2+]i 的变化。结果 OHC在标准细胞外液灌流过程中[Ca2+]i保持稳定。1 mmol/L水杨酸钠灌流致8/10个细胞的[Ca2+]i 明显升高。无钙细胞外液中灌流亦有10/10个细胞[Ca2+]i明显的升高。经3 mmol/L利多卡因作用1 h后,水杨酸钠灌流不能使细胞[Ca2+]i升高(n=10)。盐酸氟桂嗪可以明显阻断水杨酸钠导致的OHC[Ca2+]i升高效应(3/12细胞的[Ca2+]i升高), 而尼莫地平无此效应(7/7细胞的[Ca2+]i升高)。结论 水杨酸钠可以导致OHC[Ca2+]i明显增加,OHC[Ca2+]i 升高来源于细胞内钙库的动员和释放。使细胞内[Ca2+]i升高可能是水杨酸钠的耳毒性机制之一。
, http://www.100md.com
Sodium salicylate induced intracellular Ca2+ concentration change in guinea pig outer hair cells
LI Shuhua, HAN Dongyi,YANG Weiyan
(Department of Otorhinolaryngology Head Neck Surgery, PLA General Hospital, Beijing 100853, China)
【Abstract】 Objective In order to explore the mechanism of sodium salicylate ototoxicity the effect of sodium salicylate on intracellular Ca2+ ([Ca2+]i ) of the outer hair cells (OHCs) and the effects of calcium channel antagonist on sodium salicylate-induced [Ca2+]i changes of the OHCs were examined. Methods The OHCs of guinea pig cochlear were isolated using an enzyme-machine methods and loaded with 10 μmol/L Fluo-3/AM for 30 min at 37 ℃. Individual Fluo-3 loaded OHC was examined with a confocal microscope (ACAS Ultima, USA) using a 20 x objective lens and linear scan mean. The fluorescent images, collected each 5-sec for 300 sec, were stored in a computer. The fluorescent intensity of the OHCs were analyzed by the software cooperated with the confocal microscope, and a curve of fluorescent intensity changes trend against time was obtained. Results The [Ca2+]i of OHCs were steady under normal extracellular liquid perfusion. Salicylate increased [Ca2+]i in OHCs in calcium-free medium(10/10) and standard medium (8/10). 3 mmol/L lidocaine inhibited [Ca2+]i increase in OHCs induced by salicylate(0/10). The [Ca2+]i increase in OHCs induced by salicylate could be blocked by flunarizine(3/12). Nimodipin failed to block the [Ca2+]i increase of OHCs induced by salicylate (7/7). Conclusion Sodium salicylate can result in [Ca2+]i increase in OHC markedly,which may be due to the Ca2+ release from intracellular calcium stores. The effects of salicylate on[Ca2+]i in OHCs might be one of the mechanisms of salicylate ototoxicity.
, 百拇医药
【Key words】 Cochlea; Hair cells,outer; Calcium; Sodium salicylate; Lidocaine; Flunarizine; Nimodipine
临床上水杨酸钠广泛用于解热、镇痛及抗炎治疗,在治疗风湿热和其它结缔组织疾病时所使用的剂量常导致耳鸣和听力下降。在一定范围内,听力损失的程度随水杨酸钠在血浆中的浓度增加而加重[1]。水杨酸钠的耳毒性不同于氨基糖甙类抗生素和髓袢类利尿剂,耳鸣和听力下降一般在停用水杨酸钠24~72 h后消失。
鉴于水杨酸钠易致耳鸣,目前多利用水杨酸钠制作耳鸣的动物模型。大鼠的行为观察实验表明,水杨酸钠可使大鼠表现出耳鸣时的行为[2]。已证实,动物被注射水杨酸钠后,其听神经的自发性放电频率明显增加,但使用利多卡因后恢复至正常水平[3]。但水杨酸钠使动物听神经放电频率增加的细胞生物学机理尚不甚清楚。近来已证实,细胞内游离钙在听觉信号传输过程中起重要作用。我们用单离的豚鼠耳蜗外毛细胞(outer hair cells, OHC)作对象,观察了水杨酸钠对OHC内游离钙浓度([Ca2+]i)的影响,并对目前治疗耳鸣药物的拮抗作用进行了观察,旨在深入探讨耳鸣的分子生物学机制。
, http://www.100md.com
材料与方法
1.实验动物及耳蜗OHC的分离:用耳廓反射阳性,体重200~300 g的豚鼠12只。全身麻醉后断头活杀,解剖出双侧听泡,立即置入细胞外液中进行操作。解剖显微镜下剥离蜗壳,撕去螺旋韧带,以不锈钢针和游丝镊仔细解剖分离出基底膜,并置入含0.1 mg/ml胶原酶(Sigma公司, 美国)的细胞外液中孵育15 min后更换含2 g/L牛血清白蛋白(Sigma, 美国)的正常细胞外液。在解剖显微镜下以角膜剪将基底膜组织剪碎并以吸管吹打,即获得单离的OHC 60~100个。从每侧耳蜗分离的OHC均分3等份,分别移入预先在皿底涂上细胞粘着剂(0.25 mg/ml刀豆蛋白,Sigma公司,美国)的玻璃皿内备用。
2.Fluo-3的染色及钙成像:钙荧光探针Fluo-3/AM(Molecular Probe,美国)用纯二甲亚砜(dimethylsulfoxide, DMSO)配成1 mmol/L的储备液,低温保存备用。分散剂F-127(Molecular Probe,美国)以溶于纯DMSO中(20 mmol/L)备用。实验前将Fluo-3/AM与F-127储备液以4∶3体积比混于细胞外液中,Fluo-3/AM的终浓度为10 μmol/L。单离细胞在37℃下避光孵育约30 min,更换新鲜细胞外液即可用于观察。实验采用ACAS Ultima 型激光扫描共聚焦显微镜(laser scan confocal microscope, LSCM,Meridian公司,美国)。以LSCM观察用Fluo-3/AM染色后的OHC[Ca2+]i的变化。用20倍物镜,线扫描方式荧光图像由冷电荷藕荷器件摄像记录,经模-数转换储存于计算机内,每5 s记录1次,每个细胞记录300 s。
, 百拇医药
3.溶液、试剂及给药方法:正常细胞外液的组成(单位:mmol/L):NaCl 150; KCl 5; CaCl2 2; MgCl2 1;Hepes 10; D-葡萄糖 5。用电子分析天平(Sartorius A 120S,Sartorius公司,德国)称量各种成分(北京化学试剂三厂),用三蒸水配制。用pH试纸及酸度计(PHS-29A型,上海第二分析仪器厂)测定,并以1 mmol/L NaOH 和1 mmol/L HCl 将pH值调至7.4。全自动冰点渗透压计(FM-6型,上海第一医科大学仪器厂)测定,并用1 mol/L NaCl 及三蒸水调节渗透浓度到(300±5)Osm mol/L。无钙细胞外液组成则以1 mmol/L的EGTA(Ethylene Glycol-bis N,N,N′,N′-tetraacetic Acid,Sigma公司,美国)取代上述溶液中CaCl2。水杨酸钠、利多卡因、盐酸氟桂嗪(Sigma公司,美国)等试剂均于实验前加入标准细胞外液或无钙细胞外液中备用,尼莫地平预先以高浓度溶于无水乙醇内并在实验前加入细胞外液至所需浓度。各溶液的渗透浓度均调至300 Osm mol/L左右。
, http://www.100md.com
整个实验过程约需5 min。以蠕动泵持续灌流更换玻璃皿中的细胞外液,蠕动泵流速为400 μL/min,其中第1 min灌流正常细胞外液,第2~3 min灌流含一定浓度所用药物的细胞外液,第4~5 min重新灌流细胞外液,每个玻璃皿内的细胞只使用一次。
4.数据处理:LSCM所配微机存储下的荧光图像,由Meridian公司提供的配套软件计算特定区域的荧光强度值,并绘制荧光强度随时间变化的曲线。Fluo-3/AM的钙解离常数为0.39 μmol/L,适用于测量较高浓度的钙离子。Fluo-3与钙离子结合后荧光强度增加40倍,但发射光的波长仅轻微改变[4],未经校正不能计算细胞内钙离子浓度的绝对值,故本文仅观察所绘出曲线的升降趋势。
5.细胞活性鉴定:判定细胞活性正常的标准为细胞双折射现象存在,细胞核位置正常,细胞无水肿,细胞内无布朗运动的颗粒[5-7]。
, http://www.100md.com
结果
1.单离OHC的形态特征:图1为单离的OHC。单离的OHC呈柱状,长度约40~70 μm不等。在相差显微镜下其细胞体呈半透明状,细胞器主要分布于表皮板下及核下,细胞核位于底部。实验中以前述细胞活性鉴定标准选用活性良好的细胞观察。
2. OHC的钙成像:激光共聚焦显微镜下钙成像的OHC仍可见普通倒置显微镜下的形态特征,细胞内游离钙离子浓度的高低由细胞被激发出的荧光的强弱表示(图2),越偏红表示细胞内游离钙离子浓度越高,越偏蓝则越低。
3. 静息状态下正常OHC[Ca2+]i的动态变化:为证明灌流的细胞外液对OHC [Ca2+]i的影响,在11个单离OHC观察了标准细胞外液灌流过程中[Ca2+]i的动态变化。结果表明,细胞外液灌流的整个时间内OHC[Ca2+]i 保持稳定(图3)。
, 百拇医药
4.水杨酸钠对OHC[Ca2+]i的影响:在有钙和无钙细胞外液中各观察了10个细胞灌流1 mmol/L水杨酸钠时OHC[Ca2+]i的变化。结果表明,在有钙和无钙细胞外液中灌流水杨酸钠即导致绝大多数OHC[Ca2+]i明显升高,且随着水杨酸钠灌流时间的延长OHC[Ca2+]i升高更加明显,恢复灌流正常细胞外液后,OHC[Ca2+]i也逐渐恢复至水杨酸钠灌流前的水平(图4)。10个OHC在正常细胞外液中[Ca2+]i升高的有8个,在无钙细胞外液中10个细胞[Ca2+]i均升高,经卡方检验(直接概率法)P=0.473 7(P>0.05),两组间差异无显著性。
5.利多卡因对水杨酸钠诱发OHC[Ca2+]i升高效应的影响:10个单离OHC在有3 mmol/L利多卡因的细胞外液中放置1 h再灌流水杨酸钠,发现10个细胞[Ca2+]i均未见明显升高,而空白对照组10个细胞中8个[Ca2+]i升高,经卡方检验(直接概率法)P=0.000 71,两组间差异有极显著性。
, http://www.100md.com
6.钙通道阻滞剂对水杨酸钠所致OHC[Ca2+]i升高效应的影响:7个单离OHC在加入0.5 mmol/L尼莫地平的细胞外液、12个OHC在加入1 mmol/L盐酸氟桂嗪的细胞外液中放置1 h,再灌流水杨酸钠。盐酸氟桂嗪组有9个细胞[Ca2+]i没有升高,采用卡方检验(直接概率法),与未经药物处理的空白对照组相比,P值=0.029 9(<0.05),差异有显著性意义,说明其有阻断水杨酸钠导致OHC[Ca2+]i升高的效应。尼莫地平组7个细胞[Ca2+]i均升高,与未经药物处理的空白对照组相比,P=0.485 3(>0.05),差异无显著性意义。
讨论
已有研究证实,给动物使用较大剂量的水杨酸钠可致动物听阈可逆性的升高,听神经动作电位及听觉脑干诱发电位阈值升高,耳蜗微音器电位CM波振幅升高,畸变产物耳声发射(distortion production otoacoustic emission,DPOAE)减弱[8]。水杨酸钠对耳蜗听觉电生理影响的机理仍不清楚。
, 百拇医药
本实验采用钙敏荧光探针Fluo-3/AM和激光共聚焦显微镜成像技术,系统观察了水杨酸钠对耳蜗单离OHC[Ca2+]i 的影响,为排除其它非相关因素对实验结果的影响,首先观察了细胞外液灌流对OHC[Ca2+]i的影响,发现细胞外液灌流本身不影响OHC[Ca2+]i。细胞外液中加入水杨酸钠后OHC[Ca2+]i明显增加,去除水杨酸钠后OHC[Ca2+]i逐渐恢复至加入前的水平,而且在无钙细胞外液中加入水杨酸钠仍可使OHC[Ca2+]i明显升高。为进一步阐明上述水杨酸钠导致OHC[Ca2+]i升高的机理,观察了细胞膜L-型电压依赖性钙通道阻断剂尼莫地平和既阻断细胞膜钙通道又抑制细胞内钙库释放的盐酸氟桂嗪对其结果的影响。结果表明,以水杨酸钠刺激经尼莫地平处理过的OHC时,仍可使OHC[Ca2+]i明显升高,而盐酸氟桂嗪则明显抑制水杨酸钠所致OHC[Ca2+]i升高作用。上述结果说明,水杨酸钠引起OHC[Ca2+]i升高不是细胞外钙离子经细胞膜钙通道流入细胞内,而是通过细胞内钙库的动员和释放的结果。根据本组结果推测,水杨酸钠的耳毒性机理之一可能是通过耳蜗感受细胞或听觉初级神经元细胞的细胞内钙库的释放导致细胞内钙浓度的升高和超载,进而引起这些细胞的功能障碍,但其确切机制尚需进一步验证。
, http://www.100md.com
已证实水杨酸钠可致人和动物耳鸣、听力下降[8]。有实验证明水杨酸钠可致动物听神经元的自发放电增加,后者可被利多卡因所抑制,推测这些现象与水杨酸钠引起的耳鸣有关[3]。然而上述水杨酸钠使听神经元自发放电增加的机制至今不明。如上述,水杨酸钠可使OHC[Ca2+]i明显增加,且这种增加效应与细胞内钙库的释放有关。Shehata等[9]报告水杨酸钠可使豚鼠耳蜗毛细胞膜下池的空泡形成,而膜下池正是毛细胞内钙库之一。Martin等[3]报告使用利多卡因可暂时性地降低水杨酸钠所致动物听神经放电增加效应。本研究结果表明,3 mmol/L的利多卡因使水杨酸钠导致的OHC[Ca2+]i的升高效应明显受抑制,与前述电生理的结果一致。显然,水杨酸钠使OHC[Ca2+]i升高可能是水杨酸钠致听觉神经元放电增加的机制之一,这为水杨酸钠引起的耳鸣机制研究提供了另一间接证据。至于上述水杨酸钠引起OHC[Ca2+]i 的升高与临床上水杨酸钠引起患者听力下降和耳鸣的关系尚待更多的实验来阐明。
, 百拇医药
编后 一般认为水杨酸类药物对内耳毛细胞的损害机制是使外毛细胞的电导、电容、能动性和膜下池发生可逆性的变化。本文得出水杨酸钠使毛细胞[Ca2+]i 升高致听觉神经元放电增加,从而提出引起耳鸣的机制的新观点。本文的实验材料是外毛细胞,而不是内毛细胞。内毛细胞对[Ca2+]i升高将启动耳蜗主动调控机制,这可能反而使听觉神经纤维的放电降低,此问题尚需进一步研究。
图1 豚鼠耳蜗不同长度(a、b)的单离外毛细胞。倒置相差显微镜 ×1 000
图2 豚鼠耳蜗外毛细胞钙成像。LSCM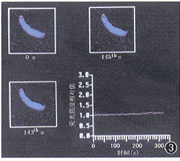
, 百拇医药
图3 正常细胞外液灌流过程中外毛细胞内钙浓度保持稳定。右下为一个毛细胞荧光强度随时间变化的曲线。LSCM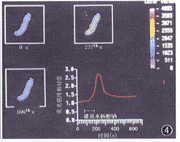
图4 无钙细胞外液中1 mmol/L水杨酸钠灌流导致外毛细胞内钙明显升高,去除水杨酸钠则升高的细胞内钙逐渐降低到灌流水杨酸钠前水平。右下为一个毛细胞荧光强度随时间变化的曲线。LSCM
基金项目: 国家自然科学基金资助项目(39670778);军队杰出青年人才基金资助课题
通信作者:李树华 110015 沈阳军区总医院耳鼻咽喉科(Email: shuhua-lee@263.net)
参考文献
1,Mongan E, Kelly P, Nies K, et al. Tinnitus as an indicator of therapeutic serum salicylate levels. JAMA,1973,226:142-145.
, 百拇医药
2,Jastreboff PJ, Brennan JF. Evaluating the loudness of phantom auditory perception(tinnitus) in rats. Audiology,1994, 33:202-217.
3,Martin WH, Schwegler JW, Scheibelhoffer J, et al. Salicylate-induced changes in cat auditory nerve activity. Laryngoscope, 1993, 103:600-604.
4,Housley GD,Nonis CH,Guth PS. Electrophysiological properties and morphology of hair cells isolated from the semicircular canal of the frog. Hear Res,1989, 38: 259-276.
, 百拇医药
5,苏振伦,姜泗长,顾瑞,等. 豚鼠耳蜗毛细胞分离法. 中华耳鼻咽喉科杂志,1992, 27: 133-135.
6,Minta A, Kao JP,Tsien RY. Fluorescent indictors for cytosolic calcium based on rhodamine and fluorescein chromophores. J Biol Chem, 1989, 264:8171-8178.
7,Brown MC. Morphology of labeled afferent fibers in the guinea pig cochlea. J Comp Neurol,1987,260:591-604.
8,Stypulkowski PH. Mechanisms of salicylate ototoxicity.Hear Res,1990, 46:113-145.
9,Shehata WE, Brownell WE, Dieler R. Effects of salicylate on shape, electromotility and membrane characteristics of isolated outer hair cells from guinea pig cochlea. Acta Otolaryngol,1991,111:707-718.
(收稿日期:2000-03-13), 百拇医药
单位:100853 北京 解放军总医院耳鼻咽喉-头颈外科
关键词:耳蜗;毛细胞;外;钙;水杨酸钠;利多卡因;氟桂嗪;尼莫地平
中华耳鼻咽喉科杂志000407 【摘要】 目的 观察水杨酸钠对豚鼠耳蜗外毛细胞(outer hair cells,OHC)内游离钙浓度 [Ca2+]i的影响,并对钙通道调控药物的拮抗作用进行观察,以深入探讨水杨酸钠耳毒性的分子生物学机制。方法 豚鼠全身麻醉后断头活杀,酶-机械法分离获得耳蜗单离OHC。10 μmol/L的 Fluo-3/AM负载30 min后用ACAS Ultima 型激光扫描共聚焦显微镜观察不同药物灌流下OHC[Ca2+]i 的变化。结果 OHC在标准细胞外液灌流过程中[Ca2+]i保持稳定。1 mmol/L水杨酸钠灌流致8/10个细胞的[Ca2+]i 明显升高。无钙细胞外液中灌流亦有10/10个细胞[Ca2+]i明显的升高。经3 mmol/L利多卡因作用1 h后,水杨酸钠灌流不能使细胞[Ca2+]i升高(n=10)。盐酸氟桂嗪可以明显阻断水杨酸钠导致的OHC[Ca2+]i升高效应(3/12细胞的[Ca2+]i升高), 而尼莫地平无此效应(7/7细胞的[Ca2+]i升高)。结论 水杨酸钠可以导致OHC[Ca2+]i明显增加,OHC[Ca2+]i 升高来源于细胞内钙库的动员和释放。使细胞内[Ca2+]i升高可能是水杨酸钠的耳毒性机制之一。
, http://www.100md.com
Sodium salicylate induced intracellular Ca2+ concentration change in guinea pig outer hair cells
LI Shuhua, HAN Dongyi,YANG Weiyan
(Department of Otorhinolaryngology Head Neck Surgery, PLA General Hospital, Beijing 100853, China)
【Abstract】 Objective In order to explore the mechanism of sodium salicylate ototoxicity the effect of sodium salicylate on intracellular Ca2+ ([Ca2+]i ) of the outer hair cells (OHCs) and the effects of calcium channel antagonist on sodium salicylate-induced [Ca2+]i changes of the OHCs were examined. Methods The OHCs of guinea pig cochlear were isolated using an enzyme-machine methods and loaded with 10 μmol/L Fluo-3/AM for 30 min at 37 ℃. Individual Fluo-3 loaded OHC was examined with a confocal microscope (ACAS Ultima, USA) using a 20 x objective lens and linear scan mean. The fluorescent images, collected each 5-sec for 300 sec, were stored in a computer. The fluorescent intensity of the OHCs were analyzed by the software cooperated with the confocal microscope, and a curve of fluorescent intensity changes trend against time was obtained. Results The [Ca2+]i of OHCs were steady under normal extracellular liquid perfusion. Salicylate increased [Ca2+]i in OHCs in calcium-free medium(10/10) and standard medium (8/10). 3 mmol/L lidocaine inhibited [Ca2+]i increase in OHCs induced by salicylate(0/10). The [Ca2+]i increase in OHCs induced by salicylate could be blocked by flunarizine(3/12). Nimodipin failed to block the [Ca2+]i increase of OHCs induced by salicylate (7/7). Conclusion Sodium salicylate can result in [Ca2+]i increase in OHC markedly,which may be due to the Ca2+ release from intracellular calcium stores. The effects of salicylate on[Ca2+]i in OHCs might be one of the mechanisms of salicylate ototoxicity.
, 百拇医药
【Key words】 Cochlea; Hair cells,outer; Calcium; Sodium salicylate; Lidocaine; Flunarizine; Nimodipine
临床上水杨酸钠广泛用于解热、镇痛及抗炎治疗,在治疗风湿热和其它结缔组织疾病时所使用的剂量常导致耳鸣和听力下降。在一定范围内,听力损失的程度随水杨酸钠在血浆中的浓度增加而加重[1]。水杨酸钠的耳毒性不同于氨基糖甙类抗生素和髓袢类利尿剂,耳鸣和听力下降一般在停用水杨酸钠24~72 h后消失。
鉴于水杨酸钠易致耳鸣,目前多利用水杨酸钠制作耳鸣的动物模型。大鼠的行为观察实验表明,水杨酸钠可使大鼠表现出耳鸣时的行为[2]。已证实,动物被注射水杨酸钠后,其听神经的自发性放电频率明显增加,但使用利多卡因后恢复至正常水平[3]。但水杨酸钠使动物听神经放电频率增加的细胞生物学机理尚不甚清楚。近来已证实,细胞内游离钙在听觉信号传输过程中起重要作用。我们用单离的豚鼠耳蜗外毛细胞(outer hair cells, OHC)作对象,观察了水杨酸钠对OHC内游离钙浓度([Ca2+]i)的影响,并对目前治疗耳鸣药物的拮抗作用进行了观察,旨在深入探讨耳鸣的分子生物学机制。
, http://www.100md.com
材料与方法
1.实验动物及耳蜗OHC的分离:用耳廓反射阳性,体重200~300 g的豚鼠12只。全身麻醉后断头活杀,解剖出双侧听泡,立即置入细胞外液中进行操作。解剖显微镜下剥离蜗壳,撕去螺旋韧带,以不锈钢针和游丝镊仔细解剖分离出基底膜,并置入含0.1 mg/ml胶原酶(Sigma公司, 美国)的细胞外液中孵育15 min后更换含2 g/L牛血清白蛋白(Sigma, 美国)的正常细胞外液。在解剖显微镜下以角膜剪将基底膜组织剪碎并以吸管吹打,即获得单离的OHC 60~100个。从每侧耳蜗分离的OHC均分3等份,分别移入预先在皿底涂上细胞粘着剂(0.25 mg/ml刀豆蛋白,Sigma公司,美国)的玻璃皿内备用。
2.Fluo-3的染色及钙成像:钙荧光探针Fluo-3/AM(Molecular Probe,美国)用纯二甲亚砜(dimethylsulfoxide, DMSO)配成1 mmol/L的储备液,低温保存备用。分散剂F-127(Molecular Probe,美国)以溶于纯DMSO中(20 mmol/L)备用。实验前将Fluo-3/AM与F-127储备液以4∶3体积比混于细胞外液中,Fluo-3/AM的终浓度为10 μmol/L。单离细胞在37℃下避光孵育约30 min,更换新鲜细胞外液即可用于观察。实验采用ACAS Ultima 型激光扫描共聚焦显微镜(laser scan confocal microscope, LSCM,Meridian公司,美国)。以LSCM观察用Fluo-3/AM染色后的OHC[Ca2+]i的变化。用20倍物镜,线扫描方式荧光图像由冷电荷藕荷器件摄像记录,经模-数转换储存于计算机内,每5 s记录1次,每个细胞记录300 s。
, 百拇医药
3.溶液、试剂及给药方法:正常细胞外液的组成(单位:mmol/L):NaCl 150; KCl 5; CaCl2 2; MgCl2 1;Hepes 10; D-葡萄糖 5。用电子分析天平(Sartorius A 120S,Sartorius公司,德国)称量各种成分(北京化学试剂三厂),用三蒸水配制。用pH试纸及酸度计(PHS-29A型,上海第二分析仪器厂)测定,并以1 mmol/L NaOH 和1 mmol/L HCl 将pH值调至7.4。全自动冰点渗透压计(FM-6型,上海第一医科大学仪器厂)测定,并用1 mol/L NaCl 及三蒸水调节渗透浓度到(300±5)Osm mol/L。无钙细胞外液组成则以1 mmol/L的EGTA(Ethylene Glycol-bis N,N,N′,N′-tetraacetic Acid,Sigma公司,美国)取代上述溶液中CaCl2。水杨酸钠、利多卡因、盐酸氟桂嗪(Sigma公司,美国)等试剂均于实验前加入标准细胞外液或无钙细胞外液中备用,尼莫地平预先以高浓度溶于无水乙醇内并在实验前加入细胞外液至所需浓度。各溶液的渗透浓度均调至300 Osm mol/L左右。
, http://www.100md.com
整个实验过程约需5 min。以蠕动泵持续灌流更换玻璃皿中的细胞外液,蠕动泵流速为400 μL/min,其中第1 min灌流正常细胞外液,第2~3 min灌流含一定浓度所用药物的细胞外液,第4~5 min重新灌流细胞外液,每个玻璃皿内的细胞只使用一次。
4.数据处理:LSCM所配微机存储下的荧光图像,由Meridian公司提供的配套软件计算特定区域的荧光强度值,并绘制荧光强度随时间变化的曲线。Fluo-3/AM的钙解离常数为0.39 μmol/L,适用于测量较高浓度的钙离子。Fluo-3与钙离子结合后荧光强度增加40倍,但发射光的波长仅轻微改变[4],未经校正不能计算细胞内钙离子浓度的绝对值,故本文仅观察所绘出曲线的升降趋势。
5.细胞活性鉴定:判定细胞活性正常的标准为细胞双折射现象存在,细胞核位置正常,细胞无水肿,细胞内无布朗运动的颗粒[5-7]。
, http://www.100md.com
结果
1.单离OHC的形态特征:图1为单离的OHC。单离的OHC呈柱状,长度约40~70 μm不等。在相差显微镜下其细胞体呈半透明状,细胞器主要分布于表皮板下及核下,细胞核位于底部。实验中以前述细胞活性鉴定标准选用活性良好的细胞观察。
2. OHC的钙成像:激光共聚焦显微镜下钙成像的OHC仍可见普通倒置显微镜下的形态特征,细胞内游离钙离子浓度的高低由细胞被激发出的荧光的强弱表示(图2),越偏红表示细胞内游离钙离子浓度越高,越偏蓝则越低。
3. 静息状态下正常OHC[Ca2+]i的动态变化:为证明灌流的细胞外液对OHC [Ca2+]i的影响,在11个单离OHC观察了标准细胞外液灌流过程中[Ca2+]i的动态变化。结果表明,细胞外液灌流的整个时间内OHC[Ca2+]i 保持稳定(图3)。
, 百拇医药
4.水杨酸钠对OHC[Ca2+]i的影响:在有钙和无钙细胞外液中各观察了10个细胞灌流1 mmol/L水杨酸钠时OHC[Ca2+]i的变化。结果表明,在有钙和无钙细胞外液中灌流水杨酸钠即导致绝大多数OHC[Ca2+]i明显升高,且随着水杨酸钠灌流时间的延长OHC[Ca2+]i升高更加明显,恢复灌流正常细胞外液后,OHC[Ca2+]i也逐渐恢复至水杨酸钠灌流前的水平(图4)。10个OHC在正常细胞外液中[Ca2+]i升高的有8个,在无钙细胞外液中10个细胞[Ca2+]i均升高,经卡方检验(直接概率法)P=0.473 7(P>0.05),两组间差异无显著性。
5.利多卡因对水杨酸钠诱发OHC[Ca2+]i升高效应的影响:10个单离OHC在有3 mmol/L利多卡因的细胞外液中放置1 h再灌流水杨酸钠,发现10个细胞[Ca2+]i均未见明显升高,而空白对照组10个细胞中8个[Ca2+]i升高,经卡方检验(直接概率法)P=0.000 71,两组间差异有极显著性。
, http://www.100md.com
6.钙通道阻滞剂对水杨酸钠所致OHC[Ca2+]i升高效应的影响:7个单离OHC在加入0.5 mmol/L尼莫地平的细胞外液、12个OHC在加入1 mmol/L盐酸氟桂嗪的细胞外液中放置1 h,再灌流水杨酸钠。盐酸氟桂嗪组有9个细胞[Ca2+]i没有升高,采用卡方检验(直接概率法),与未经药物处理的空白对照组相比,P值=0.029 9(<0.05),差异有显著性意义,说明其有阻断水杨酸钠导致OHC[Ca2+]i升高的效应。尼莫地平组7个细胞[Ca2+]i均升高,与未经药物处理的空白对照组相比,P=0.485 3(>0.05),差异无显著性意义。
讨论
已有研究证实,给动物使用较大剂量的水杨酸钠可致动物听阈可逆性的升高,听神经动作电位及听觉脑干诱发电位阈值升高,耳蜗微音器电位CM波振幅升高,畸变产物耳声发射(distortion production otoacoustic emission,DPOAE)减弱[8]。水杨酸钠对耳蜗听觉电生理影响的机理仍不清楚。
, 百拇医药
本实验采用钙敏荧光探针Fluo-3/AM和激光共聚焦显微镜成像技术,系统观察了水杨酸钠对耳蜗单离OHC[Ca2+]i 的影响,为排除其它非相关因素对实验结果的影响,首先观察了细胞外液灌流对OHC[Ca2+]i的影响,发现细胞外液灌流本身不影响OHC[Ca2+]i。细胞外液中加入水杨酸钠后OHC[Ca2+]i明显增加,去除水杨酸钠后OHC[Ca2+]i逐渐恢复至加入前的水平,而且在无钙细胞外液中加入水杨酸钠仍可使OHC[Ca2+]i明显升高。为进一步阐明上述水杨酸钠导致OHC[Ca2+]i升高的机理,观察了细胞膜L-型电压依赖性钙通道阻断剂尼莫地平和既阻断细胞膜钙通道又抑制细胞内钙库释放的盐酸氟桂嗪对其结果的影响。结果表明,以水杨酸钠刺激经尼莫地平处理过的OHC时,仍可使OHC[Ca2+]i明显升高,而盐酸氟桂嗪则明显抑制水杨酸钠所致OHC[Ca2+]i升高作用。上述结果说明,水杨酸钠引起OHC[Ca2+]i升高不是细胞外钙离子经细胞膜钙通道流入细胞内,而是通过细胞内钙库的动员和释放的结果。根据本组结果推测,水杨酸钠的耳毒性机理之一可能是通过耳蜗感受细胞或听觉初级神经元细胞的细胞内钙库的释放导致细胞内钙浓度的升高和超载,进而引起这些细胞的功能障碍,但其确切机制尚需进一步验证。
, http://www.100md.com
已证实水杨酸钠可致人和动物耳鸣、听力下降[8]。有实验证明水杨酸钠可致动物听神经元的自发放电增加,后者可被利多卡因所抑制,推测这些现象与水杨酸钠引起的耳鸣有关[3]。然而上述水杨酸钠使听神经元自发放电增加的机制至今不明。如上述,水杨酸钠可使OHC[Ca2+]i明显增加,且这种增加效应与细胞内钙库的释放有关。Shehata等[9]报告水杨酸钠可使豚鼠耳蜗毛细胞膜下池的空泡形成,而膜下池正是毛细胞内钙库之一。Martin等[3]报告使用利多卡因可暂时性地降低水杨酸钠所致动物听神经放电增加效应。本研究结果表明,3 mmol/L的利多卡因使水杨酸钠导致的OHC[Ca2+]i的升高效应明显受抑制,与前述电生理的结果一致。显然,水杨酸钠使OHC[Ca2+]i升高可能是水杨酸钠致听觉神经元放电增加的机制之一,这为水杨酸钠引起的耳鸣机制研究提供了另一间接证据。至于上述水杨酸钠引起OHC[Ca2+]i 的升高与临床上水杨酸钠引起患者听力下降和耳鸣的关系尚待更多的实验来阐明。
, 百拇医药
编后 一般认为水杨酸类药物对内耳毛细胞的损害机制是使外毛细胞的电导、电容、能动性和膜下池发生可逆性的变化。本文得出水杨酸钠使毛细胞[Ca2+]i 升高致听觉神经元放电增加,从而提出引起耳鸣的机制的新观点。本文的实验材料是外毛细胞,而不是内毛细胞。内毛细胞对[Ca2+]i升高将启动耳蜗主动调控机制,这可能反而使听觉神经纤维的放电降低,此问题尚需进一步研究。

图1 豚鼠耳蜗不同长度(a、b)的单离外毛细胞。倒置相差显微镜 ×1 000

图2 豚鼠耳蜗外毛细胞钙成像。LSCM

, 百拇医药
图3 正常细胞外液灌流过程中外毛细胞内钙浓度保持稳定。右下为一个毛细胞荧光强度随时间变化的曲线。LSCM

图4 无钙细胞外液中1 mmol/L水杨酸钠灌流导致外毛细胞内钙明显升高,去除水杨酸钠则升高的细胞内钙逐渐降低到灌流水杨酸钠前水平。右下为一个毛细胞荧光强度随时间变化的曲线。LSCM
基金项目: 国家自然科学基金资助项目(39670778);军队杰出青年人才基金资助课题
通信作者:李树华 110015 沈阳军区总医院耳鼻咽喉科(Email: shuhua-lee@263.net)
参考文献
1,Mongan E, Kelly P, Nies K, et al. Tinnitus as an indicator of therapeutic serum salicylate levels. JAMA,1973,226:142-145.
, 百拇医药
2,Jastreboff PJ, Brennan JF. Evaluating the loudness of phantom auditory perception(tinnitus) in rats. Audiology,1994, 33:202-217.
3,Martin WH, Schwegler JW, Scheibelhoffer J, et al. Salicylate-induced changes in cat auditory nerve activity. Laryngoscope, 1993, 103:600-604.
4,Housley GD,Nonis CH,Guth PS. Electrophysiological properties and morphology of hair cells isolated from the semicircular canal of the frog. Hear Res,1989, 38: 259-276.
, 百拇医药
5,苏振伦,姜泗长,顾瑞,等. 豚鼠耳蜗毛细胞分离法. 中华耳鼻咽喉科杂志,1992, 27: 133-135.
6,Minta A, Kao JP,Tsien RY. Fluorescent indictors for cytosolic calcium based on rhodamine and fluorescein chromophores. J Biol Chem, 1989, 264:8171-8178.
7,Brown MC. Morphology of labeled afferent fibers in the guinea pig cochlea. J Comp Neurol,1987,260:591-604.
8,Stypulkowski PH. Mechanisms of salicylate ototoxicity.Hear Res,1990, 46:113-145.
9,Shehata WE, Brownell WE, Dieler R. Effects of salicylate on shape, electromotility and membrane characteristics of isolated outer hair cells from guinea pig cochlea. Acta Otolaryngol,1991,111:707-718.
(收稿日期:2000-03-13), 百拇医药