静脉免疫球蛋白对新生儿淋巴细胞CD40与CD40配体表达调节的研究
作者:李庆生 吴圣楣 林梓 应大明
单位:200092 上海第二医科大学新华医院 上海市儿科医学研究所
关键词:免疫球蛋白类;静脉内;抗原CD40;配体
中华儿科杂志/980806 【摘要】 目的 探讨静脉免疫球蛋白(IVIG)调节新生儿B细胞免疫球蛋白释放的机制。 方法 采用间接免疫荧光标记法,经流式细胞仪检测IVIG(5 mg/ml)作用后的脐血淋巴细胞及成人外周血标本的CD40与CD40配体(CD40L)的表达。结果 (1)“休止”状态下脐血单个核细胞(CBMC)可表达类似于成人外周血单个核细胞的CD40分子。(2)IVIG不改变rIL-4激活后的CBMC中CD40染色阳性细胞的百分比。(3)佛波醇乙酯及钙离子导入剂活化后的CBMC不表达CD40L。在植物血凝素诱导CBMC后,继续予以IL-2及佛波醇乙酯结合钙离子导入剂的诱导,CBMC始表达CD40L。(4)IVIG可促进活化后CBMC的CD40L表达。结论 推测IVIG抑制B细胞抗体释放的同时,产生了针对T细胞的反馈信号,刺激了CD40L表达的增加,但在B细胞上的CD40或其他共刺激信号及有关的细胞因子缺乏配合的情况下,CD40L表达的增加并无实际意义。
, 百拇医药
The effect of intravenous immunoglobulin on modulation of expressions of CD40 and CD40 ligand in neonatal lymphocyte
Li Qingsheng,Wu Shengmei,Lin Zi,et al. Xinhua Hospital of Shanghai Second Medical University, Shanghai 200092
【Abstract】 Objective To determine whether the production of immunoglobulin of neonatal B cell is inhi-bited by intravenous immunoglobulin (IVIG) through the co-stimulatory signal transduction between T and B cells. Methods The effect of IVIG (5 mg/ml) on regulating the expressions of CD40 and CD40 ligand (CD40L) in cord blood lymphocyte was examined by using indirect immunofluorescent technique with flow cytometer. Results (1) The percentage of “resting” cord blood mononuclear cell (CBMC)expressing CD40 was similar to that of adult peripheral mononuclear cell; (2) IVIG had no effect upon the number of CD+40 cells in CBMC primed by rIL-4; (3) CBMC primed with a combination of PMA and ionomycin did not express detectable levels of CD40L. CBMC began to express CD40L when CBMC was restimulated by rIL-2 and PMA combined with ionomycin after CBMC was primed with phytohemagglutinin (PHA); (4) IVIG induced an increase in the number of CD+40L cells in primed CBMC. Conclusion The authors speculated that the increased expression level of CD40L by cord blood T cells is probably due to a transductive negative signals during the inhibitory process of IVIG on the immunoglobulin production by cord blood B cells. However,in the absence of increased expression of CD40, costimulatory signals or other relevant cytokines,the increased level of CD40L expression probably has no practical significance.
, 百拇医药
【Key words】 Immunoglobulins, intravenous Antigens, CD40 Iigands
CD40分子(CD40)与CD40分子的配体(CD40L)间相互作用是导致B细胞释放免疫球蛋白(Ig)过程中的一重要环节。已有资料表明静脉免疫球蛋白(intravenous immunoglobulin,IVIG)可以抑制体外成人或新生儿B细胞Ig的产生[1], 但对IVIG调节B细胞免疫功能的确切机制仍缺乏足够的认识。作者设想IVIG是否同时影响T、B细胞间共刺激信号的传递而发挥作用?为此,在体外应用IVIG的基础上,检测了新生儿脐血淋巴细胞CD40与CD40L的表达。
资料和方法
, 百拇医药 一、脐血标本及成人外周血标本
脐血标本取自上海第二医科大学附属新华医院产房,为足月新生儿娩出时近胎盘端脐静脉血,成人外周血取自健康成年人自愿者。
二、试剂
1.IVIG溶液配制:IVIG干粉(gammgard)为Baxter Healthcare公司(CA)产品。实验前用RPMI-1640溶解IVIG并正压过滤,IVIG的终浓度为5 mg/ml。
2.抗体:抗CD40单克隆抗体(anti-CD40mAb)(M2,IgG1)、抗CD40配体单克隆抗体(anti-CD40L mAb)(M90,IgG1)由Armitge RJ博士(Immunex Research Corp. WA)赠送;羊抗鼠IgG-FITC购自华美公司。
, 百拇医药
3.其他试剂:PHA-P、佛波醇乙酯(PMA)、钙离子导入剂(ionomycin)均为Sigma公司产品;RPMI-1640培养基、胎牛血清(FCS)、rIL-4(5×106 U/mg)均为Gibco公司产品,rIL-2(13.1×106 U/mg,TGP-3)由Takeda化学公司(Osaka,Japan)赠送,其余试剂均为国产分析纯。
4.培养基:全部培养基用RPMI-1640完全培养基,该培养基中添加有青霉素(100 U/ml)、链霉素(100 μg/ml)、谷氨酰胺(2 mmol/L)、丙酮酸钠(1 mmol/L )及FCS(10%)。
三、CD40染色
密度梯度离心法分离得脐血单个核细胞(CBMC)或成人外周血单个核细胞(PBMC),每份标本分为实验组(加入IVIG)与正常对照组(加入同体积的RPMI-1640),向24孔培养板中加入细胞悬液、rIL-4(10 ng/ml)及IVIG或RPMI-1640,置37℃、5%CO2培养箱中培养48小时后,用间接免疫荧光标记法进行染色。一抗用anti-CD40 mAb(10 μg/ml),二抗用羊抗鼠IgG-FITC(1:40),以双复孔进行,设空白阴性对照与替代阴性对照,流式细胞仪(FACScan)检测标本。
, 百拇医药
四、CD40L染色
常规方法分离出CBMC,将细胞悬液置于25 ml的细胞培养瓶中,加入PHA-P(20 μg/ml)。培养48小时后,RPMI-1640洗三次,加入rIL-2(100 U/ml)继续培养5天。用RPMI-1640洗涤后,仍置37℃、5%CO2培养箱中培养2小时。实验组与正常对照组的设置同上,向24孔细胞培养板中加入细胞悬液及IVIG或RPMI-1640后,每孔再加入PMA(20 ng/ml)及钙离子导入剂(500 ng/ml),培养16小时后,用间接免疫荧光标记法进行染色。除一抗用anti-CD40L mAb(10 μg/ml)外,余下方法同前面CD40染色一致。
五、统计学处理
全部数据以均数±标准差(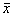 ±s)表示,采用配对t检验方法经Statistic 5.0软件分析实验数据。
±s)表示,采用配对t检验方法经Statistic 5.0软件分析实验数据。
, 百拇医药
结果
一、CD40在正常新生儿CBMC中的表达
“休止”状态下CBMC可表达CD40,其表达类似于PBMC的CD40表达。8份脐血标本及3份成人外周血标本的结果显示,CD40染色阳性细胞在CBMC及PBMC中的比例分别平均为12.93%±7.14%(范围为5.16%~22.17%)及10.18%±3.71%(范围为4.77%~12.44%)。
二、IVIG对CBMC的CD40表达无影响
将CBMC加入含rIL-4的RPMI-1640中一起孵育48小时,再观察CBMC的CD40表达。发现加入rIL-4使CBMC CD40的表达略有增加。8份脐血标本检测的CD40染色阳性细胞百分比平均为18.23%±8.98%。加入IVIG后,其百分比平均为18.11%±7.53%,两组差异无显著意义(t=0.997,P>0.05)。此外,IVIG也不改变PBMC的CD40表达,5份PBMC实验组与对照组CD40染色阳性细胞百分比的平均值分别为9.95%±3.01%(4.77%~12.44%)及15.76%±11.71%(5.76%~33.40%),两组均数间差异无显著意义(t=1.124,P>0.05)。
, 百拇医药
三、CD40L在CBMC中的表达及IVIG对表达的促进作用
采用PMA结合钙离子导入剂激活单个核细胞后,发现PBMC可表达CD40L,而CBMC不表达CD40L。PHA-P刺激48小时的CBMC,加入rIL-2继续培养5天,再经PMA及钙离子导入剂诱导16小时,则可表达一定量的CD40L。
向上述实验组中加入IVIG,以观察IVIG对CD40L表达的影响(附表)。IVIG促进了CD40L在活化后CBMC中的表达,而尽管IVIG加入后PBMC中CD40L染色阳性细胞百分比比对照组也有增高,但两组间差异无显著意义。
附表 IVIG作用前后的CD40L表达 组别
, 百拇医药
例数
CD40L表达(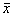 ±s,%)
±s,%)
未加IVIG
加IVIG
t值
P值
CBMC
7
13.13±4.34
28.01±10.87
-4.105
, 百拇医药
<0.01
PBMC
5
11.87±8.26
27.55±20.00
-1.490
>0.05
讨论
本实验的结果证实了“休止”及活化后的CBMC均可表达CD40,与Heldrup等[2]的结果一致(1.0%~28.0%,平均表达率12.0%)。CD40染色阳性细胞在CBMC中的百分比稍高于PBMC中的百分比;同时发现CD40染色阳性细胞在IL-4与CBMC一起孵育48小时后的表达也较“休止”状态下的稍高一些。
, http://www.100md.com
IL-4可以激活B细胞,而IVIG并不影响CD40在CBMC活化后的表达,这提示IVIG本身不影响CBMC活化后的CD40表达。本实验和先前的研究均发现,新生儿T细胞受PMA及钙离子导入剂刺激后并不表达有意义的CD40L[3,4]。在PHA诱导CBMC后,予以IL-2及PMA结合钙离子导入剂的诱导,CBMC始表达CD40L,这提示予以适当的重复刺激,新生儿T细胞可表达CD40L。或最终由于IL-2及可能的其他表面蛋白(如CD28-B7交联)的“共刺激”作用诱发了CBMC表达CD40L。
IVIG能抑制体外B细胞Ig的释放。虽然IVIG不影响活化后的脐血B细胞CD40的表达,IVIG却提高了CBMC膜表面的CD40L的表达。可能的解释是IVIG抑制B细胞Ig释放的同时,产生了针对T细胞的反馈信号,刺激了CD40L表达的增加,但在B细胞上的CD40或其他共刺激信号及有关的细胞因子缺乏配合的情况下,CD40L表达的增加并无实际的意义。支持这一推论的证据有:(1)已经发现T、B细胞一起培养时,B细胞产生的一可溶性CD40(sCD40)可以与T细胞上的CD40L结合,对T细胞CD40L的表达产生一负反馈作用[5]。尚不清楚IVIG在抑制B细胞Ig释放的同时,是否也抑制了B细胞sCD40的产生而导致T细胞上的CD40L表达增加。(2) Armitage等[6]的研究发现单独予以重组的人CD40L并不能提高B细胞Ig的释放,只有加入IL-2或IL-4才能促进B细胞的分化,而且由CD40L介导的Ig产生也需要IL-4的存在,细胞因子以正性或负性的方式调节CD40L诱发的B细胞增殖及分化。而IVIG抑制细胞因子的产生已得到相当的肯定。显然,目前对IVIG促进CBMC膜上的CD40L表达增加仍缺乏足够的认识。其生物学定义尚有待进一步研究。
, 百拇医药
参考文献
1 Toyoda M,Zhang X,Petrosian A,et al. Modulation of immunoglobulin production and cytokine mRNA expression in peripheral blood mononuclear cells by intravenous immunoglobulin. J Clin Immunol, 1994,14:178-189.
2 Heldrup J,Kalm O,Prellner K. Blood T and B lymphocyte subpopulations in healthy infants and children. Acta Paediatr, 1992,81:125-132.
3 Nonoyama S,Penix LA,Edwards CP,et al. Diminished expression of CD40 ligand and functional on activated neonatal T cells. J Clin Invest, 1995,95:66-75.
, 百拇医药
4 Durandy A,De Saint Basile G,Lisowsks-Grospierre B,et al. Undetectalble CD40 ligand expression on T cells and low B cell responses to CD40 binding agonists in human newbowns. J Immunol, 1995,154:1560-1568.
5 van Kooten C,Gaillard C,Galizzi JP,et al. B cells regulate expression of CD40 ligand on activated T cells by lowering the mRNA level and through the release of soluble CD40. Eur J Immunol, 1994,24:787-792.
6 Armitage RJ,Macduff BM,Spriggs MK,et al. Human B cell proliferation and Ig secretion induced by recombinant CD40 ligand are modulated by soluble cytokines. J Immunol, 1993,150:3671-3680., 百拇医药
单位:200092 上海第二医科大学新华医院 上海市儿科医学研究所
关键词:免疫球蛋白类;静脉内;抗原CD40;配体
中华儿科杂志/980806 【摘要】 目的 探讨静脉免疫球蛋白(IVIG)调节新生儿B细胞免疫球蛋白释放的机制。 方法 采用间接免疫荧光标记法,经流式细胞仪检测IVIG(5 mg/ml)作用后的脐血淋巴细胞及成人外周血标本的CD40与CD40配体(CD40L)的表达。结果 (1)“休止”状态下脐血单个核细胞(CBMC)可表达类似于成人外周血单个核细胞的CD40分子。(2)IVIG不改变rIL-4激活后的CBMC中CD40染色阳性细胞的百分比。(3)佛波醇乙酯及钙离子导入剂活化后的CBMC不表达CD40L。在植物血凝素诱导CBMC后,继续予以IL-2及佛波醇乙酯结合钙离子导入剂的诱导,CBMC始表达CD40L。(4)IVIG可促进活化后CBMC的CD40L表达。结论 推测IVIG抑制B细胞抗体释放的同时,产生了针对T细胞的反馈信号,刺激了CD40L表达的增加,但在B细胞上的CD40或其他共刺激信号及有关的细胞因子缺乏配合的情况下,CD40L表达的增加并无实际意义。
, 百拇医药
The effect of intravenous immunoglobulin on modulation of expressions of CD40 and CD40 ligand in neonatal lymphocyte
Li Qingsheng,Wu Shengmei,Lin Zi,et al. Xinhua Hospital of Shanghai Second Medical University, Shanghai 200092
【Abstract】 Objective To determine whether the production of immunoglobulin of neonatal B cell is inhi-bited by intravenous immunoglobulin (IVIG) through the co-stimulatory signal transduction between T and B cells. Methods The effect of IVIG (5 mg/ml) on regulating the expressions of CD40 and CD40 ligand (CD40L) in cord blood lymphocyte was examined by using indirect immunofluorescent technique with flow cytometer. Results (1) The percentage of “resting” cord blood mononuclear cell (CBMC)expressing CD40 was similar to that of adult peripheral mononuclear cell; (2) IVIG had no effect upon the number of CD+40 cells in CBMC primed by rIL-4; (3) CBMC primed with a combination of PMA and ionomycin did not express detectable levels of CD40L. CBMC began to express CD40L when CBMC was restimulated by rIL-2 and PMA combined with ionomycin after CBMC was primed with phytohemagglutinin (PHA); (4) IVIG induced an increase in the number of CD+40L cells in primed CBMC. Conclusion The authors speculated that the increased expression level of CD40L by cord blood T cells is probably due to a transductive negative signals during the inhibitory process of IVIG on the immunoglobulin production by cord blood B cells. However,in the absence of increased expression of CD40, costimulatory signals or other relevant cytokines,the increased level of CD40L expression probably has no practical significance.
, 百拇医药
【Key words】 Immunoglobulins, intravenous Antigens, CD40 Iigands
CD40分子(CD40)与CD40分子的配体(CD40L)间相互作用是导致B细胞释放免疫球蛋白(Ig)过程中的一重要环节。已有资料表明静脉免疫球蛋白(intravenous immunoglobulin,IVIG)可以抑制体外成人或新生儿B细胞Ig的产生[1], 但对IVIG调节B细胞免疫功能的确切机制仍缺乏足够的认识。作者设想IVIG是否同时影响T、B细胞间共刺激信号的传递而发挥作用?为此,在体外应用IVIG的基础上,检测了新生儿脐血淋巴细胞CD40与CD40L的表达。
资料和方法
, 百拇医药 一、脐血标本及成人外周血标本
脐血标本取自上海第二医科大学附属新华医院产房,为足月新生儿娩出时近胎盘端脐静脉血,成人外周血取自健康成年人自愿者。
二、试剂
1.IVIG溶液配制:IVIG干粉(gammgard)为Baxter Healthcare公司(CA)产品。实验前用RPMI-1640溶解IVIG并正压过滤,IVIG的终浓度为5 mg/ml。
2.抗体:抗CD40单克隆抗体(anti-CD40mAb)(M2,IgG1)、抗CD40配体单克隆抗体(anti-CD40L mAb)(M90,IgG1)由Armitge RJ博士(Immunex Research Corp. WA)赠送;羊抗鼠IgG-FITC购自华美公司。
, 百拇医药
3.其他试剂:PHA-P、佛波醇乙酯(PMA)、钙离子导入剂(ionomycin)均为Sigma公司产品;RPMI-1640培养基、胎牛血清(FCS)、rIL-4(5×106 U/mg)均为Gibco公司产品,rIL-2(13.1×106 U/mg,TGP-3)由Takeda化学公司(Osaka,Japan)赠送,其余试剂均为国产分析纯。
4.培养基:全部培养基用RPMI-1640完全培养基,该培养基中添加有青霉素(100 U/ml)、链霉素(100 μg/ml)、谷氨酰胺(2 mmol/L)、丙酮酸钠(1 mmol/L )及FCS(10%)。
三、CD40染色
密度梯度离心法分离得脐血单个核细胞(CBMC)或成人外周血单个核细胞(PBMC),每份标本分为实验组(加入IVIG)与正常对照组(加入同体积的RPMI-1640),向24孔培养板中加入细胞悬液、rIL-4(10 ng/ml)及IVIG或RPMI-1640,置37℃、5%CO2培养箱中培养48小时后,用间接免疫荧光标记法进行染色。一抗用anti-CD40 mAb(10 μg/ml),二抗用羊抗鼠IgG-FITC(1:40),以双复孔进行,设空白阴性对照与替代阴性对照,流式细胞仪(FACScan)检测标本。
, 百拇医药
四、CD40L染色
常规方法分离出CBMC,将细胞悬液置于25 ml的细胞培养瓶中,加入PHA-P(20 μg/ml)。培养48小时后,RPMI-1640洗三次,加入rIL-2(100 U/ml)继续培养5天。用RPMI-1640洗涤后,仍置37℃、5%CO2培养箱中培养2小时。实验组与正常对照组的设置同上,向24孔细胞培养板中加入细胞悬液及IVIG或RPMI-1640后,每孔再加入PMA(20 ng/ml)及钙离子导入剂(500 ng/ml),培养16小时后,用间接免疫荧光标记法进行染色。除一抗用anti-CD40L mAb(10 μg/ml)外,余下方法同前面CD40染色一致。
五、统计学处理
全部数据以均数±标准差(
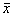 ±s)表示,采用配对t检验方法经Statistic 5.0软件分析实验数据。
±s)表示,采用配对t检验方法经Statistic 5.0软件分析实验数据。, 百拇医药
结果
一、CD40在正常新生儿CBMC中的表达
“休止”状态下CBMC可表达CD40,其表达类似于PBMC的CD40表达。8份脐血标本及3份成人外周血标本的结果显示,CD40染色阳性细胞在CBMC及PBMC中的比例分别平均为12.93%±7.14%(范围为5.16%~22.17%)及10.18%±3.71%(范围为4.77%~12.44%)。
二、IVIG对CBMC的CD40表达无影响
将CBMC加入含rIL-4的RPMI-1640中一起孵育48小时,再观察CBMC的CD40表达。发现加入rIL-4使CBMC CD40的表达略有增加。8份脐血标本检测的CD40染色阳性细胞百分比平均为18.23%±8.98%。加入IVIG后,其百分比平均为18.11%±7.53%,两组差异无显著意义(t=0.997,P>0.05)。此外,IVIG也不改变PBMC的CD40表达,5份PBMC实验组与对照组CD40染色阳性细胞百分比的平均值分别为9.95%±3.01%(4.77%~12.44%)及15.76%±11.71%(5.76%~33.40%),两组均数间差异无显著意义(t=1.124,P>0.05)。
, 百拇医药
三、CD40L在CBMC中的表达及IVIG对表达的促进作用
采用PMA结合钙离子导入剂激活单个核细胞后,发现PBMC可表达CD40L,而CBMC不表达CD40L。PHA-P刺激48小时的CBMC,加入rIL-2继续培养5天,再经PMA及钙离子导入剂诱导16小时,则可表达一定量的CD40L。
向上述实验组中加入IVIG,以观察IVIG对CD40L表达的影响(附表)。IVIG促进了CD40L在活化后CBMC中的表达,而尽管IVIG加入后PBMC中CD40L染色阳性细胞百分比比对照组也有增高,但两组间差异无显著意义。
附表 IVIG作用前后的CD40L表达 组别
, 百拇医药
例数
CD40L表达(
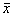 ±s,%)
±s,%)未加IVIG
加IVIG
t值
P值
CBMC
7
13.13±4.34
28.01±10.87
-4.105
, 百拇医药
<0.01
PBMC
5
11.87±8.26
27.55±20.00
-1.490
>0.05
讨论
本实验的结果证实了“休止”及活化后的CBMC均可表达CD40,与Heldrup等[2]的结果一致(1.0%~28.0%,平均表达率12.0%)。CD40染色阳性细胞在CBMC中的百分比稍高于PBMC中的百分比;同时发现CD40染色阳性细胞在IL-4与CBMC一起孵育48小时后的表达也较“休止”状态下的稍高一些。
, http://www.100md.com
IL-4可以激活B细胞,而IVIG并不影响CD40在CBMC活化后的表达,这提示IVIG本身不影响CBMC活化后的CD40表达。本实验和先前的研究均发现,新生儿T细胞受PMA及钙离子导入剂刺激后并不表达有意义的CD40L[3,4]。在PHA诱导CBMC后,予以IL-2及PMA结合钙离子导入剂的诱导,CBMC始表达CD40L,这提示予以适当的重复刺激,新生儿T细胞可表达CD40L。或最终由于IL-2及可能的其他表面蛋白(如CD28-B7交联)的“共刺激”作用诱发了CBMC表达CD40L。
IVIG能抑制体外B细胞Ig的释放。虽然IVIG不影响活化后的脐血B细胞CD40的表达,IVIG却提高了CBMC膜表面的CD40L的表达。可能的解释是IVIG抑制B细胞Ig释放的同时,产生了针对T细胞的反馈信号,刺激了CD40L表达的增加,但在B细胞上的CD40或其他共刺激信号及有关的细胞因子缺乏配合的情况下,CD40L表达的增加并无实际的意义。支持这一推论的证据有:(1)已经发现T、B细胞一起培养时,B细胞产生的一可溶性CD40(sCD40)可以与T细胞上的CD40L结合,对T细胞CD40L的表达产生一负反馈作用[5]。尚不清楚IVIG在抑制B细胞Ig释放的同时,是否也抑制了B细胞sCD40的产生而导致T细胞上的CD40L表达增加。(2) Armitage等[6]的研究发现单独予以重组的人CD40L并不能提高B细胞Ig的释放,只有加入IL-2或IL-4才能促进B细胞的分化,而且由CD40L介导的Ig产生也需要IL-4的存在,细胞因子以正性或负性的方式调节CD40L诱发的B细胞增殖及分化。而IVIG抑制细胞因子的产生已得到相当的肯定。显然,目前对IVIG促进CBMC膜上的CD40L表达增加仍缺乏足够的认识。其生物学定义尚有待进一步研究。
, 百拇医药
参考文献
1 Toyoda M,Zhang X,Petrosian A,et al. Modulation of immunoglobulin production and cytokine mRNA expression in peripheral blood mononuclear cells by intravenous immunoglobulin. J Clin Immunol, 1994,14:178-189.
2 Heldrup J,Kalm O,Prellner K. Blood T and B lymphocyte subpopulations in healthy infants and children. Acta Paediatr, 1992,81:125-132.
3 Nonoyama S,Penix LA,Edwards CP,et al. Diminished expression of CD40 ligand and functional on activated neonatal T cells. J Clin Invest, 1995,95:66-75.
, 百拇医药
4 Durandy A,De Saint Basile G,Lisowsks-Grospierre B,et al. Undetectalble CD40 ligand expression on T cells and low B cell responses to CD40 binding agonists in human newbowns. J Immunol, 1995,154:1560-1568.
5 van Kooten C,Gaillard C,Galizzi JP,et al. B cells regulate expression of CD40 ligand on activated T cells by lowering the mRNA level and through the release of soluble CD40. Eur J Immunol, 1994,24:787-792.
6 Armitage RJ,Macduff BM,Spriggs MK,et al. Human B cell proliferation and Ig secretion induced by recombinant CD40 ligand are modulated by soluble cytokines. J Immunol, 1993,150:3671-3680., 百拇医药