特发性血小板减少性紫癜患儿血小板生成素及其受体基因转录水平的研究
作者:王滔 王开颜 彭光洁 董永绥 周木想 王令仪
单位:王滔(福建省立医院,邮政编码:350001);王开颜(430030 武汉,同济医科大学附属同济医院儿科);彭光洁(430030 武汉,同济医科大学附属同济医院儿科);董永绥(430030 武汉,同济医科大学附属同济医院儿科);王令仪(430030 武汉,同济医科大学附属同济医院儿科);周木想 (美国 亚特兰大Emory 大学医学院)
关键词:紫癜;血小板减少性;特发性;血小板生成素;转录;遗传
中华儿科杂志000408 【摘要】 目的 探讨急性特发性血小板减少性紫癜(AITP)患儿血小板生成素(TPO)及血小板TPO受体c-MPL mRNA基因转录水平变化的意义。方法 采用ELISA法检测血清TPO、血小板相关抗体(PAIgG)水平;半定量RT-PCR法检测外周血血小板c-MPL mRNA的相对量。结果 AITP患儿初治时血浆TPO水平增高,血小板c-MPL mRNA较低;经大剂量甲基强的松龙冲击治疗后,伴随血小板计数增高,血清TPO水平逐渐下降,血小板c-MPL mRNA增高,且与PAIgG呈负相关。结论 血小板数可调控血清TPO水平;AITP患儿初诊时c-MPL mRNA基因转录下调,可能导致骨髓巨核细胞成熟障碍,血小板生成减少,是AITP发病的重要因素之一。
, http://www.100md.com
The level of serum thrombopoietin and its receptor mRNA in platelets in children with idiopathic thrombocytopenic purpura
WANG Tao, WANG Kaiyan, PENG Guangjie
(Department of Pediatrics, Tongji Hospital, Tongji Medical University, Wuhan 430030, China)
【Abstract】 Objective To explore the significance of serum thrombopoietin (TPO) and its receptor (c-MPL) mRNA changes in platelets in children with acute idiopathic thrombocytopenic purpura (AITP). Methods The serum TPO and platelet-associated IgG (PAIgG) were detected by ELISA. The mRNA levels of c-MPL in platelets were determined by semi-quantitative reverse transcription polymerase chain reaction (RT-PCR). Results Before treatments in chidren with ITP the serum TPO levels were mildly elevated and c-MPL mRNA levels in platelets were decreased, when compared with normal controls. After the treatment with high-does methylprednisolone, the serum TPO levels decrease gradually along with the elevation of platelets. The c-MPL mRNA levels in platelets increased with the decrease of PAIgG levels. Conclusion The platelet quantity might regulate the serum TPO level. The down-regulated transcription of c-MPL mRNA might cause maturity disturbance of megakaryocytes and decrease production of platelets, which may be one of the important factors in the pathogenesis of AITP.
, 百拇医药
【Key words】 Purpura, thrombocytopenic, idiopathic; Thrombopoietin; Transcription, genetic
急性特发性血小板减少性紫癜(AITP)为自身免疫性疾病,因病理免疫使巨核细胞成熟障碍、血小板减少。近年来发现血小板生成素(thrombopoietin,TPO)及其受体c-MPL与巨核细胞增殖分化、血小板生成密切相关[1]。我们检测了AITP患儿治疗前后TPO水平的动态变化及c-MPL mRNA转录水平,以探讨其在ITP发病中的意义。
对象和方法
一、对象
AITP患儿13例,均为初治病例,年龄2~14岁,均符合文献所报道的诊断标准[2]。采用大剂量甲基强的松龙(每日20~30 mg/kg)冲击治疗5 d后,改为泼尼松(每日1~1.5 mg/kg)口服。分别于治疗前、治疗后第5 及第10天抽取外周静脉血进行检测;正常对照20例为2~14岁的健康儿童。
, http://www.100md.com
二、方法
1.血清TPO水平检测:采用ELISA法。TPO检测试剂盒由美国 Systems Inc公司生产,检测方法参照试剂盒说明书,其单位为pg/ml。
2. 外周血血小板c-MPL mRNA水平检测:采用半定量RT-PCR法。美国Biotecs laboratories Inc公司Ultraspec RNA提取试剂盒,用于扩增受体c-MPL cDNA引物,由美国Emory University Microchemical Facility合成,序列为:上游5′-TGGAGATGCAGTGG-CACTTG-3′;下游3′-TGATGTCTGGGGTGTCAAGA-3′,扩增产物为187 bp。
采用经典的PCR产物定量标准β-actin作为内参照[3],β-actinc DNA的引物序列为上游5′-GTGGGG-CGCCCCAGGCACCA-3′;下游5′-GTCCTTAATGTCAC-GCACGATTTC-3′,扩增产物为530 bp。因为血小板内的β-actin相对稳定,故在同一反应体系中加入两对引物,用凝胶成像分析系统对PCR产物进行分析,比较同一泳道两条产物(c-MPL与β-actin)之间的密度强弱,即以每份样品中c-MPL mRNA相对于β-actin的量(c-MPL mRNA/β-actin)作为定量标准。
, 百拇医药
3.血小板表面血小板相关抗体IgG(platelet-associated immunoglobulin G ,PAIgG)检测:采用ABC-ELISA法,其单位为ng/107 PLT(每107的血小板含多少ng)。
三、统计学方法
采用配对资料t检验、随机区组F检验和直线相关分析。
结果
一、AITP患儿糖皮质激素治疗前后血清TPO和血小板表面PAIgG水平
表1显示,AITP患儿治疗前与正常对照组比较血清TPO增高,差异有显著性(P<0.05);治疗后第5天,当血小板数明显增高时,TPO下降,与正常对照组比较,差异无显著性(P>0.05);治疗后第10天,血小板数有所下降时,TPO水平又增高,与正常对照组比较,差异有显著性(P<0.05)。
, http://www.100md.com
表1 AITP治疗前后PLT、PAIgG和
血清TPO水平的变化(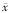 ±s) 组别
±s) 组别
例数
PLT
(×109/L)
PAIgG
(ng/107 PLT)
TPO
(ng/L)
正常对照组
, http://www.100md.com
20
192±54
37±21
62±23
AITP组
治疗前
13
40±20
453±133
82±23*
治疗后
第5天
13
, 百拇医药
184±109
124±66
60±26**
第10天
10
133±62
73±41
94±44△
注:* AITP治疗前与正常对照组的均数t检验,t=2.25, P<0.05;
**AITP治疗前与治疗后第5天配对比较,t=2.01,P>0.05;△ AITP治疗后第10天与治疗前均数t检验,t=2.68 P<0.05
, 百拇医药
二、AITP患儿血小板c-MPL mRNA水平
通过凝胶成像分析系统对8例ITP患儿治疗前后血小板PCR产物进行分析,结果如表2所示:AITP患儿治疗前血小板c-MPL mRNA相对量为0.89±0.07,糖皮质激素治疗后第5天和第10天分别为1.01±0.11和1.57±0.34。治疗前后血小板c-MPL mRNA水平差异有显著性(P<0.05)。
三、AITP患儿血清TPO与血小板数、PAIgG的关系
表1显示,TPO水平与血小板数呈负相关(r=-0.649 7,P<0.01),与PAIgG无相关性。
四、AITP患儿血小板c-MPL mRNA水平与血小板数、PAIgG和TPO的关系
表2显示,血小板c-MPL mRNA与PAIgG呈负相关(r=-0.541 4 P<0.01),而与血小板数、血清TPO无相关性。
, 百拇医药
表2 8例AITP患儿治疗前后PLT、PAIgG、血清TPO及c-MPL mRNA水平的变化(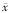 ±s) 时间
±s) 时间
PLT(×109/L)
PAIgG(ng/107PLT)
TPO(ng/L)
c-MPL mRNA
治疗前
38±23
477±58
81±17
, 百拇医药
0.89±0.07
治疗后
第5天
133±83
151±75
66±27
1.01±0.11*
第10天
126±58
74±49
101±47
1.57±0.34**△
, 百拇医药
注:* AITP治疗后第5天与治疗前的随机区组F检验,q=3.37 P>0.05;** 治疗后第10天与治疗前F检验,q=11.6,P<0.01; △ 治疗后第10天与治疗后第5天F检验,q=8.22 ,P<0.01
讨论
TPO是巨核细胞系特有的造血生长因子,具有刺激巨核祖细胞增殖、分化、成熟和促进血小板形成等作用[1]。主要由肝细胞、骨髓基质细胞、肾近曲和远曲小管细胞合成,释放入血,作用于靶细胞而发挥生理效应。TPO通过靶细胞膜的特异性受体c-MPL介导的细胞吞噬作用而摄入到靶细胞内,被胞内的凝血酶降解而失活。目前认为机体调节TPO的机制有两种:(1)受循环中血小板数调控。(2)TPO浓度在基因水平受反馈调节,血小板减少症动物模型其骨髓和脾脏TPO转录明显增高[4]。另有学者发现,转录因子Ets家族中的E4TF1/GABP可能调控TPO转录[5]。
, 百拇医药
Sakamaki等[6]发现ITP患者骨髓基质细胞TPO转录明显增强,是正常对照的1~2倍,经治疗后其水平恢复正常。提示ITP急性期机体合成TPO明显增强。Chang等[7]制作的鼠ITP和再生障碍性贫血(简称再障)动物模型,用 125 I标记的TPO静脉注射,发现ITP鼠较再障鼠血小板体积增大,且血小板摄取TPO的量增加。我们对AITP患儿血清TPO水平检测的结果显示,血小板数较低时,TPO增高;当激素冲击治疗第5天,血小板数明显增加时,TPO下降至正常水平。当改为口服激素于第10天,血小板数有所下降时,TPO水平又增高,两者呈负相关。提示血小板数是调控血清TPO水平的重要因素之一。
c-MPL是TPO的受体,特异表达于巨核细胞-血小板系。Methia等[8]发现于CD+34细胞培养体系中加入c-MPL反义寡核苷酸片段使其mRNA水平明显下降,CD+34的早期红系祖细胞(BFU-E)和粒单系祖细胞(CFU-GM)的集落形成率无明显影响,而巨核系祖细胞(CFU-MK)的集落形成率明显下降。Gurney等[9]还发现c-MPL基因缺失的小鼠其血小板比正常小鼠下降85%,而其他细胞无变化。以上研究说明,在基因水平c-MPL直接参与调节巨核细胞的增殖、分化、成熟以及血小板的形成。我们检测的外周血血小板c-MPL mRNA水平显示,治疗前AITP患儿c-MPL mRNA水平较低,经治疗后c-MPL mRNA水平逐渐增高,且与PAIgG呈负相关。提示治疗前患儿c-MPL mRNA转录下调,推测可能是骨髓巨核细胞成熟障碍的重要因素之一。但PAIgG是否为c-MPL mRNA转录影响因素尚有待进一步探讨。
, http://www.100md.com
ITP为自身免疫性疾病。一般认为,小儿AITP是病毒感染后导致机体产生抗血小板抗体,并形成免疫复合物,使血小板易于受单核-巨噬细胞系统破坏,且抗体也可影响巨核细胞成熟障碍,但其详细发病机制尚未完全清楚。本研究提示,AITP患儿可能由于致病因素使血小板表面的PAIgG升高,血小板c-MPL mRNA转录下调,血清TPO升高,血小板数减少,出现临床症状。经糖皮质激素治疗后,PAIgG水平下降,血小板破坏减少,同时c-MPL mRNA转录上调,血小板数上升。后者通过反馈调节作用,使TPO水平恢复正常。因此,巨核细胞c-MPL mRNA 水平降低及TPO水平异常,可能在ITP发病中有重要作用,至于其在临床上的意义尚需进一步研究。
参考文献
1,Wending F,Marakskovsky E,Debili N,et al.c-MPL ligand is a humoral regulator of megakaryocytopoiesis.Nature,1994,369:571-574.
, 百拇医药
2,张之南,主编.血液病诊断及疗效标准.第二版.北京:科学技术出版社,1998.279-280.
3,Mouce K,Sugiyama H,Ogawa H,et al.Expression of the interleukin-(IL-6),IL-6 receptor and gp130 genes in acute leukemia.Blood,1994,84:2672-2680.
4,McCarty JM,Sprugel KII,Fox NE.Murine thrombopoietin mRNA levels are modulated by platelet count.Blood, 1995,86:3668-3675.
5,Kamura T,Handa H,Hamasaki N,et al.Characterization of the human thrombopoietin gene promoter: a possible role of an Ets transcription factor. E4TF1/GABP.J Biol Chem,1997,272:11361-11368.
, http://www.100md.com
6,Sakamaki S,Hirayama Y,Matsunaga T,et al.TGF-beta induces thrombopoietin from bone marrow stromal cells which stimulates the expression of TGF-beta receptor on megakaryocytes and, in turn, renders them susceptible to suppression by TGF-beta itself with high specificity. Blood,1997,90,Suppl:141a.
7,Chang FY,Lones M,Buzby JS,et al.Higher uptake and degradation of thrombopoietin(TPO) by MPL+ megakaryocytes(MK) and platelets(PLT) in immune thrombocytopenic compared to irradiated thrombocytopenic mice: significant correlation to circulating TPO levels.Blood,1997,90 Suppl:140a.
, 百拇医药
8,Methia N,Fawzia L,Vainchenker W,et al.Oligodeoxynucleotides antisense to the proto-oncogene c-MPL specifically inhibit in vitro megakaryocytopoiesis. Blood,1993,82:1395-1401.
9,Gurney AL,Carver-Moore K,de Sauvage FJ,et al.Thrombocytopenia in c-MPL-deficient mice.Science,1994, 265:1445-1447.
(收稿日期:1999-06-04), http://www.100md.com
单位:王滔(福建省立医院,邮政编码:350001);王开颜(430030 武汉,同济医科大学附属同济医院儿科);彭光洁(430030 武汉,同济医科大学附属同济医院儿科);董永绥(430030 武汉,同济医科大学附属同济医院儿科);王令仪(430030 武汉,同济医科大学附属同济医院儿科);周木想 (美国 亚特兰大Emory 大学医学院)
关键词:紫癜;血小板减少性;特发性;血小板生成素;转录;遗传
中华儿科杂志000408 【摘要】 目的 探讨急性特发性血小板减少性紫癜(AITP)患儿血小板生成素(TPO)及血小板TPO受体c-MPL mRNA基因转录水平变化的意义。方法 采用ELISA法检测血清TPO、血小板相关抗体(PAIgG)水平;半定量RT-PCR法检测外周血血小板c-MPL mRNA的相对量。结果 AITP患儿初治时血浆TPO水平增高,血小板c-MPL mRNA较低;经大剂量甲基强的松龙冲击治疗后,伴随血小板计数增高,血清TPO水平逐渐下降,血小板c-MPL mRNA增高,且与PAIgG呈负相关。结论 血小板数可调控血清TPO水平;AITP患儿初诊时c-MPL mRNA基因转录下调,可能导致骨髓巨核细胞成熟障碍,血小板生成减少,是AITP发病的重要因素之一。
, http://www.100md.com
The level of serum thrombopoietin and its receptor mRNA in platelets in children with idiopathic thrombocytopenic purpura
WANG Tao, WANG Kaiyan, PENG Guangjie
(Department of Pediatrics, Tongji Hospital, Tongji Medical University, Wuhan 430030, China)
【Abstract】 Objective To explore the significance of serum thrombopoietin (TPO) and its receptor (c-MPL) mRNA changes in platelets in children with acute idiopathic thrombocytopenic purpura (AITP). Methods The serum TPO and platelet-associated IgG (PAIgG) were detected by ELISA. The mRNA levels of c-MPL in platelets were determined by semi-quantitative reverse transcription polymerase chain reaction (RT-PCR). Results Before treatments in chidren with ITP the serum TPO levels were mildly elevated and c-MPL mRNA levels in platelets were decreased, when compared with normal controls. After the treatment with high-does methylprednisolone, the serum TPO levels decrease gradually along with the elevation of platelets. The c-MPL mRNA levels in platelets increased with the decrease of PAIgG levels. Conclusion The platelet quantity might regulate the serum TPO level. The down-regulated transcription of c-MPL mRNA might cause maturity disturbance of megakaryocytes and decrease production of platelets, which may be one of the important factors in the pathogenesis of AITP.
, 百拇医药
【Key words】 Purpura, thrombocytopenic, idiopathic; Thrombopoietin; Transcription, genetic
急性特发性血小板减少性紫癜(AITP)为自身免疫性疾病,因病理免疫使巨核细胞成熟障碍、血小板减少。近年来发现血小板生成素(thrombopoietin,TPO)及其受体c-MPL与巨核细胞增殖分化、血小板生成密切相关[1]。我们检测了AITP患儿治疗前后TPO水平的动态变化及c-MPL mRNA转录水平,以探讨其在ITP发病中的意义。
对象和方法
一、对象
AITP患儿13例,均为初治病例,年龄2~14岁,均符合文献所报道的诊断标准[2]。采用大剂量甲基强的松龙(每日20~30 mg/kg)冲击治疗5 d后,改为泼尼松(每日1~1.5 mg/kg)口服。分别于治疗前、治疗后第5 及第10天抽取外周静脉血进行检测;正常对照20例为2~14岁的健康儿童。
, http://www.100md.com
二、方法
1.血清TPO水平检测:采用ELISA法。TPO检测试剂盒由美国 Systems Inc公司生产,检测方法参照试剂盒说明书,其单位为pg/ml。
2. 外周血血小板c-MPL mRNA水平检测:采用半定量RT-PCR法。美国Biotecs laboratories Inc公司Ultraspec RNA提取试剂盒,用于扩增受体c-MPL cDNA引物,由美国Emory University Microchemical Facility合成,序列为:上游5′-TGGAGATGCAGTGG-CACTTG-3′;下游3′-TGATGTCTGGGGTGTCAAGA-3′,扩增产物为187 bp。
采用经典的PCR产物定量标准β-actin作为内参照[3],β-actinc DNA的引物序列为上游5′-GTGGGG-CGCCCCAGGCACCA-3′;下游5′-GTCCTTAATGTCAC-GCACGATTTC-3′,扩增产物为530 bp。因为血小板内的β-actin相对稳定,故在同一反应体系中加入两对引物,用凝胶成像分析系统对PCR产物进行分析,比较同一泳道两条产物(c-MPL与β-actin)之间的密度强弱,即以每份样品中c-MPL mRNA相对于β-actin的量(c-MPL mRNA/β-actin)作为定量标准。
, 百拇医药
3.血小板表面血小板相关抗体IgG(platelet-associated immunoglobulin G ,PAIgG)检测:采用ABC-ELISA法,其单位为ng/107 PLT(每107的血小板含多少ng)。
三、统计学方法
采用配对资料t检验、随机区组F检验和直线相关分析。
结果
一、AITP患儿糖皮质激素治疗前后血清TPO和血小板表面PAIgG水平
表1显示,AITP患儿治疗前与正常对照组比较血清TPO增高,差异有显著性(P<0.05);治疗后第5天,当血小板数明显增高时,TPO下降,与正常对照组比较,差异无显著性(P>0.05);治疗后第10天,血小板数有所下降时,TPO水平又增高,与正常对照组比较,差异有显著性(P<0.05)。
, http://www.100md.com
表1 AITP治疗前后PLT、PAIgG和
血清TPO水平的变化(
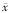 ±s) 组别
±s) 组别例数
PLT
(×109/L)
PAIgG
(ng/107 PLT)
TPO
(ng/L)
正常对照组
, http://www.100md.com
20
192±54
37±21
62±23
AITP组
治疗前
13
40±20
453±133
82±23*
治疗后
第5天
13
, 百拇医药
184±109
124±66
60±26**
第10天
10
133±62
73±41
94±44△
注:* AITP治疗前与正常对照组的均数t检验,t=2.25, P<0.05;
**AITP治疗前与治疗后第5天配对比较,t=2.01,P>0.05;△ AITP治疗后第10天与治疗前均数t检验,t=2.68 P<0.05
, 百拇医药
二、AITP患儿血小板c-MPL mRNA水平
通过凝胶成像分析系统对8例ITP患儿治疗前后血小板PCR产物进行分析,结果如表2所示:AITP患儿治疗前血小板c-MPL mRNA相对量为0.89±0.07,糖皮质激素治疗后第5天和第10天分别为1.01±0.11和1.57±0.34。治疗前后血小板c-MPL mRNA水平差异有显著性(P<0.05)。
三、AITP患儿血清TPO与血小板数、PAIgG的关系
表1显示,TPO水平与血小板数呈负相关(r=-0.649 7,P<0.01),与PAIgG无相关性。
四、AITP患儿血小板c-MPL mRNA水平与血小板数、PAIgG和TPO的关系
表2显示,血小板c-MPL mRNA与PAIgG呈负相关(r=-0.541 4 P<0.01),而与血小板数、血清TPO无相关性。
, 百拇医药
表2 8例AITP患儿治疗前后PLT、PAIgG、血清TPO及c-MPL mRNA水平的变化(
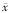 ±s) 时间
±s) 时间PLT(×109/L)
PAIgG(ng/107PLT)
TPO(ng/L)
c-MPL mRNA
治疗前
38±23
477±58
81±17
, 百拇医药
0.89±0.07
治疗后
第5天
133±83
151±75
66±27
1.01±0.11*
第10天
126±58
74±49
101±47
1.57±0.34**△
, 百拇医药
注:* AITP治疗后第5天与治疗前的随机区组F检验,q=3.37 P>0.05;** 治疗后第10天与治疗前F检验,q=11.6,P<0.01; △ 治疗后第10天与治疗后第5天F检验,q=8.22 ,P<0.01
讨论
TPO是巨核细胞系特有的造血生长因子,具有刺激巨核祖细胞增殖、分化、成熟和促进血小板形成等作用[1]。主要由肝细胞、骨髓基质细胞、肾近曲和远曲小管细胞合成,释放入血,作用于靶细胞而发挥生理效应。TPO通过靶细胞膜的特异性受体c-MPL介导的细胞吞噬作用而摄入到靶细胞内,被胞内的凝血酶降解而失活。目前认为机体调节TPO的机制有两种:(1)受循环中血小板数调控。(2)TPO浓度在基因水平受反馈调节,血小板减少症动物模型其骨髓和脾脏TPO转录明显增高[4]。另有学者发现,转录因子Ets家族中的E4TF1/GABP可能调控TPO转录[5]。
, 百拇医药
Sakamaki等[6]发现ITP患者骨髓基质细胞TPO转录明显增强,是正常对照的1~2倍,经治疗后其水平恢复正常。提示ITP急性期机体合成TPO明显增强。Chang等[7]制作的鼠ITP和再生障碍性贫血(简称再障)动物模型,用 125 I标记的TPO静脉注射,发现ITP鼠较再障鼠血小板体积增大,且血小板摄取TPO的量增加。我们对AITP患儿血清TPO水平检测的结果显示,血小板数较低时,TPO增高;当激素冲击治疗第5天,血小板数明显增加时,TPO下降至正常水平。当改为口服激素于第10天,血小板数有所下降时,TPO水平又增高,两者呈负相关。提示血小板数是调控血清TPO水平的重要因素之一。
c-MPL是TPO的受体,特异表达于巨核细胞-血小板系。Methia等[8]发现于CD+34细胞培养体系中加入c-MPL反义寡核苷酸片段使其mRNA水平明显下降,CD+34的早期红系祖细胞(BFU-E)和粒单系祖细胞(CFU-GM)的集落形成率无明显影响,而巨核系祖细胞(CFU-MK)的集落形成率明显下降。Gurney等[9]还发现c-MPL基因缺失的小鼠其血小板比正常小鼠下降85%,而其他细胞无变化。以上研究说明,在基因水平c-MPL直接参与调节巨核细胞的增殖、分化、成熟以及血小板的形成。我们检测的外周血血小板c-MPL mRNA水平显示,治疗前AITP患儿c-MPL mRNA水平较低,经治疗后c-MPL mRNA水平逐渐增高,且与PAIgG呈负相关。提示治疗前患儿c-MPL mRNA转录下调,推测可能是骨髓巨核细胞成熟障碍的重要因素之一。但PAIgG是否为c-MPL mRNA转录影响因素尚有待进一步探讨。
, http://www.100md.com
ITP为自身免疫性疾病。一般认为,小儿AITP是病毒感染后导致机体产生抗血小板抗体,并形成免疫复合物,使血小板易于受单核-巨噬细胞系统破坏,且抗体也可影响巨核细胞成熟障碍,但其详细发病机制尚未完全清楚。本研究提示,AITP患儿可能由于致病因素使血小板表面的PAIgG升高,血小板c-MPL mRNA转录下调,血清TPO升高,血小板数减少,出现临床症状。经糖皮质激素治疗后,PAIgG水平下降,血小板破坏减少,同时c-MPL mRNA转录上调,血小板数上升。后者通过反馈调节作用,使TPO水平恢复正常。因此,巨核细胞c-MPL mRNA 水平降低及TPO水平异常,可能在ITP发病中有重要作用,至于其在临床上的意义尚需进一步研究。
参考文献
1,Wending F,Marakskovsky E,Debili N,et al.c-MPL ligand is a humoral regulator of megakaryocytopoiesis.Nature,1994,369:571-574.
, 百拇医药
2,张之南,主编.血液病诊断及疗效标准.第二版.北京:科学技术出版社,1998.279-280.
3,Mouce K,Sugiyama H,Ogawa H,et al.Expression of the interleukin-(IL-6),IL-6 receptor and gp130 genes in acute leukemia.Blood,1994,84:2672-2680.
4,McCarty JM,Sprugel KII,Fox NE.Murine thrombopoietin mRNA levels are modulated by platelet count.Blood, 1995,86:3668-3675.
5,Kamura T,Handa H,Hamasaki N,et al.Characterization of the human thrombopoietin gene promoter: a possible role of an Ets transcription factor. E4TF1/GABP.J Biol Chem,1997,272:11361-11368.
, http://www.100md.com
6,Sakamaki S,Hirayama Y,Matsunaga T,et al.TGF-beta induces thrombopoietin from bone marrow stromal cells which stimulates the expression of TGF-beta receptor on megakaryocytes and, in turn, renders them susceptible to suppression by TGF-beta itself with high specificity. Blood,1997,90,Suppl:141a.
7,Chang FY,Lones M,Buzby JS,et al.Higher uptake and degradation of thrombopoietin(TPO) by MPL+ megakaryocytes(MK) and platelets(PLT) in immune thrombocytopenic compared to irradiated thrombocytopenic mice: significant correlation to circulating TPO levels.Blood,1997,90 Suppl:140a.
, 百拇医药
8,Methia N,Fawzia L,Vainchenker W,et al.Oligodeoxynucleotides antisense to the proto-oncogene c-MPL specifically inhibit in vitro megakaryocytopoiesis. Blood,1993,82:1395-1401.
9,Gurney AL,Carver-Moore K,de Sauvage FJ,et al.Thrombocytopenia in c-MPL-deficient mice.Science,1994, 265:1445-1447.
(收稿日期:1999-06-04), http://www.100md.com