重组人类肥胖抑素在大肠杆菌中的大规模纯化
作者:许婉宁 丁宗一 杜丽蓉 唐建国
单位:许婉宁(100045 北京儿科研究所营养室);丁宗一(100045 北京儿科研究所营养室);杜丽蓉(100045 北京儿科研究所营养室);唐建国(北京大学生命科学学院)
关键词:重组蛋白质类;分离和提纯;大肠杆菌
中华儿科杂志000608 【摘要】 目的 探讨产率较高,高度纯化大肠杆菌表达重组肥胖抑素的方法,深入研究肥胖抑素的分子结构,生物活性及临床应用,对在大肠杆菌中表达的重组人类肥胖抑素进行纯化。方法 温度诱导表达携有人类肥胖基因(ob)片段的大肠杆菌重组子,采用酸沉淀结合凝胶过滤层析的方法从包涵体中纯化目的蛋白。结果 1周内从3 L培养液(10 g)湿菌体中可获得70 mg高度纯化的重组人类肥胖抑素。结论 在短期内成功获得了高产高纯化的重组人类肥胖抑素,为肥胖抑素的产业化及临床应用奠定了基础。
, 百拇医药
Large -scale purification of recombinant human leptin from recombinant E.Coli
XU Wanning, DING Zongyi, DU Lirong, et al.
Department of Nutrition, Beijing Research Institute of Pediatrics, Beijing 100045, China
【Abstract】 Objective To purify recombinant human leptin from E.Coli for investigating its characteristics, biological activity and clinical application. Methods The E.Coli DH5 α cells transfected with recombinant pBV220-OB, a human obese gene. The expressed protein found in the inclusion bodies was purified by using acid precipitation and chromatography. Results Seventy milligrams of leptin with a high purity was prepared from 3 liter E.Coli culture media (10 grams of cells) within a week. Conclusion Large quantity of highly purified human leptin could be succesfully and rapidly prepared; it will hasten investigation of its production and clinical application.
, 百拇医药
【Key words】 Recombinant proteins; Isolation purification; Escherichia Coli
肥胖抑素是由肥胖基因(ob)编码的重要的体重调控因子。实验证明体外重组的肥胖抑素可以使内源性肥胖抑素缺乏的突变系C57BL/6J ob/ob 小鼠及各种原因导致的获得性肥胖鼠减少摄食和减重[1-5]。最近报道已有10种哺乳动物的肥胖基因序列被初步证实[6]。然而到目前为止仅获得了小鼠及人类的肥胖基因蛋白产物[4,7],肥胖抑素对于人类肥胖的减重效果也尚未被证明。部分原因是由于大量获得纯化的肥胖抑素比较困难,因此阻碍了对其分子结构及临床效果的进一步研究。目前已有关于大量纯化外源重组肥胖抑素的报道[8,9],但其所需条件要求较高。本研究旨在提供一种高度纯化大肠杆菌表达重组肥胖抑素的方法,产率较高且生物活性与目前报道的重组肥胖抑素类似,方法也简单易行,技术设备要求不高,有利于进一步研究肥胖抑素的结构特性及其在肥胖发生中的作用机制,并为其产业化和临床应用提供关键技术。
, http://www.100md.com
材料与方法
一、实验材料及仪器设备
1. 材料:携有重组表达质粒pBV220-ob的大肠杆菌DH5α重组子[1]。
2.试剂: 丙烯酰胺,N,N′-甲叉双丙烯酰胺,四甲基乙二胺(TEMED)为Boehringer Mannheim 公司产品。十二烷基硫酸钠(SDS)为德国Serva公司产品。胰蛋白胨(Tryptone) 及酵母提取物(Yeast extract) 为英国OXOID公司产品。蛋白质相对分子质量标准: 94×103, 67×103, 43×103, 30×103, 21×103,14.4×103 。
3.仪器: 大型恒温摇床,高速冷冻离心机,旋转真空干燥仪,普通电泳装置,葡聚糖凝胶Sephadex G-75过滤层析系统,超声波细胞粉碎机,分光光度计,紫外薄层扫描仪。
, 百拇医药
二、实验方法
1.重组肥胖抑素在大肠杆菌中的表达: 选取转化的单菌落置于3 ml 2-YT(Amp+)培养液中,37℃振荡培养12 h,转移至300 ml 2-YT(Amp+)培养液中32℃振荡培养过夜。次日上午以1∶10稀释,32℃培养2~3 h,42℃诱导5~6 h,7 000 r/min离心收获菌体,直接进行分离纯化或冻存于-20℃备用。同时取少量表达产物进行全蛋白15%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
2.表达产物的后加工:以4倍体积的菌体裂解液STET[8%蔗糖, 10 mmol/L Tris-HCl, 1 mmol/L 依地酸(EDTA), 5%TritonX-100, pH值 8.0]悬浮菌体,冰浴条件下超声破碎菌体,工作时间15 s,间隔时间10 s,循环8次。离心收集沉淀同上条件超声破碎1次。离心收集沉淀加入4倍体积的包涵体裂解液[0.1 mol/L 的Tris-HCl, 8 mol/L 的尿素, 1 mmol/L 的二硫苏糖醇(DTT), pH 8.0], 4℃裂解12 h。离心收集上清加入10 mmol/L 的DTT,37℃保温1 h。加入5倍预冷水稀释,用盐酸调pH值4~5,出现大量白色沉淀。4℃静置1~2 h。离心收集沉淀加入40 ml预冷水悬浮,用2 mol/L氢氧化钠调pH值11~12,沉淀完全溶解后加入到10倍体积的0.05 mol/L甘氨酸-氢氧化钠缓冲液(pH值 10.8)中稀释,4℃条件下重组12~24 h。
, 百拇医药
3. 葡聚糖凝胶Sephadex G-75过滤层析:将重组液超滤浓缩至20~30 ml, 离心收集上清上凝胶柱。0.05 mol/L甘氨酸-氢氧化钠缓冲液(pH值 10.8)洗脱,收集特异性蛋白峰,超滤脱盐后冷冻干燥。采用紫外吸收法检测纯化产物的纯度及定量。
4.电泳分析及紫外薄层扫描分析:采用15%SDS-PAGE 电泳分析重组蛋白的纯化过程,同时用聚丙烯酰胺凝胶电泳(Native-PAGE)对纯化蛋白进行纯度鉴定。SDS-PAGE凝胶经考马亮兰染色后,利用紫外薄层扫描分析目的蛋白的表达率及纯化效果。
结果
一、重组表达质粒在大肠杆菌中的表达
携有人类肥胖基因的重组表达质粒pBV220-ob转化大肠杆菌DH5α的转化子细胞经培养诱导后,进行SDS-PAGE凝胶电泳分析,结果显示出现了一条不含ob基因片段的空白质粒pBV220的转化子所缺乏的电泳带,其相对分子质量与文献报道的重组肥胖抑素一致(图1)。说明本实验中的重组子细胞表达了其质粒中携带的肥胖基因。紫外薄层扫描显示目的蛋白的表达量占菌体细胞总蛋白量的30%~40%,表达效率较高。
, http://www.100md.com
A: 相对分子质量标准;B: 冻干纯品蛋白;C: 柱层析洗脱目的峰蛋白;D:超滤上清;E:酸沉淀蛋白;F: 包涵体蛋白;G: pBV-220空白质粒;H:菌体表达全蛋白。图中数字为相对分子质量
图1 SDS-PAGE电泳
二、表达产物的分离纯化
重组表达产物在细胞中主要以包涵体形式存在。摇瓶培养后收集菌体, 3 L培养液可以得到湿菌体10 g。超声破碎细胞后,对包涵体进行裂解及初步纯化,经酸沉淀后可以除去大部分菌体蛋白及杂蛋白,而所需目的蛋白损失不大(图1、2);凝胶过滤层析之前的超滤上清经紫外薄层扫描检测其目的蛋白含量已达到 89%。将超滤上清液通过葡聚糖凝胶Sephadex G-75柱层析分离,可收集到三个洗脱峰,经电泳检测第三峰为目的蛋白峰(重组肥胖抑素峰)(图3)。将目的蛋白峰收集的洗脱液及冻干后的蛋白分别进行SDS-PAGE及Native-PAGE凝胶电泳,均可显示高纯度的蛋白条带(图1、2),紫外薄层扫描目的蛋白含量可达98%。在酸沉淀的过程中蛋白质易脱酰胺,以致多带一个负电荷,故在Native-PAGE电泳图谱中目的蛋白条带下方有时可见一条泳动率稍快的浅带,但这并不影响纯化蛋白的生物活性。本方法摇瓶所得10 g(3 L)湿菌体可得到纯品蛋白70 mg,其紫外吸光度 A280/A260值(曾称光度 OD)为1.7~2.0,表明其产率及纯度均高。具体纯化过程见表1。
, 百拇医药
1:超滤上清;2~7:冻干纯品蛋白
图2 Native-PAGE电泳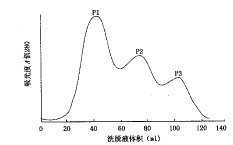
图3 葡聚糖凝胶Sephadex G-75 柱层析
表1 重组表达蛋白的纯化过程 纯化步骤
蛋白含量(mg)
回收率(%)
包涵体裂解液
727.59
100
酸沉淀
, 百拇医药
518.27
71.23
超滤上清
204.18
28.06
柱层析
70
9.62
讨论
肥胖抑素是由肥胖基因编码的蛋白产物,由于P1、P2为杂蛋白洗脱峰,P3为纯化目的蛋白峰。洗脱缓冲液为0.05 mol/L的甘氨酸-氢氧化钠(pH值 10.8),上样量10 ml,流速15 ml/h,每管收集2 ml。其在体重调控方面的重要作用日益受到关注。肥胖抑素在由脂肪细胞分泌入血的过程中失去N端信号肽而生成147个氨基酸的蛋白质,相对分子质量约为16×103。实验证明体外重组的肥胖抑素通过抑制下丘脑神经肽Y的分泌从而减少遗传性和获得性肥胖小鼠的摄食及体重,这种生理功能使得重组肥胖抑素具有极其重要的临床应用价值。研究者预测:和应用胰岛素治疗糖尿病类似,对于遗传性肥胖患者和某些缺乏具有生物活性的内源性肥胖抑素的患者,应用体外重组肥胖抑素进行替代疗法应是行之有效的方法。然而必须在获得大量高度纯化的重组肥胖抑素后,才能对其生物活性和生理功能进行深入研究,以期尽快进行临床药理和药效的试验。
, http://www.100md.com
目前大多数有关肥胖抑素生物功能的研究是应用小鼠或人类肥胖基因cDNA重组质粒在大肠杆菌中表达的蛋白产物。这些重组表达蛋白通常以包涵体的形式存在,在纯化过程中需要进行多肽链的重折叠。国外曾有关于从大肠杆菌包涵体中纯化重组肥胖抑素及其生物活性的报道[2,3,7,10],但其纯化过程复杂并且均未报道产量,同时在比较各研究组的纯化产物时发现,不同方法获得的重组蛋白其生物活性存在差别[1-5,7,10]。近年来研究者已应用免疫亲和纯化法从人类血浆中获得了天然肥胖抑素,并且证明其分子量与大肠杆菌表达的蛋白相同[11],这提示重组蛋白生物活性的降低可能是由于纯化过程中重折叠异常所致。然而从人类血浆中获得的肥胖抑素并不足以进行详细的分子结构和生物活性分析,故对于不同纯化产物活性差异的分子基础尚不十分清楚。肥胖抑素通过调节饮食摄入和能量消耗从而调节体重的生物功能需要在不同物种及各种肥胖模型中进行证明,仅仅对于小鼠的观察并不能广泛适用于包括人类在内的其他动物,这对于肥胖抑素的临床应用是很大的障碍。目前应用免疫亲和层析法从人类血浆中获得的肥胖抑素尚不足以对大型动物进行此类研究,因此提高纯化重组蛋白的产量是进一步研究肥胖抑素的结构特性以及临床应用的关键。
, 百拇医药
在两组纯化从大肠杆菌分泌入培养介质的重组蛋白的报道中,Altmann 等[7]在纯化前每升培养液仅获得3 mg分泌蛋白,而Rentsch 等[10]每升培养液也仅获得0.5~1 mg纯化蛋白。Weigle 等[5]研究表明从BHK细胞中分泌的重组肥胖抑素生物活性较大肠杆菌表达产物高,然而该实验中分泌蛋白并未纯化且重组过程复杂。目前已有Fawzi等[8]和Arieh 等[9]报道了大量纯化重组肥胖抑素的方法,但其成本和条件要求较高,结合本工作组的特点及国内的生产条件,我们采用了酸沉淀和凝胶柱层析的方法,在短时间内(1周)获得了高度纯化的重组肥胖抑素,10 g湿菌体可获得纯品蛋白70 mg,较本工作组曾采用过的硫酸铵盐析的纯化方法大大提高了产率,而且更加简便易行,对设备要求不高。体内天然肥胖抑素以单体形式存在,而文献报道许多纯化方法易导致二聚体或多聚体形成,经电泳检测本方法所得纯化蛋白仅形成极微量的二聚体,基本上以单体形式存在,从而有利于保持天然蛋白的活性。
, http://www.100md.com
本方法可获得大量纯化重组蛋白,使进行大型动物实验成为可能,并有利于进一步深入探讨肥胖抑素的结构特性。同时利用菌体的发酵表达和大型柱层析系统相结合,可在生产中获得高产高纯度的蛋白产品,加快了肥胖抑素的产业化和临床应用的进程。
基金项目:北京市自然科学基金资助项目(7972012)
参考文献
1,Zhang Y, Proenca R, Maffei M,et al. Positional cloning of the mouse obese gene and its human homologue. Nature,1994,372:425-432.
2,Pelleymounter MA, Cullen MJ, Baker MB, et al. Effects of the obese gene product on Body weight regulation in ob/ob mice. Science,1995,269:540-543.
, 百拇医药
3,Halaas JL, Gajiwala KS, Maffei M,et al. Weight-reducing effects of the plasma protein encoded by the obese gene. Science,1995,269:543-546.
4,Campfield LA, Smith FJ, Guisez Y,et al. Recombinant mouse OB protein: evidence for a peripheral signal linking adiposity and central neural networks. Science,1995, 269:546-549.
5,Weigle DS, Bukowski TR, Foster DC, et al. Recombinant ob protein reduces feeding and body weight in the ob/ob mouse. J Clin Invest,1995,96:2065-2070.
, http://www.100md.com
6,Zhang F, Basinski MB. Crystal structure of the obese protein leptin -E 100.Nature,1997, 387:206-209.
7,Altmann SW, Timans JC, Rock FL, et al. Expression and purification of a synthetic human obese gene product. Protein Expr Purif,1996,6:722-726.
8,Fawzi AB, Zhang H, Van Heek M, et al. Purification of milligram quantities of human leptin from recombinant E.Coli. Horm Metab Res,1996,28:694-697.
, 百拇医药 9,Arieh G, Julie S, Duane H, et al. Large-scale preparation of biologically active recombinant ovine obese protein(leptin). FEBS Letters,1998, 422:137-140.
10,Rentsch J, Levens N, Chiesi M. Recombinant ob-gene product reduces food intake in fasted mice. Biochem Biophys Res Commun,1995,214:131-136.
11,Cohen SL, Halaas JL, Friedman JM, et al. Human leptin characterization. Nature ,1996, 382:589.
(收稿日期:1999-07-11), http://www.100md.com
单位:许婉宁(100045 北京儿科研究所营养室);丁宗一(100045 北京儿科研究所营养室);杜丽蓉(100045 北京儿科研究所营养室);唐建国(北京大学生命科学学院)
关键词:重组蛋白质类;分离和提纯;大肠杆菌
中华儿科杂志000608 【摘要】 目的 探讨产率较高,高度纯化大肠杆菌表达重组肥胖抑素的方法,深入研究肥胖抑素的分子结构,生物活性及临床应用,对在大肠杆菌中表达的重组人类肥胖抑素进行纯化。方法 温度诱导表达携有人类肥胖基因(ob)片段的大肠杆菌重组子,采用酸沉淀结合凝胶过滤层析的方法从包涵体中纯化目的蛋白。结果 1周内从3 L培养液(10 g)湿菌体中可获得70 mg高度纯化的重组人类肥胖抑素。结论 在短期内成功获得了高产高纯化的重组人类肥胖抑素,为肥胖抑素的产业化及临床应用奠定了基础。
, 百拇医药
Large -scale purification of recombinant human leptin from recombinant E.Coli
XU Wanning, DING Zongyi, DU Lirong, et al.
Department of Nutrition, Beijing Research Institute of Pediatrics, Beijing 100045, China
【Abstract】 Objective To purify recombinant human leptin from E.Coli for investigating its characteristics, biological activity and clinical application. Methods The E.Coli DH5 α cells transfected with recombinant pBV220-OB, a human obese gene. The expressed protein found in the inclusion bodies was purified by using acid precipitation and chromatography. Results Seventy milligrams of leptin with a high purity was prepared from 3 liter E.Coli culture media (10 grams of cells) within a week. Conclusion Large quantity of highly purified human leptin could be succesfully and rapidly prepared; it will hasten investigation of its production and clinical application.
, 百拇医药
【Key words】 Recombinant proteins; Isolation purification; Escherichia Coli
肥胖抑素是由肥胖基因(ob)编码的重要的体重调控因子。实验证明体外重组的肥胖抑素可以使内源性肥胖抑素缺乏的突变系C57BL/6J ob/ob 小鼠及各种原因导致的获得性肥胖鼠减少摄食和减重[1-5]。最近报道已有10种哺乳动物的肥胖基因序列被初步证实[6]。然而到目前为止仅获得了小鼠及人类的肥胖基因蛋白产物[4,7],肥胖抑素对于人类肥胖的减重效果也尚未被证明。部分原因是由于大量获得纯化的肥胖抑素比较困难,因此阻碍了对其分子结构及临床效果的进一步研究。目前已有关于大量纯化外源重组肥胖抑素的报道[8,9],但其所需条件要求较高。本研究旨在提供一种高度纯化大肠杆菌表达重组肥胖抑素的方法,产率较高且生物活性与目前报道的重组肥胖抑素类似,方法也简单易行,技术设备要求不高,有利于进一步研究肥胖抑素的结构特性及其在肥胖发生中的作用机制,并为其产业化和临床应用提供关键技术。
, http://www.100md.com
材料与方法
一、实验材料及仪器设备
1. 材料:携有重组表达质粒pBV220-ob的大肠杆菌DH5α重组子[1]。
2.试剂: 丙烯酰胺,N,N′-甲叉双丙烯酰胺,四甲基乙二胺(TEMED)为Boehringer Mannheim 公司产品。十二烷基硫酸钠(SDS)为德国Serva公司产品。胰蛋白胨(Tryptone) 及酵母提取物(Yeast extract) 为英国OXOID公司产品。蛋白质相对分子质量标准: 94×103, 67×103, 43×103, 30×103, 21×103,14.4×103 。
3.仪器: 大型恒温摇床,高速冷冻离心机,旋转真空干燥仪,普通电泳装置,葡聚糖凝胶Sephadex G-75过滤层析系统,超声波细胞粉碎机,分光光度计,紫外薄层扫描仪。
, 百拇医药
二、实验方法
1.重组肥胖抑素在大肠杆菌中的表达: 选取转化的单菌落置于3 ml 2-YT(Amp+)培养液中,37℃振荡培养12 h,转移至300 ml 2-YT(Amp+)培养液中32℃振荡培养过夜。次日上午以1∶10稀释,32℃培养2~3 h,42℃诱导5~6 h,7 000 r/min离心收获菌体,直接进行分离纯化或冻存于-20℃备用。同时取少量表达产物进行全蛋白15%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
2.表达产物的后加工:以4倍体积的菌体裂解液STET[8%蔗糖, 10 mmol/L Tris-HCl, 1 mmol/L 依地酸(EDTA), 5%TritonX-100, pH值 8.0]悬浮菌体,冰浴条件下超声破碎菌体,工作时间15 s,间隔时间10 s,循环8次。离心收集沉淀同上条件超声破碎1次。离心收集沉淀加入4倍体积的包涵体裂解液[0.1 mol/L 的Tris-HCl, 8 mol/L 的尿素, 1 mmol/L 的二硫苏糖醇(DTT), pH 8.0], 4℃裂解12 h。离心收集上清加入10 mmol/L 的DTT,37℃保温1 h。加入5倍预冷水稀释,用盐酸调pH值4~5,出现大量白色沉淀。4℃静置1~2 h。离心收集沉淀加入40 ml预冷水悬浮,用2 mol/L氢氧化钠调pH值11~12,沉淀完全溶解后加入到10倍体积的0.05 mol/L甘氨酸-氢氧化钠缓冲液(pH值 10.8)中稀释,4℃条件下重组12~24 h。
, 百拇医药
3. 葡聚糖凝胶Sephadex G-75过滤层析:将重组液超滤浓缩至20~30 ml, 离心收集上清上凝胶柱。0.05 mol/L甘氨酸-氢氧化钠缓冲液(pH值 10.8)洗脱,收集特异性蛋白峰,超滤脱盐后冷冻干燥。采用紫外吸收法检测纯化产物的纯度及定量。
4.电泳分析及紫外薄层扫描分析:采用15%SDS-PAGE 电泳分析重组蛋白的纯化过程,同时用聚丙烯酰胺凝胶电泳(Native-PAGE)对纯化蛋白进行纯度鉴定。SDS-PAGE凝胶经考马亮兰染色后,利用紫外薄层扫描分析目的蛋白的表达率及纯化效果。
结果
一、重组表达质粒在大肠杆菌中的表达
携有人类肥胖基因的重组表达质粒pBV220-ob转化大肠杆菌DH5α的转化子细胞经培养诱导后,进行SDS-PAGE凝胶电泳分析,结果显示出现了一条不含ob基因片段的空白质粒pBV220的转化子所缺乏的电泳带,其相对分子质量与文献报道的重组肥胖抑素一致(图1)。说明本实验中的重组子细胞表达了其质粒中携带的肥胖基因。紫外薄层扫描显示目的蛋白的表达量占菌体细胞总蛋白量的30%~40%,表达效率较高。

, http://www.100md.com
A: 相对分子质量标准;B: 冻干纯品蛋白;C: 柱层析洗脱目的峰蛋白;D:超滤上清;E:酸沉淀蛋白;F: 包涵体蛋白;G: pBV-220空白质粒;H:菌体表达全蛋白。图中数字为相对分子质量
图1 SDS-PAGE电泳
二、表达产物的分离纯化
重组表达产物在细胞中主要以包涵体形式存在。摇瓶培养后收集菌体, 3 L培养液可以得到湿菌体10 g。超声破碎细胞后,对包涵体进行裂解及初步纯化,经酸沉淀后可以除去大部分菌体蛋白及杂蛋白,而所需目的蛋白损失不大(图1、2);凝胶过滤层析之前的超滤上清经紫外薄层扫描检测其目的蛋白含量已达到 89%。将超滤上清液通过葡聚糖凝胶Sephadex G-75柱层析分离,可收集到三个洗脱峰,经电泳检测第三峰为目的蛋白峰(重组肥胖抑素峰)(图3)。将目的蛋白峰收集的洗脱液及冻干后的蛋白分别进行SDS-PAGE及Native-PAGE凝胶电泳,均可显示高纯度的蛋白条带(图1、2),紫外薄层扫描目的蛋白含量可达98%。在酸沉淀的过程中蛋白质易脱酰胺,以致多带一个负电荷,故在Native-PAGE电泳图谱中目的蛋白条带下方有时可见一条泳动率稍快的浅带,但这并不影响纯化蛋白的生物活性。本方法摇瓶所得10 g(3 L)湿菌体可得到纯品蛋白70 mg,其紫外吸光度 A280/A260值(曾称光度 OD)为1.7~2.0,表明其产率及纯度均高。具体纯化过程见表1。

, 百拇医药
1:超滤上清;2~7:冻干纯品蛋白
图2 Native-PAGE电泳

图3 葡聚糖凝胶Sephadex G-75 柱层析
表1 重组表达蛋白的纯化过程 纯化步骤
蛋白含量(mg)
回收率(%)
包涵体裂解液
727.59
100
酸沉淀
, 百拇医药
518.27
71.23
超滤上清
204.18
28.06
柱层析
70
9.62
讨论
肥胖抑素是由肥胖基因编码的蛋白产物,由于P1、P2为杂蛋白洗脱峰,P3为纯化目的蛋白峰。洗脱缓冲液为0.05 mol/L的甘氨酸-氢氧化钠(pH值 10.8),上样量10 ml,流速15 ml/h,每管收集2 ml。其在体重调控方面的重要作用日益受到关注。肥胖抑素在由脂肪细胞分泌入血的过程中失去N端信号肽而生成147个氨基酸的蛋白质,相对分子质量约为16×103。实验证明体外重组的肥胖抑素通过抑制下丘脑神经肽Y的分泌从而减少遗传性和获得性肥胖小鼠的摄食及体重,这种生理功能使得重组肥胖抑素具有极其重要的临床应用价值。研究者预测:和应用胰岛素治疗糖尿病类似,对于遗传性肥胖患者和某些缺乏具有生物活性的内源性肥胖抑素的患者,应用体外重组肥胖抑素进行替代疗法应是行之有效的方法。然而必须在获得大量高度纯化的重组肥胖抑素后,才能对其生物活性和生理功能进行深入研究,以期尽快进行临床药理和药效的试验。
, http://www.100md.com
目前大多数有关肥胖抑素生物功能的研究是应用小鼠或人类肥胖基因cDNA重组质粒在大肠杆菌中表达的蛋白产物。这些重组表达蛋白通常以包涵体的形式存在,在纯化过程中需要进行多肽链的重折叠。国外曾有关于从大肠杆菌包涵体中纯化重组肥胖抑素及其生物活性的报道[2,3,7,10],但其纯化过程复杂并且均未报道产量,同时在比较各研究组的纯化产物时发现,不同方法获得的重组蛋白其生物活性存在差别[1-5,7,10]。近年来研究者已应用免疫亲和纯化法从人类血浆中获得了天然肥胖抑素,并且证明其分子量与大肠杆菌表达的蛋白相同[11],这提示重组蛋白生物活性的降低可能是由于纯化过程中重折叠异常所致。然而从人类血浆中获得的肥胖抑素并不足以进行详细的分子结构和生物活性分析,故对于不同纯化产物活性差异的分子基础尚不十分清楚。肥胖抑素通过调节饮食摄入和能量消耗从而调节体重的生物功能需要在不同物种及各种肥胖模型中进行证明,仅仅对于小鼠的观察并不能广泛适用于包括人类在内的其他动物,这对于肥胖抑素的临床应用是很大的障碍。目前应用免疫亲和层析法从人类血浆中获得的肥胖抑素尚不足以对大型动物进行此类研究,因此提高纯化重组蛋白的产量是进一步研究肥胖抑素的结构特性以及临床应用的关键。
, 百拇医药
在两组纯化从大肠杆菌分泌入培养介质的重组蛋白的报道中,Altmann 等[7]在纯化前每升培养液仅获得3 mg分泌蛋白,而Rentsch 等[10]每升培养液也仅获得0.5~1 mg纯化蛋白。Weigle 等[5]研究表明从BHK细胞中分泌的重组肥胖抑素生物活性较大肠杆菌表达产物高,然而该实验中分泌蛋白并未纯化且重组过程复杂。目前已有Fawzi等[8]和Arieh 等[9]报道了大量纯化重组肥胖抑素的方法,但其成本和条件要求较高,结合本工作组的特点及国内的生产条件,我们采用了酸沉淀和凝胶柱层析的方法,在短时间内(1周)获得了高度纯化的重组肥胖抑素,10 g湿菌体可获得纯品蛋白70 mg,较本工作组曾采用过的硫酸铵盐析的纯化方法大大提高了产率,而且更加简便易行,对设备要求不高。体内天然肥胖抑素以单体形式存在,而文献报道许多纯化方法易导致二聚体或多聚体形成,经电泳检测本方法所得纯化蛋白仅形成极微量的二聚体,基本上以单体形式存在,从而有利于保持天然蛋白的活性。
, http://www.100md.com
本方法可获得大量纯化重组蛋白,使进行大型动物实验成为可能,并有利于进一步深入探讨肥胖抑素的结构特性。同时利用菌体的发酵表达和大型柱层析系统相结合,可在生产中获得高产高纯度的蛋白产品,加快了肥胖抑素的产业化和临床应用的进程。
基金项目:北京市自然科学基金资助项目(7972012)
参考文献
1,Zhang Y, Proenca R, Maffei M,et al. Positional cloning of the mouse obese gene and its human homologue. Nature,1994,372:425-432.
2,Pelleymounter MA, Cullen MJ, Baker MB, et al. Effects of the obese gene product on Body weight regulation in ob/ob mice. Science,1995,269:540-543.
, 百拇医药
3,Halaas JL, Gajiwala KS, Maffei M,et al. Weight-reducing effects of the plasma protein encoded by the obese gene. Science,1995,269:543-546.
4,Campfield LA, Smith FJ, Guisez Y,et al. Recombinant mouse OB protein: evidence for a peripheral signal linking adiposity and central neural networks. Science,1995, 269:546-549.
5,Weigle DS, Bukowski TR, Foster DC, et al. Recombinant ob protein reduces feeding and body weight in the ob/ob mouse. J Clin Invest,1995,96:2065-2070.
, http://www.100md.com
6,Zhang F, Basinski MB. Crystal structure of the obese protein leptin -E 100.Nature,1997, 387:206-209.
7,Altmann SW, Timans JC, Rock FL, et al. Expression and purification of a synthetic human obese gene product. Protein Expr Purif,1996,6:722-726.
8,Fawzi AB, Zhang H, Van Heek M, et al. Purification of milligram quantities of human leptin from recombinant E.Coli. Horm Metab Res,1996,28:694-697.
, 百拇医药 9,Arieh G, Julie S, Duane H, et al. Large-scale preparation of biologically active recombinant ovine obese protein(leptin). FEBS Letters,1998, 422:137-140.
10,Rentsch J, Levens N, Chiesi M. Recombinant ob-gene product reduces food intake in fasted mice. Biochem Biophys Res Commun,1995,214:131-136.
11,Cohen SL, Halaas JL, Friedman JM, et al. Human leptin characterization. Nature ,1996, 382:589.
(收稿日期:1999-07-11), http://www.100md.com