一氧化氮对缺氧性肺血管结构重建大鼠肺动脉血小板源生长因子表达的影响
作者:周彬 杜军保
单位:周彬(100034 北京医科大学第一医院儿科);杜军保(100034 北京医科大学第一医院儿科)
关键词:一氧化氮;血小板源生长因子;低氧;肺动脉
中华儿科杂志000806 【摘要】 目的 探讨一氧化氮对缺氧性肺血管结构重建大鼠肺动脉中血小板源生长因子(PDGF)表达的影响。方法 将大鼠随机分为4组:常氧组(6只)、低氧组(6只)、低氧+L-精氨酸组(低氧+L-Arg组)(7只)及低氧+Nω-硝基- L-精氨酸甲酯组(低氧+L-NAME组)(6只)。以光学显微镜观测4组大鼠肺中、小肌型动脉的相对中膜厚度(RMT)。应用PDGF的单克隆抗体经免疫组织化学技术对4组大鼠肺动脉PDGF进行定位及含量分析。结果 低氧组大鼠中型肺动脉及小型肺动脉RMT均高于常氧组和低氧+L-Arg组 (P<0.01);低氧+L-NAME组均高于低氧组 (P<0.01)。4组大鼠各级肺动脉内皮细胞及平滑肌细胞中均有PDGF的表达,低氧组较常氧组表达增强(P<0.01),L-Arg使其表达明显抑制(P<0.01),而L-NAME使其表达明显增强(P<0.01)。中型肺动脉内皮细胞及平滑肌细胞中PDGF的表达与相应中型肺动脉RMT之间呈正相关(r分别为0.863 6、0.826 4,P均<0.01);小型肺动脉内皮细胞及平滑肌细胞中PDGF的表达与相应的小型肺动脉RMT之间呈正相关(r分别为0.889 8、0.868 8,P均<0.01)。结论 一氧化氮对缺氧性肺血管结构重建大鼠肺动脉中PDGF表达有抑制作用。
, 百拇医药
Impact of nitric oxide on platelet-derived growth factor expression in pulmonary arteries of rats with hypoxic pulmonary vascular remodeling
ZHOU Bin,DU Junbao
(Department of Pediatrics,First Hospital,Beijing Medical University,Beijing 100034, China)
【Abstract】 Objective The pathological basis of chronically hypoxic pulmonary hypertension is pulmonary vascular structural remodeling. Nitric oxide (NO), a new typical messenger of gas molecule, plays an important role in regulating hypoxic pulmonary vascular remodeling. However, the regulatory mechanism is unknown. Our present experiment aimed at examining the impact of NO on platelet-derived growth factor-B(PDGF-B)expression in intrapulmonary arteries of rats with hypoxic pulmonary vascular remodeling, and thereby to investigate the role of PDGF in the mechanisms by which NO regulates hypoxic pulmonary vascular remodeling. Methods Twenty-five rats were randomly divided into four groups: normoxic group (n=6), hypoxic group (n=6),hypoxic +L-arginine group (hypoxic + L-Arg group, n=7) and hypoxic +Nω -L-nitro-arginine methyl ester group (hypoxic + L-NAME group, n=6). Relative medial thickness (RMT) of small and median muscularized pulmonary arteries was observed in lung sections of rats by using a light microscope. An immunohistochemical technique was used to assess the abundance and localization of PDGF in pulmonary arteries of rats in four groups. Results RMT of small and median intrapulmonary arteries in rats of hypoxic group was markedly higher than that of normoxic group and hypoxic +L-Arg group (P<0.01). Whereas RMT of small and median intrapulmonary arteries in rats of hypoxic + L-NAME group was obviously higher than that of hypoxic group (P<0.01). PDGF-B was expressed by pulmonary artery endothelial cells and smooth muscle cells in rats of 4 groups. In rats of normoxic group, hypoxic group, hypoxic + L-Arg group and hypoxic + L-NAME group, PDGF expression score was 35.0, 58.3, 42.1 and 75.8, respectively, in endothelial cells of median pulmonary arteries, and 31.7, 50.8, 38.6 and 73.3,respectively in smooth muscle cells of median pulmonary arteries. The score was 38.3, 57.5, 47.1 and 78.3 respectively, in endothelial cells of small pulmonary arteries, and 37.5, 60.8, 45.7 and 80.8, respectively, in smooth muscle cells of small pulmonary arteries. There was a positive correlation between RMT and PDGF expression by endothelial cells and smooth muscle cells of median pulmonary arteries (r=0.863 6, 0.826 4, P<0.01, respectively). There was also a positive correlation between RMT and PDGF expression by endothelial cells and smooth muscle cells of small pulmonary arteries (r=0.889 8, 0.868 8, P<0.01, respectively). Conclusion Nitric oxide inhibited PDGF expression by pulmonary arteries of rats with hypoxic pulmonary vascular remodeling.
, 百拇医药
【Key words】 Nitric oxide; Platelet-derived growth factor; Anoxia; Pulmonary artery
缺氧性肺动脉高压(hypoxic pulmonary hyper-tension, HPH)是与许多呼吸系统疾病紧密相关的一种常见并发症[1]。肺血管结构重建是肺动脉高压形成的重要病理基础[2]。一氧化氮(nitric oxide,NO)对缺氧性肺血管结构重建具有重要的调节作用,但其调节机制尚未十分清楚。血小板源生长因子(platelet-derived growth factor,PDGF)是自1974年以来才被认识的一种刺激细胞增殖的肽类生长因子[3]。近年来,人们逐渐认识到PDGF在低氧性肺动脉高压的肺血管结构重建中发挥重要作用[4]。L-精氨酸(L-arginine,L-Arg)是NO合成的前体,Nω-硝基-L-精氨酸甲酯(Nω-nitro-L- arginine methyl ester,L-NAME)是一氧化氮合酶抑制剂。我们运用免疫组织化学方法,通过研究低氧时以及经L-Arg、L-NAME处理的低氧大鼠中型肺动脉及小型肺动脉内皮细胞及平滑肌细胞中PDGF表达的变化及其与血管结构变化之间的相关性,探讨NO对缺氧性肺血管结构重建大鼠肺动脉中PDGF表达的影响,进一步了解缺氧性肺动脉高压的发生机制。
, 百拇医药
材料和方法
一、 实验对象
雄性Wistar大鼠25只,体重200~300 g,购自北京医科大学第一医院实验动物中心。将大鼠随机分为4组,即:常氧组(6只) ,低氧组(6只), 低氧+L-Arg组 (7只),低氧+L-NAME组 (6只)。
二、 实验方法
1.大鼠缺氧方法:将大鼠置于CG1型常压低氧舱内,保持控制舱内氧浓度在(10.0±0.5)%。每天连续低氧6 h,共低氧2周。对低氧+L-Arg组在每天低氧前,予腹腔注射L-Arg 500 mg/kg,对低氧+L- NAME组在每天低氧前,予腹腔注射L- NAME 5 mg/kg。常氧组大鼠呼吸室内空气,4组大鼠的常规饲养及饮食条件相同。
2.标本取材处理:4组大鼠在上述条件下饲养2周后,取两侧肺叶,一侧肺叶做成5μm厚冰冻切片,应用PDGF的单克隆抗体经免疫组织化学方法(ABC法)对大鼠肺动脉中PDGF进行定位及定量分析;另一侧肺叶做成5 μm厚石蜡切片,进行Weight弹力纤维染色,Van Geieson复染,并进行光学显微镜观测。
, 百拇医药
三、 观测指标
1.肺动脉病理结构指标:中型肺动脉及小型肺动脉的相对中膜厚度(relative medial thickness, RMT)的测定:应用Q550LW图像处理与分析系统对整个石蜡切片中的内弹力层清晰、形状较规则的中型肺动脉及小型肺动脉进行分析,运用Leica Qwin软件测量每个血管的如下指标:通过血管轴心外弹力层之间的最长外径(D1)和最短外径(D2)、内弹力层长度(LIEL)及外弹力层长度(LEEL)。应用上述指标,根据Barth等[5]的方法,首先对血管进行理想化转换,使之成为完全圆形、中膜厚度一致的血管,然后再计算不同切面角度(0°≤α<90°)及处于不同舒缩状态的血管RMT。RMT为转化后肺理想血管中膜厚度(T)与外弹力层所包绕的理想血管半径(R)之比,而T为R与内弹力层所包绕的理想血管半径(r)之差。R值可用公式R=LEEL/{π×[1.5×(1+1/Cos α)-(1/Cos α)1/2]}求得。r值可用公式r=LIEL/{π×[1.5×(1+1/Cos α)-(1/Cos α)1/2]}求得,其中,Cos α=D2/D1,α为血管实际切面与水平切面之夹角。每只大鼠测量5~10个中型肺动脉及小型肺动脉,并求其均值。
, 百拇医药
2.中型肺动脉和小型肺动脉PDGF的含量与分布:采用免疫组织化学染色方法对中型肺动脉和小型肺动脉PDGF的含量进行测定[6]。在光学显微镜下,棕黄色颗粒为其阳性信号。采用半定量法分析PDGF的含量。首先,根据血管外径选择肺动脉:中型肺动脉 (管径50~150 μm)和小型肺动脉(管径15~50 μm)。根据每条肺动脉内皮细胞和平滑肌细胞呈现PDGF阳性表达的百分比将其免疫活性表达分为三个等级:肺动脉内皮细胞或平滑肌细胞中无PDGF表达者为(-);肺动脉有1%~50%内皮细胞或平滑肌细胞中有PDGF表达者为(+);肺动脉有51%~100%内皮细胞或平滑肌细胞中有PDGF表达者为(++)。肺动脉中PDGF含量进一步用积分值表示,即:以PDGF某一表达强度的肺动脉百分比乘以表达强度加权值(“-”者,表达强度加权值为0;“+”者,表达强度加权值为0.5;“++”者,表达强度加权值为1),每份标本各级血管至少检测10条。
四、统计学处理
, 百拇医药 分别对大鼠肺动脉PDGF表达积分值、中型肺动脉及小型肺动脉RMT在各组之间差异运用单因素方差分析(F检验)进行统计学处理。在两组之间的差异用 q检验。大鼠中型肺动脉和小型肺动脉PDGF表达积分值与RMT的相关性采用直线相关分析。
结果
一、4组大鼠中型肺动脉及小型肺动脉相对中膜厚度(表1)
4组大鼠中型肺动脉相对中膜厚度差异均有显著意义。低氧组大鼠中型肺动脉相对中膜厚度明显高于常氧组和低氧+L-Arg组 (q=9.74、6.63, P<0.01),而低氧+L-NAME组明显高于低氧组(q=4.94, P<0.01)。
4组大鼠小型肺动脉相对中膜厚度差异均有显著意义。低氧组大鼠小型肺动脉相对中膜厚度明显高于常氧组和低氧+L-Arg组 (q=7.36、5.04, P<0.01),而低氧+L-NAME组大鼠明显高于低氧组(q=6.86, P<0.01)。
, 百拇医药
表1 4组大鼠肺动脉相对中膜厚度(RMT)(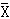 ±s,%) 组别
±s,%) 组别
大鼠数(只)
中型肺动脉
小型肺动脉
常氧组
6
8.5±0.6
12.4±0.7
低氧组
6
14.5±1.0
, http://www.100md.com
18.7±1.2
低氧+L-Arg组
7
10.6±1.2
14.5±2.3
低氧+L-NAME组
6
17.5±2.5
24.5±3.1
组间比较
F值
43.65
, 百拇医药 39.86
P值
<0.001
<0.001
二、4组大鼠肺动脉PDGF表达积分值的变化(表2)
4组大鼠中型肺动脉内皮细胞及平滑肌细胞中PDGF表达积分值经方差分析,差异均有显著意义。低氧组大鼠中型肺动脉内皮细胞及平滑肌细胞中PDGF表达积分值均高于常氧组(q=9.92、10.46, P<0.01)和低氧+L-Arg组 (q=7.14、6.94, P<0.01),而低氧+L-NAME组均高于低氧组(q=7.44、12.28, P<0.01)。
表2 4组大鼠肺动脉PDGF表达积分值(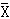 ±s) 组别
±s) 组别
, http://www.100md.com
大鼠数
(只)
中型肺动脉
小型肺动脉
内皮细胞
平滑肌细胞
内皮细胞
平滑肌细胞
常氧组
6
35.0±3.2
31.7±2.6
38.3±2.6
, 百拇医药
37.5±2.7
低氧组
6
58.3±4.1
50.8±3.8
57.5±5.2
60.8±3.8
低氧+
L-Arg组
7
42.1±9.5
38.6±6.3
, http://www.100md.com 47.1±2.7
45.7±4.5
低氧+L-
6
75.8±2.0
73.3±4.1
78.3±2.6
80.8±3.8
NAME组
组间比较
F值
60.85
101.24
, 百拇医药
153.11
154.47
P值
<0.001
<0.001
<0.001
<0.001
4组大鼠小型肺动脉内皮细胞及平滑肌细胞中PDGF表达积分值经方差分析,差异均有显著意义。低氧组大鼠肺小型动脉内皮细胞及平滑肌细胞中PDGF表达积分值均高于常氧组(q=13.69、15.11,P<0.01)和低氧+L-Arg组 (q=7.68、10.16, P<0.01 ),而低氧+L-NAME组均高于低氧组(q=14.88、12.95, P<0.01 )。
, 百拇医药
三、肺动脉PDGF表达积分值与肺动脉 RMT之间的相关性分析
以肺动脉RMT为应变量,以肺动脉PDGF表达积分值为自变量,采用直线相关分析法进行分析。结果显示:中型肺动脉RMT与中型肺动脉内皮细胞及平滑肌细胞PDGF表达积分值均呈显著正相关(r值分别为0.863 6和0.826 4,P均<0.01);小型肺动脉RMT与小型肺动脉内皮细胞及平滑肌细胞PDGF表达积分值均呈显著正相关(r值分别为0.889 8和0.868 8,P均<0.01)。讨论
大量实验证明,吸入外源性NO可以减轻缺氧性肺血管结构重建,降低肺动脉高压[7,8]。我们的以往研究表明,L-Arg可明显改善肺血管结构重建,降低肺动脉高压[9],然而其机制尚未阐明。对其深入探讨,已成为当今重要的研究热点。低氧使肺血管PDGF受体及配体基因的依序和(或)合并表达增强[4,10],而PDGF作为促进血管平滑肌细胞生长的因子(VSMCGP),与受体结合后通过激活磷酯酶C和细胞内Na+/H+交换等途径影响原癌基因的表达来促进细胞增殖、趋化及血管收缩等生物效应[11,12]。近年来 Kourembanas等[13]的体外试验表明硝普钠(NO供给剂)可抑制低氧时人脐静脉PDGF-B链的基因表达,而NO合酶(NO synthase, NOS)抑制剂L-NAME则促进低氧时人脐静脉PDGF的合成。因此,人们推测NO可否通过抑制低氧大鼠肺动脉PDGF的合成进而调节缺氧性肺动脉高压?目前,国内外对此尚无报道。
, 百拇医药
我们的实验表明,低氧2周后大鼠形成肺血管结构重建,同时肺动脉PDGF表达增强,提示PDGF在缺氧性肺血管结构重建及肺动脉高压形成中起重要作用。当低氧大鼠经L-Arg处理后,其中型及小型肺动脉RMT明显减低,并且肺动脉内皮细胞和平滑肌细胞PDGF表达明显减弱;而经L-NAME处理的缺氧性肺血管结构重建大鼠其中型及小型肺动脉RMT明显增高,且相应肺动脉内皮细胞和平滑肌细胞PDGF表达明显增强,并且肺动脉PDGF的含量与肺动脉RMT呈明显正相关。因此,我们可以推测,PDGF参与NO对缺氧性肺血管结构重建的抑制机制,从而深化了NO对缺氧性肺动脉高压的调节机制理论,同时为NO吸入矫治肺动脉高压提供了理论基础。
在对肺动脉相对中膜厚度进行测量时,我们对血管壁厚度法和平面几何法进行综合,取其优点,并引进切角α[5],使斜切血管切面先转化成理想血管切面,再求出中膜厚度和外径,故适合测定各种舒缩状态的血管,是一种较理想的测量方法。
基金项目:国家自然科学基金资助项目(39870844)
, 百拇医药
参考文献
1,冯晓东,蔡英年.内皮衍生因子(ET/NO)与低氧性肺动脉高压.基础医学与临床,1996,16:6-10.
2,蔡英年.肺动脉高压形成时肺血管细胞的增殖和调节.生理科学进展, 1992,23,298-302.
3,冉丕鑫.血小板生长因子研究进展.国外医学生理、病理科学与临床分册,1993,13:136-138.
4,Katayose D.Increased expression of PDGF A-and B-chain genes in rat lungs with hypoxic pulmonary hypertension.Am J Physiol,1993,264(2 Pt 1):100-106.
5,Barth PJ,Kimpel C,Roy S,et al.An improved mathematical approach for the assessment of the medial thickness of pulmonary arteries.Pathol Res Pract,1993,189:567-576.
, http://www.100md.com
6,杨景山,主编.医学细胞化学与细胞生物技术.北京:北京医科大学中国协和医科大学联合出版社, 1990.72-114.
7,Kouyoumdjian C.Continuous inhalation of nitric oxide protects against development of pulmonary hypertension in chronically hypoxic rats.J Clin Invest,1994,94:578-584.
8,Horstman DJ.Prolong inhaled NO attenuates hypoxic,but not monocrotaline-induced,pulmonary vascular remodeling in rats.Anesth-Analg,1998,86: 74-81.
9,齐建光,杜军保,贾建锋.内源性一氧化氮调节大鼠低氧性肺血管结构的重建.中华儿科杂志,1999,37:104-106.
, 百拇医药
10,鲁青,孙仁宇,张宏,等.血小板源生长因子及其受体基因表达在低氧大鼠肺中的变化.基础医学与临床,1995,15:192-194.
11,Quinn DA.The role of Na+/H+ exchange and growth factors in pulmonary artery smooth muscle cell proliferation.Am J Respir Cell Mol Biol,1996,14:139-145.
12,冉丕鑫,钟南山.生长因子、原癌基因与低氧性肺动脉高压.基础医学与临床,1996,16:1-5.
13,Kourembanas S,Lynda P.Nitric oxide regulates the expression of vasoconstrictors and growth factors by vascular endothelium under both normoxia and hypoxia.J Clin Invest,1993,92:99-104.
(收稿日期:2000-01-10), 百拇医药
单位:周彬(100034 北京医科大学第一医院儿科);杜军保(100034 北京医科大学第一医院儿科)
关键词:一氧化氮;血小板源生长因子;低氧;肺动脉
中华儿科杂志000806 【摘要】 目的 探讨一氧化氮对缺氧性肺血管结构重建大鼠肺动脉中血小板源生长因子(PDGF)表达的影响。方法 将大鼠随机分为4组:常氧组(6只)、低氧组(6只)、低氧+L-精氨酸组(低氧+L-Arg组)(7只)及低氧+Nω-硝基- L-精氨酸甲酯组(低氧+L-NAME组)(6只)。以光学显微镜观测4组大鼠肺中、小肌型动脉的相对中膜厚度(RMT)。应用PDGF的单克隆抗体经免疫组织化学技术对4组大鼠肺动脉PDGF进行定位及含量分析。结果 低氧组大鼠中型肺动脉及小型肺动脉RMT均高于常氧组和低氧+L-Arg组 (P<0.01);低氧+L-NAME组均高于低氧组 (P<0.01)。4组大鼠各级肺动脉内皮细胞及平滑肌细胞中均有PDGF的表达,低氧组较常氧组表达增强(P<0.01),L-Arg使其表达明显抑制(P<0.01),而L-NAME使其表达明显增强(P<0.01)。中型肺动脉内皮细胞及平滑肌细胞中PDGF的表达与相应中型肺动脉RMT之间呈正相关(r分别为0.863 6、0.826 4,P均<0.01);小型肺动脉内皮细胞及平滑肌细胞中PDGF的表达与相应的小型肺动脉RMT之间呈正相关(r分别为0.889 8、0.868 8,P均<0.01)。结论 一氧化氮对缺氧性肺血管结构重建大鼠肺动脉中PDGF表达有抑制作用。
, 百拇医药
Impact of nitric oxide on platelet-derived growth factor expression in pulmonary arteries of rats with hypoxic pulmonary vascular remodeling
ZHOU Bin,DU Junbao
(Department of Pediatrics,First Hospital,Beijing Medical University,Beijing 100034, China)
【Abstract】 Objective The pathological basis of chronically hypoxic pulmonary hypertension is pulmonary vascular structural remodeling. Nitric oxide (NO), a new typical messenger of gas molecule, plays an important role in regulating hypoxic pulmonary vascular remodeling. However, the regulatory mechanism is unknown. Our present experiment aimed at examining the impact of NO on platelet-derived growth factor-B(PDGF-B)expression in intrapulmonary arteries of rats with hypoxic pulmonary vascular remodeling, and thereby to investigate the role of PDGF in the mechanisms by which NO regulates hypoxic pulmonary vascular remodeling. Methods Twenty-five rats were randomly divided into four groups: normoxic group (n=6), hypoxic group (n=6),hypoxic +L-arginine group (hypoxic + L-Arg group, n=7) and hypoxic +Nω -L-nitro-arginine methyl ester group (hypoxic + L-NAME group, n=6). Relative medial thickness (RMT) of small and median muscularized pulmonary arteries was observed in lung sections of rats by using a light microscope. An immunohistochemical technique was used to assess the abundance and localization of PDGF in pulmonary arteries of rats in four groups. Results RMT of small and median intrapulmonary arteries in rats of hypoxic group was markedly higher than that of normoxic group and hypoxic +L-Arg group (P<0.01). Whereas RMT of small and median intrapulmonary arteries in rats of hypoxic + L-NAME group was obviously higher than that of hypoxic group (P<0.01). PDGF-B was expressed by pulmonary artery endothelial cells and smooth muscle cells in rats of 4 groups. In rats of normoxic group, hypoxic group, hypoxic + L-Arg group and hypoxic + L-NAME group, PDGF expression score was 35.0, 58.3, 42.1 and 75.8, respectively, in endothelial cells of median pulmonary arteries, and 31.7, 50.8, 38.6 and 73.3,respectively in smooth muscle cells of median pulmonary arteries. The score was 38.3, 57.5, 47.1 and 78.3 respectively, in endothelial cells of small pulmonary arteries, and 37.5, 60.8, 45.7 and 80.8, respectively, in smooth muscle cells of small pulmonary arteries. There was a positive correlation between RMT and PDGF expression by endothelial cells and smooth muscle cells of median pulmonary arteries (r=0.863 6, 0.826 4, P<0.01, respectively). There was also a positive correlation between RMT and PDGF expression by endothelial cells and smooth muscle cells of small pulmonary arteries (r=0.889 8, 0.868 8, P<0.01, respectively). Conclusion Nitric oxide inhibited PDGF expression by pulmonary arteries of rats with hypoxic pulmonary vascular remodeling.
, 百拇医药
【Key words】 Nitric oxide; Platelet-derived growth factor; Anoxia; Pulmonary artery
缺氧性肺动脉高压(hypoxic pulmonary hyper-tension, HPH)是与许多呼吸系统疾病紧密相关的一种常见并发症[1]。肺血管结构重建是肺动脉高压形成的重要病理基础[2]。一氧化氮(nitric oxide,NO)对缺氧性肺血管结构重建具有重要的调节作用,但其调节机制尚未十分清楚。血小板源生长因子(platelet-derived growth factor,PDGF)是自1974年以来才被认识的一种刺激细胞增殖的肽类生长因子[3]。近年来,人们逐渐认识到PDGF在低氧性肺动脉高压的肺血管结构重建中发挥重要作用[4]。L-精氨酸(L-arginine,L-Arg)是NO合成的前体,Nω-硝基-L-精氨酸甲酯(Nω-nitro-L- arginine methyl ester,L-NAME)是一氧化氮合酶抑制剂。我们运用免疫组织化学方法,通过研究低氧时以及经L-Arg、L-NAME处理的低氧大鼠中型肺动脉及小型肺动脉内皮细胞及平滑肌细胞中PDGF表达的变化及其与血管结构变化之间的相关性,探讨NO对缺氧性肺血管结构重建大鼠肺动脉中PDGF表达的影响,进一步了解缺氧性肺动脉高压的发生机制。
, 百拇医药
材料和方法
一、 实验对象
雄性Wistar大鼠25只,体重200~300 g,购自北京医科大学第一医院实验动物中心。将大鼠随机分为4组,即:常氧组(6只) ,低氧组(6只), 低氧+L-Arg组 (7只),低氧+L-NAME组 (6只)。
二、 实验方法
1.大鼠缺氧方法:将大鼠置于CG1型常压低氧舱内,保持控制舱内氧浓度在(10.0±0.5)%。每天连续低氧6 h,共低氧2周。对低氧+L-Arg组在每天低氧前,予腹腔注射L-Arg 500 mg/kg,对低氧+L- NAME组在每天低氧前,予腹腔注射L- NAME 5 mg/kg。常氧组大鼠呼吸室内空气,4组大鼠的常规饲养及饮食条件相同。
2.标本取材处理:4组大鼠在上述条件下饲养2周后,取两侧肺叶,一侧肺叶做成5μm厚冰冻切片,应用PDGF的单克隆抗体经免疫组织化学方法(ABC法)对大鼠肺动脉中PDGF进行定位及定量分析;另一侧肺叶做成5 μm厚石蜡切片,进行Weight弹力纤维染色,Van Geieson复染,并进行光学显微镜观测。
, 百拇医药
三、 观测指标
1.肺动脉病理结构指标:中型肺动脉及小型肺动脉的相对中膜厚度(relative medial thickness, RMT)的测定:应用Q550LW图像处理与分析系统对整个石蜡切片中的内弹力层清晰、形状较规则的中型肺动脉及小型肺动脉进行分析,运用Leica Qwin软件测量每个血管的如下指标:通过血管轴心外弹力层之间的最长外径(D1)和最短外径(D2)、内弹力层长度(LIEL)及外弹力层长度(LEEL)。应用上述指标,根据Barth等[5]的方法,首先对血管进行理想化转换,使之成为完全圆形、中膜厚度一致的血管,然后再计算不同切面角度(0°≤α<90°)及处于不同舒缩状态的血管RMT。RMT为转化后肺理想血管中膜厚度(T)与外弹力层所包绕的理想血管半径(R)之比,而T为R与内弹力层所包绕的理想血管半径(r)之差。R值可用公式R=LEEL/{π×[1.5×(1+1/Cos α)-(1/Cos α)1/2]}求得。r值可用公式r=LIEL/{π×[1.5×(1+1/Cos α)-(1/Cos α)1/2]}求得,其中,Cos α=D2/D1,α为血管实际切面与水平切面之夹角。每只大鼠测量5~10个中型肺动脉及小型肺动脉,并求其均值。
, 百拇医药
2.中型肺动脉和小型肺动脉PDGF的含量与分布:采用免疫组织化学染色方法对中型肺动脉和小型肺动脉PDGF的含量进行测定[6]。在光学显微镜下,棕黄色颗粒为其阳性信号。采用半定量法分析PDGF的含量。首先,根据血管外径选择肺动脉:中型肺动脉 (管径50~150 μm)和小型肺动脉(管径15~50 μm)。根据每条肺动脉内皮细胞和平滑肌细胞呈现PDGF阳性表达的百分比将其免疫活性表达分为三个等级:肺动脉内皮细胞或平滑肌细胞中无PDGF表达者为(-);肺动脉有1%~50%内皮细胞或平滑肌细胞中有PDGF表达者为(+);肺动脉有51%~100%内皮细胞或平滑肌细胞中有PDGF表达者为(++)。肺动脉中PDGF含量进一步用积分值表示,即:以PDGF某一表达强度的肺动脉百分比乘以表达强度加权值(“-”者,表达强度加权值为0;“+”者,表达强度加权值为0.5;“++”者,表达强度加权值为1),每份标本各级血管至少检测10条。
四、统计学处理
, 百拇医药 分别对大鼠肺动脉PDGF表达积分值、中型肺动脉及小型肺动脉RMT在各组之间差异运用单因素方差分析(F检验)进行统计学处理。在两组之间的差异用 q检验。大鼠中型肺动脉和小型肺动脉PDGF表达积分值与RMT的相关性采用直线相关分析。
结果
一、4组大鼠中型肺动脉及小型肺动脉相对中膜厚度(表1)
4组大鼠中型肺动脉相对中膜厚度差异均有显著意义。低氧组大鼠中型肺动脉相对中膜厚度明显高于常氧组和低氧+L-Arg组 (q=9.74、6.63, P<0.01),而低氧+L-NAME组明显高于低氧组(q=4.94, P<0.01)。
4组大鼠小型肺动脉相对中膜厚度差异均有显著意义。低氧组大鼠小型肺动脉相对中膜厚度明显高于常氧组和低氧+L-Arg组 (q=7.36、5.04, P<0.01),而低氧+L-NAME组大鼠明显高于低氧组(q=6.86, P<0.01)。
, 百拇医药
表1 4组大鼠肺动脉相对中膜厚度(RMT)(
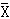 ±s,%) 组别
±s,%) 组别大鼠数(只)
中型肺动脉
小型肺动脉
常氧组
6
8.5±0.6
12.4±0.7
低氧组
6
14.5±1.0
, http://www.100md.com
18.7±1.2
低氧+L-Arg组
7
10.6±1.2
14.5±2.3
低氧+L-NAME组
6
17.5±2.5
24.5±3.1
组间比较
F值
43.65
, 百拇医药 39.86
P值
<0.001
<0.001
二、4组大鼠肺动脉PDGF表达积分值的变化(表2)
4组大鼠中型肺动脉内皮细胞及平滑肌细胞中PDGF表达积分值经方差分析,差异均有显著意义。低氧组大鼠中型肺动脉内皮细胞及平滑肌细胞中PDGF表达积分值均高于常氧组(q=9.92、10.46, P<0.01)和低氧+L-Arg组 (q=7.14、6.94, P<0.01),而低氧+L-NAME组均高于低氧组(q=7.44、12.28, P<0.01)。
表2 4组大鼠肺动脉PDGF表达积分值(
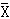 ±s) 组别
±s) 组别, http://www.100md.com
大鼠数
(只)
中型肺动脉
小型肺动脉
内皮细胞
平滑肌细胞
内皮细胞
平滑肌细胞
常氧组
6
35.0±3.2
31.7±2.6
38.3±2.6
, 百拇医药
37.5±2.7
低氧组
6
58.3±4.1
50.8±3.8
57.5±5.2
60.8±3.8
低氧+
L-Arg组
7
42.1±9.5
38.6±6.3
, http://www.100md.com 47.1±2.7
45.7±4.5
低氧+L-
6
75.8±2.0
73.3±4.1
78.3±2.6
80.8±3.8
NAME组
组间比较
F值
60.85
101.24
, 百拇医药
153.11
154.47
P值
<0.001
<0.001
<0.001
<0.001
4组大鼠小型肺动脉内皮细胞及平滑肌细胞中PDGF表达积分值经方差分析,差异均有显著意义。低氧组大鼠肺小型动脉内皮细胞及平滑肌细胞中PDGF表达积分值均高于常氧组(q=13.69、15.11,P<0.01)和低氧+L-Arg组 (q=7.68、10.16, P<0.01 ),而低氧+L-NAME组均高于低氧组(q=14.88、12.95, P<0.01 )。
, 百拇医药
三、肺动脉PDGF表达积分值与肺动脉 RMT之间的相关性分析
以肺动脉RMT为应变量,以肺动脉PDGF表达积分值为自变量,采用直线相关分析法进行分析。结果显示:中型肺动脉RMT与中型肺动脉内皮细胞及平滑肌细胞PDGF表达积分值均呈显著正相关(r值分别为0.863 6和0.826 4,P均<0.01);小型肺动脉RMT与小型肺动脉内皮细胞及平滑肌细胞PDGF表达积分值均呈显著正相关(r值分别为0.889 8和0.868 8,P均<0.01)。讨论
大量实验证明,吸入外源性NO可以减轻缺氧性肺血管结构重建,降低肺动脉高压[7,8]。我们的以往研究表明,L-Arg可明显改善肺血管结构重建,降低肺动脉高压[9],然而其机制尚未阐明。对其深入探讨,已成为当今重要的研究热点。低氧使肺血管PDGF受体及配体基因的依序和(或)合并表达增强[4,10],而PDGF作为促进血管平滑肌细胞生长的因子(VSMCGP),与受体结合后通过激活磷酯酶C和细胞内Na+/H+交换等途径影响原癌基因的表达来促进细胞增殖、趋化及血管收缩等生物效应[11,12]。近年来 Kourembanas等[13]的体外试验表明硝普钠(NO供给剂)可抑制低氧时人脐静脉PDGF-B链的基因表达,而NO合酶(NO synthase, NOS)抑制剂L-NAME则促进低氧时人脐静脉PDGF的合成。因此,人们推测NO可否通过抑制低氧大鼠肺动脉PDGF的合成进而调节缺氧性肺动脉高压?目前,国内外对此尚无报道。
, 百拇医药
我们的实验表明,低氧2周后大鼠形成肺血管结构重建,同时肺动脉PDGF表达增强,提示PDGF在缺氧性肺血管结构重建及肺动脉高压形成中起重要作用。当低氧大鼠经L-Arg处理后,其中型及小型肺动脉RMT明显减低,并且肺动脉内皮细胞和平滑肌细胞PDGF表达明显减弱;而经L-NAME处理的缺氧性肺血管结构重建大鼠其中型及小型肺动脉RMT明显增高,且相应肺动脉内皮细胞和平滑肌细胞PDGF表达明显增强,并且肺动脉PDGF的含量与肺动脉RMT呈明显正相关。因此,我们可以推测,PDGF参与NO对缺氧性肺血管结构重建的抑制机制,从而深化了NO对缺氧性肺动脉高压的调节机制理论,同时为NO吸入矫治肺动脉高压提供了理论基础。
在对肺动脉相对中膜厚度进行测量时,我们对血管壁厚度法和平面几何法进行综合,取其优点,并引进切角α[5],使斜切血管切面先转化成理想血管切面,再求出中膜厚度和外径,故适合测定各种舒缩状态的血管,是一种较理想的测量方法。
基金项目:国家自然科学基金资助项目(39870844)
, 百拇医药
参考文献
1,冯晓东,蔡英年.内皮衍生因子(ET/NO)与低氧性肺动脉高压.基础医学与临床,1996,16:6-10.
2,蔡英年.肺动脉高压形成时肺血管细胞的增殖和调节.生理科学进展, 1992,23,298-302.
3,冉丕鑫.血小板生长因子研究进展.国外医学生理、病理科学与临床分册,1993,13:136-138.
4,Katayose D.Increased expression of PDGF A-and B-chain genes in rat lungs with hypoxic pulmonary hypertension.Am J Physiol,1993,264(2 Pt 1):100-106.
5,Barth PJ,Kimpel C,Roy S,et al.An improved mathematical approach for the assessment of the medial thickness of pulmonary arteries.Pathol Res Pract,1993,189:567-576.
, http://www.100md.com
6,杨景山,主编.医学细胞化学与细胞生物技术.北京:北京医科大学中国协和医科大学联合出版社, 1990.72-114.
7,Kouyoumdjian C.Continuous inhalation of nitric oxide protects against development of pulmonary hypertension in chronically hypoxic rats.J Clin Invest,1994,94:578-584.
8,Horstman DJ.Prolong inhaled NO attenuates hypoxic,but not monocrotaline-induced,pulmonary vascular remodeling in rats.Anesth-Analg,1998,86: 74-81.
9,齐建光,杜军保,贾建锋.内源性一氧化氮调节大鼠低氧性肺血管结构的重建.中华儿科杂志,1999,37:104-106.
, 百拇医药
10,鲁青,孙仁宇,张宏,等.血小板源生长因子及其受体基因表达在低氧大鼠肺中的变化.基础医学与临床,1995,15:192-194.
11,Quinn DA.The role of Na+/H+ exchange and growth factors in pulmonary artery smooth muscle cell proliferation.Am J Respir Cell Mol Biol,1996,14:139-145.
12,冉丕鑫,钟南山.生长因子、原癌基因与低氧性肺动脉高压.基础医学与临床,1996,16:1-5.
13,Kourembanas S,Lynda P.Nitric oxide regulates the expression of vasoconstrictors and growth factors by vascular endothelium under both normoxia and hypoxia.J Clin Invest,1993,92:99-104.
(收稿日期:2000-01-10), 百拇医药