大鼠脑缺血-再灌注损伤诱导IL-1β的表达
作者:张 岚 李向红 谷志远 赵亚力 郝好杰
单位:张 岚 李向红 中国人民解放军总医院微循环研究室;谷志远 赵亚力 郝好杰 分子生物学研究室 (北京100853)
关键词:脑;局部缺血;再灌注;白细胞介素1
中国病理生理杂志990204 摘 要 目的:研究脑缺血-再灌注损伤早期大鼠脑组织中IL-1β的表达及其与中性粒细胞浸润的关系。方法:应用反转录多聚酶链反应(RT-PCR)检测IL-1β mRNA,并用图象处理系统对正常、缺血及再灌注后不同时间的IL-1β mRNA进行相对定量分析;采用MTT和MPO方法分别对大鼠脑组IL-1β的多肽活性及浸润的中性粒细胞进行检测。结果:单纯脑缺血IL-1β表达不增加;再灌注2 h,IL-1β mRNA表达量明显增加,再灌注3 h,脑组织中IL-1多肽活性显著升高;再灌注9 h,中性粒细胞粘附到微血管壁并浸润到周围脑组织中。结论:脑缺血-再灌注损伤早期即有IL-1β mRNA的表达并伴有相应活性多肽的合成分泌,与再灌注损伤后期的白细胞浸润密切相关。
, 百拇医药
Brain ischemia-reperfusion injury induces IL-1β expression in rats
ZHANG Lan,LI Xiang-Hong,GU Zhi-Yuan,ZHAO Ya-Li,HAO Hao-Jie
Lab of Microcirculation,Lab of Molecular Biology,PLA General Hospital,Beijing(100853)
Abstract AIM:To detect the expression of endogenous IL-1β in the rat brain during brain ischemia-reperfusion injury and study its relationship with the infiltration of polymorphonuclear leukocytes.METHODS:IL-1β mRNA content were measured with reverse transcription followed by polymerase chain reaction amplification (RT-PCR).Tissue IL-1 peptide activity was detected by MTT bioassay.The number of infiltrated polymorphonuclear neutrophil was quantitatively studied with MPO activity measurement.RESULTS:Ischemia alone did not lead to increased expression of IL-1β.At 2 h of reperfusion IL-1β mRNA increased markedly.After 9 h of reperfusion leukocytes adhered to microvascular walls and migrated into surrounding brain tissue.CONCLUSION:Rapid expression of IL-1β at early period of brain ischemia-reperfusion injury is closely related to the pathologic development of brain injury.
, 百拇医药
MeSH Brain; Ischemia; Reperfusion;IL-1β
IL-1β是多功能的细胞因子,在正常中枢神经系统发育和脑对各种损伤的反应中有重要的作用[1]。IL-1β的生物学作用包括刺激其它细胞因子和可溶性损伤介质的合成、诱导白细胞浸润、影响胶质细胞的基因表达等。研究说明[2],IL-1β与脑缺血-再灌注损伤有关。本实验的目的在于研究脑缺血-再灌注早期IL-1β的表达及其与中性粒细胞浸润的关系。
材料与方法
(一)动物模型的复制:参照Bannister[3]方法。雄性Wistar大鼠,平均体重250g(n=60)。钳夹右侧颈总及颈内动脉,行左侧颈总动脉远心端及颈静脉近心端插管并连接两管造成缺血。缺血60min后松开动脉夹进行再灌。激光多普勒血流图像仪(LDIPIM1.0,瑞典)监测缺血前后软脑膜血流量。大鼠随机分为正常、缺血60min及再灌注2h、3h、6h、9h和12h共7个实验组。
, 百拇医药
(二)反转录-多聚酶链反应(RT-PCR):常规提取脑组织RNA,RT-PCR反应按试剂盒(PROMAGE公司)说明进行。IL-1β[4]引物1:GACCTGCTTCTTTGAGGCTGAC,引物2:TTCATCTCGAAGCCTGCAGTG;GAPDH[5]引物1:ACCACCATGGAGAAGGCTGG,引物2:CGTAGGACCCGATGTGACTC。PCR反应条件94℃ 1 min、55℃ 1 min、72℃ 1 min,35个循环。反应产物内对照GAPDH528 bp及IL-1β 330 bp在1.6%琼脂糖凝胶电泳,图象处理系统(本院通用医学图象处理分析系统)对IL-1β及GAPDH条带灰度进行扫描,两者的灰度比率作为各组的半定量结果。
(三)IL-1多肽活性检测:96孔培养板每孔加小鼠胸腺细胞悬液100μL(6×106/mL),1640培基50μL,大鼠脑组织匀浆液50μL,设阴性对照。37 ℃二氧化碳培养箱中孵育60h后加MTT(2g/L)50μL/孔,室温放置6h。离心后加DMSO 100μL/孔,分光光度计在492nm处读取OD值。
, 百拇医药
(四)浸润白细胞的观测:生理盐水经心脏灌注,4%多聚甲醛内固定脑组织后石蜡切片、HE染色、光镜观察。
MPO定量检测浸润到组织中的白细胞数。取正常、缺血及再灌12h组大鼠脑组织匀浆液加入0.5% HTAB(SIGMA公司)放置2min。离心取上清0.1mL加0.167g/L邻联茴香胺二盐酸化物(Sigma公司)和0.0005%过氧化氢混合液2.9mL。恒温紫外分光光度计在波长460nm处每隔15s连续记录OD值。MPO活性(U)定义为27 ℃单位时间(分)内OD值的变化。
(五)统计分析:所有数据均用平均值±标准差(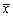 ±s)表示。个体前后资料进行自身对照t检验,两组间资料进行两均数t检验,多组资料进行方差分析。
±s)表示。个体前后资料进行自身对照t检验,两组间资料进行两均数t检验,多组资料进行方差分析。
结 果
, 百拇医药 (一)脑缺血-再灌注时脑血流的改变:脑顶部软脑膜血流量正常时左侧(4.64±0.50)V,右侧(5.40±1.12)V,缺血时左侧(1.88±1.20)V,右侧(3.07±0.29)V,两侧在缺血前后血流量均有下降(P<0.01)。缺血时血流下降的百分比为左侧59%,右侧41%,左侧(引流侧)缺血明显P<0.05。双侧血流于再灌注后恢复正常。
(二)IL-1β mRNA的表达:图1见IL-1β mRNA在正常及缺血脑组织表达较弱,再灌注2 h后表达明显升高。25例样品的灰度比率正常组为0.568±0.011、缺血组为0.603±0.023、再灌注组为1.076±0.015,再灌组与前两组相比P<0.001,缺血组与正常组间无显著差异(P>0.05)。
(三)IL-1多肽活性的改变:正常、缺血、再灌注3h、6h、9h和12h各组IL-1多肽活性(OD值/g)分别为23.10±2.13、23.78±4.51、33.73±3.16、36.40±2.38、34.48±2.51和32.04±2.41,缺血组与正常组间无显著性差异P>0.05,再灌各组与缺血组相比P<0.01(n=40,图2)。
, 百拇医药
(四)白细胞的粘附和浸润:光镜观察见再灌9h后大量的中性粒细胞嵌塞缺血区微血管并浸润到周围脑组织中。组织MPO活性在正常、缺血及再灌12h时分别为(0.40±0.06)U/g、(0.45±0.10)U/g和(0.90±0.12)U/g,缺血组与正常间无显著差异(P>0.05),再灌组明显高于缺血和正常组(P<0.01)。
Fig 1 RT-PCR detection of IL-1β mRNA expression in brain tissue
图1 RT-PCR检测脑组织中IL-1β mRNA的表达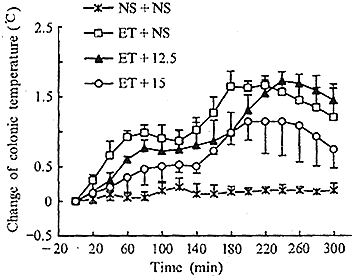
Fig 2 The change of IL-1 peptide activity in brain tissue during brain ischemia-reperfusion.
, 百拇医药
P<0.01,vs normal(n=40)图2 脑缺血-再灌注脑组织IL-1多肽活性的变化
讨 论
我们以暂时性脑缺血的大鼠模型,对内源性IL-1β mRNA及其多肽的表达进行了检测。结果显示,单纯缺血不引起IL-1 β的改变,再灌注早期有IL-1β的快速合成。在已有的文献中[2],IL-1β mRNA的表达与我们的结果相似,但缺少对其活性多肽的同期观测。我们认为,基因转录后不一定都伴有相应蛋白的翻译,而细胞因子各种生物学功能是靠其活性多肽或蛋白来完成的。因此我们对IL-1β基因和多肽水平的检测充分说明其在脑缺血-再灌注损伤早期必定发挥着重要的作用。
实验中我们也证实脑缺血-再灌注后期有大量中性粒细胞浸润到损伤区脑组织,而内源性IL-1β的表达早于中性粒细胞的浸润说明,IL-1β参与调节这种炎症反应。作为白细胞的趋化因子,IL-1β可直接诱导白细胞的趋化活动[6]。同时IL-1β又可与内皮细胞表面的I类受体结合激活内皮细胞,使之表达粘附分子ICAM-1和其它细胞因子如IL-8、ICAM-1为中性粒细胞与血管壁的粘附提供特异性结合位点,IL-8则促进了中性粒细胞的跨内皮游出[7]。我们曾报道[8],脑缺血-再灌注后内皮细胞ICAM-1的表达与脑组织中IL-1β的改变有关。又有研究表明[9],IL-1β受体拮抗剂可减少白细胞的浸润和神经元细胞的坏死。可见脑缺血-再灌注后IL-1β的表达直接和/或间接诱导了中性粒细胞在组织中的浸润。
, 百拇医药
脑缺血-再灌注后IL-1β产生的细胞机制尚不清楚。它可由胶质细胞、神经元细胞和内皮细胞合成分泌,同时又把它们作为靶细胞,不仅启动了机体对损伤的应答,而且放大了对损伤的反应。我们的实验说明,内源性IL-1β在脑缺血-再灌注损伤早期的快速合成与组织损伤的病理进程密切相关。
*国家自然科学基金资助(No.39770272)
参考文献
1 Rothwell NJ.Functional mechanism of IL-1 in the brain.Trends Phamacol Sci,1991,12:430.
2 Liu T,McDonnell PC,Young PR,et al.Interleukin-1β mRNA expression in ischemic rat cortex.Stroke,1993,24:1746.
, 百拇医药
3 Cary MB,FRCS,Sonia AC.Ischemia and revascularization of the middle cerebral territory of the rat brain by manipulation of the blood vessels.Surg Neurol,1984,21:351.
4 Nishida T,Hirato T,Nishino N.Cloning of the cDNAs for rat IL-1α and β.Prog Leukocyte Biol,1988,8:73.
5 Tso JY,Sun XH,Kao TH.Isolation and characterization of rat and human glyceraldehyde-3-phosphate dehydrogene cDNA:genomic complexity and molecular evolution of the gene.Nucleic Acids Res,1985,13:2485.
, http://www.100md.com
6 Hallenbeck JM,Dutka AJ,Kochanek PM,et al.Stroke risk factor prepare rat brain stem tissue for modified local Shwartzman reaction.Stroke,1988,19:863.
7 Kaplanski G,Farnarier C,Kaplanski S,et al.IL-1 induces IL-8 secretion from endothelial cells by a juxtractine mechanism.Blood,1994,84:4242.
8 张 岚,李向红,宋 欣.大鼠脑缺血再灌注损伤细胞间粘附分子-1表达的研究.中国应用生理学杂志,1997,13(1):1.
9 Julio HG,Kai FL,Jane KR.IL-1 receptor antagonist decrease the number of necrotic neurons in rats with middle cerebral artery occlusion.Am J Path,1995,147:1477.
收稿日期:1997年3月27日
修稿日期:1997年10月29日, 百拇医药
单位:张 岚 李向红 中国人民解放军总医院微循环研究室;谷志远 赵亚力 郝好杰 分子生物学研究室 (北京100853)
关键词:脑;局部缺血;再灌注;白细胞介素1
中国病理生理杂志990204 摘 要 目的:研究脑缺血-再灌注损伤早期大鼠脑组织中IL-1β的表达及其与中性粒细胞浸润的关系。方法:应用反转录多聚酶链反应(RT-PCR)检测IL-1β mRNA,并用图象处理系统对正常、缺血及再灌注后不同时间的IL-1β mRNA进行相对定量分析;采用MTT和MPO方法分别对大鼠脑组IL-1β的多肽活性及浸润的中性粒细胞进行检测。结果:单纯脑缺血IL-1β表达不增加;再灌注2 h,IL-1β mRNA表达量明显增加,再灌注3 h,脑组织中IL-1多肽活性显著升高;再灌注9 h,中性粒细胞粘附到微血管壁并浸润到周围脑组织中。结论:脑缺血-再灌注损伤早期即有IL-1β mRNA的表达并伴有相应活性多肽的合成分泌,与再灌注损伤后期的白细胞浸润密切相关。
, 百拇医药
Brain ischemia-reperfusion injury induces IL-1β expression in rats
ZHANG Lan,LI Xiang-Hong,GU Zhi-Yuan,ZHAO Ya-Li,HAO Hao-Jie
Lab of Microcirculation,Lab of Molecular Biology,PLA General Hospital,Beijing(100853)
Abstract AIM:To detect the expression of endogenous IL-1β in the rat brain during brain ischemia-reperfusion injury and study its relationship with the infiltration of polymorphonuclear leukocytes.METHODS:IL-1β mRNA content were measured with reverse transcription followed by polymerase chain reaction amplification (RT-PCR).Tissue IL-1 peptide activity was detected by MTT bioassay.The number of infiltrated polymorphonuclear neutrophil was quantitatively studied with MPO activity measurement.RESULTS:Ischemia alone did not lead to increased expression of IL-1β.At 2 h of reperfusion IL-1β mRNA increased markedly.After 9 h of reperfusion leukocytes adhered to microvascular walls and migrated into surrounding brain tissue.CONCLUSION:Rapid expression of IL-1β at early period of brain ischemia-reperfusion injury is closely related to the pathologic development of brain injury.
, 百拇医药
MeSH Brain; Ischemia; Reperfusion;IL-1β
IL-1β是多功能的细胞因子,在正常中枢神经系统发育和脑对各种损伤的反应中有重要的作用[1]。IL-1β的生物学作用包括刺激其它细胞因子和可溶性损伤介质的合成、诱导白细胞浸润、影响胶质细胞的基因表达等。研究说明[2],IL-1β与脑缺血-再灌注损伤有关。本实验的目的在于研究脑缺血-再灌注早期IL-1β的表达及其与中性粒细胞浸润的关系。
材料与方法
(一)动物模型的复制:参照Bannister[3]方法。雄性Wistar大鼠,平均体重250g(n=60)。钳夹右侧颈总及颈内动脉,行左侧颈总动脉远心端及颈静脉近心端插管并连接两管造成缺血。缺血60min后松开动脉夹进行再灌。激光多普勒血流图像仪(LDIPIM1.0,瑞典)监测缺血前后软脑膜血流量。大鼠随机分为正常、缺血60min及再灌注2h、3h、6h、9h和12h共7个实验组。
, 百拇医药
(二)反转录-多聚酶链反应(RT-PCR):常规提取脑组织RNA,RT-PCR反应按试剂盒(PROMAGE公司)说明进行。IL-1β[4]引物1:GACCTGCTTCTTTGAGGCTGAC,引物2:TTCATCTCGAAGCCTGCAGTG;GAPDH[5]引物1:ACCACCATGGAGAAGGCTGG,引物2:CGTAGGACCCGATGTGACTC。PCR反应条件94℃ 1 min、55℃ 1 min、72℃ 1 min,35个循环。反应产物内对照GAPDH528 bp及IL-1β 330 bp在1.6%琼脂糖凝胶电泳,图象处理系统(本院通用医学图象处理分析系统)对IL-1β及GAPDH条带灰度进行扫描,两者的灰度比率作为各组的半定量结果。
(三)IL-1多肽活性检测:96孔培养板每孔加小鼠胸腺细胞悬液100μL(6×106/mL),1640培基50μL,大鼠脑组织匀浆液50μL,设阴性对照。37 ℃二氧化碳培养箱中孵育60h后加MTT(2g/L)50μL/孔,室温放置6h。离心后加DMSO 100μL/孔,分光光度计在492nm处读取OD值。
, 百拇医药
(四)浸润白细胞的观测:生理盐水经心脏灌注,4%多聚甲醛内固定脑组织后石蜡切片、HE染色、光镜观察。
MPO定量检测浸润到组织中的白细胞数。取正常、缺血及再灌12h组大鼠脑组织匀浆液加入0.5% HTAB(SIGMA公司)放置2min。离心取上清0.1mL加0.167g/L邻联茴香胺二盐酸化物(Sigma公司)和0.0005%过氧化氢混合液2.9mL。恒温紫外分光光度计在波长460nm处每隔15s连续记录OD值。MPO活性(U)定义为27 ℃单位时间(分)内OD值的变化。
(五)统计分析:所有数据均用平均值±标准差(
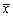 ±s)表示。个体前后资料进行自身对照t检验,两组间资料进行两均数t检验,多组资料进行方差分析。
±s)表示。个体前后资料进行自身对照t检验,两组间资料进行两均数t检验,多组资料进行方差分析。结 果
, 百拇医药 (一)脑缺血-再灌注时脑血流的改变:脑顶部软脑膜血流量正常时左侧(4.64±0.50)V,右侧(5.40±1.12)V,缺血时左侧(1.88±1.20)V,右侧(3.07±0.29)V,两侧在缺血前后血流量均有下降(P<0.01)。缺血时血流下降的百分比为左侧59%,右侧41%,左侧(引流侧)缺血明显P<0.05。双侧血流于再灌注后恢复正常。
(二)IL-1β mRNA的表达:图1见IL-1β mRNA在正常及缺血脑组织表达较弱,再灌注2 h后表达明显升高。25例样品的灰度比率正常组为0.568±0.011、缺血组为0.603±0.023、再灌注组为1.076±0.015,再灌组与前两组相比P<0.001,缺血组与正常组间无显著差异(P>0.05)。
(三)IL-1多肽活性的改变:正常、缺血、再灌注3h、6h、9h和12h各组IL-1多肽活性(OD值/g)分别为23.10±2.13、23.78±4.51、33.73±3.16、36.40±2.38、34.48±2.51和32.04±2.41,缺血组与正常组间无显著性差异P>0.05,再灌各组与缺血组相比P<0.01(n=40,图2)。
, 百拇医药
(四)白细胞的粘附和浸润:光镜观察见再灌9h后大量的中性粒细胞嵌塞缺血区微血管并浸润到周围脑组织中。组织MPO活性在正常、缺血及再灌12h时分别为(0.40±0.06)U/g、(0.45±0.10)U/g和(0.90±0.12)U/g,缺血组与正常间无显著差异(P>0.05),再灌组明显高于缺血和正常组(P<0.01)。

Fig 1 RT-PCR detection of IL-1β mRNA expression in brain tissue
图1 RT-PCR检测脑组织中IL-1β mRNA的表达

Fig 2 The change of IL-1 peptide activity in brain tissue during brain ischemia-reperfusion.
, 百拇医药
P<0.01,vs normal(n=40)图2 脑缺血-再灌注脑组织IL-1多肽活性的变化
讨 论
我们以暂时性脑缺血的大鼠模型,对内源性IL-1β mRNA及其多肽的表达进行了检测。结果显示,单纯缺血不引起IL-1 β的改变,再灌注早期有IL-1β的快速合成。在已有的文献中[2],IL-1β mRNA的表达与我们的结果相似,但缺少对其活性多肽的同期观测。我们认为,基因转录后不一定都伴有相应蛋白的翻译,而细胞因子各种生物学功能是靠其活性多肽或蛋白来完成的。因此我们对IL-1β基因和多肽水平的检测充分说明其在脑缺血-再灌注损伤早期必定发挥着重要的作用。
实验中我们也证实脑缺血-再灌注后期有大量中性粒细胞浸润到损伤区脑组织,而内源性IL-1β的表达早于中性粒细胞的浸润说明,IL-1β参与调节这种炎症反应。作为白细胞的趋化因子,IL-1β可直接诱导白细胞的趋化活动[6]。同时IL-1β又可与内皮细胞表面的I类受体结合激活内皮细胞,使之表达粘附分子ICAM-1和其它细胞因子如IL-8、ICAM-1为中性粒细胞与血管壁的粘附提供特异性结合位点,IL-8则促进了中性粒细胞的跨内皮游出[7]。我们曾报道[8],脑缺血-再灌注后内皮细胞ICAM-1的表达与脑组织中IL-1β的改变有关。又有研究表明[9],IL-1β受体拮抗剂可减少白细胞的浸润和神经元细胞的坏死。可见脑缺血-再灌注后IL-1β的表达直接和/或间接诱导了中性粒细胞在组织中的浸润。
, 百拇医药
脑缺血-再灌注后IL-1β产生的细胞机制尚不清楚。它可由胶质细胞、神经元细胞和内皮细胞合成分泌,同时又把它们作为靶细胞,不仅启动了机体对损伤的应答,而且放大了对损伤的反应。我们的实验说明,内源性IL-1β在脑缺血-再灌注损伤早期的快速合成与组织损伤的病理进程密切相关。
*国家自然科学基金资助(No.39770272)
参考文献
1 Rothwell NJ.Functional mechanism of IL-1 in the brain.Trends Phamacol Sci,1991,12:430.
2 Liu T,McDonnell PC,Young PR,et al.Interleukin-1β mRNA expression in ischemic rat cortex.Stroke,1993,24:1746.
, 百拇医药
3 Cary MB,FRCS,Sonia AC.Ischemia and revascularization of the middle cerebral territory of the rat brain by manipulation of the blood vessels.Surg Neurol,1984,21:351.
4 Nishida T,Hirato T,Nishino N.Cloning of the cDNAs for rat IL-1α and β.Prog Leukocyte Biol,1988,8:73.
5 Tso JY,Sun XH,Kao TH.Isolation and characterization of rat and human glyceraldehyde-3-phosphate dehydrogene cDNA:genomic complexity and molecular evolution of the gene.Nucleic Acids Res,1985,13:2485.
, http://www.100md.com
6 Hallenbeck JM,Dutka AJ,Kochanek PM,et al.Stroke risk factor prepare rat brain stem tissue for modified local Shwartzman reaction.Stroke,1988,19:863.
7 Kaplanski G,Farnarier C,Kaplanski S,et al.IL-1 induces IL-8 secretion from endothelial cells by a juxtractine mechanism.Blood,1994,84:4242.
8 张 岚,李向红,宋 欣.大鼠脑缺血再灌注损伤细胞间粘附分子-1表达的研究.中国应用生理学杂志,1997,13(1):1.
9 Julio HG,Kai FL,Jane KR.IL-1 receptor antagonist decrease the number of necrotic neurons in rats with middle cerebral artery occlusion.Am J Path,1995,147:1477.
收稿日期:1997年3月27日
修稿日期:1997年10月29日, 百拇医药