酶消化法分离大鼠主动脉内皮细胞的改进方法
作者:徐荣良
单位:上海长海医院心内科(200433)
关键词:
中国病理生理杂志990329 大鼠来源方便,价格相对较低,并有以往大量的研究基础,故往往成为急慢性实验的动物模型对象,它也是研究动脉粥样硬化的模型之一。但采用体外培养分离大鼠主动脉内皮细胞较困难。笔者曾用酶灌注消化法,机械刮取法及组织贴块法等来分离培养大鼠主动脉内皮细胞,均未取得满意结果,不是细胞受损伤不长就是细胞成分很杂,难以用于实验。由于大鼠胸主动脉短小,灌注消化液不易操作,加上分支极细,不可能结扎,消化液即使灌进去也会渗漏到外膜,使外膜也被消化,导致细胞杂染。因此,本文对此法作了改进,取得较好效果。
一、自制消化槽:
采用有机玻璃制作,一副消化槽包括一块底板,一块带槽孔的板,一块盖板(见图1)。三块板宽度均2.5 cm,底板及槽孔板长7 cm,盖板长4 cm,槽孔板要厚些6 mm,槽孔居中,长2 cm宽3 mm(用烧红的锯条先在有机玻璃板上穿一孔,再用扁锉或铁砂纸扩大至要求的尺寸),底板及盖板可用薄些的材料,共做6副。做好后用肥皂洗净凉干,用前用微波炉(650 W)中火消毒2 min。另外每副消化槽配两只金属文件夹(夹力大的为好)和一块大小与底板相仿的乳胶薄膜(可用乳胶手套剪取),用前高压灭菌消毒。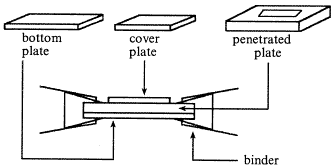
, http://www.100md.com
Fig 1 The schematic diagram of digestion device.
图1 消化槽示意图
二、操作方法:
1. 乙醚麻醉,无菌条件下剪取正常SD大鼠(200 g左右)胸主动脉6条(一般已能分离到较多内皮细胞),放入4℃PBS(pH7.4,青霉素2×105 U/L,链霉素(200 mg/L)。
2. 在超净台里用小镊子及眼科剪细心轻柔地尽量清除血管外膜上的脂肪和结缔组织,用眼科剪轻柔地沿血管纵向剪开,用PBS轻轻冲净血管内膜面血液。
3. 将消毒过的底板平放在无菌大号培养皿中,上面平铺一层乳胶膜,将剪开的血管内膜面向上纵向平铺在乳胶膜上,由于乳胶膜的粘着,血管片很容易铺平。将槽孔对准血管片平放上槽孔板,使血管片的边缘压在槽孔之外,盖上盖板。
, 百拇医药
4. 戴无菌手套,在底板及槽孔板两端用文件夹夹紧。
5. 打开盖板,将预热至37 ℃的0.1%胶原酶(Ⅱ型)用注射器滴入槽孔内至4 mm深,盖上盖板,移至37 ℃孵箱内消化15 min(消化时间视消化效果适当调整)。
6. 取出消化槽,在超净台里打开盖板,用注射器针头轻轻抽吸冲洗数次后吸出消化液,注入离心管,再用少量的PBS冲洗数次后吸出一并注入离心管,1200 r/min 离心8 min,弃上清液,用DMEM培养液洗涤一次,同样离心后弃上清液,然后用DMEM培养液接种于35 mm培养皿中。
三、注意事项:
1. 由于操作步骤较多,必须严格无菌操作,以免污染,并尽量避免损伤内皮。
2. 血管片要铺平,其边缘要压在槽孔之外,垫上乳胶片是为了四周能压紧,不使消化液外渗。取放消化槽时务使消化液不溢出,最好将盖板对向槽孔部分刻成凹形,不使盖板与槽孔边缘接触,避免由于毛细作用将消化槽内的消化液吸干。
3. 消化槽不宜用高火或长时间微波消毒,以免有机玻璃过热变形而不能使用。如用不锈钢制作消化槽则可用高压灭菌消毒,消毒效果好而且更耐用。
4. 由于大鼠主动脉细小,收集的细胞偏小,且原代生长较慢,故原代培养最好能用内皮细胞生长因子刺激细胞增殖。
1997年5月7日收稿,1997年10月6日修回, http://www.100md.com
单位:上海长海医院心内科(200433)
关键词:
中国病理生理杂志990329 大鼠来源方便,价格相对较低,并有以往大量的研究基础,故往往成为急慢性实验的动物模型对象,它也是研究动脉粥样硬化的模型之一。但采用体外培养分离大鼠主动脉内皮细胞较困难。笔者曾用酶灌注消化法,机械刮取法及组织贴块法等来分离培养大鼠主动脉内皮细胞,均未取得满意结果,不是细胞受损伤不长就是细胞成分很杂,难以用于实验。由于大鼠胸主动脉短小,灌注消化液不易操作,加上分支极细,不可能结扎,消化液即使灌进去也会渗漏到外膜,使外膜也被消化,导致细胞杂染。因此,本文对此法作了改进,取得较好效果。
一、自制消化槽:
采用有机玻璃制作,一副消化槽包括一块底板,一块带槽孔的板,一块盖板(见图1)。三块板宽度均2.5 cm,底板及槽孔板长7 cm,盖板长4 cm,槽孔板要厚些6 mm,槽孔居中,长2 cm宽3 mm(用烧红的锯条先在有机玻璃板上穿一孔,再用扁锉或铁砂纸扩大至要求的尺寸),底板及盖板可用薄些的材料,共做6副。做好后用肥皂洗净凉干,用前用微波炉(650 W)中火消毒2 min。另外每副消化槽配两只金属文件夹(夹力大的为好)和一块大小与底板相仿的乳胶薄膜(可用乳胶手套剪取),用前高压灭菌消毒。

, http://www.100md.com
Fig 1 The schematic diagram of digestion device.
图1 消化槽示意图
二、操作方法:
1. 乙醚麻醉,无菌条件下剪取正常SD大鼠(200 g左右)胸主动脉6条(一般已能分离到较多内皮细胞),放入4℃PBS(pH7.4,青霉素2×105 U/L,链霉素(200 mg/L)。
2. 在超净台里用小镊子及眼科剪细心轻柔地尽量清除血管外膜上的脂肪和结缔组织,用眼科剪轻柔地沿血管纵向剪开,用PBS轻轻冲净血管内膜面血液。
3. 将消毒过的底板平放在无菌大号培养皿中,上面平铺一层乳胶膜,将剪开的血管内膜面向上纵向平铺在乳胶膜上,由于乳胶膜的粘着,血管片很容易铺平。将槽孔对准血管片平放上槽孔板,使血管片的边缘压在槽孔之外,盖上盖板。
, 百拇医药
4. 戴无菌手套,在底板及槽孔板两端用文件夹夹紧。
5. 打开盖板,将预热至37 ℃的0.1%胶原酶(Ⅱ型)用注射器滴入槽孔内至4 mm深,盖上盖板,移至37 ℃孵箱内消化15 min(消化时间视消化效果适当调整)。
6. 取出消化槽,在超净台里打开盖板,用注射器针头轻轻抽吸冲洗数次后吸出消化液,注入离心管,再用少量的PBS冲洗数次后吸出一并注入离心管,1200 r/min 离心8 min,弃上清液,用DMEM培养液洗涤一次,同样离心后弃上清液,然后用DMEM培养液接种于35 mm培养皿中。
三、注意事项:
1. 由于操作步骤较多,必须严格无菌操作,以免污染,并尽量避免损伤内皮。
2. 血管片要铺平,其边缘要压在槽孔之外,垫上乳胶片是为了四周能压紧,不使消化液外渗。取放消化槽时务使消化液不溢出,最好将盖板对向槽孔部分刻成凹形,不使盖板与槽孔边缘接触,避免由于毛细作用将消化槽内的消化液吸干。
3. 消化槽不宜用高火或长时间微波消毒,以免有机玻璃过热变形而不能使用。如用不锈钢制作消化槽则可用高压灭菌消毒,消毒效果好而且更耐用。
4. 由于大鼠主动脉细小,收集的细胞偏小,且原代生长较慢,故原代培养最好能用内皮细胞生长因子刺激细胞增殖。
1997年5月7日收稿,1997年10月6日修回, http://www.100md.com