咖啡因对胎鼠及乳鼠睾丸生殖细胞DNA合成影响的体外研究*
作者:李 铮 夏潮涌 卢乃媚
单位:夏潮涌 卢乃媚 暨南大学医学院组织胚胎学教研室(广州 510632);李 铮 广州市肿瘤医院生物工程研究室(广州 510095)
关键词:咖啡因;睾丸;生殖细胞;DNA
咖啡因对胎鼠及乳鼠睾丸生殖细胞DNA合成 影响的体外研究
摘 要 目的:了解咖啡因对胚胎及新生时期生殖细胞合成DNA的影响及其机制。方法:采用低(0.3 mmol/L)、中(0.6 mmol/L)、高(1.2 mmol/L) 浓度咖啡因体外培养SD孕18 d胎鼠、0 d及4 d乳鼠睾丸组织块,培养时间分别为1、2、3周, 用放射自显影、计算机图像分析的方法观察咖啡因对生殖细胞摄取[3 H]-TdR及DNA含量的 影响。结果:(1)18 d胎鼠、0 d乳鼠、4 d乳鼠睾丸培养组织内生殖细胞受咖啡因影响依次增加。(2)浓度越高、培养时间越长,咖啡因对生殖细胞影响越明显。(3)生殖细胞数量的减少往往伴随DNA含量和[3H]-TdR摄取的降低。结论:高浓度咖啡因长时间培养后使生殖细胞数量减少可能与干扰细胞摄取DNA前体物质,降低细胞内DNA含量有关。
, 百拇医药
The effect of caffeine on the DNA synthese of germ cells in
testes of fetal and newborn rats in vitro research
LI Zheng*,XIA Chao-Yong, LU Nai-Mei
Department of Histology and Embryology, Medical College, Jinan University, Guangzhou (510632)
* Institute of Biological Engineering, Cancer Hospital of Guangzhou, Guangzhou (510096)
, 百拇医药
Abstract AIM: To investigate the effect of caffeine on the DNA synthese of germ cells.METHODS:Low (0.3 mmol/L), medium(0.6 mmol/L) and high (1.2 mmol/L) doses of caffeine were used in tissue culture of testicular organ explant taken from 18 days fetal rats, 0 day and 4 days neonatal rats. Autoradiogrophy and computer image analysing were used to observe the [3H]-TdR intake and DNA content of germ cells. RESULTS:(1) The effects of caffeine on the germ cells of 18 days fetal testes explant were the least; those on the 0 day were moderate; while those on the 4 days testes were the most. (2) The higher the concentration and the longer the culture time was, the more influence was exerted on germ cells. (3) The decrease of the number of germ cells was accompanied by the decrease of [3H]-TdR intake and DNA content in most groups. CONCLUSION:That high doses of caffeine inhibit the proliferation of germ cells after culturing for a long time through intervening the intake of [3H]-TdR and decrease the content of DNA.
, http://www.100md.com
MeSH Caffeine; Testis; Germ cells; DNA
由于含咖啡因(caffeine, Caf)饮料的普遍性,Caf.对人体的作用和其副作用尤其对某些器官是否有害的研究受到人们的关注[1]。Caf对男生殖系统有影响:长期服用大剂量Caf可使睾丸体积减少、生精小管退变、成熟精子的数量减少等[2]。Caf在胎儿、新生儿体内代谢较慢,使其在胎儿、新生儿体内蓄积,此时Caf对生殖细胞有无影响?值得研究。有的学者发现,Caf可作用于细胞核,影响到使胞核崩解、染色体断裂[3]。因此我们选择检测了与细胞合成DNA有关的[3H]-TdR标记细胞数、DNA含量等指标来探讨Caf对生殖细胞DNA合成的影响。
材料与方法
一、睾丸组织块培养及组织学样品制备:
, http://www.100md.com
1.培养分组:取健康SD大鼠的18 d雄性胎鼠、0 d(出生当天)、4 d雄性乳鼠之睾丸组织,切为 1mm×1mm×1 mm左右的组织块,分别于下列培养液中培养1、2、3周:a.DMEM:对照组;b.DMEM+0.3 mmol/L咖啡因,低浓度组;c.DMEM+0.6 mmol/L咖啡因,中浓度组;d.DMEM+1.2 mmol/L咖啡因,高浓度组。
每一实验组培养组织块的数量不少于10块。4 d乳鼠来源的组织块置于32℃培养箱、18 d胎鼠及0 d新生鼠来源的组织块置于37℃培养箱内培养,两个培养箱内均含湿润的体积分数为5% CO2、95%空气。每隔3 d换培养液。对拟作放射自显影的组织,培养结束前在培养液内加入3.7×104 Bq/mL的[3H]-TdR共同孵育16 h。
2.组织样品制备:培养结束后,组织块用PBS冲洗两次。经[3H]-TdR示踪的组织用10%甲醛固定,未示踪者分别用10%甲醛和FAA(甲醛∶95%酒精∶冰醋酸为10∶85∶5)固定,包埋时将同一实验条件下的5~6块组织置于同一蜡块中。切片厚度为4 μm。
, http://www.100md.com
二、HE染色及放射自显影的观察计数:
1.HE染色及生殖细胞数量的记数:常规HE染色,每组选取10个组织块,每个组织块选取10个垂直切面的生精小管(共10×10=100个),计算小管内生殖细胞数与包括支持细胞在内的全部细胞数的百分比,并将各实验组与对照组相比较。
2.[3H]-TdR放射自显影(autoradiogrophy,ARG)方法及生殖细胞阳性率的计数:[3H]-TdR示踪后的组织切片用浸膜法[4]涂布乳胶,4℃冰箱内曝光10 d,经显影、定影、苏木素复染后,常规制片。ARG的对照片用不经[3H]-TdR示踪的睾丸培养组织切片,同法涂布乳胶,其余步骤同实验片。随机选取50个生殖细胞,黑色银粒平均为3~4个/生殖细胞,定为本底。
生殖细胞摄取[3H]-TdR阳性率的计数方法是:每个实验组选取10个组织块,每个组织块选取10个垂直切面的生精小管(共10×10=100个),光镜下有5粒以上黑色银粒的生殖细胞即为标记的生殖细胞。检测生精小管内标记的生殖细胞数及生殖细胞总数(包括标记与未标记的生殖细胞),计算百分比,与对照组作比较。
, 百拇医药
三、生殖细胞核DNA染色及其DNA含量的三维定量分析:
1.Feulgen染色:切片用二甲苯脱蜡后,5 mol/L HCl室温水解20 min,Schiff试剂(常规配方)室温染色1 h。
2.生殖细胞核DNA含量的三维定量分析:(1)以核距法测量生殖细胞核体积等参数,具体方法参照文献[5]。每组分别从同一切片上的5~6块组织中选取100个以上的的生殖细胞核进行测量。(2)按柯勒照明要求调整Olympus BX50多功能显微镜光源,在物镜与黑白摄像机之间插入535/35 nm的带通滤光片。40倍物镜(NA0.75)下,使用Tiger细胞图像分析仪(其测量光密度的性能参照文献[6])测量切片上的生殖细胞DNA的二维光密度参数,具体方法参照文献[6]。(3)生殖细胞核DNA含量的三维体积积分光密度:具体方法参照文献[7]。
, 百拇医药
四、统计学处理:
各Caf浓度实验组分别与同一鼠龄、同一培养时间的对照组比较。计数资料采用卡方检验处理,计量资料采用t检验。
结果
1.Caf对生殖细胞数量的影响,见表1。
表1 Caf对生殖细胞数量的影响
Tab 1 The effect of Caf on the number of germ cells(G/T,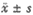 )
)
Culture medium
, http://www.100md.com
Culture time
18 days fetal rats
0 day newborn rats
4 days newborn rats
Control
0.22±0.11
0.17±0.06
0.15±0.08
0.3 mmol/L
One
0.24±0.12
, 百拇医药
0.16±0.08
0.13±0.06
0.6 mmol/L
week
0.20±0.11
0.15±0.07
0.12±0.07
1.2 mmol/L
0.18±0.09
0.14±0.09
0.12±0.06
Control
, 百拇医药
0.23±0.08
0.16±0.12
0.11±0.08
0.3 mmol/L
Two
0.21±0.12
0.15±0.09
0.12±0.09
0.6 mmol/L
weeks
0.16±0.06
0.11±0.10
, 百拇医药
0.09±0.05
1.2 mmol/L
0.12±0.06
0.10±0.06
0.03±0.01*
Control
0.22±0.11
0.17±0.09
0.11±0.07
0.3 mmol/L
Three
, http://www.100md.com 0.19±0.09
0.10±0.05
0.09±0.04
0.6 mmol/L
weeks
0.15±0.08
0.05±0.02*
0.02±0.01*
1.2 mmol/L
0.11±0.06
0.04±0.02*
, http://www.100md.com
0.01±0.01*
T=Total cell number; G=Germ cell number; *P<0.05, vs control
2.Caf对生殖细胞摄取[3H]-TdR的影响,见表2。
表2 Caf对生殖细胞摄取[3H]-TdR影响的放射自显影结果
Tab 2 The effect of Caf on [3H]-TdR intake of Germ cells (detected by ARG)(L/G,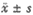 )
)
, http://www.100md.com
Culture medium
Culture time
18 days fetal rats
0 day newborn rats
4 days newborn rats
Control
0.91±0.06
0.91±0.09
0.15±0.08
0.3 mmol/L
One
, http://www.100md.com
0.89±0.08
0.87±0.10
0.74±0.10
0.6 mmol/L
week
0.80±0.10
0.68±0.10
0.66±0.10
1.2 mmol/L
0.75±0.09
0.61±0.09
0.59±0.11
, http://www.100md.com
Control
0.89±0.12
0.89±0.11
0.91±0.12
0.3 mmol/L
Two
0.84±0.09
0.72±0.09
0.70±0.09
0.6 mmol/L
weeks
0.73±0.08
, http://www.100md.com
0.56±0.10
0.25±0.08*
1.2 mmol/L
0.65±0.08
0.47±0.08*
0.19±0.07*
Control
0.89±0.11
0.88±0.11
0.90±0.13
0.3 mmol/L
, 百拇医药
Three
0.73±0.08
0.62±0.09
0.66±0.08
0.6 mmol/L
weeks
0.64±0.09
0.31±0.09*
0.09±0.04*
1.2 mmol/L
0.56±0.07*
, http://www.100md.com
0.24±0.08*
0.08±0.04*
G=Total germ cell number; L=Labeled germ cell number; *P<0.05, vs control
3.Caf对生殖细胞DNA含量的影响,见表3。
表3 Caf对生殖细胞DNA含量影响的定量分析结果
Tab 3 Quatitive analyses of the effect of caffeine on the DNA content of germ cells(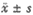 )
)
, 百拇医药
Culture medium
Culture time
18 days fetal rats
0 day newborn rats
4 days newborn rats
Control
82.6±27.4
91.8±39.1
88.2±40.8
0.3 mmol/L
One
, http://www.100md.com
88.9±35.9
82.9±38.4
84.9±39.8
0.6 mmol/L
week
79.3±29.4
83.9±42.9
91.9±43.3
1.2 mmol/L
78.0±34.4
92.7±39.5
85.0±39.1
, 百拇医药
Control
80.2±35.4
84.9±41.6
80.3±40.5
0.3 mmol/L
Two
74.1±34.7
82.3±36.3
77.2±35.6
0.6 mmol/L
weeks
81.8±38.9
, 百拇医药
77.9±42.6
68.2±30.9*
1.2 mmol/L
82.4±26.9
88.1±44.7
76.6±36.3
Control
80.6±37.2
82.3±34.9
85.9±43.9
0.3 mmol/L
, http://www.100md.com
Three
73.3±36.8
86.1±37.6
76.9±41.0
0.6 mmol/L
weeks
75.8±38.0
73.2±27.7*
72.2±38.1*
1.2 mmol/L
79.9±40.1
, 百拇医药
69.7±36.2*
80.7±39.7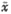 :Mean value of integrated optical density of volume unit of nuclear; *P<0.05, vs control
:Mean value of integrated optical density of volume unit of nuclear; *P<0.05, vs control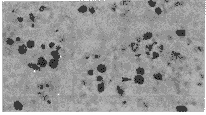
Fig 1 The 0 day testes after two weeks culture, (control group), hematoxylin restain, ×132, nucleus with black granule are cells intook [3H]-TdR
, 百拇医药
图1 0 d乳鼠睾丸组织块培养2周(对照组)
Fig 2 The 0 day testes after two weeks culture, 1.2 mmol/L Caf group,hematoxylin restain, ×132, the number of cells intook [3H]-TdR(decreased)
图1 0 d乳鼠睾丸组织块培养2周(实验组)
讨论
咖啡因对体外培养的睾丸组织内生殖细胞数量的影响,随不同浓度、不同作用时间及不同时期的睾丸组织而不同,表现一定的规律及相互联系。Caf对18 d胎鼠的睾丸组织培养块内生殖细胞影响较少;对0 d及4 d乳鼠的睾丸组织内生殖细胞的作用表现为浓度越高、培养时间越长,引起检测指标的变化越多;且4 d组比0 d组对咖啡因更敏感。这一实验结果,不仅表明了不同时期来源睾丸生殖细胞对Caf的反应性不同,也表现出不同浓度Caf对生殖细胞DNA合成的影响也有所不同。
, http://www.100md.com
结构显示,Caf使某些实验组生殖细胞中[3H]-TdR标记细胞的阳性率下降(见表2),在一定程度上说明Caf抑制了处于S期的生殖细胞对DNA特异前体物质[3H]-TdR的摄取,影响了生殖细胞DNA的合成。Caf的这一作用,可能是因为其化学结构类似腺嘌呤和鸟嘌呤,尤其是腺嘌呤,掺入到DNA结构中,干扰其复制[8]。在这一面,Tornaletti等也曾提出Caf可能插入DNA的双螺旋结构中,引起染色体损伤[3]。更新的研究表明,Caf还可抑制G2期内损伤DNA的修复[9]。所以,Caf对处于增殖状态的细胞,不仅引起S期DNA损伤,而且还抑制了这一损伤在G2期内的修复,使正常的DNA合成受到破坏,因而抑制了细胞的分裂增殖。
实验结果还显示,大部分引起[3H]-TdR标记细胞阳性率改变的实验条件,均有DNA含量及生殖细胞数量的减少,三个检测指标有一定的一致性。由此可以推想:Caf干扰了[3H]-TdR的摄取,达到一定程度后,使得DNA含量降低,细胞的分裂增殖受到抑制,最后导致细胞数量减少。由于[3 H]-TdR摄取的减少早于DNA含量的减少,是引起以后DNA含量发生改变的原因之一,所以有些实验组如18 d胎龄高浓度Caf培养3周组、0 d日龄高浓度Caf培养2周组和4 d乳鼠中浓度Caf培养2周组等并未出现三个检测指标的同时减少,但并不排除还有其它的原因,有待今后进一步探讨。
, 百拇医药
参考文献
1 Tina K L,Ronald R W, Mary E M. The effects of caffeine on various body systems:a review. J Am Diet Assoc, 1987, 87:1 048.
2 Pollard I, Smallshan J. Male mediated caffeine effects over two generations of rats. J Dev Physiol, 1988, 10(3):271.
3 Tornaletti S, Russo P, Parodi S, et al. Studies on DNA binding of caffeine and derivatives:evidence of interacion by DNA-unwinding experiments. Biochem Biophys Acta, 1989,1007:112.
, http://www.100md.com
4 刘鼎新.放射自显影技术.科学出版社,1986.
5 夏潮涌,夏志坚.细胞核体积测量与计算方法的比较研究.中国体视学与图象分析,1997,2(4):226.
6 夏潮涌,夏志坚,江博仙,等.显微图像分析系统测量细胞核DNA含量误差的研究.中国体视学与图像分析,1997,2(2):70.
7 夏潮涌,夏志坚.睾丸组织原位三维测量和分析生精细胞核的DNA含量与倍体.中国体视学与图像分析,1998,3(1):22.
8 Mitznegg P, Heim F, Hach B, et al. The effect of aging, caffeine-treatment, and ionizing-radiation on nucleic acid synthesis in the mouse liver. Life Sci, 1971,10:128.
9 Matsuda Y, Tobari I. Radiosensitivity and effects of repair inhibitors for X-ray-induced chromosomal damage in mouse zygotes in S and G2 phases. Int J Radiat Biol, 1995, 68(6):615.
(1997年9月8日收稿,1998年1月19日修回), 百拇医药
单位:夏潮涌 卢乃媚 暨南大学医学院组织胚胎学教研室(广州 510632);李 铮 广州市肿瘤医院生物工程研究室(广州 510095)
关键词:咖啡因;睾丸;生殖细胞;DNA
咖啡因对胎鼠及乳鼠睾丸生殖细胞DNA合成 影响的体外研究
摘 要 目的:了解咖啡因对胚胎及新生时期生殖细胞合成DNA的影响及其机制。方法:采用低(0.3 mmol/L)、中(0.6 mmol/L)、高(1.2 mmol/L) 浓度咖啡因体外培养SD孕18 d胎鼠、0 d及4 d乳鼠睾丸组织块,培养时间分别为1、2、3周, 用放射自显影、计算机图像分析的方法观察咖啡因对生殖细胞摄取[3 H]-TdR及DNA含量的 影响。结果:(1)18 d胎鼠、0 d乳鼠、4 d乳鼠睾丸培养组织内生殖细胞受咖啡因影响依次增加。(2)浓度越高、培养时间越长,咖啡因对生殖细胞影响越明显。(3)生殖细胞数量的减少往往伴随DNA含量和[3H]-TdR摄取的降低。结论:高浓度咖啡因长时间培养后使生殖细胞数量减少可能与干扰细胞摄取DNA前体物质,降低细胞内DNA含量有关。
, 百拇医药
The effect of caffeine on the DNA synthese of germ cells in
testes of fetal and newborn rats in vitro research
LI Zheng*,XIA Chao-Yong, LU Nai-Mei
Department of Histology and Embryology, Medical College, Jinan University, Guangzhou (510632)
* Institute of Biological Engineering, Cancer Hospital of Guangzhou, Guangzhou (510096)
, 百拇医药
Abstract AIM: To investigate the effect of caffeine on the DNA synthese of germ cells.METHODS:Low (0.3 mmol/L), medium(0.6 mmol/L) and high (1.2 mmol/L) doses of caffeine were used in tissue culture of testicular organ explant taken from 18 days fetal rats, 0 day and 4 days neonatal rats. Autoradiogrophy and computer image analysing were used to observe the [3H]-TdR intake and DNA content of germ cells. RESULTS:(1) The effects of caffeine on the germ cells of 18 days fetal testes explant were the least; those on the 0 day were moderate; while those on the 4 days testes were the most. (2) The higher the concentration and the longer the culture time was, the more influence was exerted on germ cells. (3) The decrease of the number of germ cells was accompanied by the decrease of [3H]-TdR intake and DNA content in most groups. CONCLUSION:That high doses of caffeine inhibit the proliferation of germ cells after culturing for a long time through intervening the intake of [3H]-TdR and decrease the content of DNA.
, http://www.100md.com
MeSH Caffeine; Testis; Germ cells; DNA
由于含咖啡因(caffeine, Caf)饮料的普遍性,Caf.对人体的作用和其副作用尤其对某些器官是否有害的研究受到人们的关注[1]。Caf对男生殖系统有影响:长期服用大剂量Caf可使睾丸体积减少、生精小管退变、成熟精子的数量减少等[2]。Caf在胎儿、新生儿体内代谢较慢,使其在胎儿、新生儿体内蓄积,此时Caf对生殖细胞有无影响?值得研究。有的学者发现,Caf可作用于细胞核,影响到使胞核崩解、染色体断裂[3]。因此我们选择检测了与细胞合成DNA有关的[3H]-TdR标记细胞数、DNA含量等指标来探讨Caf对生殖细胞DNA合成的影响。
材料与方法
一、睾丸组织块培养及组织学样品制备:
, http://www.100md.com
1.培养分组:取健康SD大鼠的18 d雄性胎鼠、0 d(出生当天)、4 d雄性乳鼠之睾丸组织,切为 1mm×1mm×1 mm左右的组织块,分别于下列培养液中培养1、2、3周:a.DMEM:对照组;b.DMEM+0.3 mmol/L咖啡因,低浓度组;c.DMEM+0.6 mmol/L咖啡因,中浓度组;d.DMEM+1.2 mmol/L咖啡因,高浓度组。
每一实验组培养组织块的数量不少于10块。4 d乳鼠来源的组织块置于32℃培养箱、18 d胎鼠及0 d新生鼠来源的组织块置于37℃培养箱内培养,两个培养箱内均含湿润的体积分数为5% CO2、95%空气。每隔3 d换培养液。对拟作放射自显影的组织,培养结束前在培养液内加入3.7×104 Bq/mL的[3H]-TdR共同孵育16 h。
2.组织样品制备:培养结束后,组织块用PBS冲洗两次。经[3H]-TdR示踪的组织用10%甲醛固定,未示踪者分别用10%甲醛和FAA(甲醛∶95%酒精∶冰醋酸为10∶85∶5)固定,包埋时将同一实验条件下的5~6块组织置于同一蜡块中。切片厚度为4 μm。
, http://www.100md.com
二、HE染色及放射自显影的观察计数:
1.HE染色及生殖细胞数量的记数:常规HE染色,每组选取10个组织块,每个组织块选取10个垂直切面的生精小管(共10×10=100个),计算小管内生殖细胞数与包括支持细胞在内的全部细胞数的百分比,并将各实验组与对照组相比较。
2.[3H]-TdR放射自显影(autoradiogrophy,ARG)方法及生殖细胞阳性率的计数:[3H]-TdR示踪后的组织切片用浸膜法[4]涂布乳胶,4℃冰箱内曝光10 d,经显影、定影、苏木素复染后,常规制片。ARG的对照片用不经[3H]-TdR示踪的睾丸培养组织切片,同法涂布乳胶,其余步骤同实验片。随机选取50个生殖细胞,黑色银粒平均为3~4个/生殖细胞,定为本底。
生殖细胞摄取[3H]-TdR阳性率的计数方法是:每个实验组选取10个组织块,每个组织块选取10个垂直切面的生精小管(共10×10=100个),光镜下有5粒以上黑色银粒的生殖细胞即为标记的生殖细胞。检测生精小管内标记的生殖细胞数及生殖细胞总数(包括标记与未标记的生殖细胞),计算百分比,与对照组作比较。
, 百拇医药
三、生殖细胞核DNA染色及其DNA含量的三维定量分析:
1.Feulgen染色:切片用二甲苯脱蜡后,5 mol/L HCl室温水解20 min,Schiff试剂(常规配方)室温染色1 h。
2.生殖细胞核DNA含量的三维定量分析:(1)以核距法测量生殖细胞核体积等参数,具体方法参照文献[5]。每组分别从同一切片上的5~6块组织中选取100个以上的的生殖细胞核进行测量。(2)按柯勒照明要求调整Olympus BX50多功能显微镜光源,在物镜与黑白摄像机之间插入535/35 nm的带通滤光片。40倍物镜(NA0.75)下,使用Tiger细胞图像分析仪(其测量光密度的性能参照文献[6])测量切片上的生殖细胞DNA的二维光密度参数,具体方法参照文献[6]。(3)生殖细胞核DNA含量的三维体积积分光密度:具体方法参照文献[7]。
, 百拇医药
四、统计学处理:
各Caf浓度实验组分别与同一鼠龄、同一培养时间的对照组比较。计数资料采用卡方检验处理,计量资料采用t检验。
结果
1.Caf对生殖细胞数量的影响,见表1。
表1 Caf对生殖细胞数量的影响
Tab 1 The effect of Caf on the number of germ cells(G/T,
Culture medium
, http://www.100md.com
Culture time
18 days fetal rats
0 day newborn rats
4 days newborn rats
Control
0.22±0.11
0.17±0.06
0.15±0.08
0.3 mmol/L
One
0.24±0.12
, 百拇医药
0.16±0.08
0.13±0.06
0.6 mmol/L
week
0.20±0.11
0.15±0.07
0.12±0.07
1.2 mmol/L
0.18±0.09
0.14±0.09
0.12±0.06
Control
, 百拇医药
0.23±0.08
0.16±0.12
0.11±0.08
0.3 mmol/L
Two
0.21±0.12
0.15±0.09
0.12±0.09
0.6 mmol/L
weeks
0.16±0.06
0.11±0.10
, 百拇医药
0.09±0.05
1.2 mmol/L
0.12±0.06
0.10±0.06
0.03±0.01*
Control
0.22±0.11
0.17±0.09
0.11±0.07
0.3 mmol/L
Three
, http://www.100md.com 0.19±0.09
0.10±0.05
0.09±0.04
0.6 mmol/L
weeks
0.15±0.08
0.05±0.02*
0.02±0.01*
1.2 mmol/L
0.11±0.06
0.04±0.02*
, http://www.100md.com
0.01±0.01*
T=Total cell number; G=Germ cell number; *P<0.05, vs control
2.Caf对生殖细胞摄取[3H]-TdR的影响,见表2。
表2 Caf对生殖细胞摄取[3H]-TdR影响的放射自显影结果
Tab 2 The effect of Caf on [3H]-TdR intake of Germ cells (detected by ARG)(L/G,
, http://www.100md.com
Culture medium
Culture time
18 days fetal rats
0 day newborn rats
4 days newborn rats
Control
0.91±0.06
0.91±0.09
0.15±0.08
0.3 mmol/L
One
, http://www.100md.com
0.89±0.08
0.87±0.10
0.74±0.10
0.6 mmol/L
week
0.80±0.10
0.68±0.10
0.66±0.10
1.2 mmol/L
0.75±0.09
0.61±0.09
0.59±0.11
, http://www.100md.com
Control
0.89±0.12
0.89±0.11
0.91±0.12
0.3 mmol/L
Two
0.84±0.09
0.72±0.09
0.70±0.09
0.6 mmol/L
weeks
0.73±0.08
, http://www.100md.com
0.56±0.10
0.25±0.08*
1.2 mmol/L
0.65±0.08
0.47±0.08*
0.19±0.07*
Control
0.89±0.11
0.88±0.11
0.90±0.13
0.3 mmol/L
, 百拇医药
Three
0.73±0.08
0.62±0.09
0.66±0.08
0.6 mmol/L
weeks
0.64±0.09
0.31±0.09*
0.09±0.04*
1.2 mmol/L
0.56±0.07*
, http://www.100md.com
0.24±0.08*
0.08±0.04*
G=Total germ cell number; L=Labeled germ cell number; *P<0.05, vs control
3.Caf对生殖细胞DNA含量的影响,见表3。
表3 Caf对生殖细胞DNA含量影响的定量分析结果
Tab 3 Quatitive analyses of the effect of caffeine on the DNA content of germ cells(
, 百拇医药
Culture medium
Culture time
18 days fetal rats
0 day newborn rats
4 days newborn rats
Control
82.6±27.4
91.8±39.1
88.2±40.8
0.3 mmol/L
One
, http://www.100md.com
88.9±35.9
82.9±38.4
84.9±39.8
0.6 mmol/L
week
79.3±29.4
83.9±42.9
91.9±43.3
1.2 mmol/L
78.0±34.4
92.7±39.5
85.0±39.1
, 百拇医药
Control
80.2±35.4
84.9±41.6
80.3±40.5
0.3 mmol/L
Two
74.1±34.7
82.3±36.3
77.2±35.6
0.6 mmol/L
weeks
81.8±38.9
, 百拇医药
77.9±42.6
68.2±30.9*
1.2 mmol/L
82.4±26.9
88.1±44.7
76.6±36.3
Control
80.6±37.2
82.3±34.9
85.9±43.9
0.3 mmol/L
, http://www.100md.com
Three
73.3±36.8
86.1±37.6
76.9±41.0
0.6 mmol/L
weeks
75.8±38.0
73.2±27.7*
72.2±38.1*
1.2 mmol/L
79.9±40.1
, 百拇医药
69.7±36.2*
80.7±39.7

Fig 1 The 0 day testes after two weeks culture, (control group), hematoxylin restain, ×132, nucleus with black granule are cells intook [3H]-TdR
, 百拇医药
图1 0 d乳鼠睾丸组织块培养2周(对照组)

Fig 2 The 0 day testes after two weeks culture, 1.2 mmol/L Caf group,hematoxylin restain, ×132, the number of cells intook [3H]-TdR(decreased)
图1 0 d乳鼠睾丸组织块培养2周(实验组)
讨论
咖啡因对体外培养的睾丸组织内生殖细胞数量的影响,随不同浓度、不同作用时间及不同时期的睾丸组织而不同,表现一定的规律及相互联系。Caf对18 d胎鼠的睾丸组织培养块内生殖细胞影响较少;对0 d及4 d乳鼠的睾丸组织内生殖细胞的作用表现为浓度越高、培养时间越长,引起检测指标的变化越多;且4 d组比0 d组对咖啡因更敏感。这一实验结果,不仅表明了不同时期来源睾丸生殖细胞对Caf的反应性不同,也表现出不同浓度Caf对生殖细胞DNA合成的影响也有所不同。
, http://www.100md.com
结构显示,Caf使某些实验组生殖细胞中[3H]-TdR标记细胞的阳性率下降(见表2),在一定程度上说明Caf抑制了处于S期的生殖细胞对DNA特异前体物质[3H]-TdR的摄取,影响了生殖细胞DNA的合成。Caf的这一作用,可能是因为其化学结构类似腺嘌呤和鸟嘌呤,尤其是腺嘌呤,掺入到DNA结构中,干扰其复制[8]。在这一面,Tornaletti等也曾提出Caf可能插入DNA的双螺旋结构中,引起染色体损伤[3]。更新的研究表明,Caf还可抑制G2期内损伤DNA的修复[9]。所以,Caf对处于增殖状态的细胞,不仅引起S期DNA损伤,而且还抑制了这一损伤在G2期内的修复,使正常的DNA合成受到破坏,因而抑制了细胞的分裂增殖。
实验结果还显示,大部分引起[3H]-TdR标记细胞阳性率改变的实验条件,均有DNA含量及生殖细胞数量的减少,三个检测指标有一定的一致性。由此可以推想:Caf干扰了[3H]-TdR的摄取,达到一定程度后,使得DNA含量降低,细胞的分裂增殖受到抑制,最后导致细胞数量减少。由于[3 H]-TdR摄取的减少早于DNA含量的减少,是引起以后DNA含量发生改变的原因之一,所以有些实验组如18 d胎龄高浓度Caf培养3周组、0 d日龄高浓度Caf培养2周组和4 d乳鼠中浓度Caf培养2周组等并未出现三个检测指标的同时减少,但并不排除还有其它的原因,有待今后进一步探讨。
, 百拇医药
参考文献
1 Tina K L,Ronald R W, Mary E M. The effects of caffeine on various body systems:a review. J Am Diet Assoc, 1987, 87:1 048.
2 Pollard I, Smallshan J. Male mediated caffeine effects over two generations of rats. J Dev Physiol, 1988, 10(3):271.
3 Tornaletti S, Russo P, Parodi S, et al. Studies on DNA binding of caffeine and derivatives:evidence of interacion by DNA-unwinding experiments. Biochem Biophys Acta, 1989,1007:112.
, http://www.100md.com
4 刘鼎新.放射自显影技术.科学出版社,1986.
5 夏潮涌,夏志坚.细胞核体积测量与计算方法的比较研究.中国体视学与图象分析,1997,2(4):226.
6 夏潮涌,夏志坚,江博仙,等.显微图像分析系统测量细胞核DNA含量误差的研究.中国体视学与图像分析,1997,2(2):70.
7 夏潮涌,夏志坚.睾丸组织原位三维测量和分析生精细胞核的DNA含量与倍体.中国体视学与图像分析,1998,3(1):22.
8 Mitznegg P, Heim F, Hach B, et al. The effect of aging, caffeine-treatment, and ionizing-radiation on nucleic acid synthesis in the mouse liver. Life Sci, 1971,10:128.
9 Matsuda Y, Tobari I. Radiosensitivity and effects of repair inhibitors for X-ray-induced chromosomal damage in mouse zygotes in S and G2 phases. Int J Radiat Biol, 1995, 68(6):615.
(1997年9月8日收稿,1998年1月19日修回), 百拇医药