慢性缺氧对大鼠肺内细胞增殖、凋亡及相关基因表达的影响
作者:陶清国 张珍祥 徐永健
单位:同济医科大学附属同济医院呼吸研究室(武汉 430030)
关键词:低氧;肺;基因表达;大鼠
慢性缺氧对大鼠肺内细胞增殖 摘 要 目的:探讨慢性缺氧性肺动脉高压肺血管结构改建(pulmonary vascular structural remodeling, PVSR)的细胞及分子机制。方法:大鼠慢性缺氧模型复制,免疫组化及Northern杂交检测大鼠肺内c-myc及bcl-2两基因蛋白及mRNA的表达,免疫组化及原位缺口末端标记法检测大鼠肺内增殖相关抗原Ki-67及凋亡细胞。结果:正常及慢性缺氧大鼠肺内均检出一定比率的增殖或凋亡细胞,缺氧1、2周大鼠肺内细胞增殖/凋亡比值比对照组分别增高约3、3.5倍。与细胞增殖、凋亡密切相关的c-myc、bcl-2基因表达在缺氧1周大鼠肺内显著增高,在缺氧2周更显著。结论:细胞增殖、凋亡机制共同参与了慢性缺氧性肺动脉高压时PVSR的调节。
, 百拇医药
Effects of chronic hypoxia on cell proliferation, apoptosis and
expression of c-myc and bcl-2 in lungs of rats
TAO Qing-Guo, ZHANG Zhen-Xiang, XU Yong-Jian
Respiratory Diseases Research Laboratory, Tongji Hospital, Tongji Medical University, Wuhan(430030)
Abstract AIM:To study the cellular and molecular mechenism of pulmonary vascular structural remodeling (PVSR) in hypoxic pulmonary hypertension. METHOD:In situ terminal labeling for detection of apoptotic cells, Northern blot and immunohistochemical technique for detection of c-myc, bcl-2 expression. RESULTS:Compared with control, the ratio of cellular proliferation to apoptosis in lungs of rats exposed to chronic hypoxia is increased significantly, and so is expression of c-myc and bcl-2. CONCLUSION:Cellular proliferation and apoptosis that are regulated by c-myc and bcl-2 contribute to the regulation of PVSR.
, http://www.100md.com
MeSH Anoxia; Lung; Gene expression; Rats
PVSR是慢性缺氧性肺动脉高压发生的最重要环节之一,它给肺动脉高压的治疗带来了极大的困难。PVSR总的病理特征是肺血管壁细胞(平滑肌及成纤维细胞)增殖及合成细胞外基质增多[1],对其发生的细胞及分子机制认识还不尽清楚。有关PVSR细胞增殖调节机制已有一些研究报道,但细胞凋亡机制是否参与则未见于文献。Cho等[2]认为新生羊出生后体内动脉发育(改建)过程受细胞增殖与凋亡双重机制调节,为探讨缺氧性PVSR是否亦如此,我们对慢性缺氧性大鼠肺内细胞进行了增殖与节凋亡综合分析,同时研究相关基因c-myc、bcl-2表达情况,以进一步明确PVSR的发生机理。
材料与方法
(一)动物与缺氧模型复制:250 g~300 g雄性SD大鼠随机分为3组:正常对照组、缺氧1周组,缺氧2周组,每组6只,缺氧用常压间断缺氧模型[3],缺氧浓度10%左右,每天8 h。
, 百拇医药
(二)取材和组织准备:在缺氧1、2周动物处死后,经无菌操作取新鲜肺组织一块用以提RNA。其余肺组织分为二部分,一块经PBS缓冲液漂洗数次以去掉组织中血液,立即置于液氮中快速冷冻,包埋后行冰冻切片,后用10%中性福尔马林液固定30 min以备组化分析。另一块漂洗后经10%中性福尔马林固定行常规石蜡切片备作组化、凋亡及弹力纤维染色。参照文献报道方法[3]称取右心室(R)、左心室(L)及室间隔(S)重量,以R/L+S表示右心室增厚程度。在弹力纤维染色切片上选择圆形或类圆形小动脉,用图像分析系统分析伴行于小气道(终末细支气管、呼吸性细支气管)的小动脉,计算中膜厚度百分比(中膜厚度×2/血管外径),表示肺小动脉增厚程度。每例标本选4张切片,每张切片至少计数20个小动脉。
(三)免疫组化分析:
1.凋亡检测:细胞凋亡原位dUTP缺口末端DNA碎片标记试剂盒购自德国Boehringer Mannheim公司。原理为凋亡细胞核内DNA断裂为含3’-OH末端的碎片,通过末端转移酶催化连上荧光标记的脱氧核苷酸,再用过氧化物酶标记的抗荧光抗体作二抗通过底物显色而检出[4]。使用石蜡切片。操作按说明书进行,显色后行苏木素核复染。
, 百拇医药
2.组化染色:c-myc、bcl-2、Ki-67单抗及SABC试剂盒均购自北京中山公司。前两者选用冰冻切片,后者选用石蜡切片。按常规SABC法进行。
3.阴性对照:凋亡染色加反应混合液进一步混合,液中不含末端转移酶。组化染色用PBS代替一抗。
4.细胞增殖及凋亡比率统计:每例标本取4张切片,每张切片任取5个视野进行细胞计数,每张切片至少计数1千个细胞。增殖指标是以与细胞增殖密切相关的Ki-67抗原染色表示。增殖或凋亡率是以明显的增殖或凋亡阳性染色细胞占同一视野细胞总数的百分比表示。为排除可能由于细胞固定不及时造成的早期细胞自溶形成的DNA断裂而造成的弱阳性着色,凋亡细胞只计数典型深棕色染色者。
(四)Northern杂交:用异硫氰酸-酚-氯仿一步提取法提取组织中总RNA。杂交参照“分子克隆”第二版:加样、电泳、转膜、预杂交后,与[32P]标记的c-myc探针(1.4 kb cDNA片段,EcoRI/ClaI)或bcl-2探针(0.8 kb cDNA片段,BamHI/SacI)杂交,洗膜后自显影,测各杂交带光密度值。再洗去上述探针,重新与β-actin探针杂交,以β-actin杂交量作加样内参照。
, 百拇医药
结果
一、右心室重量及肺血管壁厚度:
大鼠R/L+S值对照组为0.28±0.02,缺氧1、2周组分别为0.36±0.03和0.39±0.04(P均<0.05)。肺小动脉壁中膜厚度百分比对照组为4.58%±0.54%,缺氧1、2周组分别为7.67%±0.75%和9.74%±0.81%(P均<0.05)。
二、细胞增殖与凋亡分析:
三组大鼠肺组织内均检出一定比率的增殖及凋亡细胞。两类细胞在肺内呈散在分布,有些区域相对集中,主要可见于肺血管壁以及肺组织其它部分(图1、2)。增殖率缺氧1、2周组为6.14%±1.78%、6.54%±1.80%,显著高于对照组的3.35%±0.86%,P<0.01。凋亡率缺氧1、2周组为1.93%±0.62%、1.77%±0.88%,显著少于对照组的3.25%±0.58%,P均<0.05。增殖/凋亡值缺氧1、2周组分别约为对照组3、3.5倍。
, 百拇医药
Fig 1 In situ terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling of apoptotic cells in lung of rat exposed to hypoxia for 2 weeks, TUNEL×75
图1 慢性缺氧2周大鼠肺内细胞凋亡原位末端标记染色,示肺小管壁上凋亡阳性染色细胞
Fig 2 The Immunohistochemical detection of Ki-67 expression in lung of rat exposed to hypoxia for 2 weeks, ABC×75
, 百拇医药
图2 慢性缺氧2周大鼠肺内Ki-67抗原染色,示肺小血管壁上阳性染色细胞
三、c-myc、bcl-2组化染色:
c-myc阳性染色定位于胞核,对照组肺内仅少许弱阳性表达,低氧1、2周组可见大量阳性和强阳性表达,阳性细胞主要位于肺小血管壁(图3)。bcl-2阳性染色主要定位于胞浆,主要分布于肺小血管壁,对照组肺内仅见少许弱阳性或不表达,缺氧1、2周组内可见绕血管壁全层的强阳性或阳性表达(图4)。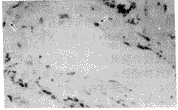
Fig 3 The Immunohistochemical detection of c-myc expression in lung of rat exposed to hypoxia for 2 weeks, ABC×75
, 百拇医药
图3 慢性缺氧2周大鼠肺内c-myc抗原染色,示肺小血管壁上大量阳性染色细胞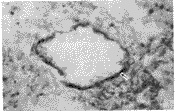
Fig 4 The Immunohistochemical detection of bcl-2 expression in lung of rat exposed to hypoxia for 2 weeks,ABC×75
图4 慢性缺氧2周大鼠肺内bcl-2抗原染色,示肺小血管壁上阳性染色
四、Northern杂交:
见图5。β-actin表达量在三组大鼠间无明显差异。c-myc表达量缺氧1、2周组显著高于对照组,分别为对照组3、3.5倍。bcl-2 mRNA检出3条带,3条带表达量显著大于对照组,分别约为对照组4~4.2倍。
, 百拇医药
Fig 5 Northern blot analysis of expression of c-myc and bcl-2 mRNA, A:control; B:hypoxia for 1 week; C: hypoxia for 2 weeks
图5 c-myc 及bcl-2 mRNA表达的Northern杂交分析
讨论
细胞凋亡即程序性细胞死亡是普遍存在的一种细胞死亡的生理形式。与坏死不同,它不引起机体局部或全身的炎症反应,是细胞悄悄进行的“自杀”。与细胞增殖一起,凋亡可调节许多组织量的大小及组织结构的改建[5]。通过诱导细胞凋亡可作为各种增殖性疾病的治疗手段。缺氧性PVSR实质上是肺血管壁的一种增殖性改变。本研究结果表明:正常及缺氧大鼠肺内特别是肺小血管壁上均检出增殖与凋亡细胞,缺氧大鼠肺内细胞增殖/凋亡值显著增高。因此可以认为,在正常大鼠、肺血管壁发生的较低的增殖水平可被同时发生的相应的自发凋亡水平所平衡,以保持血管壁细胞数的相对稳定。而在缺氧大鼠,肺血管壁细胞由于增殖加强而凋亡相应减少,造成细胞增殖、凋亡失衡,无法维持细胞数相对稳定,这种失衡长期进行,终造成细胞累积而形成PVSR。
, http://www.100md.com
细胞增殖与凋亡是通过相关基因的激活与失活进行着精确的调节。c-myc基因是决定细胞命运即增殖、静止、分化、凋亡的中心调节子[6],bcl-2表达产物是细胞凋亡的强大抑制剂。Bissonnette等[7]研究发现,用c-myc及bcl-2两基因转染的细胞表现出极大的增殖活性。本研究结果显示c-myc及bcl-2两基因在缺氧大鼠肺内表达显著增多,可以推测:由于慢性缺氧等刺激,引起肺血管壁细胞c-myc基因表达增强。c-myc本身即能促进细胞增殖,又能促进细胞凋亡[6],由于同时bcl-2基因表达加强,结果细胞凋亡趋势被抑制,细胞生长总体上出现增殖效应,因而促进了PVSR进程。
参考文献
1 Robert L, Vender. Chronic hypoxic pulmonary hypertension: Cell biology to pathophysiology. Chest, 1994, 106:236.
, 百拇医药
2 Cho A, Courtman D W, Langille B L, et al. Apoptosis (programmed cell death) in arteries of the neonatal lamb. Circ Res, 1995, 76(2):168.
3 薛全福,谢剑鸣,胡长贵,等.常压缺氧性大鼠肺动脉高压模型的建立.中华结核与呼吸杂志,1989,12(6):350.
4 Wijsman JH, Jonker RR, Keiger R, et al. A new method to detect apoptosis in paraffin sections: In situ end labeling of fragmented DNA. J Histochem, 1993, 41:7.
5 Wyllie AH. Apoptosis and the regulation of cell numbers in normal and neoplastic tissue; an overview. Cancer Matastosis Rev, 1992, 11: 95.
6 Evan GI, Wyllie AH, Gilbert CS, et al. Induction of apoptosis in fibroblasts by c-myc protein. Cell, 1992, 69:119.
7 Bissonnette RP, Echeverri F, Mahboubi A, et al. Apoptotic cell death induced by c-myc is inhibited by bcl-2. Nature, 1992, 359:552.
(1997年8月28日收稿,1998年1月19日修回), 百拇医药
单位:同济医科大学附属同济医院呼吸研究室(武汉 430030)
关键词:低氧;肺;基因表达;大鼠
慢性缺氧对大鼠肺内细胞增殖 摘 要 目的:探讨慢性缺氧性肺动脉高压肺血管结构改建(pulmonary vascular structural remodeling, PVSR)的细胞及分子机制。方法:大鼠慢性缺氧模型复制,免疫组化及Northern杂交检测大鼠肺内c-myc及bcl-2两基因蛋白及mRNA的表达,免疫组化及原位缺口末端标记法检测大鼠肺内增殖相关抗原Ki-67及凋亡细胞。结果:正常及慢性缺氧大鼠肺内均检出一定比率的增殖或凋亡细胞,缺氧1、2周大鼠肺内细胞增殖/凋亡比值比对照组分别增高约3、3.5倍。与细胞增殖、凋亡密切相关的c-myc、bcl-2基因表达在缺氧1周大鼠肺内显著增高,在缺氧2周更显著。结论:细胞增殖、凋亡机制共同参与了慢性缺氧性肺动脉高压时PVSR的调节。
, 百拇医药
Effects of chronic hypoxia on cell proliferation, apoptosis and
expression of c-myc and bcl-2 in lungs of rats
TAO Qing-Guo, ZHANG Zhen-Xiang, XU Yong-Jian
Respiratory Diseases Research Laboratory, Tongji Hospital, Tongji Medical University, Wuhan(430030)
Abstract AIM:To study the cellular and molecular mechenism of pulmonary vascular structural remodeling (PVSR) in hypoxic pulmonary hypertension. METHOD:In situ terminal labeling for detection of apoptotic cells, Northern blot and immunohistochemical technique for detection of c-myc, bcl-2 expression. RESULTS:Compared with control, the ratio of cellular proliferation to apoptosis in lungs of rats exposed to chronic hypoxia is increased significantly, and so is expression of c-myc and bcl-2. CONCLUSION:Cellular proliferation and apoptosis that are regulated by c-myc and bcl-2 contribute to the regulation of PVSR.
, http://www.100md.com
MeSH Anoxia; Lung; Gene expression; Rats
PVSR是慢性缺氧性肺动脉高压发生的最重要环节之一,它给肺动脉高压的治疗带来了极大的困难。PVSR总的病理特征是肺血管壁细胞(平滑肌及成纤维细胞)增殖及合成细胞外基质增多[1],对其发生的细胞及分子机制认识还不尽清楚。有关PVSR细胞增殖调节机制已有一些研究报道,但细胞凋亡机制是否参与则未见于文献。Cho等[2]认为新生羊出生后体内动脉发育(改建)过程受细胞增殖与凋亡双重机制调节,为探讨缺氧性PVSR是否亦如此,我们对慢性缺氧性大鼠肺内细胞进行了增殖与节凋亡综合分析,同时研究相关基因c-myc、bcl-2表达情况,以进一步明确PVSR的发生机理。
材料与方法
(一)动物与缺氧模型复制:250 g~300 g雄性SD大鼠随机分为3组:正常对照组、缺氧1周组,缺氧2周组,每组6只,缺氧用常压间断缺氧模型[3],缺氧浓度10%左右,每天8 h。
, 百拇医药
(二)取材和组织准备:在缺氧1、2周动物处死后,经无菌操作取新鲜肺组织一块用以提RNA。其余肺组织分为二部分,一块经PBS缓冲液漂洗数次以去掉组织中血液,立即置于液氮中快速冷冻,包埋后行冰冻切片,后用10%中性福尔马林液固定30 min以备组化分析。另一块漂洗后经10%中性福尔马林固定行常规石蜡切片备作组化、凋亡及弹力纤维染色。参照文献报道方法[3]称取右心室(R)、左心室(L)及室间隔(S)重量,以R/L+S表示右心室增厚程度。在弹力纤维染色切片上选择圆形或类圆形小动脉,用图像分析系统分析伴行于小气道(终末细支气管、呼吸性细支气管)的小动脉,计算中膜厚度百分比(中膜厚度×2/血管外径),表示肺小动脉增厚程度。每例标本选4张切片,每张切片至少计数20个小动脉。
(三)免疫组化分析:
1.凋亡检测:细胞凋亡原位dUTP缺口末端DNA碎片标记试剂盒购自德国Boehringer Mannheim公司。原理为凋亡细胞核内DNA断裂为含3’-OH末端的碎片,通过末端转移酶催化连上荧光标记的脱氧核苷酸,再用过氧化物酶标记的抗荧光抗体作二抗通过底物显色而检出[4]。使用石蜡切片。操作按说明书进行,显色后行苏木素核复染。
, 百拇医药
2.组化染色:c-myc、bcl-2、Ki-67单抗及SABC试剂盒均购自北京中山公司。前两者选用冰冻切片,后者选用石蜡切片。按常规SABC法进行。
3.阴性对照:凋亡染色加反应混合液进一步混合,液中不含末端转移酶。组化染色用PBS代替一抗。
4.细胞增殖及凋亡比率统计:每例标本取4张切片,每张切片任取5个视野进行细胞计数,每张切片至少计数1千个细胞。增殖指标是以与细胞增殖密切相关的Ki-67抗原染色表示。增殖或凋亡率是以明显的增殖或凋亡阳性染色细胞占同一视野细胞总数的百分比表示。为排除可能由于细胞固定不及时造成的早期细胞自溶形成的DNA断裂而造成的弱阳性着色,凋亡细胞只计数典型深棕色染色者。
(四)Northern杂交:用异硫氰酸-酚-氯仿一步提取法提取组织中总RNA。杂交参照“分子克隆”第二版:加样、电泳、转膜、预杂交后,与[32P]标记的c-myc探针(1.4 kb cDNA片段,EcoRI/ClaI)或bcl-2探针(0.8 kb cDNA片段,BamHI/SacI)杂交,洗膜后自显影,测各杂交带光密度值。再洗去上述探针,重新与β-actin探针杂交,以β-actin杂交量作加样内参照。
, 百拇医药
结果
一、右心室重量及肺血管壁厚度:
大鼠R/L+S值对照组为0.28±0.02,缺氧1、2周组分别为0.36±0.03和0.39±0.04(P均<0.05)。肺小动脉壁中膜厚度百分比对照组为4.58%±0.54%,缺氧1、2周组分别为7.67%±0.75%和9.74%±0.81%(P均<0.05)。
二、细胞增殖与凋亡分析:
三组大鼠肺组织内均检出一定比率的增殖及凋亡细胞。两类细胞在肺内呈散在分布,有些区域相对集中,主要可见于肺血管壁以及肺组织其它部分(图1、2)。增殖率缺氧1、2周组为6.14%±1.78%、6.54%±1.80%,显著高于对照组的3.35%±0.86%,P<0.01。凋亡率缺氧1、2周组为1.93%±0.62%、1.77%±0.88%,显著少于对照组的3.25%±0.58%,P均<0.05。增殖/凋亡值缺氧1、2周组分别约为对照组3、3.5倍。

, 百拇医药
Fig 1 In situ terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling of apoptotic cells in lung of rat exposed to hypoxia for 2 weeks, TUNEL×75
图1 慢性缺氧2周大鼠肺内细胞凋亡原位末端标记染色,示肺小管壁上凋亡阳性染色细胞

Fig 2 The Immunohistochemical detection of Ki-67 expression in lung of rat exposed to hypoxia for 2 weeks, ABC×75
, 百拇医药
图2 慢性缺氧2周大鼠肺内Ki-67抗原染色,示肺小血管壁上阳性染色细胞
三、c-myc、bcl-2组化染色:
c-myc阳性染色定位于胞核,对照组肺内仅少许弱阳性表达,低氧1、2周组可见大量阳性和强阳性表达,阳性细胞主要位于肺小血管壁(图3)。bcl-2阳性染色主要定位于胞浆,主要分布于肺小血管壁,对照组肺内仅见少许弱阳性或不表达,缺氧1、2周组内可见绕血管壁全层的强阳性或阳性表达(图4)。

Fig 3 The Immunohistochemical detection of c-myc expression in lung of rat exposed to hypoxia for 2 weeks, ABC×75
, 百拇医药
图3 慢性缺氧2周大鼠肺内c-myc抗原染色,示肺小血管壁上大量阳性染色细胞

Fig 4 The Immunohistochemical detection of bcl-2 expression in lung of rat exposed to hypoxia for 2 weeks,ABC×75
图4 慢性缺氧2周大鼠肺内bcl-2抗原染色,示肺小血管壁上阳性染色
四、Northern杂交:
见图5。β-actin表达量在三组大鼠间无明显差异。c-myc表达量缺氧1、2周组显著高于对照组,分别为对照组3、3.5倍。bcl-2 mRNA检出3条带,3条带表达量显著大于对照组,分别约为对照组4~4.2倍。

, 百拇医药
Fig 5 Northern blot analysis of expression of c-myc and bcl-2 mRNA, A:control; B:hypoxia for 1 week; C: hypoxia for 2 weeks
图5 c-myc 及bcl-2 mRNA表达的Northern杂交分析
讨论
细胞凋亡即程序性细胞死亡是普遍存在的一种细胞死亡的生理形式。与坏死不同,它不引起机体局部或全身的炎症反应,是细胞悄悄进行的“自杀”。与细胞增殖一起,凋亡可调节许多组织量的大小及组织结构的改建[5]。通过诱导细胞凋亡可作为各种增殖性疾病的治疗手段。缺氧性PVSR实质上是肺血管壁的一种增殖性改变。本研究结果表明:正常及缺氧大鼠肺内特别是肺小血管壁上均检出增殖与凋亡细胞,缺氧大鼠肺内细胞增殖/凋亡值显著增高。因此可以认为,在正常大鼠、肺血管壁发生的较低的增殖水平可被同时发生的相应的自发凋亡水平所平衡,以保持血管壁细胞数的相对稳定。而在缺氧大鼠,肺血管壁细胞由于增殖加强而凋亡相应减少,造成细胞增殖、凋亡失衡,无法维持细胞数相对稳定,这种失衡长期进行,终造成细胞累积而形成PVSR。
, http://www.100md.com
细胞增殖与凋亡是通过相关基因的激活与失活进行着精确的调节。c-myc基因是决定细胞命运即增殖、静止、分化、凋亡的中心调节子[6],bcl-2表达产物是细胞凋亡的强大抑制剂。Bissonnette等[7]研究发现,用c-myc及bcl-2两基因转染的细胞表现出极大的增殖活性。本研究结果显示c-myc及bcl-2两基因在缺氧大鼠肺内表达显著增多,可以推测:由于慢性缺氧等刺激,引起肺血管壁细胞c-myc基因表达增强。c-myc本身即能促进细胞增殖,又能促进细胞凋亡[6],由于同时bcl-2基因表达加强,结果细胞凋亡趋势被抑制,细胞生长总体上出现增殖效应,因而促进了PVSR进程。
参考文献
1 Robert L, Vender. Chronic hypoxic pulmonary hypertension: Cell biology to pathophysiology. Chest, 1994, 106:236.
, 百拇医药
2 Cho A, Courtman D W, Langille B L, et al. Apoptosis (programmed cell death) in arteries of the neonatal lamb. Circ Res, 1995, 76(2):168.
3 薛全福,谢剑鸣,胡长贵,等.常压缺氧性大鼠肺动脉高压模型的建立.中华结核与呼吸杂志,1989,12(6):350.
4 Wijsman JH, Jonker RR, Keiger R, et al. A new method to detect apoptosis in paraffin sections: In situ end labeling of fragmented DNA. J Histochem, 1993, 41:7.
5 Wyllie AH. Apoptosis and the regulation of cell numbers in normal and neoplastic tissue; an overview. Cancer Matastosis Rev, 1992, 11: 95.
6 Evan GI, Wyllie AH, Gilbert CS, et al. Induction of apoptosis in fibroblasts by c-myc protein. Cell, 1992, 69:119.
7 Bissonnette RP, Echeverri F, Mahboubi A, et al. Apoptotic cell death induced by c-myc is inhibited by bcl-2. Nature, 1992, 359:552.
(1997年8月28日收稿,1998年1月19日修回), 百拇医药