地塞米松对SUNE-1和B95-8细胞株中EB病毒BHRF1基因转录水平的影响*
作者:朱振宇 邓诣群 戴克胜 张清秀 马润泉
单位:中山医科大学生物化学教研室(广州 510089)
关键词:地塞米松;爱泼斯坦-巴尔病毒;基因表达调控;病毒
地塞米松对SUNE 摘 要 目的:以K562细胞为阴性对照,观察SUNE-1和B95-8两种含EBV-BHRF1基因的肿瘤细胞株在2×10-6 mol/L地塞米松(dexamethasone, DEX)作用18 h后,细胞内EBV-BHRF1基因转录水平的改变。方法:细胞RNA的提取、RNA的点杂交(Dot blot)及反转录PCR(RT-PCR)。结果:上述两种肿瘤细胞在2×10-6 mol/L地塞米松作用18 h等诱导细胞凋亡的条件下,细胞内EBV-BHRF1基因的转录水平(mRNA)明显提高。结论:本结果初步显示EBV-BHRF1基因的转录与宿主细胞抵抗凋亡的关系密切。
, 百拇医药
Dexmethasone affects EBV-BHRF1 transcription
levels of SUNE-1 and B95-8 cell lines
ZHU Zhen-Yu,DENG Yi-Qun, DAI Ke-Sheng, ZHANG Qing-Xiu, MA Jian-Quan
Department of Biochemistry, Sun Yat-sen University of Medical Sciences, Guangzhou (510089)
Abstract AIM: To observe the changes of EBV BHRF1 transcription levels of SUNE-1 and B95-8 cell lines cells incubated with 2×10-6 mol/L Dexamethasone (DEX) for 18 hours at 37℃ using EBV-BHRF1 negative K562 cell line cell as contrl. METHODS:Extraction and detection RNA by Dot blot combined with RT-PCR. RESULTS:EBV-BHRF1 transcription levels of SUNE-1 and B95-8 cell lines cells arise significantly after incubated with 2×10-6 mol/L DEX for 18 hours at 37℃. CONCLUSION:EBV-BHRF1 gene's transcription is closely related with suppression of its host cell's apoptosis.
, 百拇医药
MeSH Dexamethasone; Epstein-Barr Virus; Gene expression regulation, virus
细胞凋亡(apoptosis),也称程序性细胞死亡(programmed cell death, PCD),是目前活跃的研究领域之一[1]。EB病毒(epstein-barr virus, EBV)属于单纯疱疹病毒Ⅳ型,与人类的多种疾病密切相关,例如以珠江流域为高发中心的鼻咽癌(nasopharyngeal carcinoma, NPC)、在非洲高发的伯基特淋巴瘤及传染性单核细胞增多症等[2]。有报道认为EBV的BHRF1基因产物与Bcl-2有38%同源性,在细胞内的定位也相似,具有抑制宿主细胞凋亡的作用[3]。本室根据EBV全基因序列设计印物[4],用PCR方法证实了人低分化鼻咽癌(SUNE-1)细胞株,B95-8细胞株中含有EBV-BHRF1全基因片段(592 bp),并证实适当浓度的EBV-BHRF1反义寡核苷酸片段能够诱导无血清培养的低分化鼻咽癌(SUNE-1)细胞株发生凋亡[5]。本研究用前文[6]PCR扩增获得的EBV-BHRF1产物为模板,用[32?P]-dCTP标记合成探针,用点杂交(Dot blot)及RT-PCR方法检测SUNE-1和B95-8这两种肿瘤细胞株在2×10-6mol/L在地塞米松作用18 h,即常规诱导细胞凋亡的因素作用下,宿主细胞中EBV-BHRF1基因转录水平的改变,初步探讨该基因的活动情况与宿主细胞抵抗凋亡的关系。
, 百拇医药
材料与方法
一、材料:
1.缺口翻译(同位素探针标记)试剂盒及地塞米松均为Sigma公司产品。2. [32?P]-dCTP:匹兹堡大学核医学研究所合成,强度为74×104Bq/μL,22.2×104 Bq/pmol。3.RT-PCR试剂盒(一步法),1 kb DNA ladder, RPMI-1640培养液及胎牛血清(fetal calf serum, FCS),购于GIBCO公司。4.β-肌动蛋白(β-actin)基因片段,由匹兹堡大学癌症研究所提供。5.RNA抽提、纯化试剂盒(UltraspecTM RNA):购自Biotecx-laboratories公司。6.细胞株:SUNE-1由中山医科大学肿瘤研究所提供[7],B95-8[8]及K562由匹兹堡大学癌症研究所提供。
, http://www.100md.com
二、方法:
1.按常规方法进行细胞培养、传代。三种肿瘤细胞各取终浓度为5×10-6个/mL,2 mL经台盼蓝染色检查,死细胞小于5%,分成实验组和对照组备用。2.实验组加入终浓度为2×10-6 mol/L地塞米松,对照组则加入等体积的RPMI-1640培养液,继续培养18 h[9]。3.RNA抽提:用UltraspecTM RNA,其提取方法是:①倾去培养液,直接向培养瓶中加入UltraspecTM RNA溶液1 mL,颠倒混匀数次,在4℃放置5 min;②将液体移至新的1.5 mL Eppendorf管中,加入0.2 mL氯仿,振荡混匀后,放置冰上5 min;③4℃,12 000×g 15 min离心;④小心地将4/5上清液移至新的Eppendorf管中,加入等体积的异丙醇,混匀后4℃放置10 min;⑤4℃,12 000×g 10 min离心后,倾去上清液,分别用1 mL 75%的乙醇洗两次,每次先振荡混匀,再在4℃,7500×g 5 min离心;⑥真空干燥10 min,用30~40 μL 0.1%焦磷酸乙二酯(DEPC)水溶解,经紫外分光光度法定量后,-20℃储存备用。4.RNA定量:用紫外分光光度法和电泳法[10]。根据OD260定量:根据OD260/OD280分析其纯度,再根据紫外分光光度法测定的结果,各取5.0 μg进行常规RNA电泳,并在紫外灯下观察、拍摄。5.β-肌动蛋白基因片段和EBV-BHRF1基因片段探针标记及纯化:用缺口翻译法(nick translation)[10]。6.打点杂交(Dotblot)[10]。采用1:2等比释释法,即在5.0 μL的总体积内分别含有RNA样品量是5.0 μg→2.5 μg→1.25 μg→0.625 μg。70℃变性15 min后,将样品加在醋酸纤维膜上,经紫外交联机自动交联后,42℃预杂交2 h,再与β-actin探针在42℃杂交8 h或过夜。经常规(1)在室温下用2×SSC,0.1% SDS溶液100 mL洗2次,各10 min;(2)53℃,用2×SSC,0.1% SDS溶液洗3次,各20 min,用100 mL;(3)53℃,用pH 7.2 Na3PO4,1 mmol/L EDTA,0.1%SDS洗2次,每次15 min;(4)53℃,用pH 7.2 Na3PO4 1 mmol/L EDTA,1%SDS洗2次,每次15 min。洗膜后,在暗房中压片,曝光。若β-actin各组的曝光强度基本一致,再用0.01%×SSC,0.1% SDS经100℃×5 min作用后去除β-actin探针。洗膜后再经上述预杂交2 h后,加入EBV-BHRF1探针,杂交8 h以上。再洗膜。曝光。7.反转录PCR(RT-PCR)一步法检测3种细胞株中BHRF1基因在地塞米松作用前后的表达差异。以β-actin作为内参照。反应条件为:50℃ 30 min→94℃ 2 min→(94 ℃ 30 min, 55℃ 30 min→72℃ 60 min,共25次循环)→72℃ 10 min。取20 μL电泳。
, 百拇医药
结果
(一)RNA电泳结果:3种细胞株在2×10-6 mol/L地塞米松共同培养18 h前后,其RNA电泳结果见图1。从图中可见3种细胞株在处理前后,其RNA总量基本一致,且无降解,表明该方法所抽提的RNA可满足Dot blot及RT-PCR的要求。
Fig 1 Agarose gel electrophoresis of RNA extracted from SUNE-1, B95-8 and K562 cell lines cells before and after incubated with 2×10-6 mol/L DEX at 37℃ for 18 h. Lane 1: SUNE-1 control. Lane 4: SUNE-1 incubated with 2×10-6 mol/L DEX for 18h. Lane 2: B95-8 control. Lane 5: B95-8 incubated with 2×10-6 mol/L DEX for 18 h. Lane 3: K562 control. Lane 6: K562 incubated with 2×10-6 mol/L DEX for 18 h
, 百拇医药
图1 SUNE-1,B95-8 and K562三种肿瘤细胞株在与2×10-6 mol/L地塞米松共同培养18 h前后,其RNA电泳图
(二)以[32?P]-dCTP标记的β-肌动蛋白(β-actin)基因探针,检测细胞RNA总量。结果表明3种细胞株在2×10-6 mol/L DEX作用前后,其RNA在总量相同的条件下,β-actin的RNA转录水平基本一致,见图2。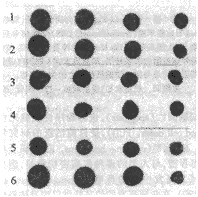
Fig 2 Detection of β-actin RNA transcription levels of SUNE-1, B95-8 and K562 cell line using [32?P]-dCTP labeled β-actin probe as internal control. Lane 1: SUNE-1 control. Lane 2: B95-8 control Lane 3: SUNE-1 incubated with 2×10-6 mol/L DEX for 18 h. Lane 4: B95-8 incubated with 2×10-6 mol/L DEX for 18h. Lane 5: K562 control. Lane 6: K562 incubated with 2×10-6 mol/L DEX for 18 h
, 百拇医药
图2 用β-肌动蛋白(β-actin)探针作为内参照,测定SUNE-1,B95-8 and K562三种肿瘤细胞株RNA转录水平
(三) 三种细胞株在2×10-6 mol/L地塞米松共同培养18 h前后,其RNA经打点杂交检测结果见图3。初步显示在此诱导细胞凋亡因素的作用下,SUNE-1和B95-8两种宿主细胞在RNA总量基本一致的条件下,其EBV-BHRF1转录水平明显提高,而K562细胞中因无EBV-BHRF1基因,故为阴性(少许阴影,可能为β-actin探针未完全洗净的缘故)。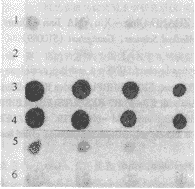
Fig 3 Detection EBV-BHRF1 transcription levels of SUNE-1,B95-8 and K562 cell line using [32 P]-dCTP labeled EBV-BHRF1 probe. Lane 1: SUNE-1 control. Lane 2: B95-8 control. Lane 3: SUNE-1 incubated with 2×10-6 mol/L DEX for 18 h.Lane 4: B95-8 incubated with 2×10-6 mol/L DEX for 18 h.Lane 5: K562control. Lane 6: K562 incubated with 2×10-6 mol/L DEX for 18 h
, 百拇医药
图3 用[32P]-dCTP标记的EBV-BHRF1探针测定SUNE-1,B95-8 and K562三种肿瘤细胞株中的EBV-BHRF1转录水平
(四)以3种肿瘤细胞株在2×10-6 mol/L DEX共同培养18 h前后的RNA作为模板,以β-actin作为内参照(在同一反应管中进行),经一步法反转录PCR(RT-PCR)扩增后,经1%琼脂糖凝胶电泳后,结果见图4。由图4可见K562细胞株中因不含有EBV-BHRF1基因片段,故DEX作用前后均为阴性。而SUNE-1和B95-8细胞株在未受DEX作用前RT-PCR为阴性,即仅出现346 bp的β-actin条带;受DEX作用后,扩增结果为阳性,即仅出现592 bp的EBV-BHRF1条带,表明EBV-BHRF1 mRNA水平显著提高(因各组β-actin的强度基本一致)。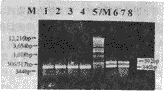
, 百拇医药
Fig 4 Agarose gel electrophoresis of RT-PCR results using RNAs extracted from K562, SUNE-1 and B95-8 cell line before and after incubated with 2×10-6 mol/L DEX at 37℃ for 18h. Lane 1: K562 control. Lane 2: SUNE-1 control. Lane 3: B95-8 control. Lane 4: K562 incubated with 2×10-6 mol/L DEX for 18 h. Lane5: 1Kb DNA ladder. Lane 6: SUNE-1 incubated with 2×10-6 mol/L DEX for 18 h. Lane 7: B95-8 incubated with 2×10-6 mol/L DEX for 18 h. Lane 8: negative control using 0.1% DEPC-H2O as template
, 百拇医药
图4 三种细胞株在DEX作用前后,其RNA经RT-PCR扩增EBV-BHRF1片段的琼脂糖电泳图
讨论
凋亡是基因调控下的细胞自我消亡的过程,它不仅参与机体的生长、发育、成熟和衰老的各个过程,而且在肿瘤的发生、发展、转移及治疗过程中均起着非常重要的作用[1]。EBV-BHRF1基因与抑制细胞凋亡的原癌基因Bcl-2具有相似的结构与功能[3],研究含有该基因片段的肿瘤细胞株在受到诱导细胞凋亡因素作用时,该基因转录水平的变化,揭示其作用,对于提高EBV相关肿瘤的治疗效果具有重要意义。前文已提示EBV-BHRF1反义寡核苷酸片段能够诱导缺血清培养条件下的SUNE-1细胞发生凋亡[5];而在有血清培养条件下,SUNE-1和B95-8细胞株可以抵抗2×10-6 mol/L DEX作用24 h所诱导的细胞凋亡[6]。本研究结果显示在2×10-6 mol/L DEX作用18 h时,SUNE-1和B95-8细胞中EBV-BHRF1基因的转录水平(RNA水平)显著提高,说明EBV-BHRF1基因的转录和表达与SUNE-1和B95-8细胞株抵抗诱导细胞凋亡因素的作用密切相关。在治疗EBV相关性肿瘤时,应注意拮抗BHRF1基因产物的作用,才可能取得较理想的治疗效果[6]。
, http://www.100md.com
*中华医学会(CMB)基金及广东省科委青年基金(950355)资助课题;主要工作在美国宾州匹兹堡大学癌症研究所(University of Pittsburgh Cancer Institute)完成
参考文献
1 Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science, 1995, 267:1456.
2 List A F, Greco F A, Vogler L B. Lymphoproliferative diseases in immunocompromised hosts: the role of Epstein-Barr virus. J Clin Oncol, 1987, 5: 1673.
3 Henderson S, Huen D, Rowe M, et al. Epstein-Barr virus-code BHRF1 protein, a viral homologue of bcl-2, protects human B cells from programmed cell death. Proc Natl Acad Sci USA, 1993, 90:8479.
, http://www.100md.com
4 Bear R, Bankier AT, Biggin M, et al. DNA sequence and expression of the B95-8 Epstein-Barr virus genome. Nature, 1984, 310:207.
5 朱振宇,黄必军,戴克胜,等.EB病毒BHRF1反义寡核苷酸片段诱导鼻咽癌SUNE-1细胞株的凋亡.中山医科大学学报,1998;19:105.
6 朱振宇,黄必军,戴克胜,等.EBV-BHRF1基因阳性与阴性细胞株对3种诱导凋亡因素抵抗性差异的研究.肿瘤,1998,18:129.
7 吴荫棠,汪慧民,扬小平,等.鼻咽癌裸鼠移植瘤及其相应体外细胞株的建立与特性研究.癌症,1995,14:83.
8 Miller G, Shope T, Lisco H, et al. Epstein-Barr virus: transformation, cytopathic changes, and viral antigens in squirrel, monkey and marmoset leukocyte. Proc Natl Acad Sci USA, 1972, 69:383.
9 朱振宇,潘景轩,赵 群,等.地塞米松诱导裸鼠脾细胞凋亡的研究.中国病理生理杂志,1996, 12:113.
10 卢圣栋,主编.现代分子生物学实验技术.第1版.北京:高等教育出版社,1993.68~238.
(1998年9月28日收稿,1999年3月5日修回), 百拇医药
单位:中山医科大学生物化学教研室(广州 510089)
关键词:地塞米松;爱泼斯坦-巴尔病毒;基因表达调控;病毒
地塞米松对SUNE 摘 要 目的:以K562细胞为阴性对照,观察SUNE-1和B95-8两种含EBV-BHRF1基因的肿瘤细胞株在2×10-6 mol/L地塞米松(dexamethasone, DEX)作用18 h后,细胞内EBV-BHRF1基因转录水平的改变。方法:细胞RNA的提取、RNA的点杂交(Dot blot)及反转录PCR(RT-PCR)。结果:上述两种肿瘤细胞在2×10-6 mol/L地塞米松作用18 h等诱导细胞凋亡的条件下,细胞内EBV-BHRF1基因的转录水平(mRNA)明显提高。结论:本结果初步显示EBV-BHRF1基因的转录与宿主细胞抵抗凋亡的关系密切。
, 百拇医药
Dexmethasone affects EBV-BHRF1 transcription
levels of SUNE-1 and B95-8 cell lines
ZHU Zhen-Yu,DENG Yi-Qun, DAI Ke-Sheng, ZHANG Qing-Xiu, MA Jian-Quan
Department of Biochemistry, Sun Yat-sen University of Medical Sciences, Guangzhou (510089)
Abstract AIM: To observe the changes of EBV BHRF1 transcription levels of SUNE-1 and B95-8 cell lines cells incubated with 2×10-6 mol/L Dexamethasone (DEX) for 18 hours at 37℃ using EBV-BHRF1 negative K562 cell line cell as contrl. METHODS:Extraction and detection RNA by Dot blot combined with RT-PCR. RESULTS:EBV-BHRF1 transcription levels of SUNE-1 and B95-8 cell lines cells arise significantly after incubated with 2×10-6 mol/L DEX for 18 hours at 37℃. CONCLUSION:EBV-BHRF1 gene's transcription is closely related with suppression of its host cell's apoptosis.
, 百拇医药
MeSH Dexamethasone; Epstein-Barr Virus; Gene expression regulation, virus
细胞凋亡(apoptosis),也称程序性细胞死亡(programmed cell death, PCD),是目前活跃的研究领域之一[1]。EB病毒(epstein-barr virus, EBV)属于单纯疱疹病毒Ⅳ型,与人类的多种疾病密切相关,例如以珠江流域为高发中心的鼻咽癌(nasopharyngeal carcinoma, NPC)、在非洲高发的伯基特淋巴瘤及传染性单核细胞增多症等[2]。有报道认为EBV的BHRF1基因产物与Bcl-2有38%同源性,在细胞内的定位也相似,具有抑制宿主细胞凋亡的作用[3]。本室根据EBV全基因序列设计印物[4],用PCR方法证实了人低分化鼻咽癌(SUNE-1)细胞株,B95-8细胞株中含有EBV-BHRF1全基因片段(592 bp),并证实适当浓度的EBV-BHRF1反义寡核苷酸片段能够诱导无血清培养的低分化鼻咽癌(SUNE-1)细胞株发生凋亡[5]。本研究用前文[6]PCR扩增获得的EBV-BHRF1产物为模板,用[32?P]-dCTP标记合成探针,用点杂交(Dot blot)及RT-PCR方法检测SUNE-1和B95-8这两种肿瘤细胞株在2×10-6mol/L在地塞米松作用18 h,即常规诱导细胞凋亡的因素作用下,宿主细胞中EBV-BHRF1基因转录水平的改变,初步探讨该基因的活动情况与宿主细胞抵抗凋亡的关系。
, 百拇医药
材料与方法
一、材料:
1.缺口翻译(同位素探针标记)试剂盒及地塞米松均为Sigma公司产品。2. [32?P]-dCTP:匹兹堡大学核医学研究所合成,强度为74×104Bq/μL,22.2×104 Bq/pmol。3.RT-PCR试剂盒(一步法),1 kb DNA ladder, RPMI-1640培养液及胎牛血清(fetal calf serum, FCS),购于GIBCO公司。4.β-肌动蛋白(β-actin)基因片段,由匹兹堡大学癌症研究所提供。5.RNA抽提、纯化试剂盒(UltraspecTM RNA):购自Biotecx-laboratories公司。6.细胞株:SUNE-1由中山医科大学肿瘤研究所提供[7],B95-8[8]及K562由匹兹堡大学癌症研究所提供。
, http://www.100md.com
二、方法:
1.按常规方法进行细胞培养、传代。三种肿瘤细胞各取终浓度为5×10-6个/mL,2 mL经台盼蓝染色检查,死细胞小于5%,分成实验组和对照组备用。2.实验组加入终浓度为2×10-6 mol/L地塞米松,对照组则加入等体积的RPMI-1640培养液,继续培养18 h[9]。3.RNA抽提:用UltraspecTM RNA,其提取方法是:①倾去培养液,直接向培养瓶中加入UltraspecTM RNA溶液1 mL,颠倒混匀数次,在4℃放置5 min;②将液体移至新的1.5 mL Eppendorf管中,加入0.2 mL氯仿,振荡混匀后,放置冰上5 min;③4℃,12 000×g 15 min离心;④小心地将4/5上清液移至新的Eppendorf管中,加入等体积的异丙醇,混匀后4℃放置10 min;⑤4℃,12 000×g 10 min离心后,倾去上清液,分别用1 mL 75%的乙醇洗两次,每次先振荡混匀,再在4℃,7500×g 5 min离心;⑥真空干燥10 min,用30~40 μL 0.1%焦磷酸乙二酯(DEPC)水溶解,经紫外分光光度法定量后,-20℃储存备用。4.RNA定量:用紫外分光光度法和电泳法[10]。根据OD260定量:根据OD260/OD280分析其纯度,再根据紫外分光光度法测定的结果,各取5.0 μg进行常规RNA电泳,并在紫外灯下观察、拍摄。5.β-肌动蛋白基因片段和EBV-BHRF1基因片段探针标记及纯化:用缺口翻译法(nick translation)[10]。6.打点杂交(Dotblot)[10]。采用1:2等比释释法,即在5.0 μL的总体积内分别含有RNA样品量是5.0 μg→2.5 μg→1.25 μg→0.625 μg。70℃变性15 min后,将样品加在醋酸纤维膜上,经紫外交联机自动交联后,42℃预杂交2 h,再与β-actin探针在42℃杂交8 h或过夜。经常规(1)在室温下用2×SSC,0.1% SDS溶液100 mL洗2次,各10 min;(2)53℃,用2×SSC,0.1% SDS溶液洗3次,各20 min,用100 mL;(3)53℃,用pH 7.2 Na3PO4,1 mmol/L EDTA,0.1%SDS洗2次,每次15 min;(4)53℃,用pH 7.2 Na3PO4 1 mmol/L EDTA,1%SDS洗2次,每次15 min。洗膜后,在暗房中压片,曝光。若β-actin各组的曝光强度基本一致,再用0.01%×SSC,0.1% SDS经100℃×5 min作用后去除β-actin探针。洗膜后再经上述预杂交2 h后,加入EBV-BHRF1探针,杂交8 h以上。再洗膜。曝光。7.反转录PCR(RT-PCR)一步法检测3种细胞株中BHRF1基因在地塞米松作用前后的表达差异。以β-actin作为内参照。反应条件为:50℃ 30 min→94℃ 2 min→(94 ℃ 30 min, 55℃ 30 min→72℃ 60 min,共25次循环)→72℃ 10 min。取20 μL电泳。
, 百拇医药
结果
(一)RNA电泳结果:3种细胞株在2×10-6 mol/L地塞米松共同培养18 h前后,其RNA电泳结果见图1。从图中可见3种细胞株在处理前后,其RNA总量基本一致,且无降解,表明该方法所抽提的RNA可满足Dot blot及RT-PCR的要求。

Fig 1 Agarose gel electrophoresis of RNA extracted from SUNE-1, B95-8 and K562 cell lines cells before and after incubated with 2×10-6 mol/L DEX at 37℃ for 18 h. Lane 1: SUNE-1 control. Lane 4: SUNE-1 incubated with 2×10-6 mol/L DEX for 18h. Lane 2: B95-8 control. Lane 5: B95-8 incubated with 2×10-6 mol/L DEX for 18 h. Lane 3: K562 control. Lane 6: K562 incubated with 2×10-6 mol/L DEX for 18 h
, 百拇医药
图1 SUNE-1,B95-8 and K562三种肿瘤细胞株在与2×10-6 mol/L地塞米松共同培养18 h前后,其RNA电泳图
(二)以[32?P]-dCTP标记的β-肌动蛋白(β-actin)基因探针,检测细胞RNA总量。结果表明3种细胞株在2×10-6 mol/L DEX作用前后,其RNA在总量相同的条件下,β-actin的RNA转录水平基本一致,见图2。

Fig 2 Detection of β-actin RNA transcription levels of SUNE-1, B95-8 and K562 cell line using [32?P]-dCTP labeled β-actin probe as internal control. Lane 1: SUNE-1 control. Lane 2: B95-8 control Lane 3: SUNE-1 incubated with 2×10-6 mol/L DEX for 18 h. Lane 4: B95-8 incubated with 2×10-6 mol/L DEX for 18h. Lane 5: K562 control. Lane 6: K562 incubated with 2×10-6 mol/L DEX for 18 h
, 百拇医药
图2 用β-肌动蛋白(β-actin)探针作为内参照,测定SUNE-1,B95-8 and K562三种肿瘤细胞株RNA转录水平
(三) 三种细胞株在2×10-6 mol/L地塞米松共同培养18 h前后,其RNA经打点杂交检测结果见图3。初步显示在此诱导细胞凋亡因素的作用下,SUNE-1和B95-8两种宿主细胞在RNA总量基本一致的条件下,其EBV-BHRF1转录水平明显提高,而K562细胞中因无EBV-BHRF1基因,故为阴性(少许阴影,可能为β-actin探针未完全洗净的缘故)。

Fig 3 Detection EBV-BHRF1 transcription levels of SUNE-1,B95-8 and K562 cell line using [32 P]-dCTP labeled EBV-BHRF1 probe. Lane 1: SUNE-1 control. Lane 2: B95-8 control. Lane 3: SUNE-1 incubated with 2×10-6 mol/L DEX for 18 h.Lane 4: B95-8 incubated with 2×10-6 mol/L DEX for 18 h.Lane 5: K562control. Lane 6: K562 incubated with 2×10-6 mol/L DEX for 18 h
, 百拇医药
图3 用[32P]-dCTP标记的EBV-BHRF1探针测定SUNE-1,B95-8 and K562三种肿瘤细胞株中的EBV-BHRF1转录水平
(四)以3种肿瘤细胞株在2×10-6 mol/L DEX共同培养18 h前后的RNA作为模板,以β-actin作为内参照(在同一反应管中进行),经一步法反转录PCR(RT-PCR)扩增后,经1%琼脂糖凝胶电泳后,结果见图4。由图4可见K562细胞株中因不含有EBV-BHRF1基因片段,故DEX作用前后均为阴性。而SUNE-1和B95-8细胞株在未受DEX作用前RT-PCR为阴性,即仅出现346 bp的β-actin条带;受DEX作用后,扩增结果为阳性,即仅出现592 bp的EBV-BHRF1条带,表明EBV-BHRF1 mRNA水平显著提高(因各组β-actin的强度基本一致)。

, 百拇医药
Fig 4 Agarose gel electrophoresis of RT-PCR results using RNAs extracted from K562, SUNE-1 and B95-8 cell line before and after incubated with 2×10-6 mol/L DEX at 37℃ for 18h. Lane 1: K562 control. Lane 2: SUNE-1 control. Lane 3: B95-8 control. Lane 4: K562 incubated with 2×10-6 mol/L DEX for 18 h. Lane5: 1Kb DNA ladder. Lane 6: SUNE-1 incubated with 2×10-6 mol/L DEX for 18 h. Lane 7: B95-8 incubated with 2×10-6 mol/L DEX for 18 h. Lane 8: negative control using 0.1% DEPC-H2O as template
, 百拇医药
图4 三种细胞株在DEX作用前后,其RNA经RT-PCR扩增EBV-BHRF1片段的琼脂糖电泳图
讨论
凋亡是基因调控下的细胞自我消亡的过程,它不仅参与机体的生长、发育、成熟和衰老的各个过程,而且在肿瘤的发生、发展、转移及治疗过程中均起着非常重要的作用[1]。EBV-BHRF1基因与抑制细胞凋亡的原癌基因Bcl-2具有相似的结构与功能[3],研究含有该基因片段的肿瘤细胞株在受到诱导细胞凋亡因素作用时,该基因转录水平的变化,揭示其作用,对于提高EBV相关肿瘤的治疗效果具有重要意义。前文已提示EBV-BHRF1反义寡核苷酸片段能够诱导缺血清培养条件下的SUNE-1细胞发生凋亡[5];而在有血清培养条件下,SUNE-1和B95-8细胞株可以抵抗2×10-6 mol/L DEX作用24 h所诱导的细胞凋亡[6]。本研究结果显示在2×10-6 mol/L DEX作用18 h时,SUNE-1和B95-8细胞中EBV-BHRF1基因的转录水平(RNA水平)显著提高,说明EBV-BHRF1基因的转录和表达与SUNE-1和B95-8细胞株抵抗诱导细胞凋亡因素的作用密切相关。在治疗EBV相关性肿瘤时,应注意拮抗BHRF1基因产物的作用,才可能取得较理想的治疗效果[6]。
, http://www.100md.com
*中华医学会(CMB)基金及广东省科委青年基金(950355)资助课题;主要工作在美国宾州匹兹堡大学癌症研究所(University of Pittsburgh Cancer Institute)完成
参考文献
1 Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science, 1995, 267:1456.
2 List A F, Greco F A, Vogler L B. Lymphoproliferative diseases in immunocompromised hosts: the role of Epstein-Barr virus. J Clin Oncol, 1987, 5: 1673.
3 Henderson S, Huen D, Rowe M, et al. Epstein-Barr virus-code BHRF1 protein, a viral homologue of bcl-2, protects human B cells from programmed cell death. Proc Natl Acad Sci USA, 1993, 90:8479.
, http://www.100md.com
4 Bear R, Bankier AT, Biggin M, et al. DNA sequence and expression of the B95-8 Epstein-Barr virus genome. Nature, 1984, 310:207.
5 朱振宇,黄必军,戴克胜,等.EB病毒BHRF1反义寡核苷酸片段诱导鼻咽癌SUNE-1细胞株的凋亡.中山医科大学学报,1998;19:105.
6 朱振宇,黄必军,戴克胜,等.EBV-BHRF1基因阳性与阴性细胞株对3种诱导凋亡因素抵抗性差异的研究.肿瘤,1998,18:129.
7 吴荫棠,汪慧民,扬小平,等.鼻咽癌裸鼠移植瘤及其相应体外细胞株的建立与特性研究.癌症,1995,14:83.
8 Miller G, Shope T, Lisco H, et al. Epstein-Barr virus: transformation, cytopathic changes, and viral antigens in squirrel, monkey and marmoset leukocyte. Proc Natl Acad Sci USA, 1972, 69:383.
9 朱振宇,潘景轩,赵 群,等.地塞米松诱导裸鼠脾细胞凋亡的研究.中国病理生理杂志,1996, 12:113.
10 卢圣栋,主编.现代分子生物学实验技术.第1版.北京:高等教育出版社,1993.68~238.
(1998年9月28日收稿,1999年3月5日修回), 百拇医药