八肽胆囊收缩素对脂多糖诱导离体兔肺动脉反应性变化的影响*
作者:谷振勇 凌亦凌 孟爱宏 丛 斌 黄善生
单位:河北医科大学病理生理教研室(石家庄 050017)
关键词:缩胆囊素;肺动脉;脂多糖类;兔
八肽胆囊收缩素对脂多糖诱导离体 兔肺动脉反应性变化的影响 摘 要 目的与方法:为探讨胆囊收缩素(CCK)缓解内毒素休克时肺动脉压增高的作用机制,应用离体血管环技术观察CCK对内毒素主要成分脂多糖(LPS)诱导兔肺动脉反应性变化的影响。结果:LPS(4 μg/mL, 2h)引起离体肺动脉对α受体激动剂苯肾上腺素(PE)的收缩反应增强,降低对乙酰胆碱(ACh)介导的内皮依赖性舒张反应;CCK-8(0.1 μg/mL和0.5 μg/mL)逆转了LPS的上述作用;CCK-8( 0.5 μg/mL, 2h)本身对正常肺动脉舒缩反应无明显影响。结论:CCK通过保护肺内皮细胞、增强肺动脉内皮依赖性舒张反应而拮抗收缩反应,可能是发挥抗肺动脉压增高的机制之一。
, http://www.100md.com
Effects of cholecystokinin octapeptide on the response of
rabbit pulomonary artery induced by LPS in vitro
GU Zhen-Yong, LING Yi-Ling, MENG Ai-Hong, CONG Bin, HUANG Shan-Sheng
Department of Pathophysiology, Hebei Medical University, Shijiazhuang(050017)
Abstract AIM and METHODS:To elucidate the mechanism of cholecystokinin (CCK) for attenuation of pulmonary hypertension in the early stage of endotoxin shock in vitro, effects of CCK-8, an important functional fragment of endogenous CCK, on the responses of rabbit pulmonary artery induced by lipopolysaccharides (LPS) in vitro were observed with isolated artery ring technique. RESULTS:The exposure of pulmonary artery to LPS (4μg/mL, 2h) 1ed to enhancement of its contractile response to α-adrenoceptor agonist phenylephrine (PE) but reduction of its relaxation response to acetylcholine, an endothelium-dependent vasodilator, both of which were reversed by the concomitant exposure to CCK-8(0.1 μg/mL and 0.5 μg/mL), whereas incubation of pulmonary artery with CCK-8 (0.5 μg/mL) had no effect on the responses. CONCLUSION:CCK can protect pulmonary artery endothelia against detrimental effects by LPS, which may be one of mechanisms underlying anti-pulmonary hypertension of CCK.
, 百拇医药
MeSH Cholecystokinin; Pulmonary artery; Lipopolysaccharides; Rabbits
内毒素休克是一种危重病征,肺动脉压增高而平均动脉压降低是其发病早期的特征性病理变化。研究显示,肺动脉压增高的程度及其维持的时间是休克并发急性呼吸窘迫综合征,导致休克难治的重要因素[1]。探索内源性抗休克物质及其作用机制一直就是研究休克的热点课题。研究表明,胆囊收缩素(cholecystokinin,CCK)具有抗休克的作用[2,3],并可防止内毒素主要成分脂多糖(LPS)诱导的大鼠肺动脉压增高[4]。然而,CCK对血管反应性影响的作用机制尚不清楚。本实验应用离体动脉环技术,观察八肽胆囊收缩素(CCK-8)对内毒素引起肺动脉反应性变化的影响,以探讨CCK缓解内毒素休克时肺动脉压增高的作用机制。
材料与方法
, http://www.100md.com
一、材料:
脂多糖(E. coli. lipopolysaccharide, LPS),八肽胆囊收缩素(CCK-8),氯化乙酰胆碱(ACh),消炎痛均为Sigma产品;苯肾上腺素(phenylephrine,PE)购于上海天丰制药厂;RPMI-1640购于邦定公司;其余试剂均系国产分析纯。
二、实验程序:
1.离体肺动脉环的制备 日本大耳白兔12只,雄雌不拘,体重2.1~2.6 kg。实验前禁食18 h,自由饮水。25%乌拉坦腹腔注射麻醉后放血处死。迅速联合摘取心肺,在预冷的Krebs液中,分离两侧近端的肺动脉,剔除外膜粘附的结缔组织,避免损伤动脉内皮细胞,剪制成3 mm长血管环。Krebs液成分(mmol/L):NaCl 118,KCl 4.7, MgSO4 1.2, KH2PO4 1.2, NaHCO3 25, CaCl2 2.5,葡萄糖11.1, (pH=7.4)。
, 百拇医药
2.实验分组 LPS组(n=10)、LPS+CCK-8 0.1 μg/mL组(n=10)、LPS+CCK-8 0.5 μg/mL组(n=8)、CCK-8 0.5 μg/mL组(n=8)及溶剂对照组(n=13)。将肺动脉环置于RPMI-1640培养液(溶剂)中,每2 mL培养液中置2个环,分别用4 μg/mL LPS、或加0.1 μg/mL、0.5 μg/mL CCK-8,单用0.5 μg/mL CCK-8或溶剂,在37℃、含5% CO2的潮湿环境中(CO2孵箱)孵育2 h。
3.肺动脉环张力检测 把预处理的肺动脉环垂直挂于夹层器官槽中,一端固定于槽底部,一端通过张力传感器(T-1型)与3066型平台记录仪(四川仪表总厂)相连。糟中通有37℃恒温含10-5 mol/L消炎痛Krebs液,并持续充入95% O2-5% CO2混合气体。血管静息张力为2 g,平衡1 h,每15 min换液1次。平台记录仪描记血管环张力变化。PE 10-6 mol/L预收缩肺动脉至平台,Krebs液冲洗至基线,以稳定肺动脉的反应性。然后观察肺动脉对PE 10-6 mol/L、ACh 10-6 mol/L的反应性变化。实验结束后,留取肺动脉,烘烤至恒重,以标化张力。收缩反应变化用克.张力/毫克环干重(g tension/mg dw)表示。舒张反应变化用g tension/mg dw和舒张张力占同组PE收缩张力的百分比表示。
, 百拇医药
三、统计处理:
实验数据为均值±标准差(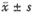 )。差异显著性用多样本均数t检验判断。
)。差异显著性用多样本均数t检验判断。
结果
一、对肺动脉收缩反应的影响:
溶剂组收缩张力为(1.77±0.31) g tension/mg dw;LPS组为(2.50±0.66) g tension/mg dw,显著高于溶剂组(P<0.01)。CCK-8(0.1,0.5 μg/mL)与LPS共同孵育后,肺动脉对PE的收缩反应张力分别为(1.78±0.34) g tension/mg dw和(1.77±0.24) g tension/mg dw,显著低于LPS组(P<0.01)(图1,2)。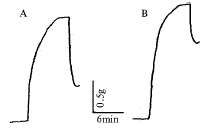
, http://www.100md.com
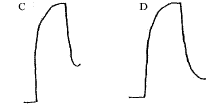
Fig 1 Representative tracings of isometric contractile responses to PE and relaxation responses to ACh of rabbit pulmonary artery pre-incubated with vehicle(A), LPS(B), LPS+CCK-8 0.1 μg/mL(C), LPS+CCK-8 0.5 μg/mL(D).
图1 兔离体肺动脉环预处理后对PE的收缩反应和ACh的舒张反应的典型原始图
Fig 2 CCK-8 reversed enhancement of contractile response of pulmonary artery induced by LPS to PE.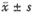 . **P<0.01, vs vehicle group ##P<0.01, vs LPS group
. **P<0.01, vs vehicle group ##P<0.01, vs LPS group
, 百拇医药
图2 CCK逆转LPS诱导兔离体肺动脉环对PE的收缩反应增强
二、对肺动脉内皮依赖性舒张反应的影响:
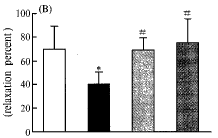
LPS(4 μg/mL)预处理后,肺动脉对ACh的舒张反应张力和舒张反应百分比明显降低(P<0.05);CCK-8(0.1 μg/mL和0.5 μg/mL)逆转LPS诱导的内皮依赖性舒张反应抑制,增强肺动脉对ACh的舒张的反应,舒张张力和舒张反应百分比均明显高于LPS组(P<0.05)(图1,3)。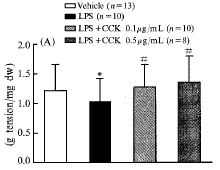
, http://www.100md.com
Fig 3 CCK-8 reversed reduction of relaxation tone(A) and relaxation percent(B) of pulmonary artery elicited by LPS to ACh.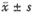 .*P<0.05, vs vehicle group; #P<0.05, vs LPS group
.*P<0.05, vs vehicle group; #P<0.05, vs LPS group
图3 CCK逆转LPS诱导兔离体肺动脉环对ACh的舒张反应抑制
CCK-8(0.5 μg/mL)单独孵育2 h,肺动脉对PE的收缩反应张力为(1.64±0.41) g tension/mg dw;对ACh的舒张反应张力和舒张反应百分比分别为(1.29±0.21) g tension/mg dw (79.13±16.47)%,与溶剂组相比均无明显差异(P>0.05)。
, 百拇医药
讨论
1928年Ivy和Oldferg首次在犬的胃肠道发现了CCK。1976年发现在羊脑内也有CCK分布,从而确立CCK是一种脑-肠肽。CCK-8(CCK26-33)为内源性CCK的重要功能片段。以往对CCK的研究多偏重于其在消化系统、神经系统及内分泌活动中的调节作用。CCK在肺脏也有分布[4,5]。然而,CCK在肺脏、特别是在内毒素休克时肺脏病理变化中的作用报道尚少。内毒素休克时,CCK的血液含量增高[5],肺脏对CCK的清除明显减少[7],预先静脉注射CCK-8防止了LPS诱导肺动脉压增高[4],改善肺脏等器官的病理变化,还可明显逆转内毒素休克大鼠的平均动脉压降低,提高休克大鼠的生存率[2],逆转失血性休克时阿片肽的血管抑制[3];而使用CCK受体拮抗剂或CCK抗血清,导致失血性休克后平均动脉压恢复明显延迟,内毒素休克大鼠的死亡率明显增加[2,3]。这些结果表明,CCK对休克动物具有保护作用,在内毒素休克时对肺循环可能具有双向调节作用。然而CCK-8保护血管的反应性以及调节血管张力变化的作用途径尚不清楚。本实验观察了CCK-8对LPS诱导离体兔肺动脉反应性变化的影响。结果显示,LPS预处理直接诱导了肺动脉对PE的收缩反应显著增强,并抑制其内皮依赖性舒张反应;CCK-8可逆转LPS对离体肺动脉的上述生物效应,提高肺动脉的内皮依赖性舒张反应而降低收缩反应;而CCK-8对正常肺动脉的收缩反应和内皮依赖性舒张反应无明显影响。
, 百拇医药
研究证实,内皮源性一氧化氮(NO)在血管张力的调控上起重要作用。ACh为内皮依赖及受体依赖性舒血管物质,内皮源性NO介导其舒张反应。肺动脉对ACh的舒张反应明显抑制,提示LPS可能直接损伤了肺动脉内皮细胞功能,如抑制内皮结构型一氧化氮合酶(ecNOS)活性,妨碍NO生成与释放;诱导血管壁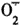 生成增多,直接清除NO;损伤内皮细胞结构,ACh的膜受体发生变化等。LPS(4 μg/mL,2 h)孵育即可诱导肺动脉对PE的收缩反应明显增强,这与内毒素休克或内毒素血症时肺动脉压增高的体内情况一致,说明LPS本身对肺动脉的直接作用是内毒素休克时肺动脉压增高的机制之一,而此时肺动脉平滑肌诱导型一氧化氮合酶(iNOS)可能尚未被诱导。肺动脉内皮细胞功能受损可能是肺动脉对PE收缩反应显著增强的原因。在离体血管水平CCK-8逆转了LPS对肺动脉的内皮依赖性舒张反应的抑制,说明CCK-8具有直接保护肺内皮细胞的功能。因CCK-8确能改善内毒素休克时肺脏的病理变化[2],因而认为CCK具有细胞保护作用。该作用至少部分是在动物整体水平CCK-8发挥抗LPS导致肺动脉压增高的机制之一。最近,应用原位RT-PCR技术证实,肺内皮细胞有CCK受体mRNA表达[8],CCK-8可提高内毒素休克时的血液SOD活性,降低MDA的含量[9],因此,CCK-8是由其内皮受体后事件诱导肺动脉SOD活性增加、直接清除活性氧,抑或通过提高ecNOS活性而发挥作用,尚有待进一步研究。
生成增多,直接清除NO;损伤内皮细胞结构,ACh的膜受体发生变化等。LPS(4 μg/mL,2 h)孵育即可诱导肺动脉对PE的收缩反应明显增强,这与内毒素休克或内毒素血症时肺动脉压增高的体内情况一致,说明LPS本身对肺动脉的直接作用是内毒素休克时肺动脉压增高的机制之一,而此时肺动脉平滑肌诱导型一氧化氮合酶(iNOS)可能尚未被诱导。肺动脉内皮细胞功能受损可能是肺动脉对PE收缩反应显著增强的原因。在离体血管水平CCK-8逆转了LPS对肺动脉的内皮依赖性舒张反应的抑制,说明CCK-8具有直接保护肺内皮细胞的功能。因CCK-8确能改善内毒素休克时肺脏的病理变化[2],因而认为CCK具有细胞保护作用。该作用至少部分是在动物整体水平CCK-8发挥抗LPS导致肺动脉压增高的机制之一。最近,应用原位RT-PCR技术证实,肺内皮细胞有CCK受体mRNA表达[8],CCK-8可提高内毒素休克时的血液SOD活性,降低MDA的含量[9],因此,CCK-8是由其内皮受体后事件诱导肺动脉SOD活性增加、直接清除活性氧,抑或通过提高ecNOS活性而发挥作用,尚有待进一步研究。
, 百拇医药
* 国家自然科学基金资助(No.39570304)
参考文献
1 Sheridan BC, McIntyre Jr RC, Moore EE, et al. Neutrophils mediate pulmonary vasomotor dysfunction in endotoxin-induced acute lung injury. J Trauma,1997,42(3):391.
2 凌亦凌,黄善生,王乐丰,等.八肽胆囊收缩素抗内毒素休克的实验研究.生理学报,1996,48(4):390.
3 梅 林,韩济生.中枢八肽胆囊收缩素对大鼠脊髓水平阿片肽心血管调节作用的拮抗效应.生理科学进展,1991,22(2):153.
4 丛 斌,凌亦凌,左 敏,等.肺组织中八肽胆囊收缩素的免疫组织化学检测.中国病理生理杂志,1998,14(3):317.
, http://www.100md.com
5 丛 斌,凌亦凌,左 敏,等.肺组织中八肽胆囊收缩素mRNA的RT-PCR方法检测.中国病理生理杂志,1998,14(3):292.
6 Riepl R, Jessen TG, Revhaug A, et al. Increases of plasma cholecystokinin by Escherichia coli endotoxin-induced shock in swine. J Gastroenterol,1986,24(1):691.
7 王乐丰,黄善生,凌亦凌,等.正常及内毒素休克时胆囊收缩素的肺内清除.中国病理生理杂志,1996,12(6):571.
8 丛 斌,凌亦凌,谷振勇,等.CCK-A及CCK-B受体mRNA在SD大鼠肺组织中的表达.河北医科大学学报,1998,19(2):100.
9 凌亦凌,黄善生,张君岚,等.胆囊收缩素对内毒素休克大鼠SOD、MDA及吞噬细胞发光的影响.中国病理生理杂志,1997,13(5):483.
(1999年3月8日收稿,1999年4月12日修回), 百拇医药
单位:河北医科大学病理生理教研室(石家庄 050017)
关键词:缩胆囊素;肺动脉;脂多糖类;兔
八肽胆囊收缩素对脂多糖诱导离体 兔肺动脉反应性变化的影响 摘 要 目的与方法:为探讨胆囊收缩素(CCK)缓解内毒素休克时肺动脉压增高的作用机制,应用离体血管环技术观察CCK对内毒素主要成分脂多糖(LPS)诱导兔肺动脉反应性变化的影响。结果:LPS(4 μg/mL, 2h)引起离体肺动脉对α受体激动剂苯肾上腺素(PE)的收缩反应增强,降低对乙酰胆碱(ACh)介导的内皮依赖性舒张反应;CCK-8(0.1 μg/mL和0.5 μg/mL)逆转了LPS的上述作用;CCK-8( 0.5 μg/mL, 2h)本身对正常肺动脉舒缩反应无明显影响。结论:CCK通过保护肺内皮细胞、增强肺动脉内皮依赖性舒张反应而拮抗收缩反应,可能是发挥抗肺动脉压增高的机制之一。
, http://www.100md.com
Effects of cholecystokinin octapeptide on the response of
rabbit pulomonary artery induced by LPS in vitro
GU Zhen-Yong, LING Yi-Ling, MENG Ai-Hong, CONG Bin, HUANG Shan-Sheng
Department of Pathophysiology, Hebei Medical University, Shijiazhuang(050017)
Abstract AIM and METHODS:To elucidate the mechanism of cholecystokinin (CCK) for attenuation of pulmonary hypertension in the early stage of endotoxin shock in vitro, effects of CCK-8, an important functional fragment of endogenous CCK, on the responses of rabbit pulmonary artery induced by lipopolysaccharides (LPS) in vitro were observed with isolated artery ring technique. RESULTS:The exposure of pulmonary artery to LPS (4μg/mL, 2h) 1ed to enhancement of its contractile response to α-adrenoceptor agonist phenylephrine (PE) but reduction of its relaxation response to acetylcholine, an endothelium-dependent vasodilator, both of which were reversed by the concomitant exposure to CCK-8(0.1 μg/mL and 0.5 μg/mL), whereas incubation of pulmonary artery with CCK-8 (0.5 μg/mL) had no effect on the responses. CONCLUSION:CCK can protect pulmonary artery endothelia against detrimental effects by LPS, which may be one of mechanisms underlying anti-pulmonary hypertension of CCK.
, 百拇医药
MeSH Cholecystokinin; Pulmonary artery; Lipopolysaccharides; Rabbits
内毒素休克是一种危重病征,肺动脉压增高而平均动脉压降低是其发病早期的特征性病理变化。研究显示,肺动脉压增高的程度及其维持的时间是休克并发急性呼吸窘迫综合征,导致休克难治的重要因素[1]。探索内源性抗休克物质及其作用机制一直就是研究休克的热点课题。研究表明,胆囊收缩素(cholecystokinin,CCK)具有抗休克的作用[2,3],并可防止内毒素主要成分脂多糖(LPS)诱导的大鼠肺动脉压增高[4]。然而,CCK对血管反应性影响的作用机制尚不清楚。本实验应用离体动脉环技术,观察八肽胆囊收缩素(CCK-8)对内毒素引起肺动脉反应性变化的影响,以探讨CCK缓解内毒素休克时肺动脉压增高的作用机制。
材料与方法
, http://www.100md.com
一、材料:
脂多糖(E. coli. lipopolysaccharide, LPS),八肽胆囊收缩素(CCK-8),氯化乙酰胆碱(ACh),消炎痛均为Sigma产品;苯肾上腺素(phenylephrine,PE)购于上海天丰制药厂;RPMI-1640购于邦定公司;其余试剂均系国产分析纯。
二、实验程序:
1.离体肺动脉环的制备 日本大耳白兔12只,雄雌不拘,体重2.1~2.6 kg。实验前禁食18 h,自由饮水。25%乌拉坦腹腔注射麻醉后放血处死。迅速联合摘取心肺,在预冷的Krebs液中,分离两侧近端的肺动脉,剔除外膜粘附的结缔组织,避免损伤动脉内皮细胞,剪制成3 mm长血管环。Krebs液成分(mmol/L):NaCl 118,KCl 4.7, MgSO4 1.2, KH2PO4 1.2, NaHCO3 25, CaCl2 2.5,葡萄糖11.1, (pH=7.4)。
, 百拇医药
2.实验分组 LPS组(n=10)、LPS+CCK-8 0.1 μg/mL组(n=10)、LPS+CCK-8 0.5 μg/mL组(n=8)、CCK-8 0.5 μg/mL组(n=8)及溶剂对照组(n=13)。将肺动脉环置于RPMI-1640培养液(溶剂)中,每2 mL培养液中置2个环,分别用4 μg/mL LPS、或加0.1 μg/mL、0.5 μg/mL CCK-8,单用0.5 μg/mL CCK-8或溶剂,在37℃、含5% CO2的潮湿环境中(CO2孵箱)孵育2 h。
3.肺动脉环张力检测 把预处理的肺动脉环垂直挂于夹层器官槽中,一端固定于槽底部,一端通过张力传感器(T-1型)与3066型平台记录仪(四川仪表总厂)相连。糟中通有37℃恒温含10-5 mol/L消炎痛Krebs液,并持续充入95% O2-5% CO2混合气体。血管静息张力为2 g,平衡1 h,每15 min换液1次。平台记录仪描记血管环张力变化。PE 10-6 mol/L预收缩肺动脉至平台,Krebs液冲洗至基线,以稳定肺动脉的反应性。然后观察肺动脉对PE 10-6 mol/L、ACh 10-6 mol/L的反应性变化。实验结束后,留取肺动脉,烘烤至恒重,以标化张力。收缩反应变化用克.张力/毫克环干重(g tension/mg dw)表示。舒张反应变化用g tension/mg dw和舒张张力占同组PE收缩张力的百分比表示。
, 百拇医药
三、统计处理:
实验数据为均值±标准差(
结果
一、对肺动脉收缩反应的影响:
溶剂组收缩张力为(1.77±0.31) g tension/mg dw;LPS组为(2.50±0.66) g tension/mg dw,显著高于溶剂组(P<0.01)。CCK-8(0.1,0.5 μg/mL)与LPS共同孵育后,肺动脉对PE的收缩反应张力分别为(1.78±0.34) g tension/mg dw和(1.77±0.24) g tension/mg dw,显著低于LPS组(P<0.01)(图1,2)。


, http://www.100md.com
Fig 1 Representative tracings of isometric contractile responses to PE and relaxation responses to ACh of rabbit pulmonary artery pre-incubated with vehicle(A), LPS(B), LPS+CCK-8 0.1 μg/mL(C), LPS+CCK-8 0.5 μg/mL(D).
图1 兔离体肺动脉环预处理后对PE的收缩反应和ACh的舒张反应的典型原始图

Fig 2 CCK-8 reversed enhancement of contractile response of pulmonary artery induced by LPS to PE.
, 百拇医药
图2 CCK逆转LPS诱导兔离体肺动脉环对PE的收缩反应增强
二、对肺动脉内皮依赖性舒张反应的影响:
LPS(4 μg/mL)预处理后,肺动脉对ACh的舒张反应张力和舒张反应百分比明显降低(P<0.05);CCK-8(0.1 μg/mL和0.5 μg/mL)逆转LPS诱导的内皮依赖性舒张反应抑制,增强肺动脉对ACh的舒张的反应,舒张张力和舒张反应百分比均明显高于LPS组(P<0.05)(图1,3)。


, http://www.100md.com
Fig 3 CCK-8 reversed reduction of relaxation tone(A) and relaxation percent(B) of pulmonary artery elicited by LPS to ACh.
图3 CCK逆转LPS诱导兔离体肺动脉环对ACh的舒张反应抑制
CCK-8(0.5 μg/mL)单独孵育2 h,肺动脉对PE的收缩反应张力为(1.64±0.41) g tension/mg dw;对ACh的舒张反应张力和舒张反应百分比分别为(1.29±0.21) g tension/mg dw (79.13±16.47)%,与溶剂组相比均无明显差异(P>0.05)。
, 百拇医药
讨论
1928年Ivy和Oldferg首次在犬的胃肠道发现了CCK。1976年发现在羊脑内也有CCK分布,从而确立CCK是一种脑-肠肽。CCK-8(CCK26-33)为内源性CCK的重要功能片段。以往对CCK的研究多偏重于其在消化系统、神经系统及内分泌活动中的调节作用。CCK在肺脏也有分布[4,5]。然而,CCK在肺脏、特别是在内毒素休克时肺脏病理变化中的作用报道尚少。内毒素休克时,CCK的血液含量增高[5],肺脏对CCK的清除明显减少[7],预先静脉注射CCK-8防止了LPS诱导肺动脉压增高[4],改善肺脏等器官的病理变化,还可明显逆转内毒素休克大鼠的平均动脉压降低,提高休克大鼠的生存率[2],逆转失血性休克时阿片肽的血管抑制[3];而使用CCK受体拮抗剂或CCK抗血清,导致失血性休克后平均动脉压恢复明显延迟,内毒素休克大鼠的死亡率明显增加[2,3]。这些结果表明,CCK对休克动物具有保护作用,在内毒素休克时对肺循环可能具有双向调节作用。然而CCK-8保护血管的反应性以及调节血管张力变化的作用途径尚不清楚。本实验观察了CCK-8对LPS诱导离体兔肺动脉反应性变化的影响。结果显示,LPS预处理直接诱导了肺动脉对PE的收缩反应显著增强,并抑制其内皮依赖性舒张反应;CCK-8可逆转LPS对离体肺动脉的上述生物效应,提高肺动脉的内皮依赖性舒张反应而降低收缩反应;而CCK-8对正常肺动脉的收缩反应和内皮依赖性舒张反应无明显影响。
, 百拇医药
研究证实,内皮源性一氧化氮(NO)在血管张力的调控上起重要作用。ACh为内皮依赖及受体依赖性舒血管物质,内皮源性NO介导其舒张反应。肺动脉对ACh的舒张反应明显抑制,提示LPS可能直接损伤了肺动脉内皮细胞功能,如抑制内皮结构型一氧化氮合酶(ecNOS)活性,妨碍NO生成与释放;诱导血管壁
, 百拇医药
* 国家自然科学基金资助(No.39570304)
参考文献
1 Sheridan BC, McIntyre Jr RC, Moore EE, et al. Neutrophils mediate pulmonary vasomotor dysfunction in endotoxin-induced acute lung injury. J Trauma,1997,42(3):391.
2 凌亦凌,黄善生,王乐丰,等.八肽胆囊收缩素抗内毒素休克的实验研究.生理学报,1996,48(4):390.
3 梅 林,韩济生.中枢八肽胆囊收缩素对大鼠脊髓水平阿片肽心血管调节作用的拮抗效应.生理科学进展,1991,22(2):153.
4 丛 斌,凌亦凌,左 敏,等.肺组织中八肽胆囊收缩素的免疫组织化学检测.中国病理生理杂志,1998,14(3):317.
, http://www.100md.com
5 丛 斌,凌亦凌,左 敏,等.肺组织中八肽胆囊收缩素mRNA的RT-PCR方法检测.中国病理生理杂志,1998,14(3):292.
6 Riepl R, Jessen TG, Revhaug A, et al. Increases of plasma cholecystokinin by Escherichia coli endotoxin-induced shock in swine. J Gastroenterol,1986,24(1):691.
7 王乐丰,黄善生,凌亦凌,等.正常及内毒素休克时胆囊收缩素的肺内清除.中国病理生理杂志,1996,12(6):571.
8 丛 斌,凌亦凌,谷振勇,等.CCK-A及CCK-B受体mRNA在SD大鼠肺组织中的表达.河北医科大学学报,1998,19(2):100.
9 凌亦凌,黄善生,张君岚,等.胆囊收缩素对内毒素休克大鼠SOD、MDA及吞噬细胞发光的影响.中国病理生理杂志,1997,13(5):483.
(1999年3月8日收稿,1999年4月12日修回), 百拇医药