“缺血”对大鼠大脑皮层神经元NMDA受体通道的影响*
作者:王中峰 万子兵 罗全生 薛春生
单位:
王中峰 中国科学院上海生理研究所7 信箱(上海200031);万子兵 罗全生 第三军医大学生理学教研室(重庆 400038);薛春生 重庆医科大学药理学教研室
关键词:局部缺血;神经元;受体;N-甲基-D-天冬氨酸;离子通道
中国病理生理杂志/990712 摘 要 目的:研究“缺血”大鼠大脑大皮层神经元N-甲 基-D-天冬氨酸(NMDA)受体通道的单通道变化特征。方法:细胞贴附式膜片 钳技术。结果:在“缺血”状态下,NMDA受体通道35 pS和100 pS电导水平 的开放概率分别由对照组的0.079±0.006和0.067±0.004增加到0.308±0.155和0.488±0.1 26 (P<0.01),35 pS通道开放时间常数τ2由对照值(4.17±0.38) ms增加到(8.54 ±2.05) ms(P<0.01),关闭时间由(75.50±14.10) ms缩短到(11.80±4.30) ms(P <0. 01)。结论:“缺血”可显著开放大鼠大脑皮层神经元NMDA受体通道,使钙 内流增加,对胞内钙超载起重要作用,此可能是脑缺血细胞损伤的机制之一。
, 百拇医药
Effects of “ischemia” on NMDA-receptor-channels
in rat cerebra l cortical neurons
WANG Zhong-Feng, XUE Chun-Sheng, WAN Zi-Bing, LUO Quan-Sheng
Department of Physiology, Third Military Medical University, Chongqing
Department of Pharmacology, Chongqing University of Medical Sciences, Chongqing( 400046)
Abstract AIM: To study the effects of “ischemia” on N-methyl- D-aspartate (NMDA) receptor-channels in isolated rat cerebral cortical neurons. METHODS:Cell-attached configuration of patch clamp technique.RESULTS::During “ischemia”, the open probability of 35 pS and 100 pS NM DA-rec eptor channels increased from control values 0.079±0.006 and 0.067±0.004 to 0. 308±0.155 and 0.488±0.126, respectively(P<0.01). The open time constant τ2 of 35 pS channels increased from (4.17±0.38) ms to (8.54±2.05) ms(P <0.01) The close time constant τ decreased from (75.50±14.10) ms to (11.80 ±4.30) ms (P<0.01).CONCLUSION::NMDA-receptor-chann els in rat cerebral cortica l neurons were activated significantly during “ischemia”, which increases Ca 2+ inflow and plays and important role in intracellular Ca2+ overl oad. It was one of the cell injury mechanisms during cerebral ischemia.
, 百拇医药
MeSH Ischemia; Neurons; Receptors, N-methyl-D-aspartate; Ion channels
兴奋性氨基酸是所有脊椎动物中枢神经系统内的主要兴奋性递质,N- 甲基-D-天冬氨酸(N-methyl-D-aspartate, NMDA)受体为其最重要的受体。NMDA受体介导了 广泛的生理和病理过程,包括神经的发育,可塑性,LTP的产生和兴奋毒等。NMDA受体耦联 的通道即NMDA受体通道。众多的学者认为脑缺血时,由于兴奋性氨基酸释放增多,从而激活 该通道,使其过度兴奋,产生离子的跨膜流动,其中以Ca2+为主,使细胞内钙浓度增 高[1,2]。本实验用细胞贴附膜片钳单通道记录技术研究大鼠大脑皮层神经元NMDA 受体通道在体外模拟缺血状态下的变化特征。
材料与方法
实验选用生后2~4周的Wistar大鼠,雌雄不拘,断头取脑,分离顶叶及其周围皮层,用手 工切成厚约400~500 μm的冠状脑片,在通混合气(95% O2+5% CO2)的人工脑脊液内孵 育,人工脑脊液成分为(mmol.L-1):NaCl 126; KCl 5;NaH2PO4 1.25;NaHCO3 26;CaCl2 2;MgSO4 2; HEPES 10;葡萄糖10,pH 7.2(NaOH调制)。0.5~ 1 h后,取 2片置入含0.1%胰 蛋白酶的2 mL人工脑脊液内消化0.5 h,消化过程中仍通混合气。将脑片稍加剪碎,移入2 mL 人工脑脊液内,用尖端火抛光的Pasteur吸管(直径500,300,150 μm)顺续吹打,使组织块 分散,细胞游离。将此液静置7~10 min,吸取上清液,滴加于事先涂有多聚赖氨酸的盖玻片上,静置10 min使细胞贴壁,加入浴液即可开始膜片钳记录。分离过程在室温(20~25℃) 下进行。
, 百拇医药
采用膜片钳细胞贴附式结构记录通道电流[3]。实验用细胞浴液成分(mmol.L -1):NaCl 140, CsCl 5, CaCl2 1.8, HEPES 10, TTX 0.001, 葡萄糖1 0,pH7.2;电极液成分(mmol.L-1);NMDA 20 μmol.L-1;L-甘氨酸1μmol.L-1,不含葡萄糖,其余同细胞浴液。“缺血”组细胞浴液成分除不含葡萄糖外 ,其余同正常浴液,在施加于细胞前通混合氮气(95%N2+5%CO2)饱和1 h以上,氧分压 为9.16 kPa(IL-1620型血气分析仪,美国)。
用微电极拉制器(PP-83,Narishige,Japan)两步拉制微电极,电极尖端直径1~1.5 μm,经 热抛光,充灌电极液后电极电阻4~6 MΩ。封接电阻一般10~30 GΩ。单通道电流经膜片钳 放大器(CEZ-2200,日本光电)放大,1 kHz滤波,用DigiData 1200接口和pClamp软件(6.02 版,Axon Instruments,Inc, USA)将信号采入微机。用Fetchex程序不间断采样,采样频率2 0 kHz,细胞钳制电位-80 mV。实验在室温(20~25℃)下进行。
, http://www.100md.com
用pClamp软件的Fetchan程序对实验记录曲线进行理想化处理,列出通道开放的事件表,忽 略水平0.01 ms,滤波设置3 kHz.用pStat程序对通道的开放和关闭时间进行指数拟合,通道 开 放的电流幅度用点电流序列密度直方图法求出,计算出通道不同电导水平的开放概率。实验 数据用 ±s表示,用t检验进行显著性测验。
±s表示,用t检验进行显著性测验。
实验所用胰蛋白酶,多聚赖氨酸,HEPES,MK-801,NMDA和L-甘氨酸为Sigma公司产品,其余 为国产分析纯。
结 果
在电极液内加入20 μmol.L-1的NMDA和1 μmol*L-1的L-甘氨酸以激动NMDA 受体,可记录到NMDA受体通道的单通道电流,其开放一般有两个电导水平,其电导值分别为 35 pS和100 pS,开放时电流幅度分别为(2.79±0.14) pA和(7.79±0.05) pA.开放概率 分别为(0.079±0.006) pS和(0.067±0.004)。 35 pS NMDA通道的开放时间需用双指数 拟合,其开放时间常数τ1和τ2分别为(0.56±0.10) ms和(4.17±0.38) ms, 10 0 pS NMDA通道的开放时间也需用双指数拟合,其开放时间常数τ1和τ2分别为(0.50 ±0.38) ms和(7.80±1.74) ms.通道的关闭时间常数τ为(75.50±14.10) ms (n= 10)。
, 百拇医药
在“缺血”状态下,NMDA受体通道被显著激活,部分细胞膜片的通道开放为单个水平的开放 增加(图1C),部分细胞膜片的通道开放为多电导的开放(图1D),其电导水平以35 pS和100 p S为主。35 pS通道的开放时间常数τ1和τ2分别为(0.69±0.15) ms和(8.54±2. 46)ms.与对照组相比,τ2显著增加(P<0.01),通道的开放概率显著增加,达到0 .308±0.155(P<0.01);100 pS通道的开放时间常数τ1和τ2分别为(0.58 ±0.12) ms和(7.91±2.53)ms,与对照组相比,τ1和τ2均无显著差异,但通道的 开放概率明显增加,达到0.488±0.126(P<0.01,n=7)。对于有多电导开放的 细胞,其总 的开放概率可达0.896±0.034,通道的关闭时间常数τ为(11.80±4.30) ms,显著缩短 于对照组(P<0.01,n=9)。NMDA受体通道拮抗剂MK-801可显著抑制“缺血”诱导 的 通道开放(图1E)。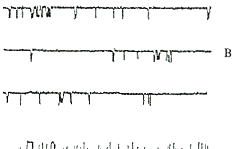



, 百拇医药
Fig 1 Effects of “ischemia” on NMDA-receptor-channels in rat cereb ral cortical neurons recorded in the cell-attached configuration. Holding potent ial was set at-80 mV. Inward currents are indicated as downward deflections. A. 100 pS channels; B. 35 pS channels; C. 35 pS channels in “ischemia" condition. D. 35 pS and 100 pS channels in “ischemia" condition; E. MK-801 0.05 mg.mL-1 on NMD A-receptor channels in "ischemia" condition
, 百拇医药
图1 “缺血”对大鼠大脑皮层神经元NMDA受体通道的影响
讨 论
NMDA受体通道是存在于中枢神经系统内的一类受体门控通道,该通道对Ca2+ 有较大 的选择性,而对Na+和K+非选择性通透,对Cl不通透,因此通道被激活后主要产生C a2+内流[4~8]。本实验在玻璃微电极内加入20μmol.L-1的 NMDA和1μmol.L-1的L-甘氨酸以激动NMDA受体,记录到正常的通道电活动,其开 放、关闭的动力学特征与文献报道基本一致,证明实验所记录到的通道是典型的NMDA受体通 道。该通道在开放时有多电导水平,本文仅分析35 pS和100 pS通道电流在“缺血”时的变 化特征。
, 百拇医药
多数实验室均证明脑缺血时,脑细胞内Ca2+浓度急剧增高,这是脑缺血损伤的 启动 因素之一。本实验用膜片钳技术直接观察到,在“缺血”状态下,大鼠大脑皮层神经元NMDA 受体通道被激活,35 pS电导水平通道开放时间常数较大的τ2显著延长,通道35 pS和1 00 pS电导水平的开放概率显著增加,关闭时间缩短,由于该通道对Ca2+有选择性 通透,因此,NMDA受体通道的激活可显著增加Ca2+内流,对缺血时细胞内钙超载起 重要 作用。有些学者认为,脑缺血时,胞内Ca2+的增多主要是通过NMDA受体通道,而膜 电压依赖性钙通道不起作用[2],但我们用膜片钳技术直接观察到了在脑“缺血” 时L-和N-型电压依赖性钙通道的开放增加[9]。从本实验结果来看,大鼠皮层NMDA 受体通道在脑“缺血”时的开放程度比电压依赖性钙通道更显著,由此导致的Ca2+ 内流可能处于主导地位,电压依赖性钙通道的开放进一步加重了胞内钙的聚集,另外,在缺 血时,胞内钙释放也参与了钙的聚集[10]。
, http://www.100md.com
* 第三军医大学科研基金资助
参考文献
1 Salinska E, Pluta R, Puka M, et al. Blockade of N-methyl-D- aspartate-sensitive excitatory amino acid receptors with 2-amino-5-phosphovalera te reduces ischemia-evoked calcium redistribution in rabbit hippocampus. Exp Neu rol, 1991, 112:89.
2 Xie YX, Zacharias E, Hoff P, et al. Ion channel involvement in anoxic depolarization induced by cardiac arrest in rat brain. J Cereb Blood Fluid Metab , 1995, 15:587.
, http://www.100md.com
3 Hamill OP, Marty A, Neher E, et al. Improved patch-clamp techniques fo r high-resolution current recording from cells and cell-free membrane patches. P flugers Arch, 1981, 391:85.
4 Gibb AJ, Colquhoun D. Glutamate activation of a single NMDA receptor-c hannel produces a cluster of channel openings. Proc R Soc Lond [Biol], 1991, 243:39.
5 Gibb AJ, Colquhoun D. Activation of N-methyl-D-aspartate receptors by L-glutamate in cells dissociated from adult rat hippocampus. J Physiol, 1992, 45 6:143.
, 百拇医药
6 Mayer ML, Miller RJ. Excitatory amino acid receptors, second messenger s and regulation of intracellular Ca2+ in mammalian neurons. Trands Phar macol Sci, 1990, 11:254.
7 高天明,邹飞,陈培熹.大脑皮层神经元NMDA受体的单通道特性.生理学报, 1995,47:133.
8 Kohr G, Koninck YD, Mody I. Properties of NMDA receptor channels in ne urons acutely isolated from epileptic (Kindled) rats. J Neurosci, 1993,13:3612.
9 王中峰,薛春生.“缺血”对大鼠大脑皮层神经元钙通道的影响.中国应用生理 学杂志,1998,14:150.
10 Wood ER, Bussey TJ, Philips AG. A glucine antagonist reduces ischemia -induced CAl cell loss in vivo. Neurosci Lett, 1992, 145:10.
(1998年3月30日收稿,19998年9月4日修回), http://www.100md.com
单位:
王中峰 中国科学院上海生理研究所7 信箱(上海200031);万子兵 罗全生 第三军医大学生理学教研室(重庆 400038);薛春生 重庆医科大学药理学教研室
关键词:局部缺血;神经元;受体;N-甲基-D-天冬氨酸;离子通道
中国病理生理杂志/990712 摘 要 目的:研究“缺血”大鼠大脑大皮层神经元N-甲 基-D-天冬氨酸(NMDA)受体通道的单通道变化特征。方法:细胞贴附式膜片 钳技术。结果:在“缺血”状态下,NMDA受体通道35 pS和100 pS电导水平 的开放概率分别由对照组的0.079±0.006和0.067±0.004增加到0.308±0.155和0.488±0.1 26 (P<0.01),35 pS通道开放时间常数τ2由对照值(4.17±0.38) ms增加到(8.54 ±2.05) ms(P<0.01),关闭时间由(75.50±14.10) ms缩短到(11.80±4.30) ms(P <0. 01)。结论:“缺血”可显著开放大鼠大脑皮层神经元NMDA受体通道,使钙 内流增加,对胞内钙超载起重要作用,此可能是脑缺血细胞损伤的机制之一。
, 百拇医药
Effects of “ischemia” on NMDA-receptor-channels
in rat cerebra l cortical neurons
WANG Zhong-Feng, XUE Chun-Sheng, WAN Zi-Bing, LUO Quan-Sheng
Department of Physiology, Third Military Medical University, Chongqing
Department of Pharmacology, Chongqing University of Medical Sciences, Chongqing( 400046)
Abstract AIM: To study the effects of “ischemia” on N-methyl- D-aspartate (NMDA) receptor-channels in isolated rat cerebral cortical neurons. METHODS:Cell-attached configuration of patch clamp technique.RESULTS::During “ischemia”, the open probability of 35 pS and 100 pS NM DA-rec eptor channels increased from control values 0.079±0.006 and 0.067±0.004 to 0. 308±0.155 and 0.488±0.126, respectively(P<0.01). The open time constant τ2 of 35 pS channels increased from (4.17±0.38) ms to (8.54±2.05) ms(P <0.01) The close time constant τ decreased from (75.50±14.10) ms to (11.80 ±4.30) ms (P<0.01).CONCLUSION::NMDA-receptor-chann els in rat cerebral cortica l neurons were activated significantly during “ischemia”, which increases Ca 2+ inflow and plays and important role in intracellular Ca2+ overl oad. It was one of the cell injury mechanisms during cerebral ischemia.
, 百拇医药
MeSH Ischemia; Neurons; Receptors, N-methyl-D-aspartate; Ion channels
兴奋性氨基酸是所有脊椎动物中枢神经系统内的主要兴奋性递质,N- 甲基-D-天冬氨酸(N-methyl-D-aspartate, NMDA)受体为其最重要的受体。NMDA受体介导了 广泛的生理和病理过程,包括神经的发育,可塑性,LTP的产生和兴奋毒等。NMDA受体耦联 的通道即NMDA受体通道。众多的学者认为脑缺血时,由于兴奋性氨基酸释放增多,从而激活 该通道,使其过度兴奋,产生离子的跨膜流动,其中以Ca2+为主,使细胞内钙浓度增 高[1,2]。本实验用细胞贴附膜片钳单通道记录技术研究大鼠大脑皮层神经元NMDA 受体通道在体外模拟缺血状态下的变化特征。
材料与方法
实验选用生后2~4周的Wistar大鼠,雌雄不拘,断头取脑,分离顶叶及其周围皮层,用手 工切成厚约400~500 μm的冠状脑片,在通混合气(95% O2+5% CO2)的人工脑脊液内孵 育,人工脑脊液成分为(mmol.L-1):NaCl 126; KCl 5;NaH2PO4 1.25;NaHCO3 26;CaCl2 2;MgSO4 2; HEPES 10;葡萄糖10,pH 7.2(NaOH调制)。0.5~ 1 h后,取 2片置入含0.1%胰 蛋白酶的2 mL人工脑脊液内消化0.5 h,消化过程中仍通混合气。将脑片稍加剪碎,移入2 mL 人工脑脊液内,用尖端火抛光的Pasteur吸管(直径500,300,150 μm)顺续吹打,使组织块 分散,细胞游离。将此液静置7~10 min,吸取上清液,滴加于事先涂有多聚赖氨酸的盖玻片上,静置10 min使细胞贴壁,加入浴液即可开始膜片钳记录。分离过程在室温(20~25℃) 下进行。
, 百拇医药
采用膜片钳细胞贴附式结构记录通道电流[3]。实验用细胞浴液成分(mmol.L -1):NaCl 140, CsCl 5, CaCl2 1.8, HEPES 10, TTX 0.001, 葡萄糖1 0,pH7.2;电极液成分(mmol.L-1);NMDA 20 μmol.L-1;L-甘氨酸1μmol.L-1,不含葡萄糖,其余同细胞浴液。“缺血”组细胞浴液成分除不含葡萄糖外 ,其余同正常浴液,在施加于细胞前通混合氮气(95%N2+5%CO2)饱和1 h以上,氧分压 为9.16 kPa(IL-1620型血气分析仪,美国)。
用微电极拉制器(PP-83,Narishige,Japan)两步拉制微电极,电极尖端直径1~1.5 μm,经 热抛光,充灌电极液后电极电阻4~6 MΩ。封接电阻一般10~30 GΩ。单通道电流经膜片钳 放大器(CEZ-2200,日本光电)放大,1 kHz滤波,用DigiData 1200接口和pClamp软件(6.02 版,Axon Instruments,Inc, USA)将信号采入微机。用Fetchex程序不间断采样,采样频率2 0 kHz,细胞钳制电位-80 mV。实验在室温(20~25℃)下进行。
, http://www.100md.com
用pClamp软件的Fetchan程序对实验记录曲线进行理想化处理,列出通道开放的事件表,忽 略水平0.01 ms,滤波设置3 kHz.用pStat程序对通道的开放和关闭时间进行指数拟合,通道 开 放的电流幅度用点电流序列密度直方图法求出,计算出通道不同电导水平的开放概率。实验 数据用
 ±s表示,用t检验进行显著性测验。
±s表示,用t检验进行显著性测验。实验所用胰蛋白酶,多聚赖氨酸,HEPES,MK-801,NMDA和L-甘氨酸为Sigma公司产品,其余 为国产分析纯。
结 果
在电极液内加入20 μmol.L-1的NMDA和1 μmol*L-1的L-甘氨酸以激动NMDA 受体,可记录到NMDA受体通道的单通道电流,其开放一般有两个电导水平,其电导值分别为 35 pS和100 pS,开放时电流幅度分别为(2.79±0.14) pA和(7.79±0.05) pA.开放概率 分别为(0.079±0.006) pS和(0.067±0.004)。 35 pS NMDA通道的开放时间需用双指数 拟合,其开放时间常数τ1和τ2分别为(0.56±0.10) ms和(4.17±0.38) ms, 10 0 pS NMDA通道的开放时间也需用双指数拟合,其开放时间常数τ1和τ2分别为(0.50 ±0.38) ms和(7.80±1.74) ms.通道的关闭时间常数τ为(75.50±14.10) ms (n= 10)。
, 百拇医药
在“缺血”状态下,NMDA受体通道被显著激活,部分细胞膜片的通道开放为单个水平的开放 增加(图1C),部分细胞膜片的通道开放为多电导的开放(图1D),其电导水平以35 pS和100 p S为主。35 pS通道的开放时间常数τ1和τ2分别为(0.69±0.15) ms和(8.54±2. 46)ms.与对照组相比,τ2显著增加(P<0.01),通道的开放概率显著增加,达到0 .308±0.155(P<0.01);100 pS通道的开放时间常数τ1和τ2分别为(0.58 ±0.12) ms和(7.91±2.53)ms,与对照组相比,τ1和τ2均无显著差异,但通道的 开放概率明显增加,达到0.488±0.126(P<0.01,n=7)。对于有多电导开放的 细胞,其总 的开放概率可达0.896±0.034,通道的关闭时间常数τ为(11.80±4.30) ms,显著缩短 于对照组(P<0.01,n=9)。NMDA受体通道拮抗剂MK-801可显著抑制“缺血”诱导 的 通道开放(图1E)。




, 百拇医药
Fig 1 Effects of “ischemia” on NMDA-receptor-channels in rat cereb ral cortical neurons recorded in the cell-attached configuration. Holding potent ial was set at-80 mV. Inward currents are indicated as downward deflections. A. 100 pS channels; B. 35 pS channels; C. 35 pS channels in “ischemia" condition. D. 35 pS and 100 pS channels in “ischemia" condition; E. MK-801 0.05 mg.mL-1 on NMD A-receptor channels in "ischemia" condition
, 百拇医药
图1 “缺血”对大鼠大脑皮层神经元NMDA受体通道的影响
讨 论
NMDA受体通道是存在于中枢神经系统内的一类受体门控通道,该通道对Ca2+ 有较大 的选择性,而对Na+和K+非选择性通透,对Cl不通透,因此通道被激活后主要产生C a2+内流[4~8]。本实验在玻璃微电极内加入20μmol.L-1的 NMDA和1μmol.L-1的L-甘氨酸以激动NMDA受体,记录到正常的通道电活动,其开 放、关闭的动力学特征与文献报道基本一致,证明实验所记录到的通道是典型的NMDA受体通 道。该通道在开放时有多电导水平,本文仅分析35 pS和100 pS通道电流在“缺血”时的变 化特征。
, 百拇医药
多数实验室均证明脑缺血时,脑细胞内Ca2+浓度急剧增高,这是脑缺血损伤的 启动 因素之一。本实验用膜片钳技术直接观察到,在“缺血”状态下,大鼠大脑皮层神经元NMDA 受体通道被激活,35 pS电导水平通道开放时间常数较大的τ2显著延长,通道35 pS和1 00 pS电导水平的开放概率显著增加,关闭时间缩短,由于该通道对Ca2+有选择性 通透,因此,NMDA受体通道的激活可显著增加Ca2+内流,对缺血时细胞内钙超载起 重要 作用。有些学者认为,脑缺血时,胞内Ca2+的增多主要是通过NMDA受体通道,而膜 电压依赖性钙通道不起作用[2],但我们用膜片钳技术直接观察到了在脑“缺血” 时L-和N-型电压依赖性钙通道的开放增加[9]。从本实验结果来看,大鼠皮层NMDA 受体通道在脑“缺血”时的开放程度比电压依赖性钙通道更显著,由此导致的Ca2+ 内流可能处于主导地位,电压依赖性钙通道的开放进一步加重了胞内钙的聚集,另外,在缺 血时,胞内钙释放也参与了钙的聚集[10]。
, http://www.100md.com
* 第三军医大学科研基金资助
参考文献
1 Salinska E, Pluta R, Puka M, et al. Blockade of N-methyl-D- aspartate-sensitive excitatory amino acid receptors with 2-amino-5-phosphovalera te reduces ischemia-evoked calcium redistribution in rabbit hippocampus. Exp Neu rol, 1991, 112:89.
2 Xie YX, Zacharias E, Hoff P, et al. Ion channel involvement in anoxic depolarization induced by cardiac arrest in rat brain. J Cereb Blood Fluid Metab , 1995, 15:587.
, http://www.100md.com
3 Hamill OP, Marty A, Neher E, et al. Improved patch-clamp techniques fo r high-resolution current recording from cells and cell-free membrane patches. P flugers Arch, 1981, 391:85.
4 Gibb AJ, Colquhoun D. Glutamate activation of a single NMDA receptor-c hannel produces a cluster of channel openings. Proc R Soc Lond [Biol], 1991, 243:39.
5 Gibb AJ, Colquhoun D. Activation of N-methyl-D-aspartate receptors by L-glutamate in cells dissociated from adult rat hippocampus. J Physiol, 1992, 45 6:143.
, 百拇医药
6 Mayer ML, Miller RJ. Excitatory amino acid receptors, second messenger s and regulation of intracellular Ca2+ in mammalian neurons. Trands Phar macol Sci, 1990, 11:254.
7 高天明,邹飞,陈培熹.大脑皮层神经元NMDA受体的单通道特性.生理学报, 1995,47:133.
8 Kohr G, Koninck YD, Mody I. Properties of NMDA receptor channels in ne urons acutely isolated from epileptic (Kindled) rats. J Neurosci, 1993,13:3612.
9 王中峰,薛春生.“缺血”对大鼠大脑皮层神经元钙通道的影响.中国应用生理 学杂志,1998,14:150.
10 Wood ER, Bussey TJ, Philips AG. A glucine antagonist reduces ischemia -induced CAl cell loss in vivo. Neurosci Lett, 1992, 145:10.
(1998年3月30日收稿,19998年9月4日修回), http://www.100md.com