甲基硝基亚硝基胍诱发的遗传不稳定细胞DNA聚合酶β mRNA表达水平研究*
作者:冯朝晖 余应年 陈星若
单位:浙江医科大学病理生理教研室及分子生物学实验室(杭州 310031)
关键词:诱变;DNA聚合酶类;基因表达;聚合酶链反应
中国病理生理杂志990808 摘 要 目的和方法:本实验室曾报道,低浓度0.2 μmol/L烷化剂甲基硝基亚硝基胍(N-methyl-N′-nitro-N-nitrosoguanidine, MNNG)可以诱导哺乳类细胞遗传不稳定状态。为明确其发生机制,本文利用定量RT-PCR方法,研究了该低浓度MNNG对人HeLa及猴肾vero细胞DNA聚合酶β(pol β) mRNA表达水平的影响。结果:经0.2 μmol/L MNNG 2.5 h处理后,HeLa细胞pol β mRNA水平在6~24 h内升高约1倍;而vero细胞pol β mRNA水平在12~30 h内亦升高1倍左右。结论:提示pol β mRNA水平改变可能参与MNNG诱发细胞遗传不稳定的发生。
, http://www.100md.com
mRNA expression of DNA polymerase β in MNNG induced genetically unstable cells
FENG Zhao-Hui, YU Ying-Nian, CHEN Xing-Ruo
Department of Pathophysiology and Laboratory of Molecular Biology, Zhejiang Medical University, Hangzhou (310031)
Abstract AIM and METHODS: It was reported from our laboratory that low concentration N-methyl-N'-nitro-N-nitrosoguanidine (MNNG) could induce genetic instability in mammalian cells. To elucidate its mechanism, quantitative RT-PCR was used to study mRNA expression of DNA polymerase β in MNNG induced genetically unstable cells. RESULTS:It was demonstrated that mRNA level of polymerase β increased by nearly one-fold in HeLa cells from the 6th to 24th hour after being treated with 0.2 μmol/L MNNG for 2.5 h;and the same was demonstrated in vero cells from 12 th to 30 th hour after 0.2 μmol/L MNNG treatment. CONCLUSION:The alteration of polymerase β expression might be involved in the genesis of MNNG induced genetic instability in mammalian cells.
, 百拇医药
MeSH Mutagenesis; DNA polymerase; Gene expression; polymerase chain reaction
化学物质或离子辐射可以诱发哺乳类细胞遗传不稳定状态(genetic instability),但其发生机制尚不明确[1]。本室证实低浓度0.2 μmol/L烷化剂甲基硝基亚硝基胍(N-methyl-N′-nitro-N-nitrosoguanidine, MNNG)处理细胞2.5 h,可诱发细胞遗传不稳定状态产生[2];同时有DNA复制保真度明显下降[3],及许多基因表达水平的改变[4];转录抑制剂可阻断该状态产生[5]。提示其产生与有关基因表达水平改变有关。
许多研究提示DNA聚合酶β(pol β)可能与MNNG诱发细胞遗传不稳定有关。pol β具有较低的DNA复制保真度,及较强的跨损伤误性DNA修复等特性。MMS、 AAF、 H2O2、 TPA及大剂量MNNG(≥20 μmol/L)可诱导细胞pol β mRNA水平的改变;甲基亚硝基脲(N-methyl-N-nitrosourea, MNU)诱导的小鼠胸腺淋巴瘤细胞中发现有DNA复制保真度下降及pol β mRNA水平升高[8];对烷化剂耐受的肿瘤细胞中也发现pol β表达水平改变[9]。为明确MNNG诱发的遗传不稳定细胞中是否有pol β表达水平的改变,我们对0.2 μmol/L MNNG处理后的人宫颈癌HeLa细胞,及猴肾vero细胞中pol β mRNA水平进行了研究。
, http://www.100md.com
材料与方法
一、细胞培养及处理:
单层生长的HeLa,vero细胞培养于含10%小牛血清的DMEM培养基(Gibco)中。用0.2 μmol/L MNNG(Sigma, 0.1% 二甲基亚砜DMSO作溶剂)处理细胞2.5 h后,经彻底漂洗,加入新鲜培养基,分别培养一定时间,对照组细胞用0.1% DMSO处理2.5 h。
二、PCR引物合成:
根据Genbank公布的人类基因序列,合成人pol β及β2-微球蛋白基因(β2m) 等二对PCR引物(上海细胞所)。其中pol β引物分别为:5’-CTT TGA GAA GAA CGT GAG CC-3’(正义),5’-CTC GTA TCA TCC TGC CGA AT-3’(反义),PCR产物长210 bp; β2m引物分别为:5’-C ACC CCC ACT GAA AAA GAT GA-3’(正义),5’-C ATC TTC AAA CCT CCA TGA TG-3’(反义),PCR产物长120 bp。
, 百拇医药
三、定量RT-PCR分析基因mRNA表达水平:
用TRIZol试剂(Gibco)按厂家说明书上方法提取HeLa细胞总RNA。取2 μg细胞总RNA, 0.5 μg d(N)6随机引物,200 μmol/L-MLV逆转录酶(Promega),25 μL总体积,37℃反应1.5 h逆转录反应合成cDNA第一链。
取对照组细胞逆转录产物2.5 μL, 20 pmol pol β及内参照β 2m基因PCR引物,总体积50 μL,对两基因同时进行PCR扩增。扩增条件:94℃ 1 min, 57℃ 35 s, 72℃ 1 min。从20个循环数起,每增加3个循环数进行一次PCR扩增,直至40个循环数为止。产物经3%琼脂糖凝胶电泳后,溴乙锭染色,紫外灯下拍照,对产物电泳条带进行光密度扫描,计算pol β和β2m条带光密度比值(OD polβ/OD β2m),以确定PCR定量扩增靶基因的合适循环数。
, http://www.100md.com
分别取各处理组细胞逆转录产物2.5 μL,严格按上述条件和选定的合适PCR循环数,对pol β和β2m基因同时进行扩增。PCR产物按上述方法进行定量分析,pol β基因表达水平以pol β和β2m PCR产物电泳条带光密度比值(OD pol β/OD β2m)来表示。各样本至少重复3次RT-PCR过程。
按上述方法,利用人β2m, polβ基因PCR引物对MNNG处理后的vero细胞中polβ基因mRNA水平进行定量分析。
结 果
以β 2m基因为内参照,扩增对照组HeLa细胞中polβ基因。对经溴乙锭染色的产物电泳条带进行光密度扫描,发现从23至32个循环间,polβ和β2m基因PCR产物条带光密度比值(OD polβ/ODβ2m)恒定。表明在此循环数范围内,polβ和β2m基因均呈指数扩增,适合作定量分析。故此选定27个循环数作为定量RT-PCR扩增的循环数(图1)。
, http://www.100md.com
Fig 1 RT-PCR products of DNA polymerase β and β2-microglobin in HeLa cells after amplification with different PCR cycle numbers. Lane 1: pGEM-7zf(+)Hae Ⅲ marker. OD polβ/OD β2m: Lane 2:0.584; Lane 3:0.713; Lane 4:0.552; Lane 5:0.654; Lane 6:1.116;
图1 经不同PCR循环数扩增后的HeLa细胞中DNA聚合酶β和β2-微球蛋白基因RT-PCR产物
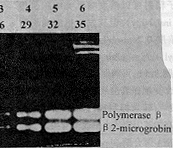
HeLa细胞经0.2 μmol/L MNNG处理2.5 h后,分别于0, 6, 12, 24, 36 h,提取总RNA, 以β2m基因为内参照,对pol β进行定量RT-PCR扩增。扩增条件同前,循环数为27个。产物电泳条带经光密度扫描,分别计算OD polβ/OD β2m比值,每样本至少经3次定量RT-PCR分析。结果发现,polβ在MNNG处理细胞后6~24 h间升高约1倍左右(图2,表1)。
, 百拇医药
Fig 2 RT-PCR products of DNA polymerase β gene in HeLa cells treated with 0.2 μmol/L MNNG for 2.5 h. Lane 1: pGEM-7zf(+) Hae Ⅲ marker. Lane 2: control; Lane 3~7:0.2 μmol/L MNNG
图2 经0.2 μmol/L MNNG 2.5 h处理后,HeLa细胞中DNA聚合酶β基因RT-PCR产物
表1 经0.2 μmol/L MNNG 2.5 h处理后的HeLa\, vero细胞中DNA聚合酶β基因mRNA表达水平
Tab 1 mRNA expression of DNA polymerase β in HeLa, vero cells after treatment
, 百拇医药
of 0.2 μmol/L MNNG for 2.5 h (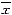 ±s, n=3)
±s, n=3)
OD polβ/OD β2m
Control
Time after MNNG treatment(h)
0
3
6
12
24
30
, 百拇医药 36
HeLa
0.628±0.124
0.597±0.136
—+
1.152±0.165*
1.213±0.173*
1.084±0.126*
—
0.587±0.078
Vero
, 百拇医药
0.485±0.086
0.463±0.062
0.312±0.074
0.476±0.105
0.975±0.092*
1.013±0.081*
0.964±0.116*
0.510±0.075
Quantitative RT-PCR was used to amplify pol β and β2m gene in cells. PCR products were electrophoresed and the bands were measured with optical density scanning. The expression levels of pol β were expressed as the ratio of the bands of pol β to that of β2m (OD pol β/ODβ2m)
, 百拇医药
*P<0.05, vs control group
利用人β2m\, polβ基因PCR引物,对vero细胞中相应基因进行扩增,发现其RT-PCR产物大小与 HeLa细胞中的大小完全一致。由于上述两基因所选定的PCR引物及扩增区域cDNA序列非常保守,在果蝇、小鼠、人不同真核生物中均有很高的同源性,故此认为所得产物即为β2m,polβ基因。发现从23至32个循环间,两基因均呈指数扩增,其PCR产物带光密度比值恒定。在此基础上,同样用27个循环进行PCR扩增,对MNNG诱发的遗传不稳定vero细胞pol βmRNA表达情况进行分析,同样发现在0.2 μmol/L MNNG处理后12~30 h内pol β mRNA水平升高约1倍(图3,表1)。

Fig 3 RT-PCR products of DNA polymerase β gene in vero cells treated with 0.2 μmol/L MNNG for 2.5 h. Lane 1~7: 0.2 μmol/L MNNG; Lane 8: control; Lane 9: pGEM-7zf(+) Hae Ⅲ marker
, 百拇医药
图3 经0.2 μmol/L MNNG 2.5 h处理后,vero细胞中DNA聚合酶β和RT-PCR产物
讨 论
目前为止,在哺乳类细胞中已发现有五类核DNA聚合酶(pol α,β,δ,ε,ζ),分别参与DNA复制、修复以及DNA损伤后诱发突变形成等过程,与DNA复制保真度直接相关。其表达水平可以被某些烷化剂、射线所诱导,在某些肿瘤细胞中也发现有所改变[6,7]。我们曾通过定量RT-PCR方法对0.2 μmol/L MNNG处理后的HeLa细胞中DNA pol α,δ及ε mRNA水平进行了动态观察,均未见明显改变。
目前对polβ研究尚未透彻,由于缺少3’→5'核酸外切酶校读活性,polβ在体外DNA聚合反应中有很高的单碱基错误掺入率(1/1000-1/6600),为复制保真度最低的DNA聚合酶。它可以通过碱基切除修复途径参与烷化剂、射线造成的DNA损伤修复。同时,pol β具有很强的跨损伤易误性DNA修复功能,在体外能够跨过AP位点或d(GpG)-顺铂加合物等DNA损伤,造成碱基缺失或替换突变[6,7]。最近发现,polβ能跨06-mG损伤(MNNG造成的主要DNA损伤类型),在新链相应位置上插入一d(A),认为是烷化剂损伤后造成细胞G→A突变的重要原因[10]。考虑到polβ的特性,尤其是复制的低保真度,本实验中MNNG处理后细胞中polβ表达水平的上升,是否与MNNG诱发细胞DNA复制保真度下降及遗传不稳定发生有关,我们拟通过反义RNA技术阻断细胞中polβ基因的表达,观察细胞非定标性突变率是否有明显改变,进一步研究在进行之中。
, http://www.100md.com
* 国家自然科学基金(No.39870684)、浙江省自然科学基金(No.397454)资助
参考文献
1 Murnane JP. Role of induced genetic instability in the mutagenic effects of chemicals and radiation. Mutat Res, 1996, 367:11.
2 Zhang X, Yu Y, Chen X. Evidece for nontargeted mutagenesis in a monkey kidney cell line and analysis of its sequence spectificity using a shuttle-vector plasmid. Mutat Res, 1994, 323:105.
, 百拇医药
3 冯朝晖,余应年,张小山,等.MNNG诱发的遗传不稳定vero细胞中DNA体外复制保真度的研究.中国药理学与毒理学杂志,1998,12(2):144.
4 胡文蔚,余应年,张小山,等.N-甲基-N’-硝基-N-亚硝基胍引起Vero细胞基因表达改变及有关cDNA片段的初步鉴定.中国药理学与毒理学杂志,1998,12:62.
5 孙雪敏,余应年,张小山,等.转录和翻译抑制对哺乳类细胞非定标性突变形成的影响.癌变.畸变.突变,1996,8:286.
6 Budd ME, Campbell JL. The roles of the eukaryotic DNA polymerases in DNA repair synthesis. Mutat Res, 1997, 384:157.
, http://www.100md.com
7 Wang TSF. Eukaryotic DNA polymerase. Ann Rev Biochem, 1991, 60:513.
8 Kubota Y, Kimiko MM, Shimada Y, et al. Reduced fidelity of DNA synthesis in cell extracts from chemically induced primary thymic lymphomas of mice. Cancer Res, 1995, 55:3777.
9 Friedman HS, Dolan ME, Kaufmann SH, et al. Elevated DNA polymerase α, DNA polymerase β, and topoisomerase Ⅱ in a melphalan-resistant rhabdomyosarcoma xenograft that is cross-resistant to nitrosoureas and topotecan. Cancer Res, 1994, 54:3487.
10 Singh J, Su L, Snow ET. Replication across O6-methylguanine by human DNA polymerase β in vitro. J Biol Chem, 1996, 271:28391.
(1998年4月15日收稿,1998年8月28日修回), http://www.100md.com
单位:浙江医科大学病理生理教研室及分子生物学实验室(杭州 310031)
关键词:诱变;DNA聚合酶类;基因表达;聚合酶链反应
中国病理生理杂志990808 摘 要 目的和方法:本实验室曾报道,低浓度0.2 μmol/L烷化剂甲基硝基亚硝基胍(N-methyl-N′-nitro-N-nitrosoguanidine, MNNG)可以诱导哺乳类细胞遗传不稳定状态。为明确其发生机制,本文利用定量RT-PCR方法,研究了该低浓度MNNG对人HeLa及猴肾vero细胞DNA聚合酶β(pol β) mRNA表达水平的影响。结果:经0.2 μmol/L MNNG 2.5 h处理后,HeLa细胞pol β mRNA水平在6~24 h内升高约1倍;而vero细胞pol β mRNA水平在12~30 h内亦升高1倍左右。结论:提示pol β mRNA水平改变可能参与MNNG诱发细胞遗传不稳定的发生。
, http://www.100md.com
mRNA expression of DNA polymerase β in MNNG induced genetically unstable cells
FENG Zhao-Hui, YU Ying-Nian, CHEN Xing-Ruo
Department of Pathophysiology and Laboratory of Molecular Biology, Zhejiang Medical University, Hangzhou (310031)
Abstract AIM and METHODS: It was reported from our laboratory that low concentration N-methyl-N'-nitro-N-nitrosoguanidine (MNNG) could induce genetic instability in mammalian cells. To elucidate its mechanism, quantitative RT-PCR was used to study mRNA expression of DNA polymerase β in MNNG induced genetically unstable cells. RESULTS:It was demonstrated that mRNA level of polymerase β increased by nearly one-fold in HeLa cells from the 6th to 24th hour after being treated with 0.2 μmol/L MNNG for 2.5 h;and the same was demonstrated in vero cells from 12 th to 30 th hour after 0.2 μmol/L MNNG treatment. CONCLUSION:The alteration of polymerase β expression might be involved in the genesis of MNNG induced genetic instability in mammalian cells.
, 百拇医药
MeSH Mutagenesis; DNA polymerase; Gene expression; polymerase chain reaction
化学物质或离子辐射可以诱发哺乳类细胞遗传不稳定状态(genetic instability),但其发生机制尚不明确[1]。本室证实低浓度0.2 μmol/L烷化剂甲基硝基亚硝基胍(N-methyl-N′-nitro-N-nitrosoguanidine, MNNG)处理细胞2.5 h,可诱发细胞遗传不稳定状态产生[2];同时有DNA复制保真度明显下降[3],及许多基因表达水平的改变[4];转录抑制剂可阻断该状态产生[5]。提示其产生与有关基因表达水平改变有关。
许多研究提示DNA聚合酶β(pol β)可能与MNNG诱发细胞遗传不稳定有关。pol β具有较低的DNA复制保真度,及较强的跨损伤误性DNA修复等特性。MMS、 AAF、 H2O2、 TPA及大剂量MNNG(≥20 μmol/L)可诱导细胞pol β mRNA水平的改变;甲基亚硝基脲(N-methyl-N-nitrosourea, MNU)诱导的小鼠胸腺淋巴瘤细胞中发现有DNA复制保真度下降及pol β mRNA水平升高[8];对烷化剂耐受的肿瘤细胞中也发现pol β表达水平改变[9]。为明确MNNG诱发的遗传不稳定细胞中是否有pol β表达水平的改变,我们对0.2 μmol/L MNNG处理后的人宫颈癌HeLa细胞,及猴肾vero细胞中pol β mRNA水平进行了研究。
, http://www.100md.com
材料与方法
一、细胞培养及处理:
单层生长的HeLa,vero细胞培养于含10%小牛血清的DMEM培养基(Gibco)中。用0.2 μmol/L MNNG(Sigma, 0.1% 二甲基亚砜DMSO作溶剂)处理细胞2.5 h后,经彻底漂洗,加入新鲜培养基,分别培养一定时间,对照组细胞用0.1% DMSO处理2.5 h。
二、PCR引物合成:
根据Genbank公布的人类基因序列,合成人pol β及β2-微球蛋白基因(β2m) 等二对PCR引物(上海细胞所)。其中pol β引物分别为:5’-CTT TGA GAA GAA CGT GAG CC-3’(正义),5’-CTC GTA TCA TCC TGC CGA AT-3’(反义),PCR产物长210 bp; β2m引物分别为:5’-C ACC CCC ACT GAA AAA GAT GA-3’(正义),5’-C ATC TTC AAA CCT CCA TGA TG-3’(反义),PCR产物长120 bp。
, 百拇医药
三、定量RT-PCR分析基因mRNA表达水平:
用TRIZol试剂(Gibco)按厂家说明书上方法提取HeLa细胞总RNA。取2 μg细胞总RNA, 0.5 μg d(N)6随机引物,200 μmol/L-MLV逆转录酶(Promega),25 μL总体积,37℃反应1.5 h逆转录反应合成cDNA第一链。
取对照组细胞逆转录产物2.5 μL, 20 pmol pol β及内参照β 2m基因PCR引物,总体积50 μL,对两基因同时进行PCR扩增。扩增条件:94℃ 1 min, 57℃ 35 s, 72℃ 1 min。从20个循环数起,每增加3个循环数进行一次PCR扩增,直至40个循环数为止。产物经3%琼脂糖凝胶电泳后,溴乙锭染色,紫外灯下拍照,对产物电泳条带进行光密度扫描,计算pol β和β2m条带光密度比值(OD polβ/OD β2m),以确定PCR定量扩增靶基因的合适循环数。
, http://www.100md.com
分别取各处理组细胞逆转录产物2.5 μL,严格按上述条件和选定的合适PCR循环数,对pol β和β2m基因同时进行扩增。PCR产物按上述方法进行定量分析,pol β基因表达水平以pol β和β2m PCR产物电泳条带光密度比值(OD pol β/OD β2m)来表示。各样本至少重复3次RT-PCR过程。
按上述方法,利用人β2m, polβ基因PCR引物对MNNG处理后的vero细胞中polβ基因mRNA水平进行定量分析。
结 果
以β 2m基因为内参照,扩增对照组HeLa细胞中polβ基因。对经溴乙锭染色的产物电泳条带进行光密度扫描,发现从23至32个循环间,polβ和β2m基因PCR产物条带光密度比值(OD polβ/ODβ2m)恒定。表明在此循环数范围内,polβ和β2m基因均呈指数扩增,适合作定量分析。故此选定27个循环数作为定量RT-PCR扩增的循环数(图1)。


, http://www.100md.com
Fig 1 RT-PCR products of DNA polymerase β and β2-microglobin in HeLa cells after amplification with different PCR cycle numbers. Lane 1: pGEM-7zf(+)Hae Ⅲ marker. OD polβ/OD β2m: Lane 2:0.584; Lane 3:0.713; Lane 4:0.552; Lane 5:0.654; Lane 6:1.116;
图1 经不同PCR循环数扩增后的HeLa细胞中DNA聚合酶β和β2-微球蛋白基因RT-PCR产物
HeLa细胞经0.2 μmol/L MNNG处理2.5 h后,分别于0, 6, 12, 24, 36 h,提取总RNA, 以β2m基因为内参照,对pol β进行定量RT-PCR扩增。扩增条件同前,循环数为27个。产物电泳条带经光密度扫描,分别计算OD polβ/OD β2m比值,每样本至少经3次定量RT-PCR分析。结果发现,polβ在MNNG处理细胞后6~24 h间升高约1倍左右(图2,表1)。


, 百拇医药
Fig 2 RT-PCR products of DNA polymerase β gene in HeLa cells treated with 0.2 μmol/L MNNG for 2.5 h. Lane 1: pGEM-7zf(+) Hae Ⅲ marker. Lane 2: control; Lane 3~7:0.2 μmol/L MNNG
图2 经0.2 μmol/L MNNG 2.5 h处理后,HeLa细胞中DNA聚合酶β基因RT-PCR产物
表1 经0.2 μmol/L MNNG 2.5 h处理后的HeLa\, vero细胞中DNA聚合酶β基因mRNA表达水平
Tab 1 mRNA expression of DNA polymerase β in HeLa, vero cells after treatment
, 百拇医药
of 0.2 μmol/L MNNG for 2.5 h (
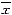 ±s, n=3)
±s, n=3)OD polβ/OD β2m
Control
Time after MNNG treatment(h)
0
3
6
12
24
30
, 百拇医药 36
HeLa
0.628±0.124
0.597±0.136
—+
1.152±0.165*
1.213±0.173*
1.084±0.126*
—
0.587±0.078
Vero
, 百拇医药
0.485±0.086
0.463±0.062
0.312±0.074
0.476±0.105
0.975±0.092*
1.013±0.081*
0.964±0.116*
0.510±0.075
Quantitative RT-PCR was used to amplify pol β and β2m gene in cells. PCR products were electrophoresed and the bands were measured with optical density scanning. The expression levels of pol β were expressed as the ratio of the bands of pol β to that of β2m (OD pol β/ODβ2m)
, 百拇医药
*P<0.05, vs control group
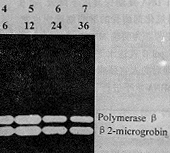
利用人β2m\, polβ基因PCR引物,对vero细胞中相应基因进行扩增,发现其RT-PCR产物大小与 HeLa细胞中的大小完全一致。由于上述两基因所选定的PCR引物及扩增区域cDNA序列非常保守,在果蝇、小鼠、人不同真核生物中均有很高的同源性,故此认为所得产物即为β2m,polβ基因。发现从23至32个循环间,两基因均呈指数扩增,其PCR产物带光密度比值恒定。在此基础上,同样用27个循环进行PCR扩增,对MNNG诱发的遗传不稳定vero细胞pol βmRNA表达情况进行分析,同样发现在0.2 μmol/L MNNG处理后12~30 h内pol β mRNA水平升高约1倍(图3,表1)。


Fig 3 RT-PCR products of DNA polymerase β gene in vero cells treated with 0.2 μmol/L MNNG for 2.5 h. Lane 1~7: 0.2 μmol/L MNNG; Lane 8: control; Lane 9: pGEM-7zf(+) Hae Ⅲ marker
, 百拇医药
图3 经0.2 μmol/L MNNG 2.5 h处理后,vero细胞中DNA聚合酶β和RT-PCR产物
讨 论
目前为止,在哺乳类细胞中已发现有五类核DNA聚合酶(pol α,β,δ,ε,ζ),分别参与DNA复制、修复以及DNA损伤后诱发突变形成等过程,与DNA复制保真度直接相关。其表达水平可以被某些烷化剂、射线所诱导,在某些肿瘤细胞中也发现有所改变[6,7]。我们曾通过定量RT-PCR方法对0.2 μmol/L MNNG处理后的HeLa细胞中DNA pol α,δ及ε mRNA水平进行了动态观察,均未见明显改变。
目前对polβ研究尚未透彻,由于缺少3’→5'核酸外切酶校读活性,polβ在体外DNA聚合反应中有很高的单碱基错误掺入率(1/1000-1/6600),为复制保真度最低的DNA聚合酶。它可以通过碱基切除修复途径参与烷化剂、射线造成的DNA损伤修复。同时,pol β具有很强的跨损伤易误性DNA修复功能,在体外能够跨过AP位点或d(GpG)-顺铂加合物等DNA损伤,造成碱基缺失或替换突变[6,7]。最近发现,polβ能跨06-mG损伤(MNNG造成的主要DNA损伤类型),在新链相应位置上插入一d(A),认为是烷化剂损伤后造成细胞G→A突变的重要原因[10]。考虑到polβ的特性,尤其是复制的低保真度,本实验中MNNG处理后细胞中polβ表达水平的上升,是否与MNNG诱发细胞DNA复制保真度下降及遗传不稳定发生有关,我们拟通过反义RNA技术阻断细胞中polβ基因的表达,观察细胞非定标性突变率是否有明显改变,进一步研究在进行之中。
, http://www.100md.com
* 国家自然科学基金(No.39870684)、浙江省自然科学基金(No.397454)资助
参考文献
1 Murnane JP. Role of induced genetic instability in the mutagenic effects of chemicals and radiation. Mutat Res, 1996, 367:11.
2 Zhang X, Yu Y, Chen X. Evidece for nontargeted mutagenesis in a monkey kidney cell line and analysis of its sequence spectificity using a shuttle-vector plasmid. Mutat Res, 1994, 323:105.
, 百拇医药
3 冯朝晖,余应年,张小山,等.MNNG诱发的遗传不稳定vero细胞中DNA体外复制保真度的研究.中国药理学与毒理学杂志,1998,12(2):144.
4 胡文蔚,余应年,张小山,等.N-甲基-N’-硝基-N-亚硝基胍引起Vero细胞基因表达改变及有关cDNA片段的初步鉴定.中国药理学与毒理学杂志,1998,12:62.
5 孙雪敏,余应年,张小山,等.转录和翻译抑制对哺乳类细胞非定标性突变形成的影响.癌变.畸变.突变,1996,8:286.
6 Budd ME, Campbell JL. The roles of the eukaryotic DNA polymerases in DNA repair synthesis. Mutat Res, 1997, 384:157.
, http://www.100md.com
7 Wang TSF. Eukaryotic DNA polymerase. Ann Rev Biochem, 1991, 60:513.
8 Kubota Y, Kimiko MM, Shimada Y, et al. Reduced fidelity of DNA synthesis in cell extracts from chemically induced primary thymic lymphomas of mice. Cancer Res, 1995, 55:3777.
9 Friedman HS, Dolan ME, Kaufmann SH, et al. Elevated DNA polymerase α, DNA polymerase β, and topoisomerase Ⅱ in a melphalan-resistant rhabdomyosarcoma xenograft that is cross-resistant to nitrosoureas and topotecan. Cancer Res, 1994, 54:3487.
10 Singh J, Su L, Snow ET. Replication across O6-methylguanine by human DNA polymerase β in vitro. J Biol Chem, 1996, 271:28391.
(1998年4月15日收稿,1998年8月28日修回), http://www.100md.com