内毒素、IL-1β对家兔下丘脑神经细胞内游离钙浓度的影响
作者:李菁 张穗梅 王达安 屈洋 颜亮 李楚杰
单位:(暨南大学医学院 发热研究室,广东 广州 510632)
关键词:内毒素类;白细胞介素-1;钙;下丘脑;体温调节
中国病理生理杂志000713
[摘 要] 目的:研究内毒素(ET)性发热家兔下丘脑神经细胞内游离钙([Ca2+]i)浓度变化及ET、白介素-1β(IL-1β)对正常家兔离体下丘脑神经细胞[Ca2+]i浓度的影响。方法:采用荧光分光光度法,应用钙离子探针(Fura-2/AM),检测[Ca2+]i浓度。结果:(1)微量ET(2 ng/mL)使正常家兔下丘脑神经细胞内[Ca2+]i浓度显著升高;ET性发热家兔下丘脑神经细胞[Ca2+]i水平也显著高于对照组;(2) 3种剂量IL-1β(100、500、1 000 ng/mL)均未能明显影响下丘脑神经细胞[Ca2+]i 浓度。结论:(1)低Ca2+参与ET性发热体温调节的作用部位,可能不是在下丘脑神经细胞内;(2)ET引起下丘脑神经细胞[Ca2+]i 浓度变化,不是通过IL-1β直接引起。
, 百拇医药
[中图分类号] R364.6 [文献标识码] A
[文章编号] 1000-4718(2000)07-0623-04
Intracellular calcium alterations induced by endotoxin and
IL-1β in rabbit hypothalamic neurons
LI Jing, ZHANG Shui-mei, WANG Da-an, QU Yang, YAN Liang, LI Chu-jie
(Department of Pathophysiology, Institute of Fever Research,Medical College of Jinan University, Guangzhou 510632, China)
, 百拇医药
[Abstract] AIM: To investigate intracellular free calcium ([Ca2+]i ) alterations in hypothalamus of febrile rabbits induced by endotoxin (ET), and compare with the effect of ET and IL-1β on [Ca2+]i in hypothalamic neurocytes from normothermia rabbits. METHOD: The concentration of [Ca2+]i was determined by using spectrofluorometer and fluorescent Ca2+ probe fura-2 /Am. RESULTS: 1. A minute dose of ET (2 ng/mL) induced a significant rise in [Ca2+]i in hypothalamic neurocytes from normothermia rabbits. The rise in [Ca2+]i in hypothalamic neurocytes from febrile rabbits induced by intravenous injection of ET was also observed. 2. In hypothalamic neurocytes from normotheria rabbits, IL-1β failed to affect [Ca2+]i at concentrations of 100, 500, 1 000 ng/mL, respectively. CONCLUSION:The action site of low concentration of calcium that plays a regulatory role during fever seems unlikely to be in cytosolic compartment of hypothalamic neurons. The change of [Ca2+]i in hypothalamic neurocytes by ET can not be considered the direct effect of IL-1β.
, http://www.100md.com
[MeSH] Endotoxins; Interleukin-1; Calcium; Hypothalamus;Body temperature regulation
70年代Feldbera等[1]和Myers等[2,3]在猫的脑灌注实验中发现,从灌注液中除去Ca2+引起体温上升,而加入Ca2+则体温下降。因而提出下丘脑Ca2+水平是调节体温的基础。本室近年发现:侧脑室灌注CaCl2能引起内毒素(endotoxin, ET)性发热兔和正常兔体温下降[4];而灌注降钙剂EGTA则引起体温升高,后者可被补充CaCl2所制止[5]。表明在家兔的ET性发热中,Ca2+浓度下降起重要作用,无疑,无论icv给CaCl2或EGTA,首先引起Ca2+浓度变化的部位是在细胞外,但究竟是神经元细胞外Ca2+还是细胞内钙([Ca2+]i)浓度变化参与体温调节,迄今尚未阐明。Skarnes等[6]曾报道ET(iv)可引起血浆Ca2+浓度一时性下降,并指出这种变化也可发生于下丘脑。而Palmi等[7]报道ET(iv)或IL-1β(icv) 引起家兔发热时,脑脊液中Ca2+浓度升高(但来源未肯定)。ET或IL-1β能否引起下丘脑神经元[Ca2+]i浓度变化,迄今未见文献报道。本研究旨在观察微量ET或IL-1β对下丘脑神经细胞[Ca2+]i水平的影响,并检测ET性发热家兔下丘脑神经细胞[Ca2+]i水平,为进一步探讨下丘脑神经细胞[Ca2+]i或细胞外Ca2+在发热调节中的作用提供基础依据。
, 百拇医药
材 料 和 方 法
一、 材料
大肠杆菌ET(E.coli O111 B4, 卫生部上海生物制品研究所); rIL-1β(美国,Dinarello教授惠赠);Fura-2/AM(美国,Sigma);荧光分光光度计RF-5000 型(日本,Shimadzu)。
二、动物
封闭群健康新西兰家兔20只,体重2.0~3.0 kg,雌雄不拘。
三、下丘脑神经细胞分离制备
细胞分离参考张均田[8]的方法。家兔迅速断头,取下丘脑组织,置冰冷Hanks液(含钙及10%小牛血清)中除去血管和残留血液,剪碎后,加入0.125%胰蛋白酶液于37℃水浴震荡15 min。以含10%小牛血清的冰冷的DEME培养液终止消化,过200目筛,将滤液1500 r/min离心5 min,弃上清,沉淀悬浮于DEME培养液中(取少量细胞悬液,用台盼兰排斥反应检测细胞存活率>90%),调节细胞数为1×106个/mL,1 mL/管分装。
, 百拇医药
四、 Fura-2/AM的标记
将所制备的细胞悬液与Fura-2/AM(终浓度为5 mmol/L),在37℃震荡孵育50 min 后,细胞悬液以1500 r/min离心5 min,弃上清,用Hanks 液洗涤2次,最后用Hanks液悬浮细胞。
五、细胞内钙离子浓度测定
(一)不同剂量的ET(0、2、6、10、15、20 ng/mL)分别与已用Fura-2/AM标记的细胞悬液37℃孵育10 min 。用荧光分光光度计检测细胞内游离钙离子浓度,激发波长为340和380 nm。
(二)将IL-1β按三种剂量(100、500、1 000 ng/mL)分别与已用Fura-2/AM标记的细胞悬液37℃孵育10 min,用荧光分光光度计检测细胞内游离钙浓度,条件同(一)。
, http://www.100md.com
六、家兔ET性发热模型的复制及下丘脑神经细胞[Ca2+]i的测定
用10只家兔随机分为2组,每组5只。正常对照组(control group),静脉注射生理盐水(0.5 mL/kg);ET组(ET group),静脉注射ET(6 ng*mL-1*kg-1)后,记录直肠温度至60 min,断头处死动物,按实验方法三、四步骤分离下丘脑神经细胞及标记Fura-2/AM,用荧光分光光度计检测[Ca2+]i 。
七、统计处理
实验数据用均数±标准差( ±s)表示、实验组与对照组均数差异显著性应用t检验判定。
±s)表示、实验组与对照组均数差异显著性应用t检验判定。
结 果
, http://www.100md.com
一、ET对下丘脑神经细胞[Ca2+]i的影响
下丘脑神经细胞悬液与含不同剂量ET的Hanks液共孵育后,[Ca2+]i 的变化见表1。当加入2 ng/mL ET后,下丘脑神经细胞[Ca2+]i 由(73.2±14.3)nmol/L,增加为(111.7±22.0) nmol/L,与对照组比较有非常显著差异(P<0.01)。当ET剂量增加至10 ng/mL,[Ca2+]i增加大于1倍。在2~10 ng/mL ET剂量范围内,呈现量效关系,但当[Ca2+]i升高到一定程度时,如继续加大ET剂量至15、20 ng/mL,并不引起[Ca2+]i 的进一步升高。
表1 不同剂量ET对下丘脑神经细胞[Ca2+]i的影响
Tab 1 Effect of ET on [Ca2+]i in hypothalamic
, 百拇医药
neurocytes ( ±s, nmol/L) Treatment
±s, nmol/L) Treatment
n
ET(ng/mL)
[Ca2+]i
Control
8
0
73.2±14.3
ET-1
5
2
, http://www.100md.com
111.7±22.0* *
ET-2
5
6
124.7±21.5* *
ET-3
7
10
159.9±59.6* *
ET-4
5
15
, 百拇医药
123.3±20.4* *
ET-5
6
20
144.8±37.9* *
**P<0.01, vs control
二、ET不同孵育时间对下丘脑神经细胞[Ca2+]i的影响
图1显示下丘脑神经细胞悬液与含10 ng/mL ET的Hanks液共孵育后,其F340/F380荧光比率随时间的变化。结果表明:在20 min的孵育时间内,F340/F380荧光比率没有出现明显的变化,即ET对下丘脑神经细胞[Ca2+]i 的作用不受孵育时间的影响。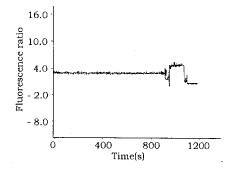
, 百拇医药
Fig 1 Effect of ET on fluorescence ratios (340 nm/380 nm) in Fura-2-filled rabbit hypothalamus neuron during different times
图1 不同孵育时间对ET引起的家兔下丘脑神经
细胞[Ca2+]i变化的影响
三、rIL-1β对下丘脑神经细胞[Ca2+]i的影响
图2显示下丘脑神经细胞悬液在加入rIL-1β前后F340/F380荧光比率的变化,由图2可见,在静息状态下,下丘脑神经细胞悬液加入100 ng rIL-1β 不能引起负载细胞的荧光比率发生变化,当再加入剂量分别为500 ng、1 000 ng rIL-1β后,荧光比率仍没有变化,表明发热剂量的rIL-1β并不能直接引起下丘脑神经细胞[Ca2+]i变化。
, 百拇医药
Fig 2 Effect of IL-1β on the fluorescence ratios (340 nm/380 nm) in Fura-2-filled rabbit hypothalamus neuron. (↓),(↓↓),(↓↓↓) shows addition of IL-1β, 100 ng, 500 ng, 1 000 ng respectively
图2 IL-1β对家兔下丘脑神经元[Ca2+]i的影响
四、ET性发热时家兔下丘脑神经细胞[Ca2+]i的变化
家兔由耳缘静脉注入ET后,直肠温度显著上升,ΔT为(1.5±0.3)℃,60 min后断头处死动物,测其下丘脑神经细胞内[Ca2+]i,结果表明ET性发热家兔下丘脑神经细胞[Ca2+]i浓度显著高于对照组(见表2)。
, 百拇医药
表2 ET性发热时家兔下丘脑神经细胞[Ca2+]i的变化
Tab 2 Effect of ET on [Ca2+]i of hypothalamic neurocytes
in febrile rabbits ( ±s, n=5, nmol/L) Group
±s, n=5, nmol/L) Group
ΔT(℃)
[Ca2+]i
Control
0.1±0.1
101.8±26.2
, 百拇医药
ET
1.5±0.3
193.3±8.5* *
** P<0.01, vs control讨 论
据以往的研究,一定量的ET均能引起红细胞、内皮细胞、肝细胞、巨噬细胞及骨髓瘤细胞[Ca2+]i 显著增加[9,10],这些研究所使用的ET剂量都较大,尚未见ET及IL-1β影响脑神经细胞[Ca2+]i的报道,本研究发现,微量的ET(2 ng/mL)即能使下丘脑神经细胞[Ca2+]i显著增加,表明与其它细胞相比,脑细胞对ET的反应相对较为敏感。
但实际上ET能否进入脑内,关键在于ET能否通过血脑屏障。对此问题存在着不同见解,一般主张ET分子量很大,不可能从外周血通过血脑屏障进入脑内,但也有学者主张大剂量ET注入外周静脉能够出现于脑脊液中[11]。目前仍不能排除大剂量ET或脑内疾病过程削弱血脑屏障时,ET进入下丘脑作用于神经元的可能性,只要有微量的ET进入下丘脑,就可能直接作用于神经元或诱生内生致热原介导发热反应,也有可能直接作用于神经元引起[Ca2+]i水平升高。本实验结果表明,在ET(iv)引起发热的同时,可检测到下丘脑神经细胞[Ca2+]i浓度的升高,后者是ET的直接作用抑或通过一定途径而引起,以及这种[Ca2+]i浓度升高是否参与发热体温调节尚待确定。大量实验已证明,icv给Ca2+能引起体温下降或解热,而降低中枢Ca2+则引起体温上升。但若在ET直接或间接引起神经细胞[Ca2+]i浓度升高之前或同时,引起神经细胞外Ca2+浓度下降(Ca2+被络合或流入细胞内),则后者可能参与介导体温上升,因而Ca2+调节体温的作用部位不是在细胞内,而可能在神经元细胞外。
, http://www.100md.com
若ET不能直接作用于下丘脑时,可否通过内生致热原(细胞因子)或发热介质介导[Ca2+]i水平变化?本实验证明IL-1β不能直接影响[Ca2+]i水平,这与文献报道IL-1β不能影响其它细胞(单核细胞、巨噬细胞、成纤维细胞、K562 细胞)的[Ca2+]i水平的结果相吻合[12,13]。那些细胞因子、中枢介质或经其它途径介导ET改变神经细胞[Ca2+]i浓度,以及ET性发热时下丘脑神经细胞[Ca2+]i升高的意义均有待进一步研究。
至于Palmi等[7]报道的ET及rIL-1β均能引起脑脊液Ca2+水平增高,尚难将其来源解释为血中Ca2+或细胞[Ca2+]i流出,因为前者不符合Skarnes等的实验结果,后者又不符合本研究结果。且Palmi等的实验资料,未能与本研究资料进行比较。总之,在中枢Ca2+浓度下降参与发热体温调节的研究领域中,本实验提供了重要的基础科学资料:ET及IL-1β均不引起下丘脑神经细胞[Ca2+]i浓度下降。相反,ET可直接或间接引起其[Ca2+]i浓度上升,ET可能先引起(直接或间接)神经细胞外Ca2+浓度下降,后者则可能参与发热体温的正调节。而神经细胞[Ca2+]i浓度增高则可能是并行的现象,其意义有待于进一步探讨。
, 百拇医药
[基金项目]广东省卫生厅科学基金资助
[参 考 文 献]
[1] Feldberg W, Myers RD, Veale WL. Perfusions from cerebral ventricle to cisterna magna in the unanesthetized cat. Effect of calcium on body temperature[J]. J Physiol ,1970,207(2):403~416.
[2] Myers RD, Tytell M. Body temperature: Possible ionic mechanism in the hypothalamus controlling the set-point[J]. Science, 1970,170(953):95~97.
, 百拇医药
[3] Myers RD, Veale WL. Fever: Reciprocal shift in brain sodium to calcium ration as the set-point temperature rise[J]. Science, 1972,178:765~767.
[4] 李 平,李楚杰. 脑室灌注CaCl2对家兔内毒素性发热及其血浆、脑脊液中cAMP含量的影响[J].中国病理生理杂志,1992,8(1):13~16.
[5] 汤穗生,李楚杰. 家兔侧脑室灌注EGTA后发热效应及脑脊液cAMP、PGE2含量变化的观察[J]. 中国病理生理杂志,1990;6(6):451~455.
[6] Skarnes RC. Host defence against bacterial endotoxemia: mechanism in normal animals[J]. J Exp Med, 1970,132:300~316.
, http://www.100md.com
[7] Palmi M, Frosini M, Sgaragli G. Calcium changes in rabbit csf during endotoxin, IL-1β and PGE2 fever[J]. Pharmacol Biochem Behav, 1992,43:1253~1263.
[8] 张均田,李锡明,石成璋,等. 用Fura-2/AM测定细胞内游离钙浓度的方法[J]. 中国药学杂志,1991,26(11):655~658.
[9] Portoles MT, Ainaga MJ, Angel M. Intracellular calcium and pH alterations induced by Escherichia coli endotoxin in rat hepatocytes[J] . Biochim Biophys Acta, 1991,1092:1~6.
, 百拇医药
[10] Todd JC, Poulos ND, Mollitt DL. The effect of endotoxin on neonata erythrocyte intracelluar calcium concentration[J]. J Pediatr Surg,1994 , 29(6):805~807.
[11] 李楚杰. 内毒素性发热的机制[M]. 见:潘世(山)/(成),罗正曜主编:病理生理学进展(三).人民卫生出版社, 1987. 121~139.
[12] Ierner UH, Brunius G, Modeer T. On the signal transducing mechanisms involved in the synergistic interaction between interleukin-1 and bradykinin on prostaglandin biosynthesis in human gingival fibroblasts[J]. Biosci Rep, 1992 ,12(4):263~271.
[13] Hurme M, Viherluolo J, Nordstreom J. The effect of calcium mobilization on LPS-induced IL-1 beta production depends on the differentiation stage of the monocytes/macrophages[J]. Scand J Immunol, 1992,36(3):507~511.
[收稿日期]2000-02-28
[修回日期]2000-03-29, 百拇医药
单位:(暨南大学医学院 发热研究室,广东 广州 510632)
关键词:内毒素类;白细胞介素-1;钙;下丘脑;体温调节
中国病理生理杂志000713
[摘 要] 目的:研究内毒素(ET)性发热家兔下丘脑神经细胞内游离钙([Ca2+]i)浓度变化及ET、白介素-1β(IL-1β)对正常家兔离体下丘脑神经细胞[Ca2+]i浓度的影响。方法:采用荧光分光光度法,应用钙离子探针(Fura-2/AM),检测[Ca2+]i浓度。结果:(1)微量ET(2 ng/mL)使正常家兔下丘脑神经细胞内[Ca2+]i浓度显著升高;ET性发热家兔下丘脑神经细胞[Ca2+]i水平也显著高于对照组;(2) 3种剂量IL-1β(100、500、1 000 ng/mL)均未能明显影响下丘脑神经细胞[Ca2+]i 浓度。结论:(1)低Ca2+参与ET性发热体温调节的作用部位,可能不是在下丘脑神经细胞内;(2)ET引起下丘脑神经细胞[Ca2+]i 浓度变化,不是通过IL-1β直接引起。
, 百拇医药
[中图分类号] R364.6 [文献标识码] A
[文章编号] 1000-4718(2000)07-0623-04
Intracellular calcium alterations induced by endotoxin and
IL-1β in rabbit hypothalamic neurons
LI Jing, ZHANG Shui-mei, WANG Da-an, QU Yang, YAN Liang, LI Chu-jie
(Department of Pathophysiology, Institute of Fever Research,Medical College of Jinan University, Guangzhou 510632, China)
, 百拇医药
[Abstract] AIM: To investigate intracellular free calcium ([Ca2+]i ) alterations in hypothalamus of febrile rabbits induced by endotoxin (ET), and compare with the effect of ET and IL-1β on [Ca2+]i in hypothalamic neurocytes from normothermia rabbits. METHOD: The concentration of [Ca2+]i was determined by using spectrofluorometer and fluorescent Ca2+ probe fura-2 /Am. RESULTS: 1. A minute dose of ET (2 ng/mL) induced a significant rise in [Ca2+]i in hypothalamic neurocytes from normothermia rabbits. The rise in [Ca2+]i in hypothalamic neurocytes from febrile rabbits induced by intravenous injection of ET was also observed. 2. In hypothalamic neurocytes from normotheria rabbits, IL-1β failed to affect [Ca2+]i at concentrations of 100, 500, 1 000 ng/mL, respectively. CONCLUSION:The action site of low concentration of calcium that plays a regulatory role during fever seems unlikely to be in cytosolic compartment of hypothalamic neurons. The change of [Ca2+]i in hypothalamic neurocytes by ET can not be considered the direct effect of IL-1β.
, http://www.100md.com
[MeSH] Endotoxins; Interleukin-1; Calcium; Hypothalamus;Body temperature regulation
70年代Feldbera等[1]和Myers等[2,3]在猫的脑灌注实验中发现,从灌注液中除去Ca2+引起体温上升,而加入Ca2+则体温下降。因而提出下丘脑Ca2+水平是调节体温的基础。本室近年发现:侧脑室灌注CaCl2能引起内毒素(endotoxin, ET)性发热兔和正常兔体温下降[4];而灌注降钙剂EGTA则引起体温升高,后者可被补充CaCl2所制止[5]。表明在家兔的ET性发热中,Ca2+浓度下降起重要作用,无疑,无论icv给CaCl2或EGTA,首先引起Ca2+浓度变化的部位是在细胞外,但究竟是神经元细胞外Ca2+还是细胞内钙([Ca2+]i)浓度变化参与体温调节,迄今尚未阐明。Skarnes等[6]曾报道ET(iv)可引起血浆Ca2+浓度一时性下降,并指出这种变化也可发生于下丘脑。而Palmi等[7]报道ET(iv)或IL-1β(icv) 引起家兔发热时,脑脊液中Ca2+浓度升高(但来源未肯定)。ET或IL-1β能否引起下丘脑神经元[Ca2+]i浓度变化,迄今未见文献报道。本研究旨在观察微量ET或IL-1β对下丘脑神经细胞[Ca2+]i水平的影响,并检测ET性发热家兔下丘脑神经细胞[Ca2+]i水平,为进一步探讨下丘脑神经细胞[Ca2+]i或细胞外Ca2+在发热调节中的作用提供基础依据。
, 百拇医药
材 料 和 方 法
一、 材料
大肠杆菌ET(E.coli O111 B4, 卫生部上海生物制品研究所); rIL-1β(美国,Dinarello教授惠赠);Fura-2/AM(美国,Sigma);荧光分光光度计RF-5000 型(日本,Shimadzu)。
二、动物
封闭群健康新西兰家兔20只,体重2.0~3.0 kg,雌雄不拘。
三、下丘脑神经细胞分离制备
细胞分离参考张均田[8]的方法。家兔迅速断头,取下丘脑组织,置冰冷Hanks液(含钙及10%小牛血清)中除去血管和残留血液,剪碎后,加入0.125%胰蛋白酶液于37℃水浴震荡15 min。以含10%小牛血清的冰冷的DEME培养液终止消化,过200目筛,将滤液1500 r/min离心5 min,弃上清,沉淀悬浮于DEME培养液中(取少量细胞悬液,用台盼兰排斥反应检测细胞存活率>90%),调节细胞数为1×106个/mL,1 mL/管分装。
, 百拇医药
四、 Fura-2/AM的标记
将所制备的细胞悬液与Fura-2/AM(终浓度为5 mmol/L),在37℃震荡孵育50 min 后,细胞悬液以1500 r/min离心5 min,弃上清,用Hanks 液洗涤2次,最后用Hanks液悬浮细胞。
五、细胞内钙离子浓度测定
(一)不同剂量的ET(0、2、6、10、15、20 ng/mL)分别与已用Fura-2/AM标记的细胞悬液37℃孵育10 min 。用荧光分光光度计检测细胞内游离钙离子浓度,激发波长为340和380 nm。
(二)将IL-1β按三种剂量(100、500、1 000 ng/mL)分别与已用Fura-2/AM标记的细胞悬液37℃孵育10 min,用荧光分光光度计检测细胞内游离钙浓度,条件同(一)。
, http://www.100md.com
六、家兔ET性发热模型的复制及下丘脑神经细胞[Ca2+]i的测定
用10只家兔随机分为2组,每组5只。正常对照组(control group),静脉注射生理盐水(0.5 mL/kg);ET组(ET group),静脉注射ET(6 ng*mL-1*kg-1)后,记录直肠温度至60 min,断头处死动物,按实验方法三、四步骤分离下丘脑神经细胞及标记Fura-2/AM,用荧光分光光度计检测[Ca2+]i 。
七、统计处理
实验数据用均数±标准差(
 ±s)表示、实验组与对照组均数差异显著性应用t检验判定。
±s)表示、实验组与对照组均数差异显著性应用t检验判定。结 果
, http://www.100md.com
一、ET对下丘脑神经细胞[Ca2+]i的影响
下丘脑神经细胞悬液与含不同剂量ET的Hanks液共孵育后,[Ca2+]i 的变化见表1。当加入2 ng/mL ET后,下丘脑神经细胞[Ca2+]i 由(73.2±14.3)nmol/L,增加为(111.7±22.0) nmol/L,与对照组比较有非常显著差异(P<0.01)。当ET剂量增加至10 ng/mL,[Ca2+]i增加大于1倍。在2~10 ng/mL ET剂量范围内,呈现量效关系,但当[Ca2+]i升高到一定程度时,如继续加大ET剂量至15、20 ng/mL,并不引起[Ca2+]i 的进一步升高。
表1 不同剂量ET对下丘脑神经细胞[Ca2+]i的影响
Tab 1 Effect of ET on [Ca2+]i in hypothalamic
, 百拇医药
neurocytes (
 ±s, nmol/L) Treatment
±s, nmol/L) Treatmentn
ET(ng/mL)
[Ca2+]i
Control
8
0
73.2±14.3
ET-1
5
2
, http://www.100md.com
111.7±22.0* *
ET-2
5
6
124.7±21.5* *
ET-3
7
10
159.9±59.6* *
ET-4
5
15
, 百拇医药
123.3±20.4* *
ET-5
6
20
144.8±37.9* *
**P<0.01, vs control
二、ET不同孵育时间对下丘脑神经细胞[Ca2+]i的影响
图1显示下丘脑神经细胞悬液与含10 ng/mL ET的Hanks液共孵育后,其F340/F380荧光比率随时间的变化。结果表明:在20 min的孵育时间内,F340/F380荧光比率没有出现明显的变化,即ET对下丘脑神经细胞[Ca2+]i 的作用不受孵育时间的影响。

, 百拇医药
Fig 1 Effect of ET on fluorescence ratios (340 nm/380 nm) in Fura-2-filled rabbit hypothalamus neuron during different times
图1 不同孵育时间对ET引起的家兔下丘脑神经
细胞[Ca2+]i变化的影响
三、rIL-1β对下丘脑神经细胞[Ca2+]i的影响
图2显示下丘脑神经细胞悬液在加入rIL-1β前后F340/F380荧光比率的变化,由图2可见,在静息状态下,下丘脑神经细胞悬液加入100 ng rIL-1β 不能引起负载细胞的荧光比率发生变化,当再加入剂量分别为500 ng、1 000 ng rIL-1β后,荧光比率仍没有变化,表明发热剂量的rIL-1β并不能直接引起下丘脑神经细胞[Ca2+]i变化。

, 百拇医药
Fig 2 Effect of IL-1β on the fluorescence ratios (340 nm/380 nm) in Fura-2-filled rabbit hypothalamus neuron. (↓),(↓↓),(↓↓↓) shows addition of IL-1β, 100 ng, 500 ng, 1 000 ng respectively
图2 IL-1β对家兔下丘脑神经元[Ca2+]i的影响
四、ET性发热时家兔下丘脑神经细胞[Ca2+]i的变化
家兔由耳缘静脉注入ET后,直肠温度显著上升,ΔT为(1.5±0.3)℃,60 min后断头处死动物,测其下丘脑神经细胞内[Ca2+]i,结果表明ET性发热家兔下丘脑神经细胞[Ca2+]i浓度显著高于对照组(见表2)。
, 百拇医药
表2 ET性发热时家兔下丘脑神经细胞[Ca2+]i的变化
Tab 2 Effect of ET on [Ca2+]i of hypothalamic neurocytes
in febrile rabbits (
 ±s, n=5, nmol/L) Group
±s, n=5, nmol/L) GroupΔT(℃)
[Ca2+]i
Control
0.1±0.1
101.8±26.2
, 百拇医药
ET
1.5±0.3
193.3±8.5* *
** P<0.01, vs control讨 论
据以往的研究,一定量的ET均能引起红细胞、内皮细胞、肝细胞、巨噬细胞及骨髓瘤细胞[Ca2+]i 显著增加[9,10],这些研究所使用的ET剂量都较大,尚未见ET及IL-1β影响脑神经细胞[Ca2+]i的报道,本研究发现,微量的ET(2 ng/mL)即能使下丘脑神经细胞[Ca2+]i显著增加,表明与其它细胞相比,脑细胞对ET的反应相对较为敏感。
但实际上ET能否进入脑内,关键在于ET能否通过血脑屏障。对此问题存在着不同见解,一般主张ET分子量很大,不可能从外周血通过血脑屏障进入脑内,但也有学者主张大剂量ET注入外周静脉能够出现于脑脊液中[11]。目前仍不能排除大剂量ET或脑内疾病过程削弱血脑屏障时,ET进入下丘脑作用于神经元的可能性,只要有微量的ET进入下丘脑,就可能直接作用于神经元或诱生内生致热原介导发热反应,也有可能直接作用于神经元引起[Ca2+]i水平升高。本实验结果表明,在ET(iv)引起发热的同时,可检测到下丘脑神经细胞[Ca2+]i浓度的升高,后者是ET的直接作用抑或通过一定途径而引起,以及这种[Ca2+]i浓度升高是否参与发热体温调节尚待确定。大量实验已证明,icv给Ca2+能引起体温下降或解热,而降低中枢Ca2+则引起体温上升。但若在ET直接或间接引起神经细胞[Ca2+]i浓度升高之前或同时,引起神经细胞外Ca2+浓度下降(Ca2+被络合或流入细胞内),则后者可能参与介导体温上升,因而Ca2+调节体温的作用部位不是在细胞内,而可能在神经元细胞外。
, http://www.100md.com
若ET不能直接作用于下丘脑时,可否通过内生致热原(细胞因子)或发热介质介导[Ca2+]i水平变化?本实验证明IL-1β不能直接影响[Ca2+]i水平,这与文献报道IL-1β不能影响其它细胞(单核细胞、巨噬细胞、成纤维细胞、K562 细胞)的[Ca2+]i水平的结果相吻合[12,13]。那些细胞因子、中枢介质或经其它途径介导ET改变神经细胞[Ca2+]i浓度,以及ET性发热时下丘脑神经细胞[Ca2+]i升高的意义均有待进一步研究。
至于Palmi等[7]报道的ET及rIL-1β均能引起脑脊液Ca2+水平增高,尚难将其来源解释为血中Ca2+或细胞[Ca2+]i流出,因为前者不符合Skarnes等的实验结果,后者又不符合本研究结果。且Palmi等的实验资料,未能与本研究资料进行比较。总之,在中枢Ca2+浓度下降参与发热体温调节的研究领域中,本实验提供了重要的基础科学资料:ET及IL-1β均不引起下丘脑神经细胞[Ca2+]i浓度下降。相反,ET可直接或间接引起其[Ca2+]i浓度上升,ET可能先引起(直接或间接)神经细胞外Ca2+浓度下降,后者则可能参与发热体温的正调节。而神经细胞[Ca2+]i浓度增高则可能是并行的现象,其意义有待于进一步探讨。
, 百拇医药
[基金项目]广东省卫生厅科学基金资助
[参 考 文 献]
[1] Feldberg W, Myers RD, Veale WL. Perfusions from cerebral ventricle to cisterna magna in the unanesthetized cat. Effect of calcium on body temperature[J]. J Physiol ,1970,207(2):403~416.
[2] Myers RD, Tytell M. Body temperature: Possible ionic mechanism in the hypothalamus controlling the set-point[J]. Science, 1970,170(953):95~97.
, 百拇医药
[3] Myers RD, Veale WL. Fever: Reciprocal shift in brain sodium to calcium ration as the set-point temperature rise[J]. Science, 1972,178:765~767.
[4] 李 平,李楚杰. 脑室灌注CaCl2对家兔内毒素性发热及其血浆、脑脊液中cAMP含量的影响[J].中国病理生理杂志,1992,8(1):13~16.
[5] 汤穗生,李楚杰. 家兔侧脑室灌注EGTA后发热效应及脑脊液cAMP、PGE2含量变化的观察[J]. 中国病理生理杂志,1990;6(6):451~455.
[6] Skarnes RC. Host defence against bacterial endotoxemia: mechanism in normal animals[J]. J Exp Med, 1970,132:300~316.
, http://www.100md.com
[7] Palmi M, Frosini M, Sgaragli G. Calcium changes in rabbit csf during endotoxin, IL-1β and PGE2 fever[J]. Pharmacol Biochem Behav, 1992,43:1253~1263.
[8] 张均田,李锡明,石成璋,等. 用Fura-2/AM测定细胞内游离钙浓度的方法[J]. 中国药学杂志,1991,26(11):655~658.
[9] Portoles MT, Ainaga MJ, Angel M. Intracellular calcium and pH alterations induced by Escherichia coli endotoxin in rat hepatocytes[J] . Biochim Biophys Acta, 1991,1092:1~6.
, 百拇医药
[10] Todd JC, Poulos ND, Mollitt DL. The effect of endotoxin on neonata erythrocyte intracelluar calcium concentration[J]. J Pediatr Surg,1994 , 29(6):805~807.
[11] 李楚杰. 内毒素性发热的机制[M]. 见:潘世(山)/(成),罗正曜主编:病理生理学进展(三).人民卫生出版社, 1987. 121~139.
[12] Ierner UH, Brunius G, Modeer T. On the signal transducing mechanisms involved in the synergistic interaction between interleukin-1 and bradykinin on prostaglandin biosynthesis in human gingival fibroblasts[J]. Biosci Rep, 1992 ,12(4):263~271.
[13] Hurme M, Viherluolo J, Nordstreom J. The effect of calcium mobilization on LPS-induced IL-1 beta production depends on the differentiation stage of the monocytes/macrophages[J]. Scand J Immunol, 1992,36(3):507~511.
[收稿日期]2000-02-28
[修回日期]2000-03-29, 百拇医药