产组织型纤溶酶原激活剂CHO工程细胞无血清培基的研究
作者:陈昭烈 刘 红 吴本传 林福玉 李世崇 黄培堂
单位:军事医学科学院生物工程研究所,北京100071
关键词:细胞培养;CHO工程细胞;无血清培基;组织型纤溶酶原激活剂
摘 要 在对DMEM 摘 要 在对DMEM:F12(1∶1)进行优化的基础上,以细胞生长和组织型纤溶酶原激活剂(t-PA)表达为评价指标,筛选无血清培基添加成分,建立了由优化DMEM:F12(1:1)、胰岛素、PluronicF-68、维生素C、乙醇胺和微量元素混合液组成的适于产t-PACHO工程细胞4B3生长和t-PA表达效果均优于相同条件下用含血清培基培养的效果。
Study on Serum-Free Medium for Genetically-engineered
, 百拇医药 CHO Cells Produ cing Tissue Type Plasminogen Activator
Chen Zhaolie, Liu Hong, Wu Be nchuan, Lin Fuyu, Li Shichong, Huang Peitang
(Institute of Biotechnology, Academy of Military Medical Sciences, Beiji ng 100071)
Abstract Based on the optimization of DMEM∶F12(1∶1), and the selection of supplements for serum-free medium using the cell growth and the t-PA expres sion as the evaluation indexes, a serum-free medium, DF5S, which consisted of o ptimized DMEM∶F12(1∶1), insulin, pluronic F-68, vitamin C, trace element mix and ethanolamine, for the growth of genetically-engineered CHO cell line 4B3 wa s formulated. Immobilized cultivation of 4B3 cells with Cytopore in spinner fla sks, the growth and t-PA production of 4B3 in DF5S were superior to that observ ed in serum-containing medium.
, 百拇医药
Key Words Cell cultrue, Serum-free medium, Recombinant CHO cell, t-PA
随着医药生物高技术的研究和应用的发展,动物细胞无血清培养技术已成为优质、高效、低成本地生产具有重要医用价值的动物细胞产品的重要技术[1]。动物细胞无血清培养的核心技术是与培养细胞相适应的无血清培基。由于无血清培基成分明确、质量一致、蛋白含量低,因而不仅有利于提高细胞产品生产的稳定性并使细胞产品易于纯化,同时也可使不同的细胞能各自在最有利其生长或最有利于表达目的产物的培养环境中生长[2]。随着越来越多的编码具有重要医用价值的人体蛋白基因相继在CHO工程细胞中获得高效表达,要求有相应的无血清培基来满足重组蛋白大量生产的需要。商品化的CHO工程细胞无血清培基价格昂贵,不能实际用于CHO工程细胞的大规模培养。本文介绍一种适于产组织型纤溶酶原激活剂(t-PA)CHO工程细胞生长和t-PA生产的价格低廉的无血清培基。
, http://www.100md.com
1 材 料
1.1 细胞
产t-PACHO工程细胞4B3是由含t-PA目的基因和dhfr标记基因的表达载体,用电击法转染CHO-dhfr细胞所建立的具有稳定表达t-PA表型的细胞株,t-PA的表达水平为800~1000IU/106cells.d-1(由本所蛋白质工程研究室构建)[3]。
1.2 培基和培基添加成分
DMEM、F12、MEM、RPMI1640为GIBCO产品。胰岛素(I)、铁转运蛋白(T)、丝氨酸、脯氨酸、蛋白胨(P)、酵母提取物(Y)、PluronicF-68(F-68)、腐胺(PUT)、亚硒酸钠(SE)、乙醇胺(ETH)、维生素C(VITC)、柠檬酸铁、硫酸锌和硫酸铜购自Sigma公司;新生小牛血清(NBS)和牛血清白蛋白(BSA)为国产试剂。
, 百拇医药
1.3 细胞固定化培养载体
Cytopore多孔微球为Pharmacia产品。
1.4 细胞计数和t-PA测定试剂
四甲基偶氮唑蓝(MTT)为Fluka产品:N.N-二甲基酰胺、TritonX-100、牛凝血酶和牛纤维蛋白原为国产试剂;t-PA标准品由英国国立生物标准和控制研究所(86/670,NIBSA)提供
2 方 法
2.1 基础培基的选择及优化
以4B3细胞的生长为指标,在方瓶中比较4B3细胞在低血清含量的不同培基中的细胞生长,从中选出适于4B3细胞生长的基础培基。在此基础上采用HPLC分析技术,分析4B3细胞对培基中氨基酸的消耗情况,根据分析结果调整培基成分。
, 百拇医药
2.2 无血清培基的设计
以不含NBS的优化基础培基作为设计无血清培基的基础培基,先在24孔板中比较胰岛素、铁转运蛋白、蛋白胨、酵母提取物和BSA等对4B3细胞的生长促进作用。继而在添加胰岛素的优化基础培基中,以细胞的增殖和t-PA的表达为评价指标,分析PluronicF-68、腐胺、亚硒酸钠、乙醇胺、维生素C和由柠檬酸铁、硫酸锌和硫酸铜组成的微量元素混合液(TraceElementMix,TEM)对4B3细胞的生长和t-PA表达的影响,根据分析结果确定无血清培基的添加成分。
2.3 4B3细胞的固定化培养
在2000ml的Bellco转瓶内用含2%(v/v)NBS的DMEM∶F12(DF+NBS)扩殖4B3细胞,待细胞形成致密单层后,用0.25%的胰蛋白酶进行消化,经不含NBS的DMEM∶F12洗涤后,分别用DF+NBS和无血清培基DF5S悬浮4B3细胞,在250mlBellco搅拌瓶内用Cytopore2g/L固定化培养4B3细胞。自培养的第2天起更换培基,培基更换量从培养体积的40%逐渐增加至85%。取样测定细胞密度和t-PA活性。
, http://www.100md.com
2.4 细胞计数和t-PA活性测定
在方瓶中培养的4B3细胞用细胞计数板直接计数;用改良MTT比色法[4]计数24孔板和Cytopore多孔微球固定化培养的4B3细胞的活细胞密度;t-PA活性测定采用琼脂糖-纤维蛋白-平板法[5]。
3 结 果
3.1 优化基础培基及4B3细胞在优化基础培基中的培养效果
设计无血清培基的第一步骤是从常用的商品化培基中选出较适于细胞体外培养的培基作为无血清培基的基础培基。在低血清含量的培养条件下,比较4B3细胞在DMEM、F12、MEM、PRMI1640和DMEM∶F12(1∶1)中的细胞生长。其中以DMEM∶F12(1∶1)培养4B3细胞的生长效果为最佳(表1)。用HPLC分析含1%NBS的DMEM∶F12(1∶1)培养4B3细胞前后的氨基酸含量,4B3细胞对脯氨酸和丝氨酸的消耗量较大,培基中脯氨酸和丝氨酸的含量相对不足。增加培基中脯氨酸和丝氨酸的含量,同时加入有利于稳定培基成分和改善4B3细胞贴附的β-环状糊精和6-氨基己酸对DMEM∶F12(1∶1)进行优化。在相同的培养条件下,4B3细胞在优化基础培基中的细胞密度比DMEM∶F12提高20~30%。
, 百拇医药
Tab 1 Growth of 4B3 cells in several low NBS containing media
Media
Cell density×104cells/ml
+0%NBS
+0 .1%NBS
+1%NBS
F12
5.8
12.0
18.0
MEM
, 百拇医药
2.5
3.8
12.6
DMEM
4.6
8.0
21.0
RPMI 1640
3.8
7.2
12.6
DMEM∶
F12 (1∶1)
, http://www.100md.com
9.0
16.0
28.2
3.2 培基添加成分对4B3细胞的生长和t-PA表达的影响
胰岛素、BSA、铁转运蛋白、蛋白胨和酵母提取物等均为具有支持细胞生长的无血清培基添加成分。在不含NBS的优化基础培基中分别加入一定量的BSA、酵母提取物、蛋白胨、铁转运蛋白和胰岛素,均有利于4B3细胞的生长。其对4B3细胞的生长刺激作用自强而弱依次为:BSA、酵母提取物、胰岛素、蛋白胨和铁转运蛋白(图1)。结合t-PA的后续纯化和质量控制考虑,确定胰岛素作为无血清培基中起主要支持4B3细胞生长作用的唯一蛋白类添加成分。在含胰岛素的优化基础培基中,添加维生素C、乙醇胺、F-68均有利于4B3的生长,微量元素混合液对4B3细胞有轻微的生长抑制作用,但有利于4B3细胞表达t-PA。培基添加成分亚硒酸钠和腐胺对4B3细胞的生长和t-PA表达均无明显影响(图2)。根据以上结果确定了在优化基础培基中添加胰岛素、乙醇胺、PluronicF-68、维生素C和微量元素混合液组成的无血清培基DF5S。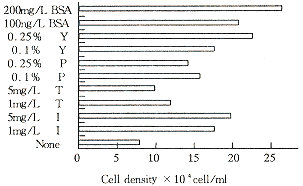
, 百拇医药
Fig 1 Effect of different supplements on
4B3 cells growth in optimized medium

Fig 2 Effects of different supplements on growth
and t-PA expression of 4B3 cells in optimized
, http://www.100md.com
medium in the pressence of insulin
3.3 无血清培基DF5S对4B3细胞的生长和t-PA表达的影响
将4B3细胞从含2%(v/v)NBS的DMEM∶F12转入用DF5S培养,其生长方式由贴壁依赖型转变为非贴壁依赖型,呈单个球形细胞和细胞团块悬浮于培基中(图3)。在方瓶中用DF5S悬浮培养4B3细胞,t-PA的表达水平与用DF+NBS培养相当,但4B3细胞的生长速率和饱和细胞密度只分别相当于用含血清培基培养的80%和70%左右(表2)。在搅拌瓶中用Cytopore多孔微球和DF5S或固定化培养4B3细胞,细胞附着于多孔微球的孔隙微球的孔隙内生长,并逐渐充填了Cytopore的孔隙,在载体的表面形成致密的细胞层(图3)。比较在搅拌瓶中有血清和无血清培养条件下,用Cytopore多孔微球固定化培养4B3细胞的生长和t-PA表达,用DF5S培养4B3的细胞生长和t-PA生产效果均优于用含血清培基培养(图4)。

, 百拇医药
A. Non-immobilized B. Immobilized
Fig 3 Growth of 4B3 cell in EF5S
Tab 2 Growth and t-PA expression of 4B3 cells in DF5S
Medium
Growth rate
(h-1)
Saturated cell
density
(104 cells/ml)
, 百拇医药
S pecific rate of
t-PA production
(IU/106
cells.day-1)
DF+NBS
0.041
134±31
1006±264
DF5S
0.033
94±27
, 百拇医药
926±232
Fig 4 Growth and t-PA production of 4BS cells immo
bilized with Cytopore and DF5S in spinner flask
4 讨 论
商品化的动物细胞培基大多是根据细胞在低密度培养或克隆生长的营养需要而设计的,不能完全适用于以动物细胞产品生产为目的的细胞培养的需要[6]。根据不同培基的特点,将其合理地混合使用,可在有血清的培养条件下在一定程度上提高细胞的培养效果。由于不同的细胞对营养成分的需求有所不同,培基中某些成分的不足,可能成为细胞生长的限制性因素[7]。因此在设计无血清培基时,有必要在适合的商品化培基的基础上,通过分析细胞的营养需求对基础培基进行优化。
, 百拇医药
细胞因子、激素和某些动物源性蛋白类产品是无血清培基中支持细胞生长的蛋白或多肽类添加成分。在设计无血清培基时,除了考虑不同添加成分的细胞生长刺激作用外,还应考虑其是否成分明确及其使用剂量的大小。对于非蛋白类添加成分,则在分析其对细胞生长影响的同时,还需结合细胞培养的目的,分析添加成分对细胞的某些特定的分化功能的影响。尽可能使所设计的无血清培基能满足成分明确,蛋白含量低,使用效果好的要求。
4B3在有血清培养条件下是呈贴壁依赖性生长的。当4B3细胞从含血清的培基转入DF5S培养后,细胞的生长随之转变为非贴壁依赖性生长。4B3细胞生长方式的改变虽不影响其表达t-PA的功能,但可能影响细胞的生长速度。在搅拌瓶中用Cytopore多孔微球固定化培养4B3细胞,4B3细胞在DF5S中培养的细胞生长和t-PA表达效果均优于含血清培基培养,表明采用DF5S和Cytopore多孔微球固定化培养4B3细胞可望用于生物反应器规模生产t-PA。
本研究 为“863”中试研究项目(Z18-03-12)
, 百拇医药
参考文献
1 Broad D, Doraston R, Rhodes M. Production of recombinant proteins in serum-free medium. Cytotechnology, 1991,5(1)∶47
2 Murakari H. What should be focused in the study of cell culture technology for production of bioactive proteins. Cytotechnology, 1990,3 (1)∶3
3 欧阳应斌,黄培堂,徐秀英,等.t-PA cDNA在CHO细胞中的稳定高效表达.生 物技术通讯,1995,6(1)∶207
4 贾熙华,肖成祖.MTT比色法在微囊培养动物细胞计数中的应用.军事医学科学 院院刊,1995,17(3):207
, http://www.100md.com
5 韩素文,俞炜源,李秀珍,等.培养细胞分泌的血纤维蛋白溶酶原激活剂的研究.军事医学科学院院刊,1987,11(2)∶101
6 Jayme D W.Nutrient optimization for high density biological production applic ation. Cytotechnology,1991,5(1)∶15
7 Hewlett G. Strategies for optimising serum-free mediua. Cytotechnology ,1991,5
(1)∶3
收稿日期:1998-08-22, http://www.100md.com
单位:军事医学科学院生物工程研究所,北京100071
关键词:细胞培养;CHO工程细胞;无血清培基;组织型纤溶酶原激活剂
摘 要 在对DMEM 摘 要 在对DMEM:F12(1∶1)进行优化的基础上,以细胞生长和组织型纤溶酶原激活剂(t-PA)表达为评价指标,筛选无血清培基添加成分,建立了由优化DMEM:F12(1:1)、胰岛素、PluronicF-68、维生素C、乙醇胺和微量元素混合液组成的适于产t-PACHO工程细胞4B3生长和t-PA表达效果均优于相同条件下用含血清培基培养的效果。
Study on Serum-Free Medium for Genetically-engineered
, 百拇医药 CHO Cells Produ cing Tissue Type Plasminogen Activator
Chen Zhaolie, Liu Hong, Wu Be nchuan, Lin Fuyu, Li Shichong, Huang Peitang
(Institute of Biotechnology, Academy of Military Medical Sciences, Beiji ng 100071)
Abstract Based on the optimization of DMEM∶F12(1∶1), and the selection of supplements for serum-free medium using the cell growth and the t-PA expres sion as the evaluation indexes, a serum-free medium, DF5S, which consisted of o ptimized DMEM∶F12(1∶1), insulin, pluronic F-68, vitamin C, trace element mix and ethanolamine, for the growth of genetically-engineered CHO cell line 4B3 wa s formulated. Immobilized cultivation of 4B3 cells with Cytopore in spinner fla sks, the growth and t-PA production of 4B3 in DF5S were superior to that observ ed in serum-containing medium.
, 百拇医药
Key Words Cell cultrue, Serum-free medium, Recombinant CHO cell, t-PA
随着医药生物高技术的研究和应用的发展,动物细胞无血清培养技术已成为优质、高效、低成本地生产具有重要医用价值的动物细胞产品的重要技术[1]。动物细胞无血清培养的核心技术是与培养细胞相适应的无血清培基。由于无血清培基成分明确、质量一致、蛋白含量低,因而不仅有利于提高细胞产品生产的稳定性并使细胞产品易于纯化,同时也可使不同的细胞能各自在最有利其生长或最有利于表达目的产物的培养环境中生长[2]。随着越来越多的编码具有重要医用价值的人体蛋白基因相继在CHO工程细胞中获得高效表达,要求有相应的无血清培基来满足重组蛋白大量生产的需要。商品化的CHO工程细胞无血清培基价格昂贵,不能实际用于CHO工程细胞的大规模培养。本文介绍一种适于产组织型纤溶酶原激活剂(t-PA)CHO工程细胞生长和t-PA生产的价格低廉的无血清培基。
, http://www.100md.com
1 材 料
1.1 细胞
产t-PACHO工程细胞4B3是由含t-PA目的基因和dhfr标记基因的表达载体,用电击法转染CHO-dhfr细胞所建立的具有稳定表达t-PA表型的细胞株,t-PA的表达水平为800~1000IU/106cells.d-1(由本所蛋白质工程研究室构建)[3]。
1.2 培基和培基添加成分
DMEM、F12、MEM、RPMI1640为GIBCO产品。胰岛素(I)、铁转运蛋白(T)、丝氨酸、脯氨酸、蛋白胨(P)、酵母提取物(Y)、PluronicF-68(F-68)、腐胺(PUT)、亚硒酸钠(SE)、乙醇胺(ETH)、维生素C(VITC)、柠檬酸铁、硫酸锌和硫酸铜购自Sigma公司;新生小牛血清(NBS)和牛血清白蛋白(BSA)为国产试剂。
, 百拇医药
1.3 细胞固定化培养载体
Cytopore多孔微球为Pharmacia产品。
1.4 细胞计数和t-PA测定试剂
四甲基偶氮唑蓝(MTT)为Fluka产品:N.N-二甲基酰胺、TritonX-100、牛凝血酶和牛纤维蛋白原为国产试剂;t-PA标准品由英国国立生物标准和控制研究所(86/670,NIBSA)提供
2 方 法
2.1 基础培基的选择及优化
以4B3细胞的生长为指标,在方瓶中比较4B3细胞在低血清含量的不同培基中的细胞生长,从中选出适于4B3细胞生长的基础培基。在此基础上采用HPLC分析技术,分析4B3细胞对培基中氨基酸的消耗情况,根据分析结果调整培基成分。
, 百拇医药
2.2 无血清培基的设计
以不含NBS的优化基础培基作为设计无血清培基的基础培基,先在24孔板中比较胰岛素、铁转运蛋白、蛋白胨、酵母提取物和BSA等对4B3细胞的生长促进作用。继而在添加胰岛素的优化基础培基中,以细胞的增殖和t-PA的表达为评价指标,分析PluronicF-68、腐胺、亚硒酸钠、乙醇胺、维生素C和由柠檬酸铁、硫酸锌和硫酸铜组成的微量元素混合液(TraceElementMix,TEM)对4B3细胞的生长和t-PA表达的影响,根据分析结果确定无血清培基的添加成分。
2.3 4B3细胞的固定化培养
在2000ml的Bellco转瓶内用含2%(v/v)NBS的DMEM∶F12(DF+NBS)扩殖4B3细胞,待细胞形成致密单层后,用0.25%的胰蛋白酶进行消化,经不含NBS的DMEM∶F12洗涤后,分别用DF+NBS和无血清培基DF5S悬浮4B3细胞,在250mlBellco搅拌瓶内用Cytopore2g/L固定化培养4B3细胞。自培养的第2天起更换培基,培基更换量从培养体积的40%逐渐增加至85%。取样测定细胞密度和t-PA活性。
, http://www.100md.com
2.4 细胞计数和t-PA活性测定
在方瓶中培养的4B3细胞用细胞计数板直接计数;用改良MTT比色法[4]计数24孔板和Cytopore多孔微球固定化培养的4B3细胞的活细胞密度;t-PA活性测定采用琼脂糖-纤维蛋白-平板法[5]。
3 结 果
3.1 优化基础培基及4B3细胞在优化基础培基中的培养效果
设计无血清培基的第一步骤是从常用的商品化培基中选出较适于细胞体外培养的培基作为无血清培基的基础培基。在低血清含量的培养条件下,比较4B3细胞在DMEM、F12、MEM、PRMI1640和DMEM∶F12(1∶1)中的细胞生长。其中以DMEM∶F12(1∶1)培养4B3细胞的生长效果为最佳(表1)。用HPLC分析含1%NBS的DMEM∶F12(1∶1)培养4B3细胞前后的氨基酸含量,4B3细胞对脯氨酸和丝氨酸的消耗量较大,培基中脯氨酸和丝氨酸的含量相对不足。增加培基中脯氨酸和丝氨酸的含量,同时加入有利于稳定培基成分和改善4B3细胞贴附的β-环状糊精和6-氨基己酸对DMEM∶F12(1∶1)进行优化。在相同的培养条件下,4B3细胞在优化基础培基中的细胞密度比DMEM∶F12提高20~30%。
, 百拇医药
Tab 1 Growth of 4B3 cells in several low NBS containing media
Media
Cell density×104cells/ml
+0%NBS
+0 .1%NBS
+1%NBS
F12
5.8
12.0
18.0
MEM
, 百拇医药
2.5
3.8
12.6
DMEM
4.6
8.0
21.0
RPMI 1640
3.8
7.2
12.6
DMEM∶
F12 (1∶1)
, http://www.100md.com
9.0
16.0
28.2
3.2 培基添加成分对4B3细胞的生长和t-PA表达的影响
胰岛素、BSA、铁转运蛋白、蛋白胨和酵母提取物等均为具有支持细胞生长的无血清培基添加成分。在不含NBS的优化基础培基中分别加入一定量的BSA、酵母提取物、蛋白胨、铁转运蛋白和胰岛素,均有利于4B3细胞的生长。其对4B3细胞的生长刺激作用自强而弱依次为:BSA、酵母提取物、胰岛素、蛋白胨和铁转运蛋白(图1)。结合t-PA的后续纯化和质量控制考虑,确定胰岛素作为无血清培基中起主要支持4B3细胞生长作用的唯一蛋白类添加成分。在含胰岛素的优化基础培基中,添加维生素C、乙醇胺、F-68均有利于4B3的生长,微量元素混合液对4B3细胞有轻微的生长抑制作用,但有利于4B3细胞表达t-PA。培基添加成分亚硒酸钠和腐胺对4B3细胞的生长和t-PA表达均无明显影响(图2)。根据以上结果确定了在优化基础培基中添加胰岛素、乙醇胺、PluronicF-68、维生素C和微量元素混合液组成的无血清培基DF5S。

, 百拇医药
Fig 1 Effect of different supplements on
4B3 cells growth in optimized medium


Fig 2 Effects of different supplements on growth
and t-PA expression of 4B3 cells in optimized
, http://www.100md.com
medium in the pressence of insulin
3.3 无血清培基DF5S对4B3细胞的生长和t-PA表达的影响
将4B3细胞从含2%(v/v)NBS的DMEM∶F12转入用DF5S培养,其生长方式由贴壁依赖型转变为非贴壁依赖型,呈单个球形细胞和细胞团块悬浮于培基中(图3)。在方瓶中用DF5S悬浮培养4B3细胞,t-PA的表达水平与用DF+NBS培养相当,但4B3细胞的生长速率和饱和细胞密度只分别相当于用含血清培基培养的80%和70%左右(表2)。在搅拌瓶中用Cytopore多孔微球和DF5S或固定化培养4B3细胞,细胞附着于多孔微球的孔隙微球的孔隙内生长,并逐渐充填了Cytopore的孔隙,在载体的表面形成致密的细胞层(图3)。比较在搅拌瓶中有血清和无血清培养条件下,用Cytopore多孔微球固定化培养4B3细胞的生长和t-PA表达,用DF5S培养4B3的细胞生长和t-PA生产效果均优于用含血清培基培养(图4)。


, 百拇医药
A. Non-immobilized B. Immobilized
Fig 3 Growth of 4B3 cell in EF5S
Tab 2 Growth and t-PA expression of 4B3 cells in DF5S
Medium
Growth rate
(h-1)
Saturated cell
density
(104 cells/ml)
, 百拇医药
S pecific rate of
t-PA production
(IU/106
cells.day-1)
DF+NBS
0.041
134±31
1006±264
DF5S
0.033
94±27
, 百拇医药
926±232

Fig 4 Growth and t-PA production of 4BS cells immo
bilized with Cytopore and DF5S in spinner flask
4 讨 论
商品化的动物细胞培基大多是根据细胞在低密度培养或克隆生长的营养需要而设计的,不能完全适用于以动物细胞产品生产为目的的细胞培养的需要[6]。根据不同培基的特点,将其合理地混合使用,可在有血清的培养条件下在一定程度上提高细胞的培养效果。由于不同的细胞对营养成分的需求有所不同,培基中某些成分的不足,可能成为细胞生长的限制性因素[7]。因此在设计无血清培基时,有必要在适合的商品化培基的基础上,通过分析细胞的营养需求对基础培基进行优化。
, 百拇医药
细胞因子、激素和某些动物源性蛋白类产品是无血清培基中支持细胞生长的蛋白或多肽类添加成分。在设计无血清培基时,除了考虑不同添加成分的细胞生长刺激作用外,还应考虑其是否成分明确及其使用剂量的大小。对于非蛋白类添加成分,则在分析其对细胞生长影响的同时,还需结合细胞培养的目的,分析添加成分对细胞的某些特定的分化功能的影响。尽可能使所设计的无血清培基能满足成分明确,蛋白含量低,使用效果好的要求。
4B3在有血清培养条件下是呈贴壁依赖性生长的。当4B3细胞从含血清的培基转入DF5S培养后,细胞的生长随之转变为非贴壁依赖性生长。4B3细胞生长方式的改变虽不影响其表达t-PA的功能,但可能影响细胞的生长速度。在搅拌瓶中用Cytopore多孔微球固定化培养4B3细胞,4B3细胞在DF5S中培养的细胞生长和t-PA表达效果均优于含血清培基培养,表明采用DF5S和Cytopore多孔微球固定化培养4B3细胞可望用于生物反应器规模生产t-PA。
本研究 为“863”中试研究项目(Z18-03-12)
, 百拇医药
参考文献
1 Broad D, Doraston R, Rhodes M. Production of recombinant proteins in serum-free medium. Cytotechnology, 1991,5(1)∶47
2 Murakari H. What should be focused in the study of cell culture technology for production of bioactive proteins. Cytotechnology, 1990,3 (1)∶3
3 欧阳应斌,黄培堂,徐秀英,等.t-PA cDNA在CHO细胞中的稳定高效表达.生 物技术通讯,1995,6(1)∶207
4 贾熙华,肖成祖.MTT比色法在微囊培养动物细胞计数中的应用.军事医学科学 院院刊,1995,17(3):207
, http://www.100md.com
5 韩素文,俞炜源,李秀珍,等.培养细胞分泌的血纤维蛋白溶酶原激活剂的研究.军事医学科学院院刊,1987,11(2)∶101
6 Jayme D W.Nutrient optimization for high density biological production applic ation. Cytotechnology,1991,5(1)∶15
7 Hewlett G. Strategies for optimising serum-free mediua. Cytotechnology ,1991,5
(1)∶3
收稿日期:1998-08-22, http://www.100md.com