无菌性松动假体-骨界面溶骨因子和成骨因子表达的对比研究
作者:蔡谞 王继芳 卢世璧 赵斌 张笑明
单位:蔡谞 王继芳 卢世璧 赵斌(解放军总医院骨科北京,100853);张笑明(解放军总医院病理科)
关键词:人工关节;血小板源生长因子;骨形态发生蛋白质类;假体失效
中华骨科杂志001110
【摘要】目的 对比研究无菌性松动假体周围界膜组织中溶骨因子和成骨因子的表达,进一步探讨磨损颗粒致界面骨溶解的生物学原因。方法 采用逆转录-聚合酶链反应(reverse transcription polymerase chain reaction, RT-PCR)和计算机图像分析的方法,分别检测溶骨区界膜(含磨损颗粒)和非溶骨区界膜中PDGF-B和BMP-7mRNA的表达量,并以正常滑膜、骨性关节炎(osteoarthritis,OA)滑膜和正常松质骨为对照。结果 界膜组织中PDGF-Bm RNA的表达量由高到低依次为OA滑膜、溶骨区界膜、正常松质骨、非溶骨区界膜、正常滑膜(P<0.01)。BMP-7 mRNA在溶骨区界膜、正常滑膜和OA滑膜中未测出表达,在非溶骨区界膜中呈不典型表达,在正常松质骨中呈明显表达(P<0.01)。结论 松动的假体-骨界面界膜组织中溶骨因子和成骨因子表达总体失衡,即使界膜中的间质细胞具备了向骨组织衍化的能力,也因局部微环境骨诱导效应的低下而不能实现,这可能是磨损颗粒造成界面骨重建受阻而溶骨大量发生的关键环节之一。
, http://www.100md.com
PDGF-B and BMP-7 mRNA expression in the interface membrane around aseptically loosened prosthesis
CAI Xu, WANG Jifang, LU Shibi, et al.
(Department of Orthopaedics, General Hospital of Chinese People's Liberation Army, Beijing 100853, China)
【 Abstract】Objective To compare the expression of osteolysis and osteogenesis cytokines in the interface membrane around aseptically loosened prosthesis for the elucidation of the biological mechanism of osteolysis caused by wear particles at bone-implant interface. Methods Reverse transcription polymerase chain reaction(RT-PCR) and computerized image processing were adopted to determine the mRNA expression of PDGF-B and BMP-7 respectively in the interface membrane(IM) at osteolysis region(with wear particles) and non-osteolysis region. Normal synovial membrane(NSM), OA synovial membrane(OASM) and normal cancellous bone(NCB) were obtained as negative or positive control. Results Expression of PDGF-B mRNA from high to low was OASM, IM at osteolysis region, NCB, IM at non-osteolysis region and NSM(P< 0.01). No BMP-7 mRNA expression in the IM at osteolysis region or NSM and OASM. Non-typical expression of BMP-7 mRNA appeared in the IM at non-osteolysis while obvious expression existed in NCB(P< 0.01). Conclusion Imbalance of expression of osteolysis cytokines and osteogenesis cytokines may be one of the key points of bone reconstruction inhibition and bone resorption at bone-implant interface under the stimulation of wear particles.
, 百拇医药
【Key words】 Joint prosthesis; Platelet-derived growth factor; Bone morphogenetic proteins; Prosthesis failure
无菌性松动人工关节假体周围骨溶解部位的界膜组织中存在多种磨损颗粒。研究表明,磨损颗粒-骨界面巨噬细胞(macrophage,MФ)-骨溶解-无菌性松动之间存在一定的内在联系,该联系的一个关键环节为MФ被磨损颗粒激活后释放的多种强效溶骨因子,如白细胞介素1(interlukin-1,IL-1)、白细胞介素6(interlukin-6,IL-6)、肿瘤坏死因子α(tumornecrosisfactor-α,TNF-α)、转化生长因子α(transforminggrowthfactor-α,TGF-α)和血小板源生长因子(platelet-derivedgrowthfactor,PDGF)等[1,2],其中PDGF-B因其同时具有促溶骨和成纤维双重作用而受到关注[3]。以往人们多注重研究磨损颗粒刺激界膜组织中溶骨因子分泌对假体松动的影响,而很少将界膜组织中成骨因子与溶骨因子的表达进行对比分析。本研究以PDGF-B和骨形态发生蛋白7(bonemorphogeneticprotein-7,BMP-7)为代表,采用逆转录-聚合酶链反应(reversetranscriptionpolymerasechainreaction,RT-PCR)的方法,对其在无菌性松动假体周围界膜组织中的表达进行初步观察。
, http://www.100md.com
图1PDGF-BmRNART-PCR扩增产物电泳条带
材料与方法
一、取材及分组
取无菌性松动人工关节翻修术时获得的溶骨区和非溶骨区界膜,设为2个实验组;另从相关手术中获取正常滑膜、骨性关节炎(osteoarthritis,OA)滑膜和正常松质骨,设为3个对照组。每组随机抽取10具标本,置-70℃保存备用。
二、引物设计与合成
根据PCR引物合成原则,用计算机设计系统测试,选定引物。
1.PDGF-B引物
意义链:5-CCGCACCAACGCCAACTTCC-3
, 百拇医药
反意链:5-TTTGGCTCGCTGCTCCTGGG-3
扩增片段长度271bp[4](美国CyberSyn公司合成)。
2.BMP-7引物
意义链:5-GGCAAGCACAACTCGGCACC-3
反意链:5-TTGGGGTTGATGCTCTGCCC-3
扩增片段长度560bp[5](美国CyberSyn公司合成)。
3.内对照β2M引物
意义链:5-CCACTGAAAAAGATGAGTAT-3
, 百拇医药
反意链:5-CTTCAACCTCCATGATGCTG-3
扩增片段长度227bp(军事医学科学院基础所合成)。
所有引物均用1×TE(Tris-EDTA)缓冲液配成20μmol/L浓度。
三、实验步骤
据文献报道的RT-PCR方法,依次进行组织总RNA提取、逆转录、cDNA合成及PCR扩增等[6]。扩增产物以质量浓度为2%的TBE(Tris-硼酸-EDTA)缓冲液作琼脂糖凝胶板电泳,等体积pBR322/HinfⅠ作为相对分子质量标准。在图像分析仪上测定电泳条带的灰度值,作半定量分析。未出现明确条带时,以标准的相对分子质量条带为参照,于扩增产物应出现的相应位置测定灰度值。以PDGF-B或BMP-7扩增产物与β2M扩增产物条带灰度值的比值表示组织中该细胞因子的表达水平。
, http://www.100md.com
四、统计学处理
对所得PDGF-B/β2M或BMP-7/β2M值行各组间方差分析。
结果
界膜组织中PDGF-BmRNA的表达量由高到低依次为OA滑膜、溶骨区界膜(含大量磨损颗粒)、正常松质骨、非溶骨区界膜、正常滑膜(P<0.01,图1)。BMP-7mRNA在溶骨区界膜、正常滑膜和OA滑膜中未测出表达,在非溶骨区界膜中呈不典型表达,在正常松质骨中呈明显表达(P<0.01,表1)。
表1无菌性松动假体周围界膜组织中PDGF-B
和BMP-7mRNA表达量的比较(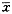 ±s)
±s)
组织来源
, http://www.100md.com
PDGFB/β2M
BMP7/β2M
溶骨区界膜
7.2967±2.7194
-
非溶骨区界膜
2.1598±0.5559
0.7928±0.1901
正常滑膜
0.3998±0.0824
-
OA滑膜
, http://www.100md.com
10.6254±3.3970
-
正常松质骨
4.4976±1.4402
7.0614±2.0572
注:与其它各组比较:P<0.01
讨论
以往认为,假体微动、应力遮挡、应力集中、对金属离子的过敏反应、手术操作、骨水泥造成的骨滋养血管损伤、骨水泥聚合反应及高温造成坏死等,均可造成人工关节假体周围无菌性骨溶解[7]。但近年来通过对X线片的观察发现,人工髋关节发生无菌性松动后假体周围骨溶解的发4生部位和严重程度与磨损颗粒自关节面等处产生后的迁移途径和易聚集部位存在一定的相关性[8]。因此,磨损颗粒激活假体-骨界面MФ,引起溶骨因子介导的破骨细胞性骨溶解在人工关节无菌性松动中的重要作用已得到普遍认同[3]。然而亦有研究表明,磨损颗粒可抑制成骨细胞活性,与网织骨形成障碍有关[9]。因此,有必要将松动假体周围界膜组织中溶骨、成骨因子的表达进行对比分析,以进一步探讨人工关节无菌性松动的生物学原因。
, http://www.100md.com
PDGF是许多间充质衍生细胞进行有丝分裂的刺激因子,其中包括骨系细胞,并对成纤维细胞(fibroblast,FB)的增殖功能具有选择性刺激作用[10]。在骨代谢方面,PDGF具有双重作用。一方面,它是有效的骨细胞有丝分裂源,可刺激成骨细胞的增殖[11];另一方面,它又参与调节破骨细胞性骨吸收,在骨修复重建过程中同样具有重要意义[12]。研究表明,PDGF的有效成分PDGF-A可能主要与骨形成有关,而主要由MФ表达的PDGF-B则对纤维组织增生和骨破坏具有重要作用[13]。目前对无菌性松动人工关节界膜中PDGFs表达c的研究尚不多见。Jiranek等[2]曾用原位杂交的方法在界膜组织中发现MФ和FB均有PDGF-BmRNA的表达,但体外研究钛合金颗粒未能引起FB分泌PDGF-AB[14]。本实验结果表明,松动假体周围界膜组织中PDGF-B在界面破骨和纤维组织增生过程中起着重要作用,而在非溶骨区和正常松质骨中也有PDGF-B的表达,提示其在骨形成后的改建过程中是不可缺少的。
, http://www.100md.com
BMP-7为TGF-β超家族的一员,与Sampath等[15]报告的成骨蛋白1(osteogenicprotein-1,OP-1)完全相同,具有BMP家族因子的多种生物学作用,如刺激成骨细胞的胶原和碱性磷酸酶合成以及前中胚层诱导等[16]。在体内,它主要诱导软骨内成骨,但在成骨中的作用机制尚未确定。鉴于无菌性松动假体周围界膜组织中BMP的表达情况目前鲜见报道,本实验采用灵敏度极高的RT-PCR技术对其中的BMP-7mRNA表达进行了检测。结果显示,非溶骨区界膜中BMP-7mRNA呈不典型表达,符合组织学观察所见即无磨损颗粒的非溶骨区界膜中可有含软骨细胞样细胞的不成熟软骨组织与假体侧纤维组织相延续并密切交织的现象。然而其表达量与正常松质骨中BMP-7mRNA的表达量相差甚远。含颗粒的溶骨区界膜中则未能测出该因子的表达,与滑膜组织的情况一致。因此,即使目前尚不能完全排除无菌性松动假体周围界膜组织中有BMP-7或其它BMP家族成员的存在,也至少提示它们在界膜,尤其在有磨损颗粒的溶骨区界膜中的表达是极微量的,不足以在界膜组织中产生骨诱导作用。
, 百拇医药
由于假体置入手术可造成骨内膜与髓腔内壁骨质或髋臼骨的损伤,与其它骨损伤一样,术后假体-骨界面应存在骨质的修复过程,即以成骨因子及其诱导的成骨作用占主导地位的骨床重建。然而,在介入的磨损颗粒刺激下,一方面,界膜组织中固有的MФ以及因诱导趋化而从血管内逸出的单核细胞(在组织中亦成熟为MФ)被激活[17],并释放多种生物活性物质,其中绝大部分有强效溶骨作用,如前列腺素E2(prostaglantinE2,PGE2)、IL-1、IL-6和TNF-α等均可刺激破骨细胞性骨吸收;另外一部分,如PDGF-B,既有溶骨效应,又有促进纤维修复的功能,从而造成骨溶解和纤维修复的交替过程。而另一方面,界膜组织中成骨因子的表达却受到抑制,如BMPs,其表达量明显低于正常骨组织。因而,假体-骨界面成骨与溶骨的优势倒置,在大量溶骨因子的介导下,经过一系列级联放大反应,最终引起骨溶解。同时,过剩的PDGF可导致持续性纤维增生,过度增生的纤维组织又进一步阻碍了假体-骨界面骨整合的发生,并造成有利于磨损颗粒继续扩散的有效关节空间[18]。本实验检测结果证实,无菌性松动假体周围界膜组织中溶骨因子和纤维修复因子PDGF-BmRNA表达量高,而成骨因子BMP-7mRNA与正常松质骨相比无表达或表达量极低。因此我们认为,松动的假体-骨界面界膜组织中溶骨因子和成骨因子分泌总体上严重失衡,故即使界膜组织中的间质细胞具备了向骨组织衍化的能力,也因局部微环境骨诱导效应的低下而不能实现,这可能是磨损颗粒造成界面骨重建受阻而溶骨大量发生的关键环节之一。
, 百拇医药
参考文献
1,Perry MJ, Mortuza FY, Ponsford FM, et al. Analysis of cell types and mediator production from tissues around loosening joint implants. Br J Rheumatol, 1995, 34:1127- 1134.
2,Jiranek WA, Machado M, Jasty M, et al. Production of cytokines around loosened cemented acetabular components: analysis with immunohistochemical techniques and in situ hybridization. J Bone Joint Surg(Am), 1993,75:863- 879.
, http://www.100md.com
3,董凡,戴尅戎.巨噬细胞介导的人工关节晚期松动.中华医学杂志,1994,74:514-516.
4,Holt CM, Francis SE, Gadsdon PA, et al. Release of platelet-derived growth factor in serum-free organ culture of human coronary artery. Cardiovasc Res,1994,28:1170- 1175.
5,Ozkaynak E, Rueger DC, Drier EA, et al. OP-1 cDNA encodes an osteogenic protein in the TGF-beta family. EMBO J,1990,9:2085- 2093.
6,林学颜,张玲.体外基因扩增(PCR)技术在医学上的应用.第1版.北京:北京医科大学,中国协和医科大学联合出版社,1993.7-43.
, 百拇医药
7,Pritchett JW. Femoral bone loss following hip replacement:a comparative study. Clin Orthop, 1995, (314):156- 161.
8,蔡谞,王继芳,胡永成,等.从骨溶解的X线特征探讨磨损颗粒与人工髋关节无菌性松动的关系.中华骨科杂志,2000,20:197-200.
9,Goodman S, Aspenberg P, Song Y, et al. Tissue ingrowth and differentiation in the bone-harvest chamber in the presence of cobalt-chromium-alloy and high-density-polyethylene particles. J Bone Joint Surg(Am), 1995, 77:1025- 1035.
, 百拇医药
10,Habenicht AJR, Calbach P, Blattner C, et al. Platelet-derived growth factor:formation and biological activities. In:Habenicht A. Growth factors, differentiation factors, and cytokines. 1st ed. Berlin Heidelberg: Springer-Verlag, 1990. 31- 52.
11,Andrew JG, Hoyland JA, Freemont AJ, et al. Platelet-derived growth factor expression in normally healing human fractures. Bone, 1995, 16:455- 460.
12,Goldring SR, Goldring MB. Cytokines and skeletal physiology. Clin Orthop, 1996, (324):13- 23.
, 百拇医药
13,Qu Z, Picou M, Dang TT, et al. Immunolocalization of basic fibroblast growth factor and platelet-derived growth factor:a during adjuvant arthritis in the Lewis rat. Am J Pathol, 1994, 145:1127- 1139.
14,Manlapaz M, Maloney WJ, Smith RL. In vitro activation of human fibroblasts by retrieved titanium alloy wear debris. J Orthop Res,1996, 14:465- 472.
15,Sampath TK, Maliakal JC, Hauschka PV, et al. Recombinant human osteogenic protein-1(hOP-1) induces new bone formation in vivo with a specific activity comparable with natural bovine osteogenic protein and stimulates osteoblast proliferation and differentiation in vitro. J Biol Chem, 1992, 267:20352- 20362.
, 百拇医药
16,Cook SD, Rueger DC. Osteogenic protein-1:biology and applications. Clin Orthop, 1996, (324):29- 38.
17,Frokjaer J, Deleuran B, Lind M, et al. Polyethylene particles stimulate monocyte chemotactic and activating factor production in synovial mononuclear cells in vivo: an immunohistochemical study in rabbits. Acta Orthop Scand, 1995, 66:303- 307.
18,Schmalzried TP, Jasty M, Harris WH. Periprosthetic bone loss in total hip arthroplasty:polyethylene wear debris and the concept of the effective joint space. J Bone Joint Surg(Am), 1992,74:849- 863.
(收稿日期:1999-10-11), 百拇医药
单位:蔡谞 王继芳 卢世璧 赵斌(解放军总医院骨科北京,100853);张笑明(解放军总医院病理科)
关键词:人工关节;血小板源生长因子;骨形态发生蛋白质类;假体失效
中华骨科杂志001110
【摘要】目的 对比研究无菌性松动假体周围界膜组织中溶骨因子和成骨因子的表达,进一步探讨磨损颗粒致界面骨溶解的生物学原因。方法 采用逆转录-聚合酶链反应(reverse transcription polymerase chain reaction, RT-PCR)和计算机图像分析的方法,分别检测溶骨区界膜(含磨损颗粒)和非溶骨区界膜中PDGF-B和BMP-7mRNA的表达量,并以正常滑膜、骨性关节炎(osteoarthritis,OA)滑膜和正常松质骨为对照。结果 界膜组织中PDGF-Bm RNA的表达量由高到低依次为OA滑膜、溶骨区界膜、正常松质骨、非溶骨区界膜、正常滑膜(P<0.01)。BMP-7 mRNA在溶骨区界膜、正常滑膜和OA滑膜中未测出表达,在非溶骨区界膜中呈不典型表达,在正常松质骨中呈明显表达(P<0.01)。结论 松动的假体-骨界面界膜组织中溶骨因子和成骨因子表达总体失衡,即使界膜中的间质细胞具备了向骨组织衍化的能力,也因局部微环境骨诱导效应的低下而不能实现,这可能是磨损颗粒造成界面骨重建受阻而溶骨大量发生的关键环节之一。
, http://www.100md.com
PDGF-B and BMP-7 mRNA expression in the interface membrane around aseptically loosened prosthesis
CAI Xu, WANG Jifang, LU Shibi, et al.
(Department of Orthopaedics, General Hospital of Chinese People's Liberation Army, Beijing 100853, China)
【 Abstract】Objective To compare the expression of osteolysis and osteogenesis cytokines in the interface membrane around aseptically loosened prosthesis for the elucidation of the biological mechanism of osteolysis caused by wear particles at bone-implant interface. Methods Reverse transcription polymerase chain reaction(RT-PCR) and computerized image processing were adopted to determine the mRNA expression of PDGF-B and BMP-7 respectively in the interface membrane(IM) at osteolysis region(with wear particles) and non-osteolysis region. Normal synovial membrane(NSM), OA synovial membrane(OASM) and normal cancellous bone(NCB) were obtained as negative or positive control. Results Expression of PDGF-B mRNA from high to low was OASM, IM at osteolysis region, NCB, IM at non-osteolysis region and NSM(P< 0.01). No BMP-7 mRNA expression in the IM at osteolysis region or NSM and OASM. Non-typical expression of BMP-7 mRNA appeared in the IM at non-osteolysis while obvious expression existed in NCB(P< 0.01). Conclusion Imbalance of expression of osteolysis cytokines and osteogenesis cytokines may be one of the key points of bone reconstruction inhibition and bone resorption at bone-implant interface under the stimulation of wear particles.
, 百拇医药
【Key words】 Joint prosthesis; Platelet-derived growth factor; Bone morphogenetic proteins; Prosthesis failure
无菌性松动人工关节假体周围骨溶解部位的界膜组织中存在多种磨损颗粒。研究表明,磨损颗粒-骨界面巨噬细胞(macrophage,MФ)-骨溶解-无菌性松动之间存在一定的内在联系,该联系的一个关键环节为MФ被磨损颗粒激活后释放的多种强效溶骨因子,如白细胞介素1(interlukin-1,IL-1)、白细胞介素6(interlukin-6,IL-6)、肿瘤坏死因子α(tumornecrosisfactor-α,TNF-α)、转化生长因子α(transforminggrowthfactor-α,TGF-α)和血小板源生长因子(platelet-derivedgrowthfactor,PDGF)等[1,2],其中PDGF-B因其同时具有促溶骨和成纤维双重作用而受到关注[3]。以往人们多注重研究磨损颗粒刺激界膜组织中溶骨因子分泌对假体松动的影响,而很少将界膜组织中成骨因子与溶骨因子的表达进行对比分析。本研究以PDGF-B和骨形态发生蛋白7(bonemorphogeneticprotein-7,BMP-7)为代表,采用逆转录-聚合酶链反应(reversetranscriptionpolymerasechainreaction,RT-PCR)的方法,对其在无菌性松动假体周围界膜组织中的表达进行初步观察。

, http://www.100md.com
图1PDGF-BmRNART-PCR扩增产物电泳条带
材料与方法
一、取材及分组
取无菌性松动人工关节翻修术时获得的溶骨区和非溶骨区界膜,设为2个实验组;另从相关手术中获取正常滑膜、骨性关节炎(osteoarthritis,OA)滑膜和正常松质骨,设为3个对照组。每组随机抽取10具标本,置-70℃保存备用。
二、引物设计与合成
根据PCR引物合成原则,用计算机设计系统测试,选定引物。
1.PDGF-B引物
意义链:5-CCGCACCAACGCCAACTTCC-3
, 百拇医药
反意链:5-TTTGGCTCGCTGCTCCTGGG-3
扩增片段长度271bp[4](美国CyberSyn公司合成)。
2.BMP-7引物
意义链:5-GGCAAGCACAACTCGGCACC-3
反意链:5-TTGGGGTTGATGCTCTGCCC-3
扩增片段长度560bp[5](美国CyberSyn公司合成)。
3.内对照β2M引物
意义链:5-CCACTGAAAAAGATGAGTAT-3
, 百拇医药
反意链:5-CTTCAACCTCCATGATGCTG-3
扩增片段长度227bp(军事医学科学院基础所合成)。
所有引物均用1×TE(Tris-EDTA)缓冲液配成20μmol/L浓度。
三、实验步骤
据文献报道的RT-PCR方法,依次进行组织总RNA提取、逆转录、cDNA合成及PCR扩增等[6]。扩增产物以质量浓度为2%的TBE(Tris-硼酸-EDTA)缓冲液作琼脂糖凝胶板电泳,等体积pBR322/HinfⅠ作为相对分子质量标准。在图像分析仪上测定电泳条带的灰度值,作半定量分析。未出现明确条带时,以标准的相对分子质量条带为参照,于扩增产物应出现的相应位置测定灰度值。以PDGF-B或BMP-7扩增产物与β2M扩增产物条带灰度值的比值表示组织中该细胞因子的表达水平。
, http://www.100md.com
四、统计学处理
对所得PDGF-B/β2M或BMP-7/β2M值行各组间方差分析。
结果
界膜组织中PDGF-BmRNA的表达量由高到低依次为OA滑膜、溶骨区界膜(含大量磨损颗粒)、正常松质骨、非溶骨区界膜、正常滑膜(P<0.01,图1)。BMP-7mRNA在溶骨区界膜、正常滑膜和OA滑膜中未测出表达,在非溶骨区界膜中呈不典型表达,在正常松质骨中呈明显表达(P<0.01,表1)。
表1无菌性松动假体周围界膜组织中PDGF-B
和BMP-7mRNA表达量的比较(
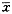 ±s)
±s)组织来源
, http://www.100md.com
PDGFB/β2M
BMP7/β2M
溶骨区界膜
7.2967±2.7194
-
非溶骨区界膜
2.1598±0.5559
0.7928±0.1901
正常滑膜
0.3998±0.0824
-
OA滑膜
, http://www.100md.com
10.6254±3.3970
-
正常松质骨
4.4976±1.4402
7.0614±2.0572
注:与其它各组比较:P<0.01
讨论
以往认为,假体微动、应力遮挡、应力集中、对金属离子的过敏反应、手术操作、骨水泥造成的骨滋养血管损伤、骨水泥聚合反应及高温造成坏死等,均可造成人工关节假体周围无菌性骨溶解[7]。但近年来通过对X线片的观察发现,人工髋关节发生无菌性松动后假体周围骨溶解的发4生部位和严重程度与磨损颗粒自关节面等处产生后的迁移途径和易聚集部位存在一定的相关性[8]。因此,磨损颗粒激活假体-骨界面MФ,引起溶骨因子介导的破骨细胞性骨溶解在人工关节无菌性松动中的重要作用已得到普遍认同[3]。然而亦有研究表明,磨损颗粒可抑制成骨细胞活性,与网织骨形成障碍有关[9]。因此,有必要将松动假体周围界膜组织中溶骨、成骨因子的表达进行对比分析,以进一步探讨人工关节无菌性松动的生物学原因。
, http://www.100md.com
PDGF是许多间充质衍生细胞进行有丝分裂的刺激因子,其中包括骨系细胞,并对成纤维细胞(fibroblast,FB)的增殖功能具有选择性刺激作用[10]。在骨代谢方面,PDGF具有双重作用。一方面,它是有效的骨细胞有丝分裂源,可刺激成骨细胞的增殖[11];另一方面,它又参与调节破骨细胞性骨吸收,在骨修复重建过程中同样具有重要意义[12]。研究表明,PDGF的有效成分PDGF-A可能主要与骨形成有关,而主要由MФ表达的PDGF-B则对纤维组织增生和骨破坏具有重要作用[13]。目前对无菌性松动人工关节界膜中PDGFs表达c的研究尚不多见。Jiranek等[2]曾用原位杂交的方法在界膜组织中发现MФ和FB均有PDGF-BmRNA的表达,但体外研究钛合金颗粒未能引起FB分泌PDGF-AB[14]。本实验结果表明,松动假体周围界膜组织中PDGF-B在界面破骨和纤维组织增生过程中起着重要作用,而在非溶骨区和正常松质骨中也有PDGF-B的表达,提示其在骨形成后的改建过程中是不可缺少的。
, http://www.100md.com
BMP-7为TGF-β超家族的一员,与Sampath等[15]报告的成骨蛋白1(osteogenicprotein-1,OP-1)完全相同,具有BMP家族因子的多种生物学作用,如刺激成骨细胞的胶原和碱性磷酸酶合成以及前中胚层诱导等[16]。在体内,它主要诱导软骨内成骨,但在成骨中的作用机制尚未确定。鉴于无菌性松动假体周围界膜组织中BMP的表达情况目前鲜见报道,本实验采用灵敏度极高的RT-PCR技术对其中的BMP-7mRNA表达进行了检测。结果显示,非溶骨区界膜中BMP-7mRNA呈不典型表达,符合组织学观察所见即无磨损颗粒的非溶骨区界膜中可有含软骨细胞样细胞的不成熟软骨组织与假体侧纤维组织相延续并密切交织的现象。然而其表达量与正常松质骨中BMP-7mRNA的表达量相差甚远。含颗粒的溶骨区界膜中则未能测出该因子的表达,与滑膜组织的情况一致。因此,即使目前尚不能完全排除无菌性松动假体周围界膜组织中有BMP-7或其它BMP家族成员的存在,也至少提示它们在界膜,尤其在有磨损颗粒的溶骨区界膜中的表达是极微量的,不足以在界膜组织中产生骨诱导作用。
, 百拇医药
由于假体置入手术可造成骨内膜与髓腔内壁骨质或髋臼骨的损伤,与其它骨损伤一样,术后假体-骨界面应存在骨质的修复过程,即以成骨因子及其诱导的成骨作用占主导地位的骨床重建。然而,在介入的磨损颗粒刺激下,一方面,界膜组织中固有的MФ以及因诱导趋化而从血管内逸出的单核细胞(在组织中亦成熟为MФ)被激活[17],并释放多种生物活性物质,其中绝大部分有强效溶骨作用,如前列腺素E2(prostaglantinE2,PGE2)、IL-1、IL-6和TNF-α等均可刺激破骨细胞性骨吸收;另外一部分,如PDGF-B,既有溶骨效应,又有促进纤维修复的功能,从而造成骨溶解和纤维修复的交替过程。而另一方面,界膜组织中成骨因子的表达却受到抑制,如BMPs,其表达量明显低于正常骨组织。因而,假体-骨界面成骨与溶骨的优势倒置,在大量溶骨因子的介导下,经过一系列级联放大反应,最终引起骨溶解。同时,过剩的PDGF可导致持续性纤维增生,过度增生的纤维组织又进一步阻碍了假体-骨界面骨整合的发生,并造成有利于磨损颗粒继续扩散的有效关节空间[18]。本实验检测结果证实,无菌性松动假体周围界膜组织中溶骨因子和纤维修复因子PDGF-BmRNA表达量高,而成骨因子BMP-7mRNA与正常松质骨相比无表达或表达量极低。因此我们认为,松动的假体-骨界面界膜组织中溶骨因子和成骨因子分泌总体上严重失衡,故即使界膜组织中的间质细胞具备了向骨组织衍化的能力,也因局部微环境骨诱导效应的低下而不能实现,这可能是磨损颗粒造成界面骨重建受阻而溶骨大量发生的关键环节之一。
, 百拇医药
参考文献
1,Perry MJ, Mortuza FY, Ponsford FM, et al. Analysis of cell types and mediator production from tissues around loosening joint implants. Br J Rheumatol, 1995, 34:1127- 1134.
2,Jiranek WA, Machado M, Jasty M, et al. Production of cytokines around loosened cemented acetabular components: analysis with immunohistochemical techniques and in situ hybridization. J Bone Joint Surg(Am), 1993,75:863- 879.
, http://www.100md.com
3,董凡,戴尅戎.巨噬细胞介导的人工关节晚期松动.中华医学杂志,1994,74:514-516.
4,Holt CM, Francis SE, Gadsdon PA, et al. Release of platelet-derived growth factor in serum-free organ culture of human coronary artery. Cardiovasc Res,1994,28:1170- 1175.
5,Ozkaynak E, Rueger DC, Drier EA, et al. OP-1 cDNA encodes an osteogenic protein in the TGF-beta family. EMBO J,1990,9:2085- 2093.
6,林学颜,张玲.体外基因扩增(PCR)技术在医学上的应用.第1版.北京:北京医科大学,中国协和医科大学联合出版社,1993.7-43.
, 百拇医药
7,Pritchett JW. Femoral bone loss following hip replacement:a comparative study. Clin Orthop, 1995, (314):156- 161.
8,蔡谞,王继芳,胡永成,等.从骨溶解的X线特征探讨磨损颗粒与人工髋关节无菌性松动的关系.中华骨科杂志,2000,20:197-200.
9,Goodman S, Aspenberg P, Song Y, et al. Tissue ingrowth and differentiation in the bone-harvest chamber in the presence of cobalt-chromium-alloy and high-density-polyethylene particles. J Bone Joint Surg(Am), 1995, 77:1025- 1035.
, 百拇医药
10,Habenicht AJR, Calbach P, Blattner C, et al. Platelet-derived growth factor:formation and biological activities. In:Habenicht A. Growth factors, differentiation factors, and cytokines. 1st ed. Berlin Heidelberg: Springer-Verlag, 1990. 31- 52.
11,Andrew JG, Hoyland JA, Freemont AJ, et al. Platelet-derived growth factor expression in normally healing human fractures. Bone, 1995, 16:455- 460.
12,Goldring SR, Goldring MB. Cytokines and skeletal physiology. Clin Orthop, 1996, (324):13- 23.
, 百拇医药
13,Qu Z, Picou M, Dang TT, et al. Immunolocalization of basic fibroblast growth factor and platelet-derived growth factor:a during adjuvant arthritis in the Lewis rat. Am J Pathol, 1994, 145:1127- 1139.
14,Manlapaz M, Maloney WJ, Smith RL. In vitro activation of human fibroblasts by retrieved titanium alloy wear debris. J Orthop Res,1996, 14:465- 472.
15,Sampath TK, Maliakal JC, Hauschka PV, et al. Recombinant human osteogenic protein-1(hOP-1) induces new bone formation in vivo with a specific activity comparable with natural bovine osteogenic protein and stimulates osteoblast proliferation and differentiation in vitro. J Biol Chem, 1992, 267:20352- 20362.
, 百拇医药
16,Cook SD, Rueger DC. Osteogenic protein-1:biology and applications. Clin Orthop, 1996, (324):29- 38.
17,Frokjaer J, Deleuran B, Lind M, et al. Polyethylene particles stimulate monocyte chemotactic and activating factor production in synovial mononuclear cells in vivo: an immunohistochemical study in rabbits. Acta Orthop Scand, 1995, 66:303- 307.
18,Schmalzried TP, Jasty M, Harris WH. Periprosthetic bone loss in total hip arthroplasty:polyethylene wear debris and the concept of the effective joint space. J Bone Joint Surg(Am), 1992,74:849- 863.
(收稿日期:1999-10-11), 百拇医药