反义寡核苷酸对正常和常压缺氧大鼠肺血流动力学的作用
作者:杜云鹏 胡清华 王建枝 王迪浔
单位:杜云鹏 胡清华 王建枝 王迪浔,同济医科大学基础医学院病理生理学教研室,武汉 430030
关键词:缺氧症;内皮素1;反义寡核苷酸;脑室注射
同济医科大学学报990401 摘要 筛选出针对内皮素-1(ET-1)前体基因反义硫代寡核苷酸片断(ETASODN),已证明ETASODN能显著抑制培养细胞ET-1的生成(P<0.05)。通过实验观察侧脑室注射该片断对常氧和常压缺氧大鼠的作用,发现缺氧性肺动脉高压大鼠下丘脑ET-1含量显著高于常氧大鼠(P<0.05);侧脑室内注ETASODN能显著降低常氧和缺氧大鼠下丘脑ET-1水平(P<0.05)、降低常氧大鼠肺动脉平均压( )(P<0.05)和降低缺氧大鼠的
)(P<0.05)和降低缺氧大鼠的 和肺血管阻力(PVR)(P<0.01),而且缺氧组大鼠下丘脑ET-1及
和肺血管阻力(PVR)(P<0.01),而且缺氧组大鼠下丘脑ET-1及 下降的幅度均显著大于常氧组大鼠,尤以两组
下降的幅度均显著大于常氧组大鼠,尤以两组 与PVR降幅差最为显著(P<0.01)。结果表明:ET-1作为中枢神经介质,参与肺血管张力的调节和缺氧性肺动脉高压的形成,ETASODN颅内注射能舒张肺血管和降低肺动脉压,有可能用于肺动脉高压的基因治疗。
与PVR降幅差最为显著(P<0.01)。结果表明:ET-1作为中枢神经介质,参与肺血管张力的调节和缺氧性肺动脉高压的形成,ETASODN颅内注射能舒张肺血管和降低肺动脉压,有可能用于肺动脉高压的基因治疗。
, 百拇医药
中图法分类号 R845.2, Q524, R331.3
Effects of ET-1 Antisense on Pulmonary Hemodynamics in the Normoxic and Hypoxic Rats
Du Yunpeng, Hu Qinghua, Wang Jianzhi et al
Department of Pathophysiology, Tongji Medical University, Wuhan 430030
Abstract Phosphorothioated antisense oligodeoxynucleotide(ASODN) targeted to preproendothelin1 was administered intracerebroventricularly in normoxic and hypoxic rats to develop a new way to prevent the process of hypoxic pulmonary arterial hypertension(HPAH). Following the administrtion of ETASODN, the changes of pulmonary hemodynamics and ET-1 levels in specific brain regions were recorded, and the effects of ETASODN on ET-1 levels were observed. It was showed that the ET-1 levels at hypothalamus in HPAH rats were higher than in normoxic ones;Injection of ETASODN decreased hypothalamus ET-1 levels in normoxic and hypoxic rats, reduced pulmonary arterial mean pressure( ) in normoxic rats, diminished pa and pulmonary vascular resistance(PVR) in hypoxic rats and the diminished amplitude of hypothalamus ET-1 levels and
) in normoxic rats, diminished pa and pulmonary vascular resistance(PVR) in hypoxic rats and the diminished amplitude of hypothalamus ET-1 levels and  in hypoxic rats were higher than in normoxic ones,especially the diminished amplitude of
in hypoxic rats were higher than in normoxic ones,especially the diminished amplitude of  and PVR were much different between the two groups. These results suggest that ET-1, as a central neurotransmitter, participated in the regulation of pulmonary vascular tension and the development of HPAH in rats, and that intracranial injection of ETASODN could relax pulmonary vessels, decreas
and PVR were much different between the two groups. These results suggest that ET-1, as a central neurotransmitter, participated in the regulation of pulmonary vascular tension and the development of HPAH in rats, and that intracranial injection of ETASODN could relax pulmonary vessels, decreas  and might be a genic tool for treating HPAH.
and might be a genic tool for treating HPAH.
, 百拇医药
Key words anoxia; endothelin1; DNA antisense; ICV
内皮素(ET)是近年发现的一种血管活性多肽,是目前所知作用最强的长效内源性血管收缩因子[1]。最近研究发现,ET广泛存在于中枢神经系统,尤其是ET-1,作为一种新的神经多肽,参与血压的调节和许多呼吸系统疾病的发病过程[2,3]。反义寡核苷酸(ASODN)是根据碱基互补原理设计的与目标靶遗传物质(DNA或RNA)特定互补的短核苷酸片段,可封闭某个靶基因的表达,治疗与该基因有关的疾病。我室设计了针对ET-1前体基因的反义硫代寡核苷酸,它可抑制培养的内皮细胞生成ET-1。为了进一步研究该片段在体内的作用,本实验观察了侧脑室注射该片段对正常和常压缺氧大鼠血流动力学及中枢部分脑区ET-1含量的作用。
1 材料与方法
1.1 ASODN的设计合成及修饰
, 百拇医药
针对猪和人ET-1前体基因第-6至第9位核苷酸,设计硫代修饰的互补反义寡核酸片段,序列为5'-ATAATCCATTCTGAA-3'(分子量4867.5),由上海生工生物工程公司合成。在上述硫代ASODN的5'端连接异硫氰酸荧光素,即为荧光标记的ASODN。
1.2 模型复制及肺循环血流动力学实验
Wistar大鼠, 雄性,体重250~300 g,按薜氏法[4]复制常压缺氧性肺动脉高压模型, 将大鼠置缺氧箱内(O2=10%,CO2=0), 箱内放置钠石灰吸收CO2, 每天缺氧8 h,每周6 d,共3周, 对照组同样生活条件饲养3周。大鼠缺氧后,乙醚麻醉下行肺动脉插管,连接换能器(CYBK型),用生理多导仪(日本光电公司产品)测定和记录肺动脉平均压( ),同步记录心电图计算心率(HR),作心阻抗血流图,按Kubicek公式计算心输出量(CO),计算肺血管阻力(PVR): PVR (kPa.S/L)=
),同步记录心电图计算心率(HR),作心阻抗血流图,按Kubicek公式计算心输出量(CO),计算肺血管阻力(PVR): PVR (kPa.S/L)= (kPa)×60/CO(L/min)。然而退出导管,结扎颈外静脉,缝合皮肤。20 min 后再乙醚麻醉,经脑立体定位仪按Konig Klippel图谱将外径0.8 mm不锈钢导管插入侧脑室固定,见透明脑脊液外流后,插入与微量注射器相连注药管,2~5 min 恒速注入ASODN 10 μl(55 μg,注药组),或生理盐水(NS)10 μl(对照组),10 min 后抽出导管,缝合头皮;饲养48 h后,乙醚麻醉下,于前次结扎的颈外静脉处插肺动脉导管,并记录上述指标。正常大鼠(注药组和对照组)的处理均同缺氧大鼠;另取正常大鼠,侧脑室注射荧光素标记ASODN 10 μl (55 μg),1 h后处死,取注射附近脑组织作冰冻切片,用荧光显微镜观察ASODN的分布和细胞摄取情况。
(kPa)×60/CO(L/min)。然而退出导管,结扎颈外静脉,缝合皮肤。20 min 后再乙醚麻醉,经脑立体定位仪按Konig Klippel图谱将外径0.8 mm不锈钢导管插入侧脑室固定,见透明脑脊液外流后,插入与微量注射器相连注药管,2~5 min 恒速注入ASODN 10 μl(55 μg,注药组),或生理盐水(NS)10 μl(对照组),10 min 后抽出导管,缝合头皮;饲养48 h后,乙醚麻醉下,于前次结扎的颈外静脉处插肺动脉导管,并记录上述指标。正常大鼠(注药组和对照组)的处理均同缺氧大鼠;另取正常大鼠,侧脑室注射荧光素标记ASODN 10 μl (55 μg),1 h后处死,取注射附近脑组织作冰冻切片,用荧光显微镜观察ASODN的分布和细胞摄取情况。
, http://www.100md.com
1.3 ET-1含量的测定
取颅内注射48 h后大鼠的脑组织分离下丘脑、脑干和小脑,称重后〔(125±5)mg〕置EP管-80℃保存,ET-1含量测定采用放免法(北京邦定公司试剂)。
1.4 统计分析
实验结果以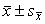 表示,以方差分析,组间t检验及直线相关分析作统计学处理。
表示,以方差分析,组间t检验及直线相关分析作统计学处理。
2 结果
2.1 缺氧大鼠肺动脉平均压的变化
大鼠常压缺氧3周后,肺动脉平均压升高, (3.89±0.06) kPa(n=14),未缺氧大鼠
(3.89±0.06) kPa(n=14),未缺氧大鼠 (2.45±0.05) kPa(n=14),两者相比,有非常显著差异(P<0.001)。
(2.45±0.05) kPa(n=14),两者相比,有非常显著差异(P<0.001)。
, 百拇医药
2.2 血流动力学指标和脑区ET-1含量的变化
ASODN颅内注射引起的各指标变化值△=注射后48 h值-注射前值。正常大鼠ASODN组△ 显著低于注NS组(P<0.05),缺氧大鼠ASODN组△
显著低于注NS组(P<0.05),缺氧大鼠ASODN组△ 和△PVR亦显著低于NS组(P<0.01)。注射ASODN后缺氧大鼠
和△PVR亦显著低于NS组(P<0.01)。注射ASODN后缺氧大鼠 和PVR降低幅度均显著大于常氧组(P<0.01),缺氧与常氧组间及注ASODN与注NS组间之HR和CO均无显著性差异(表1)。
和PVR降低幅度均显著大于常氧组(P<0.01),缺氧与常氧组间及注ASODN与注NS组间之HR和CO均无显著性差异(表1)。
表1 侧脑室注射ASODN对正常和常压缺氧大鼠血流动力学的影响(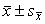 ) 项 目
) 项 目
, 百拇医药
常氧组
低氧组
NS
(n=7)
ASODN
(n=7)
NS
(n=7)
ASODN
(n=7)
△ (kPa)
(kPa)
-0.06±0.09
, 百拇医药
-0.41±0.11*
-0.27±0.09
-1.4±0.11**△△
△HR(min-1)
5.14±5.17
-3.71±5.36
-1.86±4.54
-9.43±4.71
△CO(ml/min)
-0.99±0.74
-3.59±1.28
, 百拇医药
-1.14±0.76
-3.76±1.07
△PVR(kPa.S/L)
-60.10±144.41
-337.6±239.2
-137.9±439.5
-2115.5±281.5**△△
与注生理盐水组相比 *P<0.05, **P<0.01; 与正常注药组相比△△P<0.01
ET-1标准曲线的相关系数和回归方程分别为r=0.9897;Y=3.76120.76 X。注射NS组,缺氧大鼠下丘脑ET-1含量显著高于常氧组(P<0.05), 脑干和小脑含量两组间无差异;正常大鼠ASODN组与NS组相比,下丘脑和脑干ET-1含量均显著降低(P<0.05),小脑含量无差异;缺氧大鼠ASODN组与NS组相比, 下丘脑含量显著降低(P<0.05), 脑干和小脑含量无差异(表2)。
, 百拇医药
表2 下丘脑、脑干和小脑ET-1含量的变化(pg/mg,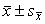 ) 项目
) 项目
n
常氧组
低氧组
NS
ASODN
NS
ASODN
下丘脑
6
8.68±0.59
, 百拇医药
2.79±0.20*
14.31±0.48
6.38±1.05*△
脑干
6
22.63±1.13
16.65±0.67*
19.03±0.68
15.41±0.43
小脑
6
, http://www.100md.com
5.53±0.60
5.51±0.59
5.77±0.25
6.41±0.22
与注生理盐水组相比 *P<0.05;与正常注药组相比 △P<0.052.3 脑室周围荧光素标记ASODN的分布
注射区和脑室周围有广泛的ASODN分布,在注射区较远处有散在分布,ASODN主要在神经细胞内(附图)。
附图 侧脑室注射荧光素标记ASODN脑室周围ASODN的分布
3 讨论
, http://www.100md.com
近十年来,ASODN作为基因治疗药物,在临床应用方面已取得重大进展,目前已有数种反义药物进入Ⅱ期临床。经过特定修饰的ASODN(如硫代修饰)具有较强的抗核酸酶活性,同时对细胞膜的穿透力增强,ASODN进入细胞后,可从基因转录和/或剪切、翻译等多个环节特异阻断目标基因的表达[5]。本室筛选出ET-1的硫代型ASODN(12 μmol/L)能显著抑制培养内皮细胞ET-1的产生,无细胞毒性。在脑脊液(CSF)中,核酸酶含量和活性均明显低于血浆,100 μmol/L ET-1 ASODN才产生细胞毒作用[6]。本实验注入10 μl(55 μg)ASODN,由于大鼠CSF总量约为1 ml,因此ASODN的浓度为11.3 μmol/L,不会产生细胞毒作用, 同时针对ET-1的ASODN经硫代修饰,可较长时间保持稳定性和完整性,应用荧光素标记ASODN显示硫代型ASODN能迅速穿透细胞膜,在细胞内发挥作用。缺氧性肺动脉高压大鼠,血浆和中枢ET-1含量明显升高[7,8],正常大鼠中枢ET-1含量与心血管功能亦明显相关[9],提示中枢ET-1参与正常和缺氧大鼠心血管功能的调节。研究发现,在中枢神经系统,ET-1有3/4分布于神经细胞,并与降钙素基因相关肽(cGRP)共存于运动神经元,与P物质(SP)共存于感觉神经元,侧脑室注射ET-1,大鼠血压、肾交感神经活性、血浆儿茶酚胺(CA)、血管加压素(AVP)水平均呈剂量依赖性增加,可被酚妥拉明和AVP受体阻断剂(TMeAVP)消除,ET-1受体拮抗剂FR139317亦能在中枢阻断ET-1上述作用[9,10]。关于ET-1的中枢机制,目前认为是作用于ETA受体,升高交感调节神经元内Ca2+浓度,增加交感活性,使血压和血浆CA水平升高,同时ET-1还可刺激神经垂体,使AVP释放增多,共同发挥升压作用[11]。
, 百拇医药
本实验常压缺氧性肺动脉高压大鼠下丘脑ET-1含量显著高于正常大鼠,提示中枢ET-1参与大鼠缺氧性肺动脉高压的形成和发展。 注入ASODN后,缺氧与常氧大鼠下丘脑ET-1含量均显著降低, 和PVR也均下降,缺氧大鼠下降幅度显著大于常氧组,提示ASODN通过抑制中枢ET-1生成对缺氧性肺动脉高压具有治疗作用。正常大鼠脑室注ASODN也使下丘脑和脑干ET-1含量及
和PVR也均下降,缺氧大鼠下降幅度显著大于常氧组,提示ASODN通过抑制中枢ET-1生成对缺氧性肺动脉高压具有治疗作用。正常大鼠脑室注ASODN也使下丘脑和脑干ET-1含量及 显著降低,提示ET-1对大鼠正常肺动脉压具中枢调节作用。小脑ET-1含量低且各组无差异,表明小脑ET-1对肺循环可能无调节作用。
显著降低,提示ET-1对大鼠正常肺动脉压具中枢调节作用。小脑ET-1含量低且各组无差异,表明小脑ET-1对肺循环可能无调节作用。
总之,本室研究的ET-1 ASODN可以抑制中枢ET-1生成,影响常氧和缺氧大鼠心血管中枢的调节,产生扩张肺血管和降肺动脉压的效果。本实验从整体实验证明ET-1 ASODN抑制ET-1生成及改善肺循环的作用,为肺动脉高压的防治提供了基因治疗的新途径。
, 百拇医药
作者简介:杜云鹏,男,1963年生,医学博士
参 考 文 献
1 Yanagisawa M. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature, 1988,332:4112 Schiffrin E L. Endothelin in hypertension. Curr Opin Cardiol, 1995,10:485
3 Chew B H, Weaver D F,Gross P M. Dose-related potent brain stimulation by the neuropeptide endothelin-1 after intraventricular administration in conscious rats. Pharmacol Biochem Behar, 1995,51:37
, 百拇医药
4 薛全福,谢剑鸣,胡长贵等.常压缺氧性肺动脉高压模型的建立.中华结核和呼吸杂志,1989,12(6):350
5 Wielbo D, Sernia C,Gyurko R et al. Antisense inhibition of hypertension in the spontaneously hypertensive rat. Hypertension, 1995,25:314
6 Keisuke M D. Inhibition of vascular contraction by intracisternal administration of preproendothelin1 mRNA antisense oligo DNA in a rat experimental vasopasm model. J Neurosurg ,1996, 85:846
7 Tjen-A-Looi S, Ekman R,Osborn J et al. Pulmonary vascular pressure effects by endothelin-1 in normal and chronic hypoxia: a longitudinal study. Am J Physiol, 1996,271(6pt2):H2246
, 百拇医药
8 Eddahibi S, Raffestin B, Braquet P et al. Pulmonary vascular reactivity to endothelin-1 in normal and chronically pulmonary hypertensive rats. J Cardi Pharm,1991,17:S358
9 Gulati A, Rebello S,Kumar A et al. Role of sympathetic nervous system in cardiovascular effects of centrally administered endothelin1 in rats. Am J Physiol,1997,273:H1177
10 Yamamoto T, Kimura T,Ota K et al. Central effects of endothelin1 on vasopressin release, blood pressure, and renal solute excretion. Am J Physiol,1992,262(6pt1):E856
11 Gulati A, Kumar A,Morrison S et al. Effect of centrally administered endothelin agonists on systemic and regional blood circulation in the rat: role of sympathetic nervous system. Neuropeptides,1997,31:301
(1998-11-09 收稿)
, 百拇医药
单位:杜云鹏 胡清华 王建枝 王迪浔,同济医科大学基础医学院病理生理学教研室,武汉 430030
关键词:缺氧症;内皮素1;反义寡核苷酸;脑室注射
同济医科大学学报990401 摘要 筛选出针对内皮素-1(ET-1)前体基因反义硫代寡核苷酸片断(ETASODN),已证明ETASODN能显著抑制培养细胞ET-1的生成(P<0.05)。通过实验观察侧脑室注射该片断对常氧和常压缺氧大鼠的作用,发现缺氧性肺动脉高压大鼠下丘脑ET-1含量显著高于常氧大鼠(P<0.05);侧脑室内注ETASODN能显著降低常氧和缺氧大鼠下丘脑ET-1水平(P<0.05)、降低常氧大鼠肺动脉平均压(
 )(P<0.05)和降低缺氧大鼠的
)(P<0.05)和降低缺氧大鼠的 和肺血管阻力(PVR)(P<0.01),而且缺氧组大鼠下丘脑ET-1及
和肺血管阻力(PVR)(P<0.01),而且缺氧组大鼠下丘脑ET-1及 下降的幅度均显著大于常氧组大鼠,尤以两组
下降的幅度均显著大于常氧组大鼠,尤以两组 与PVR降幅差最为显著(P<0.01)。结果表明:ET-1作为中枢神经介质,参与肺血管张力的调节和缺氧性肺动脉高压的形成,ETASODN颅内注射能舒张肺血管和降低肺动脉压,有可能用于肺动脉高压的基因治疗。
与PVR降幅差最为显著(P<0.01)。结果表明:ET-1作为中枢神经介质,参与肺血管张力的调节和缺氧性肺动脉高压的形成,ETASODN颅内注射能舒张肺血管和降低肺动脉压,有可能用于肺动脉高压的基因治疗。, 百拇医药
中图法分类号 R845.2, Q524, R331.3
Effects of ET-1 Antisense on Pulmonary Hemodynamics in the Normoxic and Hypoxic Rats
Du Yunpeng, Hu Qinghua, Wang Jianzhi et al
Department of Pathophysiology, Tongji Medical University, Wuhan 430030
Abstract Phosphorothioated antisense oligodeoxynucleotide(ASODN) targeted to preproendothelin1 was administered intracerebroventricularly in normoxic and hypoxic rats to develop a new way to prevent the process of hypoxic pulmonary arterial hypertension(HPAH). Following the administrtion of ETASODN, the changes of pulmonary hemodynamics and ET-1 levels in specific brain regions were recorded, and the effects of ETASODN on ET-1 levels were observed. It was showed that the ET-1 levels at hypothalamus in HPAH rats were higher than in normoxic ones;Injection of ETASODN decreased hypothalamus ET-1 levels in normoxic and hypoxic rats, reduced pulmonary arterial mean pressure(
 ) in normoxic rats, diminished pa and pulmonary vascular resistance(PVR) in hypoxic rats and the diminished amplitude of hypothalamus ET-1 levels and
) in normoxic rats, diminished pa and pulmonary vascular resistance(PVR) in hypoxic rats and the diminished amplitude of hypothalamus ET-1 levels and  in hypoxic rats were higher than in normoxic ones,especially the diminished amplitude of
in hypoxic rats were higher than in normoxic ones,especially the diminished amplitude of  and PVR were much different between the two groups. These results suggest that ET-1, as a central neurotransmitter, participated in the regulation of pulmonary vascular tension and the development of HPAH in rats, and that intracranial injection of ETASODN could relax pulmonary vessels, decreas
and PVR were much different between the two groups. These results suggest that ET-1, as a central neurotransmitter, participated in the regulation of pulmonary vascular tension and the development of HPAH in rats, and that intracranial injection of ETASODN could relax pulmonary vessels, decreas  and might be a genic tool for treating HPAH.
and might be a genic tool for treating HPAH., 百拇医药
Key words anoxia; endothelin1; DNA antisense; ICV
内皮素(ET)是近年发现的一种血管活性多肽,是目前所知作用最强的长效内源性血管收缩因子[1]。最近研究发现,ET广泛存在于中枢神经系统,尤其是ET-1,作为一种新的神经多肽,参与血压的调节和许多呼吸系统疾病的发病过程[2,3]。反义寡核苷酸(ASODN)是根据碱基互补原理设计的与目标靶遗传物质(DNA或RNA)特定互补的短核苷酸片段,可封闭某个靶基因的表达,治疗与该基因有关的疾病。我室设计了针对ET-1前体基因的反义硫代寡核苷酸,它可抑制培养的内皮细胞生成ET-1。为了进一步研究该片段在体内的作用,本实验观察了侧脑室注射该片段对正常和常压缺氧大鼠血流动力学及中枢部分脑区ET-1含量的作用。
1 材料与方法
1.1 ASODN的设计合成及修饰
, 百拇医药
针对猪和人ET-1前体基因第-6至第9位核苷酸,设计硫代修饰的互补反义寡核酸片段,序列为5'-ATAATCCATTCTGAA-3'(分子量4867.5),由上海生工生物工程公司合成。在上述硫代ASODN的5'端连接异硫氰酸荧光素,即为荧光标记的ASODN。
1.2 模型复制及肺循环血流动力学实验
Wistar大鼠, 雄性,体重250~300 g,按薜氏法[4]复制常压缺氧性肺动脉高压模型, 将大鼠置缺氧箱内(O2=10%,CO2=0), 箱内放置钠石灰吸收CO2, 每天缺氧8 h,每周6 d,共3周, 对照组同样生活条件饲养3周。大鼠缺氧后,乙醚麻醉下行肺动脉插管,连接换能器(CYBK型),用生理多导仪(日本光电公司产品)测定和记录肺动脉平均压(
 ),同步记录心电图计算心率(HR),作心阻抗血流图,按Kubicek公式计算心输出量(CO),计算肺血管阻力(PVR): PVR (kPa.S/L)=
),同步记录心电图计算心率(HR),作心阻抗血流图,按Kubicek公式计算心输出量(CO),计算肺血管阻力(PVR): PVR (kPa.S/L)= (kPa)×60/CO(L/min)。然而退出导管,结扎颈外静脉,缝合皮肤。20 min 后再乙醚麻醉,经脑立体定位仪按Konig Klippel图谱将外径0.8 mm不锈钢导管插入侧脑室固定,见透明脑脊液外流后,插入与微量注射器相连注药管,2~5 min 恒速注入ASODN 10 μl(55 μg,注药组),或生理盐水(NS)10 μl(对照组),10 min 后抽出导管,缝合头皮;饲养48 h后,乙醚麻醉下,于前次结扎的颈外静脉处插肺动脉导管,并记录上述指标。正常大鼠(注药组和对照组)的处理均同缺氧大鼠;另取正常大鼠,侧脑室注射荧光素标记ASODN 10 μl (55 μg),1 h后处死,取注射附近脑组织作冰冻切片,用荧光显微镜观察ASODN的分布和细胞摄取情况。
(kPa)×60/CO(L/min)。然而退出导管,结扎颈外静脉,缝合皮肤。20 min 后再乙醚麻醉,经脑立体定位仪按Konig Klippel图谱将外径0.8 mm不锈钢导管插入侧脑室固定,见透明脑脊液外流后,插入与微量注射器相连注药管,2~5 min 恒速注入ASODN 10 μl(55 μg,注药组),或生理盐水(NS)10 μl(对照组),10 min 后抽出导管,缝合头皮;饲养48 h后,乙醚麻醉下,于前次结扎的颈外静脉处插肺动脉导管,并记录上述指标。正常大鼠(注药组和对照组)的处理均同缺氧大鼠;另取正常大鼠,侧脑室注射荧光素标记ASODN 10 μl (55 μg),1 h后处死,取注射附近脑组织作冰冻切片,用荧光显微镜观察ASODN的分布和细胞摄取情况。, http://www.100md.com
1.3 ET-1含量的测定
取颅内注射48 h后大鼠的脑组织分离下丘脑、脑干和小脑,称重后〔(125±5)mg〕置EP管-80℃保存,ET-1含量测定采用放免法(北京邦定公司试剂)。
1.4 统计分析
实验结果以
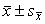 表示,以方差分析,组间t检验及直线相关分析作统计学处理。
表示,以方差分析,组间t检验及直线相关分析作统计学处理。2 结果
2.1 缺氧大鼠肺动脉平均压的变化
大鼠常压缺氧3周后,肺动脉平均压升高,
 (3.89±0.06) kPa(n=14),未缺氧大鼠
(3.89±0.06) kPa(n=14),未缺氧大鼠 (2.45±0.05) kPa(n=14),两者相比,有非常显著差异(P<0.001)。
(2.45±0.05) kPa(n=14),两者相比,有非常显著差异(P<0.001)。, 百拇医药
2.2 血流动力学指标和脑区ET-1含量的变化
ASODN颅内注射引起的各指标变化值△=注射后48 h值-注射前值。正常大鼠ASODN组△
 显著低于注NS组(P<0.05),缺氧大鼠ASODN组△
显著低于注NS组(P<0.05),缺氧大鼠ASODN组△ 和△PVR亦显著低于NS组(P<0.01)。注射ASODN后缺氧大鼠
和△PVR亦显著低于NS组(P<0.01)。注射ASODN后缺氧大鼠 和PVR降低幅度均显著大于常氧组(P<0.01),缺氧与常氧组间及注ASODN与注NS组间之HR和CO均无显著性差异(表1)。
和PVR降低幅度均显著大于常氧组(P<0.01),缺氧与常氧组间及注ASODN与注NS组间之HR和CO均无显著性差异(表1)。表1 侧脑室注射ASODN对正常和常压缺氧大鼠血流动力学的影响(
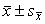 ) 项 目
) 项 目, 百拇医药
常氧组
低氧组
NS
(n=7)
ASODN
(n=7)
NS
(n=7)
ASODN
(n=7)
△
 (kPa)
(kPa)-0.06±0.09
, 百拇医药
-0.41±0.11*
-0.27±0.09
-1.4±0.11**△△
△HR(min-1)
5.14±5.17
-3.71±5.36
-1.86±4.54
-9.43±4.71
△CO(ml/min)
-0.99±0.74
-3.59±1.28
, 百拇医药
-1.14±0.76
-3.76±1.07
△PVR(kPa.S/L)
-60.10±144.41
-337.6±239.2
-137.9±439.5
-2115.5±281.5**△△
与注生理盐水组相比 *P<0.05, **P<0.01; 与正常注药组相比△△P<0.01
ET-1标准曲线的相关系数和回归方程分别为r=0.9897;Y=3.76120.76 X。注射NS组,缺氧大鼠下丘脑ET-1含量显著高于常氧组(P<0.05), 脑干和小脑含量两组间无差异;正常大鼠ASODN组与NS组相比,下丘脑和脑干ET-1含量均显著降低(P<0.05),小脑含量无差异;缺氧大鼠ASODN组与NS组相比, 下丘脑含量显著降低(P<0.05), 脑干和小脑含量无差异(表2)。
, 百拇医药
表2 下丘脑、脑干和小脑ET-1含量的变化(pg/mg,
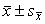 ) 项目
) 项目n
常氧组
低氧组
NS
ASODN
NS
ASODN
下丘脑
6
8.68±0.59
, 百拇医药
2.79±0.20*
14.31±0.48
6.38±1.05*△
脑干
6
22.63±1.13
16.65±0.67*
19.03±0.68
15.41±0.43
小脑
6
, http://www.100md.com
5.53±0.60
5.51±0.59
5.77±0.25
6.41±0.22
与注生理盐水组相比 *P<0.05;与正常注药组相比 △P<0.052.3 脑室周围荧光素标记ASODN的分布
注射区和脑室周围有广泛的ASODN分布,在注射区较远处有散在分布,ASODN主要在神经细胞内(附图)。

附图 侧脑室注射荧光素标记ASODN脑室周围ASODN的分布
3 讨论
, http://www.100md.com
近十年来,ASODN作为基因治疗药物,在临床应用方面已取得重大进展,目前已有数种反义药物进入Ⅱ期临床。经过特定修饰的ASODN(如硫代修饰)具有较强的抗核酸酶活性,同时对细胞膜的穿透力增强,ASODN进入细胞后,可从基因转录和/或剪切、翻译等多个环节特异阻断目标基因的表达[5]。本室筛选出ET-1的硫代型ASODN(12 μmol/L)能显著抑制培养内皮细胞ET-1的产生,无细胞毒性。在脑脊液(CSF)中,核酸酶含量和活性均明显低于血浆,100 μmol/L ET-1 ASODN才产生细胞毒作用[6]。本实验注入10 μl(55 μg)ASODN,由于大鼠CSF总量约为1 ml,因此ASODN的浓度为11.3 μmol/L,不会产生细胞毒作用, 同时针对ET-1的ASODN经硫代修饰,可较长时间保持稳定性和完整性,应用荧光素标记ASODN显示硫代型ASODN能迅速穿透细胞膜,在细胞内发挥作用。缺氧性肺动脉高压大鼠,血浆和中枢ET-1含量明显升高[7,8],正常大鼠中枢ET-1含量与心血管功能亦明显相关[9],提示中枢ET-1参与正常和缺氧大鼠心血管功能的调节。研究发现,在中枢神经系统,ET-1有3/4分布于神经细胞,并与降钙素基因相关肽(cGRP)共存于运动神经元,与P物质(SP)共存于感觉神经元,侧脑室注射ET-1,大鼠血压、肾交感神经活性、血浆儿茶酚胺(CA)、血管加压素(AVP)水平均呈剂量依赖性增加,可被酚妥拉明和AVP受体阻断剂(TMeAVP)消除,ET-1受体拮抗剂FR139317亦能在中枢阻断ET-1上述作用[9,10]。关于ET-1的中枢机制,目前认为是作用于ETA受体,升高交感调节神经元内Ca2+浓度,增加交感活性,使血压和血浆CA水平升高,同时ET-1还可刺激神经垂体,使AVP释放增多,共同发挥升压作用[11]。
, 百拇医药
本实验常压缺氧性肺动脉高压大鼠下丘脑ET-1含量显著高于正常大鼠,提示中枢ET-1参与大鼠缺氧性肺动脉高压的形成和发展。 注入ASODN后,缺氧与常氧大鼠下丘脑ET-1含量均显著降低,
 和PVR也均下降,缺氧大鼠下降幅度显著大于常氧组,提示ASODN通过抑制中枢ET-1生成对缺氧性肺动脉高压具有治疗作用。正常大鼠脑室注ASODN也使下丘脑和脑干ET-1含量及
和PVR也均下降,缺氧大鼠下降幅度显著大于常氧组,提示ASODN通过抑制中枢ET-1生成对缺氧性肺动脉高压具有治疗作用。正常大鼠脑室注ASODN也使下丘脑和脑干ET-1含量及 显著降低,提示ET-1对大鼠正常肺动脉压具中枢调节作用。小脑ET-1含量低且各组无差异,表明小脑ET-1对肺循环可能无调节作用。
显著降低,提示ET-1对大鼠正常肺动脉压具中枢调节作用。小脑ET-1含量低且各组无差异,表明小脑ET-1对肺循环可能无调节作用。总之,本室研究的ET-1 ASODN可以抑制中枢ET-1生成,影响常氧和缺氧大鼠心血管中枢的调节,产生扩张肺血管和降肺动脉压的效果。本实验从整体实验证明ET-1 ASODN抑制ET-1生成及改善肺循环的作用,为肺动脉高压的防治提供了基因治疗的新途径。
, 百拇医药
作者简介:杜云鹏,男,1963年生,医学博士
参 考 文 献
1 Yanagisawa M. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature, 1988,332:4112 Schiffrin E L. Endothelin in hypertension. Curr Opin Cardiol, 1995,10:485
3 Chew B H, Weaver D F,Gross P M. Dose-related potent brain stimulation by the neuropeptide endothelin-1 after intraventricular administration in conscious rats. Pharmacol Biochem Behar, 1995,51:37
, 百拇医药
4 薛全福,谢剑鸣,胡长贵等.常压缺氧性肺动脉高压模型的建立.中华结核和呼吸杂志,1989,12(6):350
5 Wielbo D, Sernia C,Gyurko R et al. Antisense inhibition of hypertension in the spontaneously hypertensive rat. Hypertension, 1995,25:314
6 Keisuke M D. Inhibition of vascular contraction by intracisternal administration of preproendothelin1 mRNA antisense oligo DNA in a rat experimental vasopasm model. J Neurosurg ,1996, 85:846
7 Tjen-A-Looi S, Ekman R,Osborn J et al. Pulmonary vascular pressure effects by endothelin-1 in normal and chronic hypoxia: a longitudinal study. Am J Physiol, 1996,271(6pt2):H2246
, 百拇医药
8 Eddahibi S, Raffestin B, Braquet P et al. Pulmonary vascular reactivity to endothelin-1 in normal and chronically pulmonary hypertensive rats. J Cardi Pharm,1991,17:S358
9 Gulati A, Rebello S,Kumar A et al. Role of sympathetic nervous system in cardiovascular effects of centrally administered endothelin1 in rats. Am J Physiol,1997,273:H1177
10 Yamamoto T, Kimura T,Ota K et al. Central effects of endothelin1 on vasopressin release, blood pressure, and renal solute excretion. Am J Physiol,1992,262(6pt1):E856
11 Gulati A, Kumar A,Morrison S et al. Effect of centrally administered endothelin agonists on systemic and regional blood circulation in the rat: role of sympathetic nervous system. Neuropeptides,1997,31:301
(1998-11-09 收稿)
, 百拇医药