茶多酚对小鼠肿瘤L2细胞DNA引物酶-多聚酶α复合体活性的抑制作用
作者:郝东磊 谢冰芬 刘宗潮 朱孝峰 冯公侃 潘启超
单位:郝东磊 谢冰芬 刘宗潮 朱孝峰(中山医科大学肿瘤防治中心,广东 广州 510060);冯公侃 潘启超(中山医科大学肿瘤防治中心,广东 广州 510060)
关键词:
癌症000403
【摘要】目的:探讨茶多酚的抗癌作用机理。方法:应用DE-52和P-11层析柱分离小鼠肿瘤L2细胞DNA引物酶-多聚酶α复合体,并通过闪烁计数仪测定茶多酚对DNA引物酶的影响。结果:茶多酚对小鼠肿瘤L2细胞DNA引物酶-多聚酶α复合体活性有抑制作用,半数抑制浓度(IC50)值为20.28(15.17~27.13)μg/ml;对DNA引物合成有促进作用;对引物延长亦有明显抑制作用,其IC50值为36.43μg/ml。结论:茶多酚对DNA引物酶-多聚酶α复合体和引物延长活性有抑制作用,DNA引物酶-多聚酶α复合体是茶多酚的靶点之一。
, 百拇医药
中图分类号:R979.1 文献标识码:A 文章编号:1000-467X(2000)04-0314-03
Inhibition effect of tea polyphenol on the activity of DNA primase-polymerase α complex from tumor L2 cells in mice
HAO Dong-lei XIE Bing-fen LIU Zong-chao et al.
(Cancer Institute, Sun Yet-sen University of Medical Sciences, Guangzhou 510060,P.R.China)
【Abstract】 Objective: To investigate the mechanism of antitumor action of tea polyphenol (TP). Methods: DNA primase-polymerase α complex was extracted from mice tumor cell line L2. The crude enzyme was loaded on DE-52 column and P-11 column,sequentially, to obtain partial purified enzyme.Effect of TP on DNA primase-polymerase α complex activity was examined using Liquid Scintillation counter. Results:It showed that IC50 value of TP inhibiting DNA primase-polymerase α complex activity was 20.28 (15.17~ 27.13) μ g/ml. TP could promote DNA primer synthesis but inhibit DNA primer extension. IC50 value of TP inhibiting DNA primer extension was 36.43 (12.55~ 105.25)μ g/ml. Conclusion: TP was shown to have inhibitory effect on activity of DNA primase-polymerase α complex and primer extention. DNA primase-polymerase α complex may be one of the target of TP.
, 百拇医药
Key words: Tea polyphenol(TP); Tumor cells; DNA primase; Inhibitory effect
DNA引物酶在DNA复制中起着非常重要的作用,它负责DNA链的启动。DNA复制首先合成一段引物,然后供DNA多聚酶α来延长DNA链[1]。而DNA引物酶与多聚酶α是以复合体形式存在于细胞核中,不管用什么方法提取,得到的DNA引物酶仍然是与多聚酶α结合在一起的复合体[2]。肿瘤细胞中DNA复制活跃,引物酶活性明显高于正常细胞[3]。先前研究表明,茶多酚(teapolyphenol,TP)和毛叶茶提取物及龙井茶提取物具有抗癌作用[4,5]。亦证明毛叶茶和龙井茶提取物对DNA引物酶-多聚酶α复合体活性有抑制作用[6]。TP是绿茶中提取的多酚类物质,是茶叶的主要活性成分,对DNA引物酶-多聚酶α复合体活性的作用如何,国内外尚未见报道。本文研究茶多酚对DNA引物酶-多聚酶α复合体活性等的影响,为茶多酚可能的抗癌作用机理提供理论依据。
, http://www.100md.com
1 材料和方法
1.1实验材料
TP是黄褐色粉末,总儿茶素的最小含量为60%,Sigma公司产品,临用前用三蒸水配制,调pH为7.4。实验用昆明种小鼠,购自中山医科大学动物中心,合格证号:粤检证字96A53;小鼠网织
细胞肉瘤(L2)腹水型,由本科室传代。DEAE-cellulise(DE-52)为Serva公司产品,Phosphocellulose(P-11)为Whatman公司产品,Dithiothreitol(DTT)为Promeger公司产品。Poly(dT)、激活小牛胸腺DNA、ATP为Sigma公司产品,BSA、PMSF、乙酸纤维素膜、dTTP、dCTP、dGTP均为国内购买。3H-dATP为中科院上海技术开发公司产品,比活为962GBq/毫克分子、放射性浓度37GBq/L;α-32P-ATP为Amersham公司产品,放射性浓度37GBq/L。闪烁计数仪为Beckman公司产品,型号LS6500。
, http://www.100md.com
1.2实验方法
1.2.1 DNA引物酶-多聚酶α复合体的分离和提取[7]:抽取接种7~9天的小鼠肿瘤L2腹水,2000rpm离心5min,分别用PBS洗涤2次,再2000rpm离心5min,以下步骤均在4℃中进行。取上述细胞10ml(约10克),加入30mlbufferA(含50mmol/LTris-HClpH7.5,1mmol/LDTT,0.1mmol/LEDTA,0.1mmol/LPMSF)混匀,用18A超声破碎器作用1.5min,停1min,共5次。细胞破碎液于4℃下18000rpm×30min恒温匀速离心,取上清液(此液含粗酶)。
取上述粗酶液上样于预先用bufferB(50mmol/LTris-HClpH7.2,20mmol/LKCl,0.1mmol/LEDTA,20%甘油)平衡过的DE-52柱(30ml)用60mlbufferB洗之,再用20mlbufferB和20mlbufferC(50mmol/LTris-HClpH7.2,300mmol/LKCl,0.1mmol/LEDTA,20%甘油)作线性梯度洗脱,共收集22管,每管2ml,检测各管的蛋白含量,测定各管的酶活性。收集有酶活性部分,混合加入预先用bufferD(50mmol/LTris-HClpH7.2,150mmol/LKCl,1mmol/LDTT,30%甘油)平衡过的P-11柱,用50mlbufferD洗之,再用10mlbufferD和10mlbufferE(50mmol/LTris-HClpH7.2,400mmol/LKCl,1mmol/LDTT,30%甘油)作线性梯度洗脱,共收集11管,每管2ml,测定酶活性,收集有酶活性部分,并于-70℃保存备用。
, 百拇医药
1.2.2 引物酶活性的测定[7]:酶反应液含50mmol/LTris-HClpH7.2,0.1%
PEG6000,0.1mg/mlBSA,3mmol/LDTT,6mmol/LMgCl2,10%甘油,33.3μg/mlPoly(dT),2mmol/LATP,5μl1mci/ml3H-dATP。取上述反应液30μl分装各测定管,每一管再加入待测的酶液3μl,37℃水浴30分钟,然后加入EDTA至10mmol/L终止反应,转移至乙酸纤维素薄膜上晾干。留一管不漂洗用于测定总cpm数,其余均用5%三氯乙酸漂洗3min×2次,再用95%乙醇漂洗2min×2次,晾干,放入内有5ml闪烁液的测定瓶中,在LKB液闪仪中检测cpm数。以每聚合1pmoldATP为一个酶活性单位。
1.2.3 TP对DNA引物酶-多聚酶α复合体活性的影响[2]:取上述酶反应液30μl/每管,设对照管和实验管,实验管中加入不同浓度的TP,使TP的最终浓度分别为7.81μg/ml、15.63μg/ml、31.25μg/ml、62.5μg/ml和125μg/ml。各组均设2个平行管,各管加入酶3μl,充分混匀,其他步骤与1.2.2同,测定各管的放射性活度cpm数。按如下公式计算TP对酶活性的抑制率。
, http://www.100md.com
再按Litchfield&WilcoxonI(46)计算半数抑制浓度(IC50)。
1.2.4 TP对DNA引物合成的影响[2,8]:酶反应液与酶活性检测液基本相同。不同的是以α-
32P-ATP取代3H-dATP。每管含酶反应液30μl,加入TP液使其最终浓度分别为7.81μg/ml、15.63μg/ml、31.25μg/ml、62.5μg/ml和125μg/ml,每管加上酶液3μl,在37℃水浴中30分钟,以下步骤同前1.2.2项。根据各的管cpm数再按如下公式计算TP对引物合成的影响。
1.2.5 TP对DNA引物延长的影响[2]:以激活小牛胸腺DNA为模板引物,3H-dATP为底物进行检测。反应液(50μl)含50mmol/LTris-HClpH8.5,5mmol/LMgCl2,75mmol/LKCl,1mmol/LDTT,0.1mg/mlBSA,100μmol/LdGTP,100μmol/LdTTP,100μmol/LdCTP,3.7GBq/L3H-dATP,200μg/ml激活的小牛胸腺DNA。酶反应液中依次加入上述不同浓度的TP和酶液4.5μl,其他步骤同1.2.3。根据cpm数计算引物延长的抑制率及其IC50。
, http://www.100md.com
2 实验结果
2.1TP对DNA引物酶-多聚酶α复合体活性的抑制作用
在TP7.81μg/ml、15.63μg/ml、31.25μg/ml、62.5μg/ml和125μg/ml浓度作用下对DNA引物酶-多聚酶α复合体活性的抑制作用见表1,其平均抑制率分别为29.8%、47.6%、63.8%、66.4%和74.8%。IC50及95%可信区间为20.28(15.17,27.13)μg/ml。可见随TP浓度增加,酶抑制率亦逐渐增加,各浓度抑制率相关检测r=0.9152,P<0.0001
表1 不同浓度的TP对DNA引物酶-多聚酶α复合体活性的抑制率(IR%) 实验次数
TP作用浓度(μg/ml)
7.81
, http://www.100md.com
15.63
31.25
62.5
125
1
32.1
39.3
59.4
61.0
70.1
2
25.5
57.4
, 百拇医药
69.4
72.4
82.3
3
31.9
46.2
62.1
65.8
72.1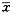 ±s(%)
±s(%)
29.8±3.7
47.6±7.4
63.8±5.4
, http://www.100md.com
66.4±4.6
74.8±6.5
2.2TP对DNA引物合成的影响
从表2可见,TP在7.81μg/ml、15.63μg/ml、31.25μg/ml、62.5μg/ml和125μg/ml浓度作用下,引物合成的平均促进率分别为116.1%、209.2%、280.6%、298.3%和390.6%。结果表明TP对DNA引物合成有促进作用,随TP浓度增加,促进率也增加,各浓度抑制率相关检测r=0.9324,P<0.0001表2 不同浓度的TP对DNA引物合成的促进率(promotiverate,PR%) 实验次数
TP作用浓度(μg/ml)
7.81
15.63
, 百拇医药
31.25
62.5
125
1
115.3
212.6
266.1
281.5
395.2
2
105.2
217.1
345.2
, 百拇医药
347.9
422.3
3
127.9
197.9
230.6
265.5
354.3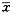 ±s(%)
±s(%)
116.111.4
209.2±9.9
280.6±
, http://www.100md.com
298.3±43.7
390.6±34.3
2.3TP对DNA引物延长的影响
从表3可见,TP在7.81μg/ml、15.63μg/ml、31.25μg/ml、62.5μg/ml和125μg/ml浓度作用下,对引物延长的平均抑制率分别为7.1%、49.2%、52.2%、61.6%和72.7%,IC50值及95%可信区间为36.43(12.55,105.75)μg/ml。该结果显示,TP对DNA引物延长有抑制作用,其抑制作用随TP浓度的增加而增强,各浓度抑制率相关检测r=0.9069,P<0.0001表3 不同浓度的TP对DNA引物延长的抑制率(IR%) 实验次数
TP作用浓度(μg/ml)
7.81
, 百拇医药
15.63
31.25
62.5
125
1
5.7
49.7
51.3
60.1
70.3
2
8.3
46.2
, 百拇医药
50.3
59.8
71.5
3
7.3
51.8
54.7
64.7
76.4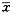 ±s(%)
±s(%)
7.1±1.3
49.2±2.8
52.2±2.2
, 百拇医药
61.6±2.7
72.7±3.3
3 讨论
先前研究证明绿茶提取物对多种人癌细胞有细胞毒作用,体内有抗小鼠移植性肿瘤的作用[5];TP对小鼠移植肿瘤和裸鼠移植人肺癌有抗瘤作用。本结果又表明,TP对小鼠L2细胞DNA引物酶-多聚酶α复合体活性有抑制作用,对DNA引物延长有明显抑制作用,而对DNA引物的合成有促进作用。因为DNA引物酶-多聚酶α复合体具有引物合成和引物延长的两种活性,而DNA复制首先要通过DNA拓扑异构酶Ⅱ来解旋,然后由DNA引物酶-多聚酶α复合体启动,合成一段7~10个核苷酸的RNA引物,再由多聚酶α聚合dNTP来完成引物的延长[9]。TP对DNA引物酶-多聚酶α复合体活性的抑制,即是抑制了DNA引物的合成或链的延长,使DNA合成受抑制[10],从而阻止肿瘤细胞的繁殖,这可能是其抗瘤作用机理之一,即DNA引物酶-多聚酶α复合体可能是TP的靶酶。至于TP既能抑制引物的延长,又能促进引物的合成,其抑制作用和促进作用是否同一种物质起作用,尚未清楚,因为茶多酚中80%左右虽均为儿茶素组成,但尚有20%的其他物质如黄酮、黄酮醇及花色素类等物质,对本酶各活性起作用的是哪种成份,因目前国内外尚未见有关的报道,有待进一步探讨。
, http://www.100md.com
基金项目:本课题受国家自然科学基金(N0:39370800)、国家“九五”攻关研究项目(
No:96-906-01-03)及中山医科大学“211工程”重点学科基金(No:98069)资助
通讯作者:谢冰芬 Tel:86-20-87765368-7333
[参考文献]
[1]Catapano CV, Perrino FW, Fernandes DJ. Primer RNA chain termination induced by 9-beta-D-
arabinofuranosyl-2-fluoroadenine 5
-triphosphate [J]. J Biol Chem, 1993, 268: 7179~ 7185.
, 百拇医药
[2]Kuchta RD, Reid B, Chang LM, et al. DNA primase:Processivity and the primase to polymerase
alpha activity switch [J]. J Bio Chem, 1990, 265: 16158~ 16165.
[3]Kuchta RD, Ilsley D,Kravig KD,et al. Inhibition of DNA primase and polymerase alpha by arabino
furanosylnucleoside triphosphates and related compounds [J].Biochemistry,1992,31:4720~ 4728.
[4]谢冰芬,郝东磊,刘宗潮,等.茶多酚的细胞毒作用和抗瘤作用研究[J].癌症,1998,17(6):418~420.
, 百拇医药
[5]谢冰芬,刘宗潮,潘启超,等.毛叶茶和龙井茶提取物的抗瘤作用及对DNA拓扑异构酶II的抑制
作用[J].癌症,1991,11(6):424~428.
[6]朱孝峰,刘宗潮,潘启超,等.绿茶提取物对肿瘤细胞DNA引物酶多聚酶α复合体活性的影响[J].
癌症,1997,16(3):161~164.
[7]朱孝峰,刘宗潮,谢冰芬,等.DNA引物酶的提取分离与引物合成活性的研究[J].中山医科大学
学报,1997,18(4):279~281.
[8]Chang LM,Rafter E,Augl C,et al. Purification of a DNA polymerase-DNA primase complex from calf thymus
, 百拇医药
glands [J]. J. Biol Chem, 1984, 259 (23): 14679~ 14687.
[9]Sheaff RJ,Kuchta RD,Ilsley D. Calf thymus DNA polymerase α -primase:“ communication” and
primertemplate movement between the two active sites [J]. Biochemistry, 1994, 3: 2247~ 2254.
[10]Nasheuer HP, Grosse F. DNA polymerase α -primase from calf thymus [J]. J Biol Chem, 1988,263: 8981~ 8983.
收稿日期:1999-08-11
修回日期:1999-09-17, 百拇医药
单位:郝东磊 谢冰芬 刘宗潮 朱孝峰(中山医科大学肿瘤防治中心,广东 广州 510060);冯公侃 潘启超(中山医科大学肿瘤防治中心,广东 广州 510060)
关键词:
癌症000403
【摘要】目的:探讨茶多酚的抗癌作用机理。方法:应用DE-52和P-11层析柱分离小鼠肿瘤L2细胞DNA引物酶-多聚酶α复合体,并通过闪烁计数仪测定茶多酚对DNA引物酶的影响。结果:茶多酚对小鼠肿瘤L2细胞DNA引物酶-多聚酶α复合体活性有抑制作用,半数抑制浓度(IC50)值为20.28(15.17~27.13)μg/ml;对DNA引物合成有促进作用;对引物延长亦有明显抑制作用,其IC50值为36.43μg/ml。结论:茶多酚对DNA引物酶-多聚酶α复合体和引物延长活性有抑制作用,DNA引物酶-多聚酶α复合体是茶多酚的靶点之一。
, 百拇医药
中图分类号:R979.1 文献标识码:A 文章编号:1000-467X(2000)04-0314-03
Inhibition effect of tea polyphenol on the activity of DNA primase-polymerase α complex from tumor L2 cells in mice
HAO Dong-lei XIE Bing-fen LIU Zong-chao et al.
(Cancer Institute, Sun Yet-sen University of Medical Sciences, Guangzhou 510060,P.R.China)
【Abstract】 Objective: To investigate the mechanism of antitumor action of tea polyphenol (TP). Methods: DNA primase-polymerase α complex was extracted from mice tumor cell line L2. The crude enzyme was loaded on DE-52 column and P-11 column,sequentially, to obtain partial purified enzyme.Effect of TP on DNA primase-polymerase α complex activity was examined using Liquid Scintillation counter. Results:It showed that IC50 value of TP inhibiting DNA primase-polymerase α complex activity was 20.28 (15.17~ 27.13) μ g/ml. TP could promote DNA primer synthesis but inhibit DNA primer extension. IC50 value of TP inhibiting DNA primer extension was 36.43 (12.55~ 105.25)μ g/ml. Conclusion: TP was shown to have inhibitory effect on activity of DNA primase-polymerase α complex and primer extention. DNA primase-polymerase α complex may be one of the target of TP.
, 百拇医药
Key words: Tea polyphenol(TP); Tumor cells; DNA primase; Inhibitory effect
DNA引物酶在DNA复制中起着非常重要的作用,它负责DNA链的启动。DNA复制首先合成一段引物,然后供DNA多聚酶α来延长DNA链[1]。而DNA引物酶与多聚酶α是以复合体形式存在于细胞核中,不管用什么方法提取,得到的DNA引物酶仍然是与多聚酶α结合在一起的复合体[2]。肿瘤细胞中DNA复制活跃,引物酶活性明显高于正常细胞[3]。先前研究表明,茶多酚(teapolyphenol,TP)和毛叶茶提取物及龙井茶提取物具有抗癌作用[4,5]。亦证明毛叶茶和龙井茶提取物对DNA引物酶-多聚酶α复合体活性有抑制作用[6]。TP是绿茶中提取的多酚类物质,是茶叶的主要活性成分,对DNA引物酶-多聚酶α复合体活性的作用如何,国内外尚未见报道。本文研究茶多酚对DNA引物酶-多聚酶α复合体活性等的影响,为茶多酚可能的抗癌作用机理提供理论依据。
, http://www.100md.com
1 材料和方法
1.1实验材料
TP是黄褐色粉末,总儿茶素的最小含量为60%,Sigma公司产品,临用前用三蒸水配制,调pH为7.4。实验用昆明种小鼠,购自中山医科大学动物中心,合格证号:粤检证字96A53;小鼠网织
细胞肉瘤(L2)腹水型,由本科室传代。DEAE-cellulise(DE-52)为Serva公司产品,Phosphocellulose(P-11)为Whatman公司产品,Dithiothreitol(DTT)为Promeger公司产品。Poly(dT)、激活小牛胸腺DNA、ATP为Sigma公司产品,BSA、PMSF、乙酸纤维素膜、dTTP、dCTP、dGTP均为国内购买。3H-dATP为中科院上海技术开发公司产品,比活为962GBq/毫克分子、放射性浓度37GBq/L;α-32P-ATP为Amersham公司产品,放射性浓度37GBq/L。闪烁计数仪为Beckman公司产品,型号LS6500。
, http://www.100md.com
1.2实验方法
1.2.1 DNA引物酶-多聚酶α复合体的分离和提取[7]:抽取接种7~9天的小鼠肿瘤L2腹水,2000rpm离心5min,分别用PBS洗涤2次,再2000rpm离心5min,以下步骤均在4℃中进行。取上述细胞10ml(约10克),加入30mlbufferA(含50mmol/LTris-HClpH7.5,1mmol/LDTT,0.1mmol/LEDTA,0.1mmol/LPMSF)混匀,用18A超声破碎器作用1.5min,停1min,共5次。细胞破碎液于4℃下18000rpm×30min恒温匀速离心,取上清液(此液含粗酶)。
取上述粗酶液上样于预先用bufferB(50mmol/LTris-HClpH7.2,20mmol/LKCl,0.1mmol/LEDTA,20%甘油)平衡过的DE-52柱(30ml)用60mlbufferB洗之,再用20mlbufferB和20mlbufferC(50mmol/LTris-HClpH7.2,300mmol/LKCl,0.1mmol/LEDTA,20%甘油)作线性梯度洗脱,共收集22管,每管2ml,检测各管的蛋白含量,测定各管的酶活性。收集有酶活性部分,混合加入预先用bufferD(50mmol/LTris-HClpH7.2,150mmol/LKCl,1mmol/LDTT,30%甘油)平衡过的P-11柱,用50mlbufferD洗之,再用10mlbufferD和10mlbufferE(50mmol/LTris-HClpH7.2,400mmol/LKCl,1mmol/LDTT,30%甘油)作线性梯度洗脱,共收集11管,每管2ml,测定酶活性,收集有酶活性部分,并于-70℃保存备用。
, 百拇医药
1.2.2 引物酶活性的测定[7]:酶反应液含50mmol/LTris-HClpH7.2,0.1%
PEG6000,0.1mg/mlBSA,3mmol/LDTT,6mmol/LMgCl2,10%甘油,33.3μg/mlPoly(dT),2mmol/LATP,5μl1mci/ml3H-dATP。取上述反应液30μl分装各测定管,每一管再加入待测的酶液3μl,37℃水浴30分钟,然后加入EDTA至10mmol/L终止反应,转移至乙酸纤维素薄膜上晾干。留一管不漂洗用于测定总cpm数,其余均用5%三氯乙酸漂洗3min×2次,再用95%乙醇漂洗2min×2次,晾干,放入内有5ml闪烁液的测定瓶中,在LKB液闪仪中检测cpm数。以每聚合1pmoldATP为一个酶活性单位。
1.2.3 TP对DNA引物酶-多聚酶α复合体活性的影响[2]:取上述酶反应液30μl/每管,设对照管和实验管,实验管中加入不同浓度的TP,使TP的最终浓度分别为7.81μg/ml、15.63μg/ml、31.25μg/ml、62.5μg/ml和125μg/ml。各组均设2个平行管,各管加入酶3μl,充分混匀,其他步骤与1.2.2同,测定各管的放射性活度cpm数。按如下公式计算TP对酶活性的抑制率。

, http://www.100md.com
再按Litchfield&WilcoxonI(46)计算半数抑制浓度(IC50)。
1.2.4 TP对DNA引物合成的影响[2,8]:酶反应液与酶活性检测液基本相同。不同的是以α-
32P-ATP取代3H-dATP。每管含酶反应液30μl,加入TP液使其最终浓度分别为7.81μg/ml、15.63μg/ml、31.25μg/ml、62.5μg/ml和125μg/ml,每管加上酶液3μl,在37℃水浴中30分钟,以下步骤同前1.2.2项。根据各的管cpm数再按如下公式计算TP对引物合成的影响。

1.2.5 TP对DNA引物延长的影响[2]:以激活小牛胸腺DNA为模板引物,3H-dATP为底物进行检测。反应液(50μl)含50mmol/LTris-HClpH8.5,5mmol/LMgCl2,75mmol/LKCl,1mmol/LDTT,0.1mg/mlBSA,100μmol/LdGTP,100μmol/LdTTP,100μmol/LdCTP,3.7GBq/L3H-dATP,200μg/ml激活的小牛胸腺DNA。酶反应液中依次加入上述不同浓度的TP和酶液4.5μl,其他步骤同1.2.3。根据cpm数计算引物延长的抑制率及其IC50。
, http://www.100md.com
2 实验结果
2.1TP对DNA引物酶-多聚酶α复合体活性的抑制作用
在TP7.81μg/ml、15.63μg/ml、31.25μg/ml、62.5μg/ml和125μg/ml浓度作用下对DNA引物酶-多聚酶α复合体活性的抑制作用见表1,其平均抑制率分别为29.8%、47.6%、63.8%、66.4%和74.8%。IC50及95%可信区间为20.28(15.17,27.13)μg/ml。可见随TP浓度增加,酶抑制率亦逐渐增加,各浓度抑制率相关检测r=0.9152,P<0.0001
表1 不同浓度的TP对DNA引物酶-多聚酶α复合体活性的抑制率(IR%) 实验次数
TP作用浓度(μg/ml)
7.81
, http://www.100md.com
15.63
31.25
62.5
125
1
32.1
39.3
59.4
61.0
70.1
2
25.5
57.4
, 百拇医药
69.4
72.4
82.3
3
31.9
46.2
62.1
65.8
72.1
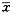 ±s(%)
±s(%)29.8±3.7
47.6±7.4
63.8±5.4
, http://www.100md.com
66.4±4.6
74.8±6.5
2.2TP对DNA引物合成的影响
从表2可见,TP在7.81μg/ml、15.63μg/ml、31.25μg/ml、62.5μg/ml和125μg/ml浓度作用下,引物合成的平均促进率分别为116.1%、209.2%、280.6%、298.3%和390.6%。结果表明TP对DNA引物合成有促进作用,随TP浓度增加,促进率也增加,各浓度抑制率相关检测r=0.9324,P<0.0001表2 不同浓度的TP对DNA引物合成的促进率(promotiverate,PR%) 实验次数
TP作用浓度(μg/ml)
7.81
15.63
, 百拇医药
31.25
62.5
125
1
115.3
212.6
266.1
281.5
395.2
2
105.2
217.1
345.2
, 百拇医药
347.9
422.3
3
127.9
197.9
230.6
265.5
354.3
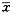 ±s(%)
±s(%)116.111.4
209.2±9.9
280.6±
, http://www.100md.com
298.3±43.7
390.6±34.3
2.3TP对DNA引物延长的影响
从表3可见,TP在7.81μg/ml、15.63μg/ml、31.25μg/ml、62.5μg/ml和125μg/ml浓度作用下,对引物延长的平均抑制率分别为7.1%、49.2%、52.2%、61.6%和72.7%,IC50值及95%可信区间为36.43(12.55,105.75)μg/ml。该结果显示,TP对DNA引物延长有抑制作用,其抑制作用随TP浓度的增加而增强,各浓度抑制率相关检测r=0.9069,P<0.0001表3 不同浓度的TP对DNA引物延长的抑制率(IR%) 实验次数
TP作用浓度(μg/ml)
7.81
, 百拇医药
15.63
31.25
62.5
125
1
5.7
49.7
51.3
60.1
70.3
2
8.3
46.2
, 百拇医药
50.3
59.8
71.5
3
7.3
51.8
54.7
64.7
76.4
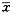 ±s(%)
±s(%)7.1±1.3
49.2±2.8
52.2±2.2
, 百拇医药
61.6±2.7
72.7±3.3
3 讨论
先前研究证明绿茶提取物对多种人癌细胞有细胞毒作用,体内有抗小鼠移植性肿瘤的作用[5];TP对小鼠移植肿瘤和裸鼠移植人肺癌有抗瘤作用。本结果又表明,TP对小鼠L2细胞DNA引物酶-多聚酶α复合体活性有抑制作用,对DNA引物延长有明显抑制作用,而对DNA引物的合成有促进作用。因为DNA引物酶-多聚酶α复合体具有引物合成和引物延长的两种活性,而DNA复制首先要通过DNA拓扑异构酶Ⅱ来解旋,然后由DNA引物酶-多聚酶α复合体启动,合成一段7~10个核苷酸的RNA引物,再由多聚酶α聚合dNTP来完成引物的延长[9]。TP对DNA引物酶-多聚酶α复合体活性的抑制,即是抑制了DNA引物的合成或链的延长,使DNA合成受抑制[10],从而阻止肿瘤细胞的繁殖,这可能是其抗瘤作用机理之一,即DNA引物酶-多聚酶α复合体可能是TP的靶酶。至于TP既能抑制引物的延长,又能促进引物的合成,其抑制作用和促进作用是否同一种物质起作用,尚未清楚,因为茶多酚中80%左右虽均为儿茶素组成,但尚有20%的其他物质如黄酮、黄酮醇及花色素类等物质,对本酶各活性起作用的是哪种成份,因目前国内外尚未见有关的报道,有待进一步探讨。
, http://www.100md.com
基金项目:本课题受国家自然科学基金(N0:39370800)、国家“九五”攻关研究项目(
No:96-906-01-03)及中山医科大学“211工程”重点学科基金(No:98069)资助
通讯作者:谢冰芬 Tel:86-20-87765368-7333
[参考文献]
[1]Catapano CV, Perrino FW, Fernandes DJ. Primer RNA chain termination induced by 9-beta-D-
arabinofuranosyl-2-fluoroadenine 5
-triphosphate [J]. J Biol Chem, 1993, 268: 7179~ 7185.
, 百拇医药
[2]Kuchta RD, Reid B, Chang LM, et al. DNA primase:Processivity and the primase to polymerase
alpha activity switch [J]. J Bio Chem, 1990, 265: 16158~ 16165.
[3]Kuchta RD, Ilsley D,Kravig KD,et al. Inhibition of DNA primase and polymerase alpha by arabino
furanosylnucleoside triphosphates and related compounds [J].Biochemistry,1992,31:4720~ 4728.
[4]谢冰芬,郝东磊,刘宗潮,等.茶多酚的细胞毒作用和抗瘤作用研究[J].癌症,1998,17(6):418~420.
, 百拇医药
[5]谢冰芬,刘宗潮,潘启超,等.毛叶茶和龙井茶提取物的抗瘤作用及对DNA拓扑异构酶II的抑制
作用[J].癌症,1991,11(6):424~428.
[6]朱孝峰,刘宗潮,潘启超,等.绿茶提取物对肿瘤细胞DNA引物酶多聚酶α复合体活性的影响[J].
癌症,1997,16(3):161~164.
[7]朱孝峰,刘宗潮,谢冰芬,等.DNA引物酶的提取分离与引物合成活性的研究[J].中山医科大学
学报,1997,18(4):279~281.
[8]Chang LM,Rafter E,Augl C,et al. Purification of a DNA polymerase-DNA primase complex from calf thymus
, 百拇医药
glands [J]. J. Biol Chem, 1984, 259 (23): 14679~ 14687.
[9]Sheaff RJ,Kuchta RD,Ilsley D. Calf thymus DNA polymerase α -primase:“ communication” and
primertemplate movement between the two active sites [J]. Biochemistry, 1994, 3: 2247~ 2254.
[10]Nasheuer HP, Grosse F. DNA polymerase α -primase from calf thymus [J]. J Biol Chem, 1988,263: 8981~ 8983.
收稿日期:1999-08-11
修回日期:1999-09-17, 百拇医药