放射医学系放射性核素内照射诱发大鼠外周血淋巴细胞HPRT基因位点突变与染色体畸变的研究
作者:赵经涌 劳勤华 徐永忠 王六一
单位:江苏,苏州医学院 215006
关键词:放射性核素;内照射;大鼠;HPRT基因位点突变;染色体畸变;剂量效应关系
中华放射医学与防护杂志000104 【摘要】 目的 阐明放射性核素内照射诱发外周血淋巴细胞HPRT基因位点突变的剂量效应关系,并与染色体畸变剂量效应关系进行比较。方法 给动物尾静脉注射放射性核素,注射量为0.5 ml/100 g体重。剂量效应关系组动物注射活度为3.64×105 Bq/ml,于注射后1、3、6和9 d心脏穿刺取血。剂量率效应关系组动物注射活度分别为3.64×105、1.82×105、0.91×105和0.445×105 Bq/ml,于注射后3、6.7、17和42 d心脏穿刺取血。应用多核细胞法及胞质分裂阻断法(CBMN)和常规染色体畸变分析法检测HPRT基因位点突变率和染色体畸变率。用计算机拟合剂量效应关系和剂量率效应关系函数。结果 淋巴细胞HPRT基因位点突变率不仅随内照射剂量和剂量率增加而增加,呈现出良好的正相关,而且与染色体畸变亦呈现出较好的相关性。结论 辐射诱发HPRT基因位点突变有可能成为有效的辐射生物剂量计。
, 百拇医药
HPRT gene locus mutation and chromosomal aberration in
rat peripheral blood lymphocytes induced by internal exposure to radionuclides
ZHAO Jingyong LAO Qinhua XU Yongzhong,et al.
(Department of Radiotoxicology,Suzhou Medical College,Suzhou 215006, China)
【Abstract】 Objective HPRT gene locus mutation in rat peripheral blood lymphocytes induced by internal exposure to radionuclides was performed,and compared with chromosomal aberration. Methods Rats were injected intravenously with radionuclides of specific activity of 3.64×105 Bq/ml for the study of dose-effect relationship and 3.64×105,1.82×105,0.91×105,0.455×105 Bq/ml respectively for the study of dose rate-effect relationship.The blood was sampled at different times after injection.HPRT gene mutation frequency(GMF) and chromosomal aberration frequency (CAF) were examined by methods of multinucleus cell assay,cytokinesis-block micronucleus (CBMN) and chromosome aberration assay.Dose-response functions were fitted with a computer. Results GMF and CAF did not increase with increase of dose and dose-rates but were clearly interrelated between GMF and CAF. Conclusion The HPRT gene mutation may be used as a biological dosimeter.
, 百拇医药
【Key words】 Radionuclides; Internal exposure; Rat; HPRT gene mutant; Chromosomal aberration; Dose-response relationship▲
近年来国内、外研究表明,体细胞次黄嘌呤鸟嘌呤磷酸核糖转移酶(hypoxanthine-guanine phosphoribosyl transferase,HPRT)基因位点不仅对电离辐射敏感,而且其突变是不可逆的,可以在体内累积。因此HPRT基因不仅是研究电离辐射所致DNA损伤和对人体远后效应的较为理想的靶基因,而且有可能成为辐射生物剂量计[1-4]。目前国内、外检测HPRT基因位点突变的方法有放射自显影法、克隆法和多核细胞法等,上述诸方法各有优缺点,其中多核细胞法简便、快速、灵敏且检出率高[5]。
目前国内、外研究电离辐射诱发HPRT基因位点突变多限于外照射,内照射较少。本研究是采用多核细胞法探讨不同剂量和剂量率放射性核素内照射诱发大鼠外周血淋巴细胞HPRT基因位点突变并与染色体畸变进行比较,以期为HPRT基因位点突变能否作为辐射生物剂量计,从内照射角度积累一些资料。
, 百拇医药
材料和方法
1.材料
(1)放射性核素:本研究中所用放射性核素是晚期混合裂变产物的主要成分,其组成及放射性活度百分比分别为:90Sr∶26.82%;137Cs∶73.15%;144Ce-144Pr∶ 0.002%;106Ru-106Rh∶0.02%;95Zr-95Nb微量。
(2)动物:Wistar雄性大鼠,体重(146±19) g,由苏州医学院实验动物中心提供。
(3)细胞松弛素-B(Cyt-B),6-巯基鸟嘌呤(6-TG),秋水仙素系美国Sigma化学公司产品;RPMI 1640培养基系美国GIBCO公司产品;小牛血清购于华美生物工程公司;植物血凝素(PHA)购于广州医药工业研究所。
, http://www.100md.com
2.方法
(1)大鼠随机分成1个对照组,4个不同累积剂量组和4个不同剂量率组,每组6只。对照组尾静脉注射生理盐水(pH 3.0),注射量为0.5 ml/100 g体重,注射后1 d心脏穿刺取血。不同累积剂量组尾静脉注射浓度为3.64×105 Bq/ml的放射性核素,注射量同对照组,注射后1、3、6和9 d心脏穿刺取血。不同剂量率组尾静脉注射放射性核素,其浓度分别为3.64×105,1.82×105,0.91×105和0.455×105 Bq/ml,注射量同对照组,于注射后3、6.7、17和42 d心脏穿刺取血。
(2)取抗凝血1.5 ml于离心管中,加Hank's液8 ml混匀后,1 000 r.min-1离心10 min,去上清液,再重复洗涤一次。将沉积血细胞悬浮于生长培养基(内含90%RPMI 1640,体积分数为10%灭活小牛血清,庆大霉素100 IU/ml,PHA适量)中至体积1.5 ml,取上述血细胞悬液0.4 ml接种于5 ml生长培养基中。每个样本培养2瓶,其中一瓶加入6-TG,终浓度为1×10-5 mol/L,置(38.2±0.3)℃培养56 h,加入Cyt-B,终浓度为6 μg/ml,再继续培养至96 h。培养物离心、固定、制片。每个样本计数6!000个转化淋巴细胞(其中加与不加6-TG各计数3!000个),统计其中双核或多核淋巴细胞数,将含6-TG的1!000个转化淋巴细胞中双核或多核淋巴细胞数除以不含6-TG的1!000个转化淋巴细胞中双核或多核淋巴细胞数,所得结果为HPRT基因位点突变率(‰)。
, 百拇医药
3.取上述血细胞悬浮液0.4 ml接种于5 ml生长培养基中,在(38.2±0.3) ℃培养96 h,在收获前6 h加秋水仙素。培养结束后,按常规法低渗、固定、空气干燥、Giemsa染色。每例分析200个有丝分裂中期细胞,光镜下观察染色体畸变数,双着丝粒体加着丝粒环(D+R)数,计算出染色体畸变率(%)和(D+R)率(%)。
4.统计处理:不同剂量和剂量率诱发HPRT基因位点突变率间比较采用秩和检验。不同剂量和剂量率诱发染色体畸变率间比较采用χ2检验。HPRT基因位点突变率与染色体畸变率间相关性采用直线相关系数假设检验。用计算机拟合剂量效应关系函数和HPRT基因位点突变与染色体畸变间相关性函数。
结果和讨论
不同累积剂量内照射诱发HPRT基因位点突变和染色体畸变结果见表1。
由表1中的数据拟合的HPRT基因位点突变频率(Y,‰)与累积剂量(X,cSv)函数为:
, 百拇医药
Y=1.1498+0.1199ln X, r=0.9706
染色体畸变率(Y,%)与累积剂量(X,cSv)函数为:
Y=0.4996+0.4580ln X, r=0.9864
双着丝粒体和着丝粒环率(Y,%)与剂量(X,cSv)函数为:
Y=0.0003+0.2970ln X, r=0.9866
HPRT基因位点突变频率(Y,‰)与染色体畸变率(X,%)相关函数为:
Y=0.9031+0.3443X, r=0.9903,P<0.01
不同剂量率内照射诱发HPRT基因位点突变及染色体畸变结果见表2。
, 百拇医药
表1 不同累积剂量内照射诱发HPRT基因位点突变和染色体畸变(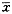 ±s) 累积剂量(cSv)
±s) 累积剂量(cSv)
HPRT基因位点突变率(‰)
染色体畸变率(%)
双着丝粒体加着丝粒环率(%)
0.00
1.0311±0.0404
0.4000±0.5477
0.0000
1.73±0.01
1.2037±0.0377*
, 百拇医药
0.8600±0.8649
0.2000±0.4472
4.76±0.07
1.3623±0.0316*
1.2600±0.8296+
0.4000±0.5477
8.49±0.17
1.4046±0.0264*
1.4600±0.5079+
0.6000±0.5477
, http://www.100md.com
11.96±0.37
1.4353±0.0274*
1.6000±0.5477*
0.8000±0.4472
注:与对照组相比:*P<0.01;+P<0.05
表2 不同剂量率内照射诱发HPRT基因位点突变和染色体畸变(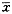 ±s)
±s)
累积剂量(cSv)
剂量率(mSv.d-1)
, http://www.100md.com
HPRT基因位点突变率(‰)
染色体畸变率(%)
双着丝粒体加着丝粒环率(%)
0.00
0.00
1.0311±0.0404
0.4000±0.5477
0.0000
4.60±0.22
2.36
1.1363±0.0244
0.8000±0.8367
, 百拇医药
0.2000±0.4472
4.71±0.16
4.72
1.2154±0.0241
1.0000±0.7071
0.4000±0.5477
4.65±0.10
9.44
1.3164±0.0392*
—
—
, http://www.100md.com 4.77±0.07
18.88
1.3623±0.0316*
1.2600±0.8295
0.4000±0.5477
注:与2.36 mSv.d-1相比:*P<0.01 由表2的数据拟合的HPRT基因位点突变频率(Y,‰)与剂量率(X,mSv.d-1)函数为:
Y=1.0442+0.1124ln X, r=0.9815
染色体畸变率(Y,%)与剂量率(X,mSv.d-1)函数为:
, 百拇医药
Y=0.4979+0.2633ln X, r=0.9573
HPRT基因位点突变频率(Y,‰)与染色体畸变率(X,%)相关函数为:
Y=0.8600+0.3772X, r=0.9613,P<0.01
人类体细胞中HPRT基因位于Xq26上,基因序列长44 kb,有9个外显子和8个内含子,其核甘酸序列已清楚。该基因表达的产物是次黄嘌呤鸟嘌呤磷酸核糖转移酶,该酶是由2~4个蛋白亚单位组成的一种细胞膜酶,并存在于人体所有组织中。但该酶特异性不强。对维持细胞生命是非必需的。因此HPRT基因突变后,细胞仍能存活。6-TG的结构与次黄嘌呤和鸟嘌呤类似。在HPRT催化作用下,6-TG与5-磷酸核糖-1-焦磷酸(PRPP)生成具有毒性的6-巯基鸟嘌呤单核苷酸(6-TGMP),在DNA合成过程中,6-TGMP掺入DNA,阻断其半保留复制,从而导致细胞死亡。反之,HPRT基因突变的细胞不能编码生成HPRT,6-TG不能掺入DNA,不影响其复制,细胞存活。因此在含有6-TG的选择性培养基中,HPRT基因突变型细胞存活,非突变型细胞死亡。藉此就可以筛选出HPRT基因的突变体[6]。因此国内外研究者试图通过检测外周血淋巴细胞HPRT基因位点突变来评价环境诱变剂,其中包括电离辐射致突变效应,并试图使其成为辐射生物剂量计。
, 百拇医药
本研究结果表明,放射性核素内照射诱发淋巴细胞HPRT基因位点突变率随累积剂量增加而增加,呈现出良好的正相关。这与文献中报道的外照射结果一致。但本研究结果与迄今文献中报道的外照射结果相比可以看出,辐射诱发相近的HPRT基因位点突变率,内照射剂量要比外照射剂量低1~2个数量级,其原因可能在于:外照射是一次性照射,而内照射则是一种持续性照射。在总的累积剂量大致相等的情况下,不同剂量率内照射诱发HPRT基因位点突变率有差异,也呈现出良好的正相关。
辐射诱发染色体畸变是传统的辐射生物剂量计。本研究结果表明,放射性核素内照射诱发HPRT基因位点突变和染色体畸变之间的关系,不管是剂量效应关系,还是剂量率效应关系,均呈现出良好的相关性。不同累积剂量诱发HPRT基因位点突变与染色体畸变相关系数r=0.9903,P<0.01,不同剂量率诱发HPRT基因位点突变与染色体畸变相关系数r=0.9613,P<0.01(见图1,2)。上述结果表明,辐射诱发HPRT基因位点突变和染色体畸变的剂量效应动力学和剂量率效应动力学相似[7]。可见HPRT基因位点突变有可能成为一种辐射生物剂量计。■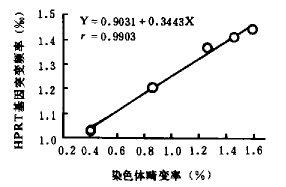
, 百拇医药
图1 不同累积剂量内照射诱发HPRT
基因位点突变和染色体畸变相关性
图2 不同剂量率内照射诱发HPRT
基因位点突变和染色体畸变相关性
参考文献
[1]Thacker J,The nature of mutants induced by ionizing radiation in cultured hamster cell.Mutat Res,1986,160:267-275.
[2]Hakoda M,Akiyama M,Kyoizumi S,et al.Increased somatic cell mutant frequency in atomic bomb survivors.Mutat Res,1988,201:39-48.
, 百拇医药
[3]Nickllas JA,O'Neill JP,Hunter TC,et al.In vivo ionizing irradiation produce deletions in the HPRT gene of human T lymphocytes.Mutat Res,1991,250:383-396.
[4]Hirai Y,Kusunoki Y,Kyoizumi S, et al.Mutant frequency at the HPRT locus in peripheral blood T-lymphocytes of atomic bomb survivors.Mutat Res,1995,329:183-196.
[5]Norman A,Mitchel JC,Iwamoto KS.A sensitive assay for 6-thioguanine resistant lymphocytes.Mutat Res,1988,208:17-19.
[6]Cole J,Skopek TR.Somatic mutant frequency,mutation rates and mutational spectra in the human population in vivo ICPEMC,Mutat Res,1994,304:33-105.
[7]史纪兰,商希梅,李志荣,等.低剂量X射线诱发人体细胞HPRT基因位点突变的剂量效应关系研究.中国辐射卫生,1993,2:181-182.
收稿日期:1999-06-10, 百拇医药
单位:江苏,苏州医学院 215006
关键词:放射性核素;内照射;大鼠;HPRT基因位点突变;染色体畸变;剂量效应关系
中华放射医学与防护杂志000104 【摘要】 目的 阐明放射性核素内照射诱发外周血淋巴细胞HPRT基因位点突变的剂量效应关系,并与染色体畸变剂量效应关系进行比较。方法 给动物尾静脉注射放射性核素,注射量为0.5 ml/100 g体重。剂量效应关系组动物注射活度为3.64×105 Bq/ml,于注射后1、3、6和9 d心脏穿刺取血。剂量率效应关系组动物注射活度分别为3.64×105、1.82×105、0.91×105和0.445×105 Bq/ml,于注射后3、6.7、17和42 d心脏穿刺取血。应用多核细胞法及胞质分裂阻断法(CBMN)和常规染色体畸变分析法检测HPRT基因位点突变率和染色体畸变率。用计算机拟合剂量效应关系和剂量率效应关系函数。结果 淋巴细胞HPRT基因位点突变率不仅随内照射剂量和剂量率增加而增加,呈现出良好的正相关,而且与染色体畸变亦呈现出较好的相关性。结论 辐射诱发HPRT基因位点突变有可能成为有效的辐射生物剂量计。
, 百拇医药
HPRT gene locus mutation and chromosomal aberration in
rat peripheral blood lymphocytes induced by internal exposure to radionuclides
ZHAO Jingyong LAO Qinhua XU Yongzhong,et al.
(Department of Radiotoxicology,Suzhou Medical College,Suzhou 215006, China)
【Abstract】 Objective HPRT gene locus mutation in rat peripheral blood lymphocytes induced by internal exposure to radionuclides was performed,and compared with chromosomal aberration. Methods Rats were injected intravenously with radionuclides of specific activity of 3.64×105 Bq/ml for the study of dose-effect relationship and 3.64×105,1.82×105,0.91×105,0.455×105 Bq/ml respectively for the study of dose rate-effect relationship.The blood was sampled at different times after injection.HPRT gene mutation frequency(GMF) and chromosomal aberration frequency (CAF) were examined by methods of multinucleus cell assay,cytokinesis-block micronucleus (CBMN) and chromosome aberration assay.Dose-response functions were fitted with a computer. Results GMF and CAF did not increase with increase of dose and dose-rates but were clearly interrelated between GMF and CAF. Conclusion The HPRT gene mutation may be used as a biological dosimeter.
, 百拇医药
【Key words】 Radionuclides; Internal exposure; Rat; HPRT gene mutant; Chromosomal aberration; Dose-response relationship▲
近年来国内、外研究表明,体细胞次黄嘌呤鸟嘌呤磷酸核糖转移酶(hypoxanthine-guanine phosphoribosyl transferase,HPRT)基因位点不仅对电离辐射敏感,而且其突变是不可逆的,可以在体内累积。因此HPRT基因不仅是研究电离辐射所致DNA损伤和对人体远后效应的较为理想的靶基因,而且有可能成为辐射生物剂量计[1-4]。目前国内、外检测HPRT基因位点突变的方法有放射自显影法、克隆法和多核细胞法等,上述诸方法各有优缺点,其中多核细胞法简便、快速、灵敏且检出率高[5]。
目前国内、外研究电离辐射诱发HPRT基因位点突变多限于外照射,内照射较少。本研究是采用多核细胞法探讨不同剂量和剂量率放射性核素内照射诱发大鼠外周血淋巴细胞HPRT基因位点突变并与染色体畸变进行比较,以期为HPRT基因位点突变能否作为辐射生物剂量计,从内照射角度积累一些资料。
, 百拇医药
材料和方法
1.材料
(1)放射性核素:本研究中所用放射性核素是晚期混合裂变产物的主要成分,其组成及放射性活度百分比分别为:90Sr∶26.82%;137Cs∶73.15%;144Ce-144Pr∶ 0.002%;106Ru-106Rh∶0.02%;95Zr-95Nb微量。
(2)动物:Wistar雄性大鼠,体重(146±19) g,由苏州医学院实验动物中心提供。
(3)细胞松弛素-B(Cyt-B),6-巯基鸟嘌呤(6-TG),秋水仙素系美国Sigma化学公司产品;RPMI 1640培养基系美国GIBCO公司产品;小牛血清购于华美生物工程公司;植物血凝素(PHA)购于广州医药工业研究所。
, http://www.100md.com
2.方法
(1)大鼠随机分成1个对照组,4个不同累积剂量组和4个不同剂量率组,每组6只。对照组尾静脉注射生理盐水(pH 3.0),注射量为0.5 ml/100 g体重,注射后1 d心脏穿刺取血。不同累积剂量组尾静脉注射浓度为3.64×105 Bq/ml的放射性核素,注射量同对照组,注射后1、3、6和9 d心脏穿刺取血。不同剂量率组尾静脉注射放射性核素,其浓度分别为3.64×105,1.82×105,0.91×105和0.455×105 Bq/ml,注射量同对照组,于注射后3、6.7、17和42 d心脏穿刺取血。
(2)取抗凝血1.5 ml于离心管中,加Hank's液8 ml混匀后,1 000 r.min-1离心10 min,去上清液,再重复洗涤一次。将沉积血细胞悬浮于生长培养基(内含90%RPMI 1640,体积分数为10%灭活小牛血清,庆大霉素100 IU/ml,PHA适量)中至体积1.5 ml,取上述血细胞悬液0.4 ml接种于5 ml生长培养基中。每个样本培养2瓶,其中一瓶加入6-TG,终浓度为1×10-5 mol/L,置(38.2±0.3)℃培养56 h,加入Cyt-B,终浓度为6 μg/ml,再继续培养至96 h。培养物离心、固定、制片。每个样本计数6!000个转化淋巴细胞(其中加与不加6-TG各计数3!000个),统计其中双核或多核淋巴细胞数,将含6-TG的1!000个转化淋巴细胞中双核或多核淋巴细胞数除以不含6-TG的1!000个转化淋巴细胞中双核或多核淋巴细胞数,所得结果为HPRT基因位点突变率(‰)。
, 百拇医药
3.取上述血细胞悬浮液0.4 ml接种于5 ml生长培养基中,在(38.2±0.3) ℃培养96 h,在收获前6 h加秋水仙素。培养结束后,按常规法低渗、固定、空气干燥、Giemsa染色。每例分析200个有丝分裂中期细胞,光镜下观察染色体畸变数,双着丝粒体加着丝粒环(D+R)数,计算出染色体畸变率(%)和(D+R)率(%)。
4.统计处理:不同剂量和剂量率诱发HPRT基因位点突变率间比较采用秩和检验。不同剂量和剂量率诱发染色体畸变率间比较采用χ2检验。HPRT基因位点突变率与染色体畸变率间相关性采用直线相关系数假设检验。用计算机拟合剂量效应关系函数和HPRT基因位点突变与染色体畸变间相关性函数。
结果和讨论
不同累积剂量内照射诱发HPRT基因位点突变和染色体畸变结果见表1。
由表1中的数据拟合的HPRT基因位点突变频率(Y,‰)与累积剂量(X,cSv)函数为:
, 百拇医药
Y=1.1498+0.1199ln X, r=0.9706
染色体畸变率(Y,%)与累积剂量(X,cSv)函数为:
Y=0.4996+0.4580ln X, r=0.9864
双着丝粒体和着丝粒环率(Y,%)与剂量(X,cSv)函数为:
Y=0.0003+0.2970ln X, r=0.9866
HPRT基因位点突变频率(Y,‰)与染色体畸变率(X,%)相关函数为:
Y=0.9031+0.3443X, r=0.9903,P<0.01
不同剂量率内照射诱发HPRT基因位点突变及染色体畸变结果见表2。
, 百拇医药
表1 不同累积剂量内照射诱发HPRT基因位点突变和染色体畸变(
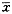 ±s) 累积剂量(cSv)
±s) 累积剂量(cSv)HPRT基因位点突变率(‰)
染色体畸变率(%)
双着丝粒体加着丝粒环率(%)
0.00
1.0311±0.0404
0.4000±0.5477
0.0000
1.73±0.01
1.2037±0.0377*
, 百拇医药
0.8600±0.8649
0.2000±0.4472
4.76±0.07
1.3623±0.0316*
1.2600±0.8296+
0.4000±0.5477
8.49±0.17
1.4046±0.0264*
1.4600±0.5079+
0.6000±0.5477
, http://www.100md.com
11.96±0.37
1.4353±0.0274*
1.6000±0.5477*
0.8000±0.4472
注:与对照组相比:*P<0.01;+P<0.05
表2 不同剂量率内照射诱发HPRT基因位点突变和染色体畸变(
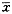 ±s)
±s)累积剂量(cSv)
剂量率(mSv.d-1)
, http://www.100md.com
HPRT基因位点突变率(‰)
染色体畸变率(%)
双着丝粒体加着丝粒环率(%)
0.00
0.00
1.0311±0.0404
0.4000±0.5477
0.0000
4.60±0.22
2.36
1.1363±0.0244
0.8000±0.8367
, 百拇医药
0.2000±0.4472
4.71±0.16
4.72
1.2154±0.0241
1.0000±0.7071
0.4000±0.5477
4.65±0.10
9.44
1.3164±0.0392*
—
—
, http://www.100md.com 4.77±0.07
18.88
1.3623±0.0316*
1.2600±0.8295
0.4000±0.5477
注:与2.36 mSv.d-1相比:*P<0.01 由表2的数据拟合的HPRT基因位点突变频率(Y,‰)与剂量率(X,mSv.d-1)函数为:
Y=1.0442+0.1124ln X, r=0.9815
染色体畸变率(Y,%)与剂量率(X,mSv.d-1)函数为:
, 百拇医药
Y=0.4979+0.2633ln X, r=0.9573
HPRT基因位点突变频率(Y,‰)与染色体畸变率(X,%)相关函数为:
Y=0.8600+0.3772X, r=0.9613,P<0.01
人类体细胞中HPRT基因位于Xq26上,基因序列长44 kb,有9个外显子和8个内含子,其核甘酸序列已清楚。该基因表达的产物是次黄嘌呤鸟嘌呤磷酸核糖转移酶,该酶是由2~4个蛋白亚单位组成的一种细胞膜酶,并存在于人体所有组织中。但该酶特异性不强。对维持细胞生命是非必需的。因此HPRT基因突变后,细胞仍能存活。6-TG的结构与次黄嘌呤和鸟嘌呤类似。在HPRT催化作用下,6-TG与5-磷酸核糖-1-焦磷酸(PRPP)生成具有毒性的6-巯基鸟嘌呤单核苷酸(6-TGMP),在DNA合成过程中,6-TGMP掺入DNA,阻断其半保留复制,从而导致细胞死亡。反之,HPRT基因突变的细胞不能编码生成HPRT,6-TG不能掺入DNA,不影响其复制,细胞存活。因此在含有6-TG的选择性培养基中,HPRT基因突变型细胞存活,非突变型细胞死亡。藉此就可以筛选出HPRT基因的突变体[6]。因此国内外研究者试图通过检测外周血淋巴细胞HPRT基因位点突变来评价环境诱变剂,其中包括电离辐射致突变效应,并试图使其成为辐射生物剂量计。
, 百拇医药
本研究结果表明,放射性核素内照射诱发淋巴细胞HPRT基因位点突变率随累积剂量增加而增加,呈现出良好的正相关。这与文献中报道的外照射结果一致。但本研究结果与迄今文献中报道的外照射结果相比可以看出,辐射诱发相近的HPRT基因位点突变率,内照射剂量要比外照射剂量低1~2个数量级,其原因可能在于:外照射是一次性照射,而内照射则是一种持续性照射。在总的累积剂量大致相等的情况下,不同剂量率内照射诱发HPRT基因位点突变率有差异,也呈现出良好的正相关。
辐射诱发染色体畸变是传统的辐射生物剂量计。本研究结果表明,放射性核素内照射诱发HPRT基因位点突变和染色体畸变之间的关系,不管是剂量效应关系,还是剂量率效应关系,均呈现出良好的相关性。不同累积剂量诱发HPRT基因位点突变与染色体畸变相关系数r=0.9903,P<0.01,不同剂量率诱发HPRT基因位点突变与染色体畸变相关系数r=0.9613,P<0.01(见图1,2)。上述结果表明,辐射诱发HPRT基因位点突变和染色体畸变的剂量效应动力学和剂量率效应动力学相似[7]。可见HPRT基因位点突变有可能成为一种辐射生物剂量计。■

, 百拇医药
图1 不同累积剂量内照射诱发HPRT
基因位点突变和染色体畸变相关性

图2 不同剂量率内照射诱发HPRT
基因位点突变和染色体畸变相关性
参考文献
[1]Thacker J,The nature of mutants induced by ionizing radiation in cultured hamster cell.Mutat Res,1986,160:267-275.
[2]Hakoda M,Akiyama M,Kyoizumi S,et al.Increased somatic cell mutant frequency in atomic bomb survivors.Mutat Res,1988,201:39-48.
, 百拇医药
[3]Nickllas JA,O'Neill JP,Hunter TC,et al.In vivo ionizing irradiation produce deletions in the HPRT gene of human T lymphocytes.Mutat Res,1991,250:383-396.
[4]Hirai Y,Kusunoki Y,Kyoizumi S, et al.Mutant frequency at the HPRT locus in peripheral blood T-lymphocytes of atomic bomb survivors.Mutat Res,1995,329:183-196.
[5]Norman A,Mitchel JC,Iwamoto KS.A sensitive assay for 6-thioguanine resistant lymphocytes.Mutat Res,1988,208:17-19.
[6]Cole J,Skopek TR.Somatic mutant frequency,mutation rates and mutational spectra in the human population in vivo ICPEMC,Mutat Res,1994,304:33-105.
[7]史纪兰,商希梅,李志荣,等.低剂量X射线诱发人体细胞HPRT基因位点突变的剂量效应关系研究.中国辐射卫生,1993,2:181-182.
收稿日期:1999-06-10, 百拇医药