治疗剂量丁胺卡那霉素药代动力学及耳毒性实验研究
作者:许红梅 王绍映
单位:
许红梅(400014 重庆医科大学儿童医院感染消化科);王绍映(400014 重庆医科大学儿童医院感染消化科)
关键词:丁胺卡那霉素;剂量效应关系,药物;豚鼠;药代动力学
中华儿科杂志000905 【摘要】 目的 明确幼年动物对氨基糖甙类抗生素耳毒性有无更高敏感性。方法 用扫描电镜及光镜观察以等效人类治疗剂量下丁胺卡那霉素(AMK)注射的10只早产、31只新生、31只幼年及31只成年豚鼠毛细胞,并用TDx法研究新生、幼年及成年组各16只豚鼠药代动力学特征。结果 (1)单剂给药证实各年龄组均为二室开放性模型,峰浓度及达峰时间差异无显著性,但新生组清除率较其他组明显降低[分别为(0.004 4±0.001 1)、(0.009 7±0.004 2)和(0.008 8±0.001 4) L/(min.kg),均P<0.01],清除半衰期明显延长,[分别为(71±13)、(53±11)和(43±8) min,分别P<0.05、P<0.01],曲线下面积明显增大分别为[(11 462±431 7)、(8 349±147 0)和(8 166±321 3),均P<0.01];幼年、成年组无差异。多次给药新生组血药浓度明显高于同时点幼年、成年组,新生及幼年组存在明显体内药物蓄积。(2) 早产、新生组损伤出现早且严重,幼年组较成年组重;停药后毛细胞缺失数继续增多。结论 即使等效人类治疗剂量的AMK对幼年(尤其早产和新生)豚鼠耳蜗均有不同程度损害,并随用药时间延长而加重。幼年动物这种高敏感性与该药从体内排出慢、易蓄积有关。
, 百拇医药
Experimental study on the ototoxicity of amikacin at therapeutic doses in infant guinea pig
XU Hongmei,WANG Shaoying
(Department of Infectious and Digestive Diseases. Children's Hospital, Chongqing University of Medical Sciences, Chongqing 400014, China)
【Abstract】 Objective To clarify the possibility of higher sensitivity to ototoxicity of aminoglycosides and its causes in infant guinea pig by comparing the differences of ototoxicity and pharmacokinetics among different age groups of guinea pig (including premature and neonatal animals) given amikacin with therapeutic doses equal to clinical doses. Methods There were 31 guinea pigs in each of neonatal, infant and adult groups and 10 in premature group. Six guinea pigs in each group were used as control. Amikacin was intramuscularly injected at a dose of 65 mg/kg (which is equal to the clinical therapeutic dose) once a day for 14 days. Five to 8 guinea pigs in each group were sacrificed for histological and scanning electron-microscopic examination of cochlea on the day after the 3rd, 5th, 7th, 10th and 14th day of drug administration, as well as on the 28th day. Pharmacokinetic parameters were investigated in all but premature group with 16 guinea pigs from each by TDx system.Results(1) The Pharmacokinetic parameters were compatible with the model of two compartments in all age groups. There were no significant differences in the peak level and peak time among the groups. The neonatal group had lower plasma clearance than the infant and adult groups [(0.004 4±0.001 1), (0.009 7±0.004 2) and (0.008 8±0.001 4) L/(min.kg), P<0.01 for all]; the half-life for elimination was longer [(71±13), (53±11) and (43±8) min, P<0.05 and P<0.01 respectively]; the AUC was larger [(11 462±4 317), (8 349±1 470) and (8 166±3 213), P<0.01 for all]. There was no statistically significant difference between the infant and adult groups in single-dose pharmacokinetics. The blood levels of amikacin after daily administration in neonatal guinea pigs were predominantly higher than those in infant and adult groups, and were increased markedly since the 10th day. It did so in infant group since 14th day. These results indicated that there was an increased accumulation of amikacin in neonatal and infant guinea pigs. (2) On histological examinations of cochlea, many stereocilia were found lain down or disappeared as early as on the 3rd day and a number of outer hair cells were found disappeared on the 5th day in either premature or neonatal group on scanning electron-microscopy. The change of stereocilia at 5th day in infant and adult groups was similar to that in premature and neonatal groups. Microscopic observation showed that more hair cells were absent in neonatal group than in infant and adult groups after the 7th day (P<0.05 or P<0.01). The hair cell absence was more obvious in premature group than in neonatal group.The hair cell absence in infant group was more severe than in adult group on 28th day (P<0.05). The severity of cochlea damage became worse with a prolonged course of amikacin administration. Continuous damage was observed within 2 weeks after the drug administration was stopped in all groups. Conclusions Significant ototoxicity of amikacin to cochlea was well observed in infant guinea pigs with various severity, particularly in premature and neonatal animals at a dose equal to clinical therapeutic dose. The severity of cochlear damage became worse with a prolonged course of the administration. The ototoxicity occurred much earlier and more severe in premature and neonatal animals. The damage to cochlea could continue for quite a longer period after the drug administration was discontinued. The higher sensitivity to ototoxicity of amikacin in young guinea pigs seemed to be related to their much slow clearance and accumulation of amikacin. The results suggest that close attention should be paid to the danger of ototoxicity caused by aminoglycosides in children (especially in premature, neonate or infant) even they are administrated at a dose recommended by pharmacopeia and for a regular course. Auditory electrophysiological eximation should be used to monitor the audition during aminoglycosides administration. Aminoglycosides should be avoided in children as long as possible, esp. in those from families with higher sensitivity to ototoxicity of aminoglycosides.
, http://www.100md.com
【Key words】 Amikacin; Dose-response relationship, drug; Guinea pigs; Pharmacokinetics
氨基糖甙类抗生素耳毒性损害已成为目前我国儿童听力语言残疾的主要因素。本研究以耳蜗发育类似人类的豚鼠为对象、研究等效人类治疗剂量丁胺卡那霉素(AMK)在不同年龄组的药代动力学与耳蜗基底膜毛细胞形态学改变的关系,为深入探讨儿科合理使用该类药物提供理论依据。
材料与方法
一、实验材料
1.实验动物:耳蜗反射阳性、无中耳炎及外耳道炎的健康杂毛豚鼠(重庆医科大学实验动物中心提供),雌雄各半。31只成年豚鼠出生后5个月,体重500~600 g、31只幼年豚鼠出生后1~3周,体重150~250 g、31只新生豚鼠(孕龄65~70 d足月出生的豚鼠)、10只早产豚鼠(足月出生前1周剖宫产的豚鼠)。
, http://www.100md.com
2.AMK:苏州第六制药厂生产,批号:971222,豚鼠剂量按人[15 mg/(kg*d)]与动物等效剂量折算公式[1]计算为65 mg/(kg*d)。
3.试剂:AMK荧光偏振免疫测定试剂盒(南京军区南京总医院临床药理研究室提供,批号:981204),0.5%的硝酸银,10 %的甲醛,0.1 mol的磷酸缓冲液,4%的戊二醛。
二、研究方法
1.药代动力学:(1)单剂给药:新生组、幼年组、成年组各6只豚鼠,上午9时大腿内侧肌肉注射,单剂给予豚鼠AMK 65 mg/kg,给药后5、10、20、30、40、60、120、180、240 min割耳缘静脉各取血0.5 ml,分离血清,TDx仪测定AMK浓度,3P87程序求出每组各个动物药代动力学参数。(2)多次给药:新生组、幼年组、成年组各10只豚鼠(AMK剂量、途径同上),每日上午9时给药×14 d,实验第3、5、7、10、14 d给药后、各组达峰时间割耳缘静脉取血0.5 ml,测定AMK浓度。
, 百拇医药
2.耳蜗基底膜毛细胞形态学:(1)分组:实验组:新生组、幼年组、成年组各31只,早产组10只,处理方法同多次给药药代动力学;对照组:对照组各组同期饲养未给予任何处理的豚鼠各6只。(2)耳蜗标本收集时间:新生组、幼年组、成年组:第3、5天给药次日各组处死1只豚鼠取一侧耳蜗作扫描电镜标本,第7、10、14天给药次日及第28天分别处死7~8只豚鼠作光镜标本;早产组:第3、5天给药次日各处死一只豚鼠作扫描电镜标本,第28天处死8只豚鼠作光镜标本;对照组:各组同期饲养6只豚鼠第28天并处死作光镜检查(由于实验期间环境噪音有可能致少数毛细胞缺失,故选用与实验组环境相同、最长实验时间内未给予处理的豚鼠为对照组)。(3)光镜标本制备及观察:采用全内耳硝酸银染色法[2]制备标本及改良 Stockwell等[3]法(每圈基底膜随机取5个视野)计算耳蜗基底膜毛细胞缺失总数。(4)扫描电镜标本制备:断头处死豚鼠,2 min内用4%的戊二醛灌注固定耳蜗,0.1 mol磷酸缓冲液漂洗,锇酸固定、乙醇脱水、叔丁醇干燥、喷金并进行观察。
, 百拇医药
3.统计学分析:采用SPSS 8.0 for windows统计分析软件进行运算,均数间两两比较时进行方差分析后采用q检验。
结果
一、一般观察
所有动物精神食欲正常,实验期间体重增加;无站立不稳、毛发竖立或脱落等异常及死亡。
二、药代动力学
1.单剂给药药代动力学:各年龄组血药浓度-时间曲线见图1。AMK在各组体内均为二室开放性模型。药代动力学参数比较显示(表1):各组峰浓度(Cm) 及 达峰时间(tp)差异无显著性(P>0.05),新生组与幼年组、成年组比较,其清除半衰期[T(1)/(2)(β)]显著延长(分别P<0.05,P<0.01),清除率(Cl)显著降低(均P<0.01),曲线下面积[(AUC),表示在服用某一剂量的药物后一定时间内吸收入血的药物相对量]明显增大(均P<0.01),而幼年组与成年组比较差异无显著性(均P>0.05);说明AMK 从新生组体内清除较幼年组、成年组显著为慢。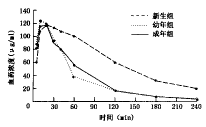
, http://www.100md.com
图1 不同年龄组血药浓度时间曲线
2.多次给药药代动力学(表2):同时点各年龄组组间比较:新生组各时点血药浓度均高于幼年组(P<0.05或P<0.01)和成年组(P<0.05或P<0.01);幼年组与成年组比较,前者于第14天高于后者,差异有显著性(P<0.05),其余各时点两组间差异无显著性(P>0.05)。说明新生组多次给药后血药浓度累积性增高;年龄越小,AMK更易在体内蓄积。不同给药时间各年龄组内比较:?新生组各时点血药浓度比较差异有非常显著性(P<0.01),第3、5、7天间比较差异无显著性(均P>0.05),但这三个时点中血药浓度最高的第7天与第10、14天比较差异有显著性(分别P<0.05,P<0.01);幼年组各时点比较差异有显著性(P<0.05),第3、5、7、10天比较差异无显著性(均P>0.05),但第14天与第10天比较差异有显著性(P<0.05);成年组各时点差异均无显著性(P>0.05)。结果进一步表明,AMK在新生和幼年组体内有较明显的蓄积现象(以新生组明显)。
, 百拇医药
三、耳蜗毛细胞形态学
1.光镜结果(表3):各年龄组毛细胞缺失程度均随给药次数增加而逐渐加重,与对照组比较显示新生组于第7天已出现明显毛细胞缺失(P<0.01),而幼年组、成年组于第10天才有明显变化(均P<0.05);虽然各实验组于第14天均已停药,但实验第28天毛细胞缺失数进一步较第14天显著增高(均P<0.01)。说明年龄越小,损伤出现越早,停药后毛细胞损伤过程仍在继续。同时间组间比较显示早产组、新生组较幼年组、成年组毛细胞缺失数多(以早产组最严重),而第28天幼年组较成年组缺失数多,说明年龄越小,毛细胞缺失程度越重。
2.电镜结果:早产组、新生组在给药第3天已出现基底膜底圈毛细胞听毛改变(图2、3),第5天出现毛细胞缺失(图4、5),均以早产组损伤更明显;而幼年组、成年组第3天正常(图6、7),第5天才出现轻度听毛改变(图8、9)。
表1 新生组、幼年组、成年组药物动力学主要指标( ±s) 分组
±s) 分组
, 百拇医药
动物数
(只)
tp(达峰时间)
(min)
Cm(峰浓度)
(μg/ml)
Cl(清除率)
[L/(min*kg)]
T(1)/(2)(β)(清除半衰期)
(min)
AUC(曲线下面积)
新生组
, 百拇医药
6
20±8
118±35
0.004 4±0.001 1
71±13
11 462±4 317
幼年组
6
13±3
129±38
0.009 7±0.004 2*
53±11**
, 百拇医药
8 349±1 470*
成年组
6
13±4
123±20
0.008 8±0.001 4*
43±8*
8 166±3 213*
F值
0.168
2.845
, 百拇医药
7.251△
9.413△
9.365△
与新生儿组比较:*P<0.01,**P<0.05;总比较: △ P<0.01表2 新生组、幼年组、成年组多次给药血药浓度( ±s,μg/ml) 分组
±s,μg/ml) 分组
动物数
第3天
第5天
第7天
, 百拇医药
第10天
第14天
F值
新生组
10
153±16
161±16
166±12
183±23
198±26
8.859
幼年组
10
, http://www.100md.com
130±21*
137±26*
136±22*
143±23**
162±13*
3.314
成年组
10
136±23*
139±25*
145±20*
, http://www.100md.com
139±17**
143±16**△
1.256
F值
4.796
6.913
4.573
12.775
20.829
与新生组比较:*P<0.05,**P<0.01;与幼年组比较:△P<0.05表3 各组光镜下(×400)不同时间毛细胞缺失数( ±s) 分组
±s) 分组
, http://www.100md.com
第7天
(n=7)
第10天
(n=7)
第14天
(n=7)
第28天
(n=8)
对照组(28天)
(n=6)
F值或t值
早产组
-
, 百拇医药
-
-
85±34
0.5 ±0.6
6.516
新生组
14±6
17±9
29±11
56±17△
0.17±0.4
36.372
幼年组
, 百拇医药
3±1.9*
7±3**
13±7**
30±11**
0.4 ±0.5
33.554
成年组
3±4*
5±3*
6±4*
14±6*▲
, 百拇医药
0.4 ±0.8
11.098
F值
7.573
12.775
20.429
20.205
0.172
注:与新生组比较:*P<0.01,**P<0.05;与早产组比较:△ P<0.05;与幼年组比较:▲ P<0.05讨论
我国每年新增3万聋儿,其中大多数为氨基糖甙类抗生素所致。本课题在排除病理因素情况下,以耳蜗发育类似人类的哺乳动物豚鼠[4]为研究对象,研究等效人类治疗剂量AMK在不同年龄组的药代动力学、耳蜗听觉感受细胞——毛细胞形态学变化,并探讨其关系,为临床正确用药提供实验依据。
, http://www.100md.com
即使相当人类治疗剂量的AMK,对幼年(尤其早产、新生)豚鼠耳蜗仍有不同程度损害,其程度重于成年组,并随用药时间的延长而加重。停药后,在相当长时间内其耳毒性损害继续加重。
药代动力学研究结果表明:AMK从新生豚鼠体内排出的速度较幼年、成年豚鼠缓慢。这与AMK在哺乳动物体内极少降解、药物几乎全以原形从肾脏滤过排出,而新生豚鼠肾脏功能发育不完善、滤过率低下有关[5]。新生豚鼠在多次给药后血药浓度高于幼年、成年豚鼠,并且于连续给药的第10天出现药物在体内的进行性蓄积现象,这除与药物在体内排出缓慢外,还可能与药物在体内进行性蓄积后导致肾脏损害、使肾小球滤过率进一步降低有关。可以推测,肾脏功能更不完善的早产豚鼠对AMK的清除更慢、更易发生药物在体内的蓄积。虽在幼年、成年豚鼠反映AMK从体内清除的参数无明显差异,但幼年组在多次给药的第14天也出现药物在体内的蓄积,推测与其肾脏功能储备能力低有关。以上均说明年龄越小,越要考虑连续用药后,AMK易在体内蓄积、导致更高血药浓度的可能性。
, http://www.100md.com
耳蜗毛细胞形态学研究显示:等效人类治疗剂量的AMK,对不同年龄期豚鼠耳蜗毛细胞均有不同程度的损害,但以幼年(尤其早产、新生)豚鼠损害较重。Lopez-Gonzalez等[6]曾报道使用氨基糖甙类药物后未成年大鼠耳蜗细胞中引起组织损伤的氧自由基明显增高,间接表明幼年动物对氨基糖甙类抗生素耳毒性有较高敏感性,而本实验结果从耳蜗组织学研究直接证明这一观点。据Dolgova等[7]报道内耳淋巴液中氨基糖甙类抗生素浓度与血中浓度密切相关,因而本实验中不同年龄期豚鼠体内药代动力学特征的差异是AMK在早产组和新生组更易引起耳蜗损伤、幼年组较成年组损伤严重的重要原因。早产豚鼠出现更严重耳毒性还与该药对毛细胞内多胺生物合成关键酶——鸟氨酸脱羧酶抑制程度有关,该酶受耳蜗发育程度的影响,其活性与耳蜗毛细胞及其神经末梢的成熟过程相一致,一旦被抑制后其受到的损伤程度较已经成熟的耳蜗(足月出生后)更严重[4]。
本实验还显示即使停药后各组毛细胞损伤现象仍继续发展,这与许多患者在停用氨基糖甙类药物后数周甚至数月才出现明显听力下降或停药后听力损害会继续加重现象一致[8]。据认为可能与药物从内耳淋巴液排除缓慢有关,有实验证明一次给药后,内耳淋巴液内该类药物的清除半衰期为血的5~6倍[9],药物在毛细胞内可残留达数周以上[5],连续给药则引起药物在内耳淋巴液内蓄积,从而导致毛细胞损伤在停药后仍可继续加重;此外,由于该类药早期损伤耳蜗底圈毛细胞,主要引起高音频的听力下降,即使已有听力障碍有可能不被及时发现,但随着耳毒性损害的加重、累及到耳蜗第二圈或第三圈毛细胞,听力下降明显时才发现“耳聋”的存在[8]。
, http://www.100md.com
本组结果表明儿童(特别是新生儿、幼儿)即使按药典剂量、疗程正规给予氨基糖甙类抗生素,仍应密切注意其耳毒性损害的潜在危险,使用时应进行听觉电生理监测。在人类存在氨基糖甙类抗生素耳毒性高度敏感家族,主要是由于其线粒体12SrRNA基因发生1555A→G变异或961位胸腺嘧啶缺失、导致线粒体功能异常[10],这类儿童应尽量避免使用该类药物。故儿科临床用药前,应详细询问耳毒性抗生素高敏的家族史。有条件争取作该基因1555和961位点突变检测,以最大程度减少氨基糖甙类抗生素耳毒性损伤。
图2 实验第3天早产豚鼠基底膜底圈外毛细胞听毛改变(×1 260):第二、三排外毛细胞听毛倒伏、部分脱落
图3 实验第3天新生豚鼠基底膜底圈外毛细胞听毛改变(×1 200):第三排外毛细胞听毛倒伏、部分脱落
, 百拇医药
图4 实验第5天早产豚鼠基底膜底圈外毛细胞听毛改变及毛细胞缺失(×1 210):三排外毛细胞听毛均受累,听毛倒伏、部分脱落,并有毛细胞缺失。
图5 实验第5天新生豚鼠基底膜底圈外毛细胞听毛改变及毛细胞缺失(×1 200);第二、三排外毛细胞听毛倒伏、部分脱落,并有毛细胞缺失
图6实验第3天幼年豚鼠基底膜底圈外毛细胞听毛正常(×1 160):听毛排列整齐,无异常
图7 实验第3天成年豚鼠基底膜底圈外毛细胞听毛正常(×1 000):听毛排列整齐,无异常
, http://www.100md.com
图8 实验第5天幼年豚鼠基底膜底圈外毛细胞听毛改变(×1 200):第二、三排外毛细胞听毛倒伏部分脱落
图9 实验第5天成年豚鼠基底膜底圈外毛细胞听毛改变(×2 000):第三排外毛细胞听毛倒伏、部分脱落
参考文献
1,药理学实验编写组.药理学实验.北京:人民卫生出版社,1985.240-241.
2,丁大连.豚鼠全内耳终器硝酸银染色法.上海第二医科大学学报,1989,4:326-327.
3,Stockwell CW, Ades HW, Engstrom H. Patterns of hair cell damage after intense auditory stimulation. Ann Otol Rhinol Laryngol, 1969,78:1148-1168.
, http://www.100md.com
4,Henley CM, Rybak LP. Ototoxicity in developing mammals. Brain Res, 1995,20:69-90.
5,Schacht J. Biochemical basis of aminoglycoside ototoxicity. Otolaryngol Clin North Am, 1993, 26:845-856.
6,Lopez-Gonzalez MA, Delgado F, Lucas M. Aminoglycosides activate oxygen metabolites production in the cochlea of mature and developing rats. Hear Res, 1999,136:165-168.
7,Dolgova GV, Berezhinskaia VV, Firsov AA. Pharmacokinetics of amikacin in the perilymph and blood serum: an approach to the comparative evaluation of the potential ototoxicity of aminoglycoside antibiotics. Antibiot Med Biotechnol, 1986, 31:909-913.
, http://www.100md.com
8,王正敏,主编.耳鼻喉科学新理论与新技术.上海:上海科学技术出版社,1997.16-22.
9,Huy PTB, Meulemans A, Wassef M, et al. Gentamicin persistence in rat endolymph and perilymph after a two-day constant infusion. Antimicrob Agents Chemother, 1983, 23:344-346.
10,Casano RA, Johnson DF, Bykhovskaya Y, et al. Inherited susceptibility to aminoglycoside ototoxicity: genetic heterogeneity and clinical implications. Am J Otolaryngol, 1999, 20:151-156.
(收稿日期:1999-11-08), http://www.100md.com
单位:
许红梅(400014 重庆医科大学儿童医院感染消化科);王绍映(400014 重庆医科大学儿童医院感染消化科)
关键词:丁胺卡那霉素;剂量效应关系,药物;豚鼠;药代动力学
中华儿科杂志000905 【摘要】 目的 明确幼年动物对氨基糖甙类抗生素耳毒性有无更高敏感性。方法 用扫描电镜及光镜观察以等效人类治疗剂量下丁胺卡那霉素(AMK)注射的10只早产、31只新生、31只幼年及31只成年豚鼠毛细胞,并用TDx法研究新生、幼年及成年组各16只豚鼠药代动力学特征。结果 (1)单剂给药证实各年龄组均为二室开放性模型,峰浓度及达峰时间差异无显著性,但新生组清除率较其他组明显降低[分别为(0.004 4±0.001 1)、(0.009 7±0.004 2)和(0.008 8±0.001 4) L/(min.kg),均P<0.01],清除半衰期明显延长,[分别为(71±13)、(53±11)和(43±8) min,分别P<0.05、P<0.01],曲线下面积明显增大分别为[(11 462±431 7)、(8 349±147 0)和(8 166±321 3),均P<0.01];幼年、成年组无差异。多次给药新生组血药浓度明显高于同时点幼年、成年组,新生及幼年组存在明显体内药物蓄积。(2) 早产、新生组损伤出现早且严重,幼年组较成年组重;停药后毛细胞缺失数继续增多。结论 即使等效人类治疗剂量的AMK对幼年(尤其早产和新生)豚鼠耳蜗均有不同程度损害,并随用药时间延长而加重。幼年动物这种高敏感性与该药从体内排出慢、易蓄积有关。
, 百拇医药
Experimental study on the ototoxicity of amikacin at therapeutic doses in infant guinea pig
XU Hongmei,WANG Shaoying
(Department of Infectious and Digestive Diseases. Children's Hospital, Chongqing University of Medical Sciences, Chongqing 400014, China)
【Abstract】 Objective To clarify the possibility of higher sensitivity to ototoxicity of aminoglycosides and its causes in infant guinea pig by comparing the differences of ototoxicity and pharmacokinetics among different age groups of guinea pig (including premature and neonatal animals) given amikacin with therapeutic doses equal to clinical doses. Methods There were 31 guinea pigs in each of neonatal, infant and adult groups and 10 in premature group. Six guinea pigs in each group were used as control. Amikacin was intramuscularly injected at a dose of 65 mg/kg (which is equal to the clinical therapeutic dose) once a day for 14 days. Five to 8 guinea pigs in each group were sacrificed for histological and scanning electron-microscopic examination of cochlea on the day after the 3rd, 5th, 7th, 10th and 14th day of drug administration, as well as on the 28th day. Pharmacokinetic parameters were investigated in all but premature group with 16 guinea pigs from each by TDx system.Results(1) The Pharmacokinetic parameters were compatible with the model of two compartments in all age groups. There were no significant differences in the peak level and peak time among the groups. The neonatal group had lower plasma clearance than the infant and adult groups [(0.004 4±0.001 1), (0.009 7±0.004 2) and (0.008 8±0.001 4) L/(min.kg), P<0.01 for all]; the half-life for elimination was longer [(71±13), (53±11) and (43±8) min, P<0.05 and P<0.01 respectively]; the AUC was larger [(11 462±4 317), (8 349±1 470) and (8 166±3 213), P<0.01 for all]. There was no statistically significant difference between the infant and adult groups in single-dose pharmacokinetics. The blood levels of amikacin after daily administration in neonatal guinea pigs were predominantly higher than those in infant and adult groups, and were increased markedly since the 10th day. It did so in infant group since 14th day. These results indicated that there was an increased accumulation of amikacin in neonatal and infant guinea pigs. (2) On histological examinations of cochlea, many stereocilia were found lain down or disappeared as early as on the 3rd day and a number of outer hair cells were found disappeared on the 5th day in either premature or neonatal group on scanning electron-microscopy. The change of stereocilia at 5th day in infant and adult groups was similar to that in premature and neonatal groups. Microscopic observation showed that more hair cells were absent in neonatal group than in infant and adult groups after the 7th day (P<0.05 or P<0.01). The hair cell absence was more obvious in premature group than in neonatal group.The hair cell absence in infant group was more severe than in adult group on 28th day (P<0.05). The severity of cochlea damage became worse with a prolonged course of amikacin administration. Continuous damage was observed within 2 weeks after the drug administration was stopped in all groups. Conclusions Significant ototoxicity of amikacin to cochlea was well observed in infant guinea pigs with various severity, particularly in premature and neonatal animals at a dose equal to clinical therapeutic dose. The severity of cochlear damage became worse with a prolonged course of the administration. The ototoxicity occurred much earlier and more severe in premature and neonatal animals. The damage to cochlea could continue for quite a longer period after the drug administration was discontinued. The higher sensitivity to ototoxicity of amikacin in young guinea pigs seemed to be related to their much slow clearance and accumulation of amikacin. The results suggest that close attention should be paid to the danger of ototoxicity caused by aminoglycosides in children (especially in premature, neonate or infant) even they are administrated at a dose recommended by pharmacopeia and for a regular course. Auditory electrophysiological eximation should be used to monitor the audition during aminoglycosides administration. Aminoglycosides should be avoided in children as long as possible, esp. in those from families with higher sensitivity to ototoxicity of aminoglycosides.
, http://www.100md.com
【Key words】 Amikacin; Dose-response relationship, drug; Guinea pigs; Pharmacokinetics
氨基糖甙类抗生素耳毒性损害已成为目前我国儿童听力语言残疾的主要因素。本研究以耳蜗发育类似人类的豚鼠为对象、研究等效人类治疗剂量丁胺卡那霉素(AMK)在不同年龄组的药代动力学与耳蜗基底膜毛细胞形态学改变的关系,为深入探讨儿科合理使用该类药物提供理论依据。
材料与方法
一、实验材料
1.实验动物:耳蜗反射阳性、无中耳炎及外耳道炎的健康杂毛豚鼠(重庆医科大学实验动物中心提供),雌雄各半。31只成年豚鼠出生后5个月,体重500~600 g、31只幼年豚鼠出生后1~3周,体重150~250 g、31只新生豚鼠(孕龄65~70 d足月出生的豚鼠)、10只早产豚鼠(足月出生前1周剖宫产的豚鼠)。
, http://www.100md.com
2.AMK:苏州第六制药厂生产,批号:971222,豚鼠剂量按人[15 mg/(kg*d)]与动物等效剂量折算公式[1]计算为65 mg/(kg*d)。
3.试剂:AMK荧光偏振免疫测定试剂盒(南京军区南京总医院临床药理研究室提供,批号:981204),0.5%的硝酸银,10 %的甲醛,0.1 mol的磷酸缓冲液,4%的戊二醛。
二、研究方法
1.药代动力学:(1)单剂给药:新生组、幼年组、成年组各6只豚鼠,上午9时大腿内侧肌肉注射,单剂给予豚鼠AMK 65 mg/kg,给药后5、10、20、30、40、60、120、180、240 min割耳缘静脉各取血0.5 ml,分离血清,TDx仪测定AMK浓度,3P87程序求出每组各个动物药代动力学参数。(2)多次给药:新生组、幼年组、成年组各10只豚鼠(AMK剂量、途径同上),每日上午9时给药×14 d,实验第3、5、7、10、14 d给药后、各组达峰时间割耳缘静脉取血0.5 ml,测定AMK浓度。
, 百拇医药
2.耳蜗基底膜毛细胞形态学:(1)分组:实验组:新生组、幼年组、成年组各31只,早产组10只,处理方法同多次给药药代动力学;对照组:对照组各组同期饲养未给予任何处理的豚鼠各6只。(2)耳蜗标本收集时间:新生组、幼年组、成年组:第3、5天给药次日各组处死1只豚鼠取一侧耳蜗作扫描电镜标本,第7、10、14天给药次日及第28天分别处死7~8只豚鼠作光镜标本;早产组:第3、5天给药次日各处死一只豚鼠作扫描电镜标本,第28天处死8只豚鼠作光镜标本;对照组:各组同期饲养6只豚鼠第28天并处死作光镜检查(由于实验期间环境噪音有可能致少数毛细胞缺失,故选用与实验组环境相同、最长实验时间内未给予处理的豚鼠为对照组)。(3)光镜标本制备及观察:采用全内耳硝酸银染色法[2]制备标本及改良 Stockwell等[3]法(每圈基底膜随机取5个视野)计算耳蜗基底膜毛细胞缺失总数。(4)扫描电镜标本制备:断头处死豚鼠,2 min内用4%的戊二醛灌注固定耳蜗,0.1 mol磷酸缓冲液漂洗,锇酸固定、乙醇脱水、叔丁醇干燥、喷金并进行观察。
, 百拇医药
3.统计学分析:采用SPSS 8.0 for windows统计分析软件进行运算,均数间两两比较时进行方差分析后采用q检验。
结果
一、一般观察
所有动物精神食欲正常,实验期间体重增加;无站立不稳、毛发竖立或脱落等异常及死亡。
二、药代动力学
1.单剂给药药代动力学:各年龄组血药浓度-时间曲线见图1。AMK在各组体内均为二室开放性模型。药代动力学参数比较显示(表1):各组峰浓度(Cm) 及 达峰时间(tp)差异无显著性(P>0.05),新生组与幼年组、成年组比较,其清除半衰期[T(1)/(2)(β)]显著延长(分别P<0.05,P<0.01),清除率(Cl)显著降低(均P<0.01),曲线下面积[(AUC),表示在服用某一剂量的药物后一定时间内吸收入血的药物相对量]明显增大(均P<0.01),而幼年组与成年组比较差异无显著性(均P>0.05);说明AMK 从新生组体内清除较幼年组、成年组显著为慢。

, http://www.100md.com
图1 不同年龄组血药浓度时间曲线
2.多次给药药代动力学(表2):同时点各年龄组组间比较:新生组各时点血药浓度均高于幼年组(P<0.05或P<0.01)和成年组(P<0.05或P<0.01);幼年组与成年组比较,前者于第14天高于后者,差异有显著性(P<0.05),其余各时点两组间差异无显著性(P>0.05)。说明新生组多次给药后血药浓度累积性增高;年龄越小,AMK更易在体内蓄积。不同给药时间各年龄组内比较:?新生组各时点血药浓度比较差异有非常显著性(P<0.01),第3、5、7天间比较差异无显著性(均P>0.05),但这三个时点中血药浓度最高的第7天与第10、14天比较差异有显著性(分别P<0.05,P<0.01);幼年组各时点比较差异有显著性(P<0.05),第3、5、7、10天比较差异无显著性(均P>0.05),但第14天与第10天比较差异有显著性(P<0.05);成年组各时点差异均无显著性(P>0.05)。结果进一步表明,AMK在新生和幼年组体内有较明显的蓄积现象(以新生组明显)。
, 百拇医药
三、耳蜗毛细胞形态学
1.光镜结果(表3):各年龄组毛细胞缺失程度均随给药次数增加而逐渐加重,与对照组比较显示新生组于第7天已出现明显毛细胞缺失(P<0.01),而幼年组、成年组于第10天才有明显变化(均P<0.05);虽然各实验组于第14天均已停药,但实验第28天毛细胞缺失数进一步较第14天显著增高(均P<0.01)。说明年龄越小,损伤出现越早,停药后毛细胞损伤过程仍在继续。同时间组间比较显示早产组、新生组较幼年组、成年组毛细胞缺失数多(以早产组最严重),而第28天幼年组较成年组缺失数多,说明年龄越小,毛细胞缺失程度越重。
2.电镜结果:早产组、新生组在给药第3天已出现基底膜底圈毛细胞听毛改变(图2、3),第5天出现毛细胞缺失(图4、5),均以早产组损伤更明显;而幼年组、成年组第3天正常(图6、7),第5天才出现轻度听毛改变(图8、9)。
表1 新生组、幼年组、成年组药物动力学主要指标(
 ±s) 分组
±s) 分组, 百拇医药
动物数
(只)
tp(达峰时间)
(min)
Cm(峰浓度)
(μg/ml)
Cl(清除率)
[L/(min*kg)]
T(1)/(2)(β)(清除半衰期)
(min)
AUC(曲线下面积)
新生组
, 百拇医药
6
20±8
118±35
0.004 4±0.001 1
71±13
11 462±4 317
幼年组
6
13±3
129±38
0.009 7±0.004 2*
53±11**
, 百拇医药
8 349±1 470*
成年组
6
13±4
123±20
0.008 8±0.001 4*
43±8*
8 166±3 213*
F值
0.168
2.845
, 百拇医药
7.251△
9.413△
9.365△
与新生儿组比较:*P<0.01,**P<0.05;总比较: △ P<0.01表2 新生组、幼年组、成年组多次给药血药浓度(
 ±s,μg/ml) 分组
±s,μg/ml) 分组动物数
第3天
第5天
第7天
, 百拇医药
第10天
第14天
F值
新生组
10
153±16
161±16
166±12
183±23
198±26
8.859
幼年组
10
, http://www.100md.com
130±21*
137±26*
136±22*
143±23**
162±13*
3.314
成年组
10
136±23*
139±25*
145±20*
, http://www.100md.com
139±17**
143±16**△
1.256
F值
4.796
6.913
4.573
12.775
20.829
与新生组比较:*P<0.05,**P<0.01;与幼年组比较:△P<0.05表3 各组光镜下(×400)不同时间毛细胞缺失数(
 ±s) 分组
±s) 分组, http://www.100md.com
第7天
(n=7)
第10天
(n=7)
第14天
(n=7)
第28天
(n=8)
对照组(28天)
(n=6)
F值或t值
早产组
-
, 百拇医药
-
-
85±34
0.5 ±0.6
6.516
新生组
14±6
17±9
29±11
56±17△
0.17±0.4
36.372
幼年组
, 百拇医药
3±1.9*
7±3**
13±7**
30±11**
0.4 ±0.5
33.554
成年组
3±4*
5±3*
6±4*
14±6*▲
, 百拇医药
0.4 ±0.8
11.098
F值
7.573
12.775
20.429
20.205
0.172
注:与新生组比较:*P<0.01,**P<0.05;与早产组比较:△ P<0.05;与幼年组比较:▲ P<0.05讨论
我国每年新增3万聋儿,其中大多数为氨基糖甙类抗生素所致。本课题在排除病理因素情况下,以耳蜗发育类似人类的哺乳动物豚鼠[4]为研究对象,研究等效人类治疗剂量AMK在不同年龄组的药代动力学、耳蜗听觉感受细胞——毛细胞形态学变化,并探讨其关系,为临床正确用药提供实验依据。
, http://www.100md.com
即使相当人类治疗剂量的AMK,对幼年(尤其早产、新生)豚鼠耳蜗仍有不同程度损害,其程度重于成年组,并随用药时间的延长而加重。停药后,在相当长时间内其耳毒性损害继续加重。
药代动力学研究结果表明:AMK从新生豚鼠体内排出的速度较幼年、成年豚鼠缓慢。这与AMK在哺乳动物体内极少降解、药物几乎全以原形从肾脏滤过排出,而新生豚鼠肾脏功能发育不完善、滤过率低下有关[5]。新生豚鼠在多次给药后血药浓度高于幼年、成年豚鼠,并且于连续给药的第10天出现药物在体内的进行性蓄积现象,这除与药物在体内排出缓慢外,还可能与药物在体内进行性蓄积后导致肾脏损害、使肾小球滤过率进一步降低有关。可以推测,肾脏功能更不完善的早产豚鼠对AMK的清除更慢、更易发生药物在体内的蓄积。虽在幼年、成年豚鼠反映AMK从体内清除的参数无明显差异,但幼年组在多次给药的第14天也出现药物在体内的蓄积,推测与其肾脏功能储备能力低有关。以上均说明年龄越小,越要考虑连续用药后,AMK易在体内蓄积、导致更高血药浓度的可能性。
, http://www.100md.com
耳蜗毛细胞形态学研究显示:等效人类治疗剂量的AMK,对不同年龄期豚鼠耳蜗毛细胞均有不同程度的损害,但以幼年(尤其早产、新生)豚鼠损害较重。Lopez-Gonzalez等[6]曾报道使用氨基糖甙类药物后未成年大鼠耳蜗细胞中引起组织损伤的氧自由基明显增高,间接表明幼年动物对氨基糖甙类抗生素耳毒性有较高敏感性,而本实验结果从耳蜗组织学研究直接证明这一观点。据Dolgova等[7]报道内耳淋巴液中氨基糖甙类抗生素浓度与血中浓度密切相关,因而本实验中不同年龄期豚鼠体内药代动力学特征的差异是AMK在早产组和新生组更易引起耳蜗损伤、幼年组较成年组损伤严重的重要原因。早产豚鼠出现更严重耳毒性还与该药对毛细胞内多胺生物合成关键酶——鸟氨酸脱羧酶抑制程度有关,该酶受耳蜗发育程度的影响,其活性与耳蜗毛细胞及其神经末梢的成熟过程相一致,一旦被抑制后其受到的损伤程度较已经成熟的耳蜗(足月出生后)更严重[4]。
本实验还显示即使停药后各组毛细胞损伤现象仍继续发展,这与许多患者在停用氨基糖甙类药物后数周甚至数月才出现明显听力下降或停药后听力损害会继续加重现象一致[8]。据认为可能与药物从内耳淋巴液排除缓慢有关,有实验证明一次给药后,内耳淋巴液内该类药物的清除半衰期为血的5~6倍[9],药物在毛细胞内可残留达数周以上[5],连续给药则引起药物在内耳淋巴液内蓄积,从而导致毛细胞损伤在停药后仍可继续加重;此外,由于该类药早期损伤耳蜗底圈毛细胞,主要引起高音频的听力下降,即使已有听力障碍有可能不被及时发现,但随着耳毒性损害的加重、累及到耳蜗第二圈或第三圈毛细胞,听力下降明显时才发现“耳聋”的存在[8]。
, http://www.100md.com
本组结果表明儿童(特别是新生儿、幼儿)即使按药典剂量、疗程正规给予氨基糖甙类抗生素,仍应密切注意其耳毒性损害的潜在危险,使用时应进行听觉电生理监测。在人类存在氨基糖甙类抗生素耳毒性高度敏感家族,主要是由于其线粒体12SrRNA基因发生1555A→G变异或961位胸腺嘧啶缺失、导致线粒体功能异常[10],这类儿童应尽量避免使用该类药物。故儿科临床用药前,应详细询问耳毒性抗生素高敏的家族史。有条件争取作该基因1555和961位点突变检测,以最大程度减少氨基糖甙类抗生素耳毒性损伤。

图2 实验第3天早产豚鼠基底膜底圈外毛细胞听毛改变(×1 260):第二、三排外毛细胞听毛倒伏、部分脱落

图3 实验第3天新生豚鼠基底膜底圈外毛细胞听毛改变(×1 200):第三排外毛细胞听毛倒伏、部分脱落

, 百拇医药
图4 实验第5天早产豚鼠基底膜底圈外毛细胞听毛改变及毛细胞缺失(×1 210):三排外毛细胞听毛均受累,听毛倒伏、部分脱落,并有毛细胞缺失。

图5 实验第5天新生豚鼠基底膜底圈外毛细胞听毛改变及毛细胞缺失(×1 200);第二、三排外毛细胞听毛倒伏、部分脱落,并有毛细胞缺失

图6实验第3天幼年豚鼠基底膜底圈外毛细胞听毛正常(×1 160):听毛排列整齐,无异常

图7 实验第3天成年豚鼠基底膜底圈外毛细胞听毛正常(×1 000):听毛排列整齐,无异常

, http://www.100md.com
图8 实验第5天幼年豚鼠基底膜底圈外毛细胞听毛改变(×1 200):第二、三排外毛细胞听毛倒伏部分脱落

图9 实验第5天成年豚鼠基底膜底圈外毛细胞听毛改变(×2 000):第三排外毛细胞听毛倒伏、部分脱落
参考文献
1,药理学实验编写组.药理学实验.北京:人民卫生出版社,1985.240-241.
2,丁大连.豚鼠全内耳终器硝酸银染色法.上海第二医科大学学报,1989,4:326-327.
3,Stockwell CW, Ades HW, Engstrom H. Patterns of hair cell damage after intense auditory stimulation. Ann Otol Rhinol Laryngol, 1969,78:1148-1168.
, http://www.100md.com
4,Henley CM, Rybak LP. Ototoxicity in developing mammals. Brain Res, 1995,20:69-90.
5,Schacht J. Biochemical basis of aminoglycoside ototoxicity. Otolaryngol Clin North Am, 1993, 26:845-856.
6,Lopez-Gonzalez MA, Delgado F, Lucas M. Aminoglycosides activate oxygen metabolites production in the cochlea of mature and developing rats. Hear Res, 1999,136:165-168.
7,Dolgova GV, Berezhinskaia VV, Firsov AA. Pharmacokinetics of amikacin in the perilymph and blood serum: an approach to the comparative evaluation of the potential ototoxicity of aminoglycoside antibiotics. Antibiot Med Biotechnol, 1986, 31:909-913.
, http://www.100md.com
8,王正敏,主编.耳鼻喉科学新理论与新技术.上海:上海科学技术出版社,1997.16-22.
9,Huy PTB, Meulemans A, Wassef M, et al. Gentamicin persistence in rat endolymph and perilymph after a two-day constant infusion. Antimicrob Agents Chemother, 1983, 23:344-346.
10,Casano RA, Johnson DF, Bykhovskaya Y, et al. Inherited susceptibility to aminoglycoside ototoxicity: genetic heterogeneity and clinical implications. Am J Otolaryngol, 1999, 20:151-156.
(收稿日期:1999-11-08), http://www.100md.com