Ri质粒转化西洋参的研究Ⅰ.西洋参毛状根培养系统的建立及鉴定
作者:王冲之 丁家宜
单位:中国药科大学植物组织培养研究室,南京210038
关键词:发根农杆菌;西洋参;毛状根;鉴定
药物生物技术990204 摘 要 以西洋参(Panax quinquefolium L.)的胚为材料,在附加GA3和IBA的培养基上获得无菌苗。分别用含有Ri质粒的发根农杆菌(Agrobacterium rhizogenes)15834菌株及经过胡萝卜提取液处理后的该菌株感染无菌苗切段,在外加萘乙酸6mg/L的MS琼脂培养基培养后获得毛状根。胡萝卜处理组较未处理组转化率提高1倍,出根时间提前10d。转化根在不含激素的培养基上可快速生长,表现为典型的毛状根性状。PCR分析证实内含577bp rolC序列的TL-DNA已整合人转化株的染色体组。
Studies on Panax Quinquefolium L.Hairy
, http://www.100md.com
Root Transformed by Ri Plasmid I. Establishment
and Identification of Transformed Hairy
Root of Panax Quinqedfolium L.
Wang Chongzhi, Ding Jiayi
(Department of Plant Tissue Culture,China Pharmaceutical University,Nanj ing 210038)
Abstract The embryo of Panax quinquefolium L.were cultivated on the MS-medium with GA3 and IBA,and aseptic plants obtained.The plants were infected with the A grobacterium rhizogenes 15834 strain with Ri plasmid which treated with carrot extract.They were cultured on the MS-agar medium by adding NAA 6mg/L an d attained the hairy roots.The root inducing rate of the carrot-extract-trea ted group was twice of the non-treated group.And time need from inoculation to rooting was shorter 10d than that of non-treated group.The inducing roots gre w rapidly on phytohormone-free MS medium and showed typical hairy root phenotyp e.PCR analysis confirmed the integration of TL-DNA including 577bp rol C seque nce in the transformed plants.
, 百拇医药
Key Words Agrobacterium rhizogenes, Panax quinquefolium L., Hairy root, Identification
发根农杆菌(Agrobacterium rhizogenes)是瘤菌科的一种土壤杆菌,含有Ri质粒。它侵染植物后,Ri质粒的一段DNA(T-DNA)在植物细胞基因组的整合和表达导致毛状根的产生[1]。毛状根能在不含激素的培养基上生长。近年来,人们在一百多种植物中建立了毛状根培养系统[2]。五加科植物的药用价值很高,目前仅见该科的人参(Panax ginseng)有Ri质粒遗传转化的报道[3]。
西洋参(Panax quinquefolium L.)是一种珍贵的药用植物,属五加科人参属,原产于加拿大和美国,我国用药已有300多年的历史。其根部含有大量的皂甙和多糖。现代药理学研究成果证明,西洋参对机体有多方面的良性调节作用。虽然我国已引种成功,但国产西洋参不能满足国内用药需求,仍以进口为主。运用现代生物技术是西洋参研究的热点,然而,到目前为止还没有关于Ri质粒转化西洋参的报道。本文用发根农杆菌感染西洋参无菌苗切段,建立了西洋参毛状根培养系统。
, 百拇医药
1 材 料
1.1 西洋参种子
经过砂藏层积处理,已经裂口的西洋参种子,由中国农科院特产研究所提供。
1.2 发根农杆菌
所用菌株为15834,由武汉大学孙天恩教授惠赠。
1.3 植物激素
α-萘乙酸(NAA):化学纯,上海曹杨第二中学化工厂产品
3-吲哚丁酸(IBA):生化试剂,上海生化试剂站分装厂产品
赤霉素(GA3):生化试剂,上海华东师范大学化工厂产品
, 百拇医药
2,4-二氯苯氧乙酸(2,4-D),生化试剂,上海试剂四厂产品
6-糠氨基嘌呤(KT),生化试剂,上海丽珠东风生物技术有限公司产品
1.4 PCR分析所用试剂
rolC基因的引物:
引物1:
5′-GATATATGCCAAATTTACACTAG-3′,引物2:
5′-GTTAACAAAGTAGGAAACAGG-3′,由宝(大连)生物有限公司合成。
4×dNTP(各2mmol/L):Promega公司产品
λDNA/EcoRⅠ+HindⅢMarkers:Promega公司产品
, http://www.100md.com
TaqDNA聚合酶:Promega公司产品
10×PCR缓冲液:KCl500mmol/L,MgCl215mmol/L,Tris-HCl100mmol/L,pH8.3,所用试剂均为分析纯,南京化学试剂厂产品
2 方 法
2.1 无菌苗的培养
西洋参种子用清水彻底清洗后,剥去种皮,先放入75%酒精中1min,再转入含3%活性氯的次氯酸钠溶液中30min,进行表面灭菌,然后用无菌水冲洗5遍,剥取胚,接种于含有GA33mg/L,IBA0.5mg/L的MS琼脂培养基[4]上,25℃,光照条件下培养20~30d成苗。
2.2 发根农杆菌的处理
, http://www.100md.com
在菌种转化试验之前挑取单菌落接种于YMB液体培养基[5],22℃振荡培养30h(120r/min)。
细菌处理液的配制:胡萝卜处理组:取新鲜胡萝卜根30g,切碎,加少量水,匀浆后榨汁,得60mL,120℃20min灭菌后,于细菌接种前过滤,加入到90mLYMB无菌母液中,使得其他无机、有机成分与YMB培养基浓度相同。未处理组为YMB液体培养基。
细菌处理:吸取前述菌液少许,分别加入到上述两种培养液中,22℃振荡培养24h(120r/min),感染前稀释至106~107个细菌/mL。
2.3 转化方法
将无菌苗切成小段,取叶柄、叶两部分,置稀释后的农杆菌菌液中,轻轻振荡30min,取出,用滤纸吸去多余的菌液,平置于含2,4-D1mg/L,KT0.1mg/L及含NAA6mg/L的MS琼脂培养基上共培养3d,然后转入含有头孢唑啉250mg/L、青霉素250mg/L的MS琼脂培养基,每隔5~7d转接一次。
, 百拇医药
2.4 毛状的培养及初步筛选
切下侵染部位长出的毛状根,每条毛状根分别接种于上述抑菌培养基上,每隔5~7d转接一次,经3~5次继代培养获得除菌的毛根系。毛根系在不含激素的MS和改良White琼脂培养基[4]中保存和繁殖,或在改良White液体培养基中振荡培养(100r/min),培养温度23±1℃。从87个株系中筛选出D101,D301,E106等几个生长较快的株系。
2.5 植物DNA提取
按照Rogers等的CTAB提取方法[6],从毛状根和非转化的西洋参愈伤组织各0.5g中提取植物总DNA。
2.6 PCR分析
在0.5ml硅化离心管中加入10×PCR缓冲液2μl,4×dNTP1μl,两种引物各1μl,TaqDNA聚合酶1U,模板DNA1μl(0.5μg),加无菌重蒸馏水至终体积20μl,混匀并离心,加石蜡油50μl。在自动PCR仪上进行以下反应过程:94℃变性45sec,45℃退火30sec,72℃反应45sec,30个循环。最后于72℃延伸反应10min。扩增产物采用0.7%琼脂糖凝胶电泳和EtBr染色进行分析。
, http://www.100md.com
3 结果与分析
3.1 激素配比对出根的影响
西洋参叶柄及叶的无菌切段被发根农杆菌侵染后,在抑菌培养过程中,叶柄有70%褐化死亡,叶有40%~50%逐渐死亡。农杆菌与外植体共培养时激素的配比对结果影响很大。在添加2,4-D1mg/L,KT0.1mg/L的MS琼脂培养基上培养,未获得毛状根;而用含NAA6mg/L的MS琼脂培养基培养,产生毛状根。
3.2 胡萝卜提取液对出根的影响
农杆菌和外植体在含NAA6mg/L的MS琼脂培养基上共培养后,于感染后4~6周,被感染部位出现愈伤组织,愈伤组织逐渐长大并生出毛状根(图1)。胡萝卜处理组最早出根在感染后第30天,而未处理最早出根在感染后第40天。胡萝卜提取液处理组较未处理组出根率高1倍(表1)。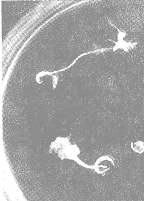

, http://www.100md.com
Fig 1 Explants infected by Agr obacterium thizogenes 15834
Tab 1 Rooting capacity of explants infected and non-infected
with Agrobacterium rhizogenes strain 15834 Type
15834 treated with
15834 non-treated
Non-infected
carrot
extract
, 百拇医药
Explants
Petiole
Leaf
P etiole
Leaf
Petiole
Leaf
Number of infecting
73
35
82
29
, 百拇医药 46
25
Number of survive
24
21
25
15
24
16
Number of rooting
8
1
4
, 百拇医药
-
-
-
Explants with roots(%)
33.3
4.8
16.0
-
-
-
Time need from inoculation to rooting(d)
30
, http://www.100md.com
45
40
-
-
-
3.3 转化毛状根的分离和选择
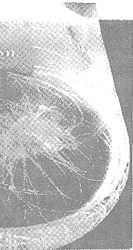
从感染部位切下的根经除菌后转入不含激素的MS或改良White琼脂培养基即可快速生长(图2)。初期培养时部分株系的根先加粗,稍愈伤化,继而生出较多根,当根长到一定量时大量分枝。生长较好的株系毛状根性状明显,根毛多,分枝多,失去向地性,生长速度较快,在不含激素的改良White液体培养基中生长速度更快。少数一些株系则几乎完全愈伤化,在无外源激素条件下愈伤组织生长较快。经过几代培养,初步筛选出几个生长较快的株系(图3),进行培养条件优化的研究。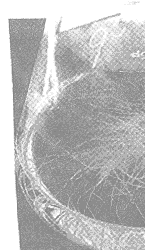
, 百拇医药
Fig 2 Hairy root D301~D307 strain cultured
in hormone-free improv e-White medium

Fig 3 Hairy root D101 strain cultured in
hormone-free liquid improve-White medium
3.4 PCR分析
利用PCRrolC基因的两引物,能从毛状根的总DNA中扩增到577bp的特异DNA片段,该片段与从阳性对照(发根农杆菌15834菌株)DNA中扩增出的特异性片段相同。非转化的西洋参愈伤组织的总DNA中扩增不到此片段(图4),这从分子水平说明Ri TL-DNA已整合入西洋参的染色体组。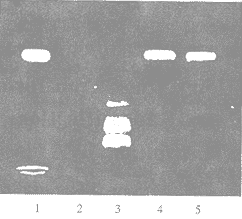
, 百拇医药
1.Agrobasterium rhizogenes 15834
2.Non-transformed callus
3.λDNA/EcoRⅠ+HindⅢ markers
4.Transformed hairy root D101 strain
5.Transformed hairy root E106 strain
Fig 4 PCR analysis:Agarose gel electrophoresis of PCR amplified samp les
4 讨 论
发根农杆菌感染植物的过程类似于根癌农杆菌(Agrob acterium rumefaciens),目前对后者研究较多。根癌农杆菌感染双子叶植物细胞是一个连续的过程,其中非常重要的一步就是Ti质粒上Vir区基因的激活。胡萝卜、烟草对农杆菌非常敏感。研究证明其中含有较多的酚类物质,而一些难以诱导的植物中酚类物质含量则很低[7]。本实验用胡萝卜提取液处理发根农杆菌后缩短了对西洋参的转化过程所需时间,诱导率也明显提高,证明胡萝卜中所含物质对转化有利,且经高温灭菌处理仍保持其活性,这可为其他对农杆菌不敏感植物的转化提供参考。
, 百拇医药
外植体器官差别对出根有很大影响。本实验曾做了西洋参无菌子叶的感染,未获得成功。西洋参的叶很难诱导毛根。叶柄则较为容易,尤其是带部分叶的叶柄生命力强,也更易获得毛状根。这可能是因为叶柄细胞再生能力强,有明显的创伤反应,伤口附近的细胞较易脱分化形成较多的感受态细胞,从而有利于农杆菌诱导毛状根。
农杆菌与外植体共培养时,培养基中所加激素的选择对诱导也有重要的影响。本文曾参考人参愈伤组织培养条件[8],用添加2,4-D1mg/L,KT0.1mg/L的MS琼脂培养基,未能诱导出毛状根。使用高浓度的NAA可诱导西洋参无菌苗切段形成愈伤组织,且愈伤组织在生长过程中生出较多的不定根。本实验使用添加NAA6mg/L的MS琼脂培养基进行农杆菌与外植体共培养,成功地获得了毛状根。NAA在诱导伤口处细胞分生的同时,可能更有利于T-DNA整合进植物的基因组及毛状根的产生。
据文献报道,一般植物在感染发根农杆菌后2~4周即可长出毛状根[2]。而本实验用未处理的15834菌株感染西洋参最早出根在第40d,比一般双子叶植物晚了近1倍。这可能是五加科植物生长较慢的缘故。同时也提示我们在对农杆菌不敏感的植物进行转化时,应延长感染后的观察时间。
, 百拇医药
本实验建立了西洋参毛状根培养系统,毛状根在不含激素的培养基上生长良好,这对探索西洋参新的药用资源有重要的意义。
参考文献
1 White F F,Nester E W.Hairy root:plasmid encodes virulence trails in Agrobacterium rhizogenes.J Bacteriol,1980,141(3)∶1134
2 周立刚,王君健,杨崇仁.植物毛状根的培养及其化学进展Ⅰ.植物毛状根的诱导形成与培养.天然产物研究与开发,1998,10(3)∶287
3 Yoshikawa T,Furuya T.Saponin production by cultures of Panax ginseng transformed with Agrobacterium rhizogenes.Plant Cell Reports, 1987,6(6)∶449
, 百拇医药
4 江苏省植物组织培养研究协会编著.经济植物组织培养实用技术.南京: 江苏科学技术出版社,1986.237
5 Hooykaas P J J, Klapwik P M, Nuti M P, et al. Transfer of the Agrobacterium tumefaciens Ti plasmid to virulent Agrobacteria and to Rhizobium explants. J Gen Microbiol, 1997,9 8(3)∶477
6 Rogers S O,Bendich A J.Extraction of DNA from milligram amo unts of fresh,herbarium and mummified plant tissues.Plant Mol Biol,1985,5(2)∶69
7 Ashby A M,Watson M D,Loake G J,et al.Ti plasmid-specified chemotax is of Agrobacterium tumefaciens C58C′toward vir-inducing phenolic compounds and soluble factors from monocotyledonous and dicotyledonous plants.J Bacteriol, 1998,170(9)∶4181
8 Ding J Y,Chen Q,Xiang D J,et al.Studies on medicinal products from Pan ax ginseng cell culture.Proceeding of Asia-pacific conference on agricultur al biotechnology,China Science and Technology Press,Beijing,1992,361
收稿日期:1999-01-06, 百拇医药
单位:中国药科大学植物组织培养研究室,南京210038
关键词:发根农杆菌;西洋参;毛状根;鉴定
药物生物技术990204 摘 要 以西洋参(Panax quinquefolium L.)的胚为材料,在附加GA3和IBA的培养基上获得无菌苗。分别用含有Ri质粒的发根农杆菌(Agrobacterium rhizogenes)15834菌株及经过胡萝卜提取液处理后的该菌株感染无菌苗切段,在外加萘乙酸6mg/L的MS琼脂培养基培养后获得毛状根。胡萝卜处理组较未处理组转化率提高1倍,出根时间提前10d。转化根在不含激素的培养基上可快速生长,表现为典型的毛状根性状。PCR分析证实内含577bp rolC序列的TL-DNA已整合人转化株的染色体组。
Studies on Panax Quinquefolium L.Hairy
, http://www.100md.com
Root Transformed by Ri Plasmid I. Establishment
and Identification of Transformed Hairy
Root of Panax Quinqedfolium L.
Wang Chongzhi, Ding Jiayi
(Department of Plant Tissue Culture,China Pharmaceutical University,Nanj ing 210038)
Abstract The embryo of Panax quinquefolium L.were cultivated on the MS-medium with GA3 and IBA,and aseptic plants obtained.The plants were infected with the A grobacterium rhizogenes 15834 strain with Ri plasmid which treated with carrot extract.They were cultured on the MS-agar medium by adding NAA 6mg/L an d attained the hairy roots.The root inducing rate of the carrot-extract-trea ted group was twice of the non-treated group.And time need from inoculation to rooting was shorter 10d than that of non-treated group.The inducing roots gre w rapidly on phytohormone-free MS medium and showed typical hairy root phenotyp e.PCR analysis confirmed the integration of TL-DNA including 577bp rol C seque nce in the transformed plants.
, 百拇医药
Key Words Agrobacterium rhizogenes, Panax quinquefolium L., Hairy root, Identification
发根农杆菌(Agrobacterium rhizogenes)是瘤菌科的一种土壤杆菌,含有Ri质粒。它侵染植物后,Ri质粒的一段DNA(T-DNA)在植物细胞基因组的整合和表达导致毛状根的产生[1]。毛状根能在不含激素的培养基上生长。近年来,人们在一百多种植物中建立了毛状根培养系统[2]。五加科植物的药用价值很高,目前仅见该科的人参(Panax ginseng)有Ri质粒遗传转化的报道[3]。
西洋参(Panax quinquefolium L.)是一种珍贵的药用植物,属五加科人参属,原产于加拿大和美国,我国用药已有300多年的历史。其根部含有大量的皂甙和多糖。现代药理学研究成果证明,西洋参对机体有多方面的良性调节作用。虽然我国已引种成功,但国产西洋参不能满足国内用药需求,仍以进口为主。运用现代生物技术是西洋参研究的热点,然而,到目前为止还没有关于Ri质粒转化西洋参的报道。本文用发根农杆菌感染西洋参无菌苗切段,建立了西洋参毛状根培养系统。
, 百拇医药
1 材 料
1.1 西洋参种子
经过砂藏层积处理,已经裂口的西洋参种子,由中国农科院特产研究所提供。
1.2 发根农杆菌
所用菌株为15834,由武汉大学孙天恩教授惠赠。
1.3 植物激素
α-萘乙酸(NAA):化学纯,上海曹杨第二中学化工厂产品
3-吲哚丁酸(IBA):生化试剂,上海生化试剂站分装厂产品
赤霉素(GA3):生化试剂,上海华东师范大学化工厂产品
, 百拇医药
2,4-二氯苯氧乙酸(2,4-D),生化试剂,上海试剂四厂产品
6-糠氨基嘌呤(KT),生化试剂,上海丽珠东风生物技术有限公司产品
1.4 PCR分析所用试剂
rolC基因的引物:
引物1:
5′-GATATATGCCAAATTTACACTAG-3′,引物2:
5′-GTTAACAAAGTAGGAAACAGG-3′,由宝(大连)生物有限公司合成。
4×dNTP(各2mmol/L):Promega公司产品
λDNA/EcoRⅠ+HindⅢMarkers:Promega公司产品
, http://www.100md.com
TaqDNA聚合酶:Promega公司产品
10×PCR缓冲液:KCl500mmol/L,MgCl215mmol/L,Tris-HCl100mmol/L,pH8.3,所用试剂均为分析纯,南京化学试剂厂产品
2 方 法
2.1 无菌苗的培养
西洋参种子用清水彻底清洗后,剥去种皮,先放入75%酒精中1min,再转入含3%活性氯的次氯酸钠溶液中30min,进行表面灭菌,然后用无菌水冲洗5遍,剥取胚,接种于含有GA33mg/L,IBA0.5mg/L的MS琼脂培养基[4]上,25℃,光照条件下培养20~30d成苗。
2.2 发根农杆菌的处理
, http://www.100md.com
在菌种转化试验之前挑取单菌落接种于YMB液体培养基[5],22℃振荡培养30h(120r/min)。
细菌处理液的配制:胡萝卜处理组:取新鲜胡萝卜根30g,切碎,加少量水,匀浆后榨汁,得60mL,120℃20min灭菌后,于细菌接种前过滤,加入到90mLYMB无菌母液中,使得其他无机、有机成分与YMB培养基浓度相同。未处理组为YMB液体培养基。
细菌处理:吸取前述菌液少许,分别加入到上述两种培养液中,22℃振荡培养24h(120r/min),感染前稀释至106~107个细菌/mL。
2.3 转化方法
将无菌苗切成小段,取叶柄、叶两部分,置稀释后的农杆菌菌液中,轻轻振荡30min,取出,用滤纸吸去多余的菌液,平置于含2,4-D1mg/L,KT0.1mg/L及含NAA6mg/L的MS琼脂培养基上共培养3d,然后转入含有头孢唑啉250mg/L、青霉素250mg/L的MS琼脂培养基,每隔5~7d转接一次。
, 百拇医药
2.4 毛状的培养及初步筛选
切下侵染部位长出的毛状根,每条毛状根分别接种于上述抑菌培养基上,每隔5~7d转接一次,经3~5次继代培养获得除菌的毛根系。毛根系在不含激素的MS和改良White琼脂培养基[4]中保存和繁殖,或在改良White液体培养基中振荡培养(100r/min),培养温度23±1℃。从87个株系中筛选出D101,D301,E106等几个生长较快的株系。
2.5 植物DNA提取
按照Rogers等的CTAB提取方法[6],从毛状根和非转化的西洋参愈伤组织各0.5g中提取植物总DNA。
2.6 PCR分析
在0.5ml硅化离心管中加入10×PCR缓冲液2μl,4×dNTP1μl,两种引物各1μl,TaqDNA聚合酶1U,模板DNA1μl(0.5μg),加无菌重蒸馏水至终体积20μl,混匀并离心,加石蜡油50μl。在自动PCR仪上进行以下反应过程:94℃变性45sec,45℃退火30sec,72℃反应45sec,30个循环。最后于72℃延伸反应10min。扩增产物采用0.7%琼脂糖凝胶电泳和EtBr染色进行分析。
, http://www.100md.com
3 结果与分析
3.1 激素配比对出根的影响
西洋参叶柄及叶的无菌切段被发根农杆菌侵染后,在抑菌培养过程中,叶柄有70%褐化死亡,叶有40%~50%逐渐死亡。农杆菌与外植体共培养时激素的配比对结果影响很大。在添加2,4-D1mg/L,KT0.1mg/L的MS琼脂培养基上培养,未获得毛状根;而用含NAA6mg/L的MS琼脂培养基培养,产生毛状根。
3.2 胡萝卜提取液对出根的影响
农杆菌和外植体在含NAA6mg/L的MS琼脂培养基上共培养后,于感染后4~6周,被感染部位出现愈伤组织,愈伤组织逐渐长大并生出毛状根(图1)。胡萝卜处理组最早出根在感染后第30天,而未处理最早出根在感染后第40天。胡萝卜提取液处理组较未处理组出根率高1倍(表1)。


, http://www.100md.com
Fig 1 Explants infected by Agr obacterium thizogenes 15834
Tab 1 Rooting capacity of explants infected and non-infected
with Agrobacterium rhizogenes strain 15834 Type
15834 treated with
15834 non-treated
Non-infected
carrot
extract
, 百拇医药
Explants
Petiole
Leaf
P etiole
Leaf
Petiole
Leaf
Number of infecting
73
35
82
29
, 百拇医药 46
25
Number of survive
24
21
25
15
24
16
Number of rooting
8
1
4
, 百拇医药
-
-
-
Explants with roots(%)
33.3
4.8
16.0
-
-
-
Time need from inoculation to rooting(d)
30
, http://www.100md.com
45
40
-
-
-
3.3 转化毛状根的分离和选择
从感染部位切下的根经除菌后转入不含激素的MS或改良White琼脂培养基即可快速生长(图2)。初期培养时部分株系的根先加粗,稍愈伤化,继而生出较多根,当根长到一定量时大量分枝。生长较好的株系毛状根性状明显,根毛多,分枝多,失去向地性,生长速度较快,在不含激素的改良White液体培养基中生长速度更快。少数一些株系则几乎完全愈伤化,在无外源激素条件下愈伤组织生长较快。经过几代培养,初步筛选出几个生长较快的株系(图3),进行培养条件优化的研究。


, 百拇医药
Fig 2 Hairy root D301~D307 strain cultured
in hormone-free improv e-White medium


Fig 3 Hairy root D101 strain cultured in
hormone-free liquid improve-White medium
3.4 PCR分析
利用PCRrolC基因的两引物,能从毛状根的总DNA中扩增到577bp的特异DNA片段,该片段与从阳性对照(发根农杆菌15834菌株)DNA中扩增出的特异性片段相同。非转化的西洋参愈伤组织的总DNA中扩增不到此片段(图4),这从分子水平说明Ri TL-DNA已整合入西洋参的染色体组。

, 百拇医药
1.Agrobasterium rhizogenes 15834
2.Non-transformed callus
3.λDNA/EcoRⅠ+HindⅢ markers
4.Transformed hairy root D101 strain
5.Transformed hairy root E106 strain
Fig 4 PCR analysis:Agarose gel electrophoresis of PCR amplified samp les
4 讨 论
发根农杆菌感染植物的过程类似于根癌农杆菌(Agrob acterium rumefaciens),目前对后者研究较多。根癌农杆菌感染双子叶植物细胞是一个连续的过程,其中非常重要的一步就是Ti质粒上Vir区基因的激活。胡萝卜、烟草对农杆菌非常敏感。研究证明其中含有较多的酚类物质,而一些难以诱导的植物中酚类物质含量则很低[7]。本实验用胡萝卜提取液处理发根农杆菌后缩短了对西洋参的转化过程所需时间,诱导率也明显提高,证明胡萝卜中所含物质对转化有利,且经高温灭菌处理仍保持其活性,这可为其他对农杆菌不敏感植物的转化提供参考。
, 百拇医药
外植体器官差别对出根有很大影响。本实验曾做了西洋参无菌子叶的感染,未获得成功。西洋参的叶很难诱导毛根。叶柄则较为容易,尤其是带部分叶的叶柄生命力强,也更易获得毛状根。这可能是因为叶柄细胞再生能力强,有明显的创伤反应,伤口附近的细胞较易脱分化形成较多的感受态细胞,从而有利于农杆菌诱导毛状根。
农杆菌与外植体共培养时,培养基中所加激素的选择对诱导也有重要的影响。本文曾参考人参愈伤组织培养条件[8],用添加2,4-D1mg/L,KT0.1mg/L的MS琼脂培养基,未能诱导出毛状根。使用高浓度的NAA可诱导西洋参无菌苗切段形成愈伤组织,且愈伤组织在生长过程中生出较多的不定根。本实验使用添加NAA6mg/L的MS琼脂培养基进行农杆菌与外植体共培养,成功地获得了毛状根。NAA在诱导伤口处细胞分生的同时,可能更有利于T-DNA整合进植物的基因组及毛状根的产生。
据文献报道,一般植物在感染发根农杆菌后2~4周即可长出毛状根[2]。而本实验用未处理的15834菌株感染西洋参最早出根在第40d,比一般双子叶植物晚了近1倍。这可能是五加科植物生长较慢的缘故。同时也提示我们在对农杆菌不敏感的植物进行转化时,应延长感染后的观察时间。
, 百拇医药
本实验建立了西洋参毛状根培养系统,毛状根在不含激素的培养基上生长良好,这对探索西洋参新的药用资源有重要的意义。
参考文献
1 White F F,Nester E W.Hairy root:plasmid encodes virulence trails in Agrobacterium rhizogenes.J Bacteriol,1980,141(3)∶1134
2 周立刚,王君健,杨崇仁.植物毛状根的培养及其化学进展Ⅰ.植物毛状根的诱导形成与培养.天然产物研究与开发,1998,10(3)∶287
3 Yoshikawa T,Furuya T.Saponin production by cultures of Panax ginseng transformed with Agrobacterium rhizogenes.Plant Cell Reports, 1987,6(6)∶449
, 百拇医药
4 江苏省植物组织培养研究协会编著.经济植物组织培养实用技术.南京: 江苏科学技术出版社,1986.237
5 Hooykaas P J J, Klapwik P M, Nuti M P, et al. Transfer of the Agrobacterium tumefaciens Ti plasmid to virulent Agrobacteria and to Rhizobium explants. J Gen Microbiol, 1997,9 8(3)∶477
6 Rogers S O,Bendich A J.Extraction of DNA from milligram amo unts of fresh,herbarium and mummified plant tissues.Plant Mol Biol,1985,5(2)∶69
7 Ashby A M,Watson M D,Loake G J,et al.Ti plasmid-specified chemotax is of Agrobacterium tumefaciens C58C′toward vir-inducing phenolic compounds and soluble factors from monocotyledonous and dicotyledonous plants.J Bacteriol, 1998,170(9)∶4181
8 Ding J Y,Chen Q,Xiang D J,et al.Studies on medicinal products from Pan ax ginseng cell culture.Proceeding of Asia-pacific conference on agricultur al biotechnology,China Science and Technology Press,Beijing,1992,361
收稿日期:1999-01-06, 百拇医药