逆转录病毒载体介导的标志基因转移研究
作者:傅建新 陈子兴 王玮 潘金兰 阮长耿
单位:苏州医学院附属第一医院,江苏省血液研究所,苏州,215006
关键词:逆转录病毒;报告基因;基因转移;白血病
苏州医学院学报990902 摘要 目的:为建立高效、安全的逆转录病毒介导的基因标记系统。方法:用脂质体方法将含有标志基因NeoR的逆转录病毒载体LXSN导入包装细胞PA317;通过与单向型包装细胞GPE86相互转导,获得高滴度的双嗜型产病毒细胞,并以其对人类白血病细胞进行基因标记。结果:脂质体转染法获得的病毒滴度约为2.0×105CFU/ml,而与GP+E86细胞转导后可提高至2.8×106CFU/ml;重组病毒转导白血病细胞(HL-60,K562,KG-1)后,聚合酶链反应(PCR)证实NeoR基因整合到靶细胞基因组,巢式PCR与补救分析均未能检测到辅助病毒。结论:“乒乓效应”可显著提高逆转录病毒滴度,而逆转录病毒介导的基因标记系统是安全的。
, 百拇医药
中图法分类 R392-33;R458
Retroviral-Mediated Reporter Gene Transfer in Human Leukemic Cells
Fu Jianxin,Chen Zixin,Ran Changgen,et al
(Jiangsu Institute of Hematology,First Hospital Affiliated to Suzhou Medical College,Suzhou,215006)
Abstract To develop an efficient gene marking system mediated by replicationincompetent retrovirus,the vector LXSN,containing NeoR gene,was transfected into amphotropic packaging cells PA317 by liposome transfection method.The retroviruscontaining supernatants were used to infect ecotropic packaging cells GP+E86. Then the PA317 cells were repeatedly infected by ecotropic virus from the GP+E86 producers to increase virus titer.This high titer retrovirus was applied to transduce the human leukemic cells.Results:The titer of liposome transfected PA317 pools assayed on NIH3T3 cells was 2.0×105 CFU/ml while the titer of GP+E86 cells transduced by amphotropic virus was 8.1×106 CFU/ml.By means of “ping-pong transduction”,the titer of PA317/NeoR cells could be markedly improved to 2.8×106 CFU/ml.Successful integration of NeoR gene into human leukemic cells (HL-60,K562,and KG-1) was verified by polymerase chain reaction(PCR).No helper virus could be found by both nested PCR and rescue assay.In conclusion,the so-called “ping-pong effect” could efficiently improve virus titer,and the safety of this gene transfer system might provide an optimal method for human gene marking/therapy.
, 百拇医药
Key words retrovirus;reporter genes;gene transfer;leukemia
逆转录病毒介导的基因移转已被现有多数基因治疗临床试验方案采用[1]。在进行基因治疗/标记时,基因转移系统的安全性至关重要,而获得高滴度病毒则是决定转移效率的关键因素。本文通过逆转录病毒将报告基因NeoR导入白血病细胞,研究其可行性与安全性,为下一步对造血干细胞进行基因转移奠定基础。
1 材料与方法
1.1 细胞系与质粒:人白血病细胞(HL-60、K562与KG-1)和NIH3T3由本室保存;双嗜型(PA317和单向型(GP+E86)逆转录病毒包装细胞分别由ATCC(CRL9078)和Bank博士(哥伦比亚大学,美国)提供,以含15%小牛血清的高糖DMEM(4.5g/L葡萄糖,Gibco-BRL)在37℃、5%CO2中培养。携带新霉素磷酸转移酶Ⅱ基因(NeoR)的逆转录病毒载体LXSN由Cowan博士(NCI,美国)惠赠,按分子生物学常规方法鉴定、扩增。
, 百拇医药
1.2 病毒生产细胞:取Wizard微量系统(Promega)纯化的LXSN质粒DNA 2μg,用脂质体试剂DOSPER(Boehringer Mannheim)转染包装细胞PA317,并以0.8g/L G418(Gibco-BRL)筛选获得耐药克隆;将含重组病毒的混合耐药细胞培养上清用0.45μm滤膜过滤,加至传代24h的GP+E86细胞中(2ml/105细胞),并加入终浓度8mg/L的聚凝胺(Polybrene,Sigma),37℃感染2h后换成新鲜病毒悬液重复感染一次,然后加入培养基使聚凝胺降至2mg/L,48h后以0.8g/L G418选择培养,获得单向型病毒生产细胞GP+E86/NeoR。以GP+E86/NeoR细胞上清同上重复感染PA317细胞,获得扩增的双嗜型病毒生产细胞PA317/NeoR。NIH3T3为受体细胞测定上清的病毒滴度。
1.3 白血病细胞的基因标记:将扩增的PA317/NeoR细胞扩大培养、制备高滴度的重组病毒悬液,并用其感染白血病细胞。转导2次后,将靶细胞离心并加入新鲜培养基培养48h,然后在含0.8g/L G418的培养基中选择培养2周。
, http://www.100md.com
1.4 检测整合的NeoR基因:根据NeoR基因序列设计并合成特异性引物,以快速法制备的基因组DNA[2]为模板,用聚合酶链反应(PCR)分析NeoR基因的整合状况。引物序列Neol∶5'-CGTTG-TCACT GAAGC GGGAA GG-3',Neo2∶5'-CCATG ATATT CGGCA AGCAG GC-3'(复旦大学遗传学研究所卢大儒博士馈赠);PCR试剂由上海生工公司提供。PCR反应参数:95℃30s,63℃45s,共30个循环。扩增产物经2%琼脂糖凝胶电泳分析。
1.5 巢式PCR检测辅助病毒env基因:根据双嗜型鼠白血病病毒4070A的env基因序列合成巢式PCR引物(见图1),分别为外侧引物env1(5'-GGGAG TCCTG TTAGG AGTAG GG-3')与env2(5'-ATGAT GTG GG CTTCC AGTAA GC-3'),内侧引物env3(5'-ACCAA CCTGA TGACT GGGCG-3')与env4(5'-CCCGA CTTTA CGGTA TGCCC-3')。常规蛋白酶K-酚/氯仿法提取病毒转导的白血病细胞DNA,并进行巢式PCR扩增,以PA317细胞为阳性对照。反应条件为:94℃30s,60℃30s,72℃60s,共32个循环。
, 百拇医药
图1 包装细胞PA317内病毒反式结构基因示意图,图中显示扩增env基因的引物相对位置及产物。
1.6 标志基因补救分析检测辅助病毒:参照文献[3]进行。
2 结果
2.1 病毒生产细胞的鉴定:经脂质体介导将LXSN质粒转染PA317细胞,以G418选择得到耐药克隆,其混合上清中病毒滴度约为2.0×105CFU/ml。由于PA317细胞和GP+E86细胞具有不同的包膜蛋白ENV,可利用所谓的“乒乓效应”来提高病毒滴度,结果发现GP+E86/NeoR细胞所产生的单向型病毒滴度可达8.1×106CFU/ml;而以其重复转导所得的扩增的双嗜型病毒生产细胞PA317/NeoR的滴度亦被提高到2.8×106CFU/ml。此外,PCR证实NeoR基因已整合到两种生产细胞的基因组(图2)。
, 百拇医药
图2 PCR分析NeoR基因的整合
1 PA317/NeoR细胞 2 GP+E86/NeoR细胞 3 HL-60/NeoR细胞 4 K562/NeoR 5 KG-1/NeoR细胞 6 阴性对照 7 X174RF DNA/HaeⅢ分子量标准(Gibco-BRL)
X174RF DNA/HaeⅢ分子量标准(Gibco-BRL)
2.2 逆转录病毒介导标志基因转移:用滴度约为2.8×106CFU/ml的病毒感染HL-60、K562与KG-1细胞,经G418筛选相应获得抗性细胞HL-60/NeoR、K562/NeoR与KG-1/NeoR。PCR证实,3种转导的白血病细胞均可扩增出NeoR基因特异的347bp片段(图2)。提示逆转录病毒已将NeoR基因成功转移入白血病细胞并整合到基因组。
, 百拇医药
2.3 辅助病毒的检测:用于介导基因转移的逆转录病毒为仅有一次感染能力的复制缺陷型病毒,病毒结构基因(如:gag,pol,env等)不应被包装入病毒颗粒,靶细胞被转导后也无反式结构基因的整合,因而检测靶细胞内的env基因可反映辅助病毒。分别以HL-60/NeoR、K562/NeoR与KG-1/NeoR的基因组DNA(图3)为模板进行巢式PCR扩增,结果如图3所示:3种靶细胞均未扩增出env基因产物(224bp),而对照PA317细胞则为强阳性,说明无辅助病毒产生和转移。在标志基因补救分析实验中,本研究使用的重组病毒不能与NIH3T3/NeoR细胞已含有的病毒顺式结构基因发生反式互补,因而不能将NeoR基因转移至NIH3T3受体细胞,经G418选择后未发现抗性克隆,在功能性检测方面证实本系统的安全性。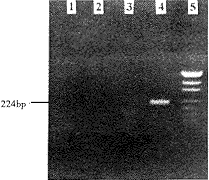
, 百拇医药
图3 巢式PCR扩增辅助病毒env基因
1 HL-60/NeoR细胞 2 K562/NeoR细胞 3 KG-1/NeoR细胞 4 PA317细胞 5 pUC19/MspI分子量标准(MBI)
3 讨论
基因治疗可能是治愈遗传病与恶性肿瘤的唯一手段,现已有多项方案进入临床并显示其应用前景[1]。由于Donahue等发现可复制逆转录病毒(RCR)可在免疫受抑的猴体内引发T细胞淋巴瘤[4],所以在人类基因治疗中必须高度重视基因转移系统的安全性,即将产生RCR的可能性降至最低。逆转录病毒介导的基因转移需要包装细胞和复制缺陷型病毒载体,其安全性也可从载体与包装细胞进行改进。LXSN是基因治疗最常用的载体之一,骨架为Moloney鼠白血病病毒(MoMLV),其序列与包装细胞中的反式结构基因同源性较小,且将gag基因起始密码子ATG突变为TAG并切除env基因[5];双嗜型包装细胞PA317中的辅助病毒缺失Ψ包装信号、3’LTR及部分5’LTR,因同源重组产生RCR的可能性很低。本研究采用巢式PCR和补救分析等方法均未检测到RCR的存在,证明是较为安全的。但PA317细胞的病毒结构基因位于同一载体,当导入安全性较低的载体时,仍有产生RCR的可能[6]。为此,新一代的包装细胞,如:GP+envAm12和PG13,将其辅助病毒结构基因分置于两个质粒,至少需三次独立重组事件才能形成完整的病毒基因组,从理论上来说比PA317更为安全。我们也正以GP+envAm12为包装细胞进行基因转移研究。
, http://www.100md.com
高基因转移效率是基因治疗/标记的前提。尽管逆转录病毒可有效地对多种靶细胞(如:造血干/祖细胞、淋巴细胞、肿瘤细胞等)进行基因转移,但与腺病毒相比而言,其病毒滴度显然较低[6],故提高病毒滴度仍是目前研究的重要课题。逆转录病毒滴度主要与病毒RNA转录水平、细胞外半衰期及原病毒拷贝数有关[7]。丁酸钠可活化病毒启动子而增强病毒基因组RNA的转录,提高病毒滴度达2~1000倍;在32℃培养生产细胞则可延长病毒的细胞外半衰期,亦可提高病毒滴度约10倍;而将具不同宿主范围的包装细胞共培养以扩增原病毒拷贝数量是最为简便、有效的方法,部分报道甚至可达1010CFU/ml[6]。本研究以PA317细胞与GP+E86细胞上清相互重复转导,避免了共培养后的选择过程,也使病毒滴度提高14倍,并未发现RCR产生,与文献[6]相近。此外,在更为安全的GP+E86/GP+envAm12系统亦取得类似结果[3]。因此,通过“乒乓效应”来提高病毒的滴度是有效而安全的,对提高逆转录病毒介导的基因转移效率有重要意义。
, http://www.100md.com
NeoR、LacZ和绿色荧光蛋白(GFP)基因是目前最常用的标记基因,主要用于分析基因转移效率、示踪细胞等,其中仅有NeoR基因可用于体外药物选择。目前,基因标记技术在诸多领域已被应用,其取得的实质性进展比基因治疗更为显著。例如:Cornetta等[8]用NeoR基因对慢性髓性白血病患者的骨髓细胞进行标记,发现白血病细胞的转导率明显高于正常对照,提示基因治疗的可行性;该作者对成人急性白血病患者的自体骨髓移植物亦进行了基因标记,并用以分析白血病复发细胞的来源[9];Lu等[10]则用该技术探讨对脐血干/祖细胞进行高效的基因转导。本研究建立的高效、安全的逆转录病毒介导的基因转移系统,可用于对造血细胞的基因标记,以研究CD34+细胞的生物学特性及白血病患者自体干细胞移植后的复发来源,并为恶性肿瘤的基因治疗奠定基础。
国防科技预研项(55.7.3.1.01-1)和江苏省卫生科研基金(H9549)资助课题
, 百拇医药
参考文献
1 Roth JA,Cristiano RJ.Gene therapy for cancer:what have we done and where are we going?J Nat Cancer Inst,1997,89∶21
2 Tafuro S,et al.Rapid retrovirus titration using competitive polymerase chain reaction.Gene Ther,1996,3∶679
3 傅建新,等.逆转录病毒介导高效的白血病细胞基因转移.中华肿瘤杂志,1998,20∶178
4 Donahue RE,et al.Helper virus induced T cell lymphoma in non-human primates after retroviral mediated gene transfer.J Exp Med,1992,176∶1125
, http://www.100md.com
5 Miller AD,Rosman GJ.Improved retroviral vectors for gene transfer and expression.Bio Techniques,1989,7∶980
6 Lynch CM,Miller AD.Production of high-titer helper virus-free retroviral vectors by cocultivation of packaging cells with different host ranges.J Virol,1991,65∶3887
7 Havenga M,et al.Retroviral stem cell gene therapy.Stem Cells,1997,15∶162
8 Cornetta K,et al.Retroviral mediated gene transfer in chronic myelogenous leukaemia.Br J Haematol,1994,87∶308
, http://www.100md.com
9 Cornetta K,et al.Retroviral gene transfer in autologous bone marrow transplantation for adult acute leukemia.Hum Gene Ther,1996,7∶1323
10 Lu L,et al.High efficiency retroviral mediated gene transduction into single isolated immature and replatable CD343+ hematopoietic stem/progenitor cells from human umbilical cord blood.J Exp Med,1993,178∶2089
(1999年6月2日收稿), http://www.100md.com
单位:苏州医学院附属第一医院,江苏省血液研究所,苏州,215006
关键词:逆转录病毒;报告基因;基因转移;白血病
苏州医学院学报990902 摘要 目的:为建立高效、安全的逆转录病毒介导的基因标记系统。方法:用脂质体方法将含有标志基因NeoR的逆转录病毒载体LXSN导入包装细胞PA317;通过与单向型包装细胞GPE86相互转导,获得高滴度的双嗜型产病毒细胞,并以其对人类白血病细胞进行基因标记。结果:脂质体转染法获得的病毒滴度约为2.0×105CFU/ml,而与GP+E86细胞转导后可提高至2.8×106CFU/ml;重组病毒转导白血病细胞(HL-60,K562,KG-1)后,聚合酶链反应(PCR)证实NeoR基因整合到靶细胞基因组,巢式PCR与补救分析均未能检测到辅助病毒。结论:“乒乓效应”可显著提高逆转录病毒滴度,而逆转录病毒介导的基因标记系统是安全的。
, 百拇医药
中图法分类 R392-33;R458
Retroviral-Mediated Reporter Gene Transfer in Human Leukemic Cells
Fu Jianxin,Chen Zixin,Ran Changgen,et al
(Jiangsu Institute of Hematology,First Hospital Affiliated to Suzhou Medical College,Suzhou,215006)
Abstract To develop an efficient gene marking system mediated by replicationincompetent retrovirus,the vector LXSN,containing NeoR gene,was transfected into amphotropic packaging cells PA317 by liposome transfection method.The retroviruscontaining supernatants were used to infect ecotropic packaging cells GP+E86. Then the PA317 cells were repeatedly infected by ecotropic virus from the GP+E86 producers to increase virus titer.This high titer retrovirus was applied to transduce the human leukemic cells.Results:The titer of liposome transfected PA317 pools assayed on NIH3T3 cells was 2.0×105 CFU/ml while the titer of GP+E86 cells transduced by amphotropic virus was 8.1×106 CFU/ml.By means of “ping-pong transduction”,the titer of PA317/NeoR cells could be markedly improved to 2.8×106 CFU/ml.Successful integration of NeoR gene into human leukemic cells (HL-60,K562,and KG-1) was verified by polymerase chain reaction(PCR).No helper virus could be found by both nested PCR and rescue assay.In conclusion,the so-called “ping-pong effect” could efficiently improve virus titer,and the safety of this gene transfer system might provide an optimal method for human gene marking/therapy.
, 百拇医药
Key words retrovirus;reporter genes;gene transfer;leukemia
逆转录病毒介导的基因移转已被现有多数基因治疗临床试验方案采用[1]。在进行基因治疗/标记时,基因转移系统的安全性至关重要,而获得高滴度病毒则是决定转移效率的关键因素。本文通过逆转录病毒将报告基因NeoR导入白血病细胞,研究其可行性与安全性,为下一步对造血干细胞进行基因转移奠定基础。
1 材料与方法
1.1 细胞系与质粒:人白血病细胞(HL-60、K562与KG-1)和NIH3T3由本室保存;双嗜型(PA317和单向型(GP+E86)逆转录病毒包装细胞分别由ATCC(CRL9078)和Bank博士(哥伦比亚大学,美国)提供,以含15%小牛血清的高糖DMEM(4.5g/L葡萄糖,Gibco-BRL)在37℃、5%CO2中培养。携带新霉素磷酸转移酶Ⅱ基因(NeoR)的逆转录病毒载体LXSN由Cowan博士(NCI,美国)惠赠,按分子生物学常规方法鉴定、扩增。
, 百拇医药
1.2 病毒生产细胞:取Wizard微量系统(Promega)纯化的LXSN质粒DNA 2μg,用脂质体试剂DOSPER(Boehringer Mannheim)转染包装细胞PA317,并以0.8g/L G418(Gibco-BRL)筛选获得耐药克隆;将含重组病毒的混合耐药细胞培养上清用0.45μm滤膜过滤,加至传代24h的GP+E86细胞中(2ml/105细胞),并加入终浓度8mg/L的聚凝胺(Polybrene,Sigma),37℃感染2h后换成新鲜病毒悬液重复感染一次,然后加入培养基使聚凝胺降至2mg/L,48h后以0.8g/L G418选择培养,获得单向型病毒生产细胞GP+E86/NeoR。以GP+E86/NeoR细胞上清同上重复感染PA317细胞,获得扩增的双嗜型病毒生产细胞PA317/NeoR。NIH3T3为受体细胞测定上清的病毒滴度。
1.3 白血病细胞的基因标记:将扩增的PA317/NeoR细胞扩大培养、制备高滴度的重组病毒悬液,并用其感染白血病细胞。转导2次后,将靶细胞离心并加入新鲜培养基培养48h,然后在含0.8g/L G418的培养基中选择培养2周。
, http://www.100md.com
1.4 检测整合的NeoR基因:根据NeoR基因序列设计并合成特异性引物,以快速法制备的基因组DNA[2]为模板,用聚合酶链反应(PCR)分析NeoR基因的整合状况。引物序列Neol∶5'-CGTTG-TCACT GAAGC GGGAA GG-3',Neo2∶5'-CCATG ATATT CGGCA AGCAG GC-3'(复旦大学遗传学研究所卢大儒博士馈赠);PCR试剂由上海生工公司提供。PCR反应参数:95℃30s,63℃45s,共30个循环。扩增产物经2%琼脂糖凝胶电泳分析。
1.5 巢式PCR检测辅助病毒env基因:根据双嗜型鼠白血病病毒4070A的env基因序列合成巢式PCR引物(见图1),分别为外侧引物env1(5'-GGGAG TCCTG TTAGG AGTAG GG-3')与env2(5'-ATGAT GTG GG CTTCC AGTAA GC-3'),内侧引物env3(5'-ACCAA CCTGA TGACT GGGCG-3')与env4(5'-CCCGA CTTTA CGGTA TGCCC-3')。常规蛋白酶K-酚/氯仿法提取病毒转导的白血病细胞DNA,并进行巢式PCR扩增,以PA317细胞为阳性对照。反应条件为:94℃30s,60℃30s,72℃60s,共32个循环。

, 百拇医药
图1 包装细胞PA317内病毒反式结构基因示意图,图中显示扩增env基因的引物相对位置及产物。
1.6 标志基因补救分析检测辅助病毒:参照文献[3]进行。
2 结果
2.1 病毒生产细胞的鉴定:经脂质体介导将LXSN质粒转染PA317细胞,以G418选择得到耐药克隆,其混合上清中病毒滴度约为2.0×105CFU/ml。由于PA317细胞和GP+E86细胞具有不同的包膜蛋白ENV,可利用所谓的“乒乓效应”来提高病毒滴度,结果发现GP+E86/NeoR细胞所产生的单向型病毒滴度可达8.1×106CFU/ml;而以其重复转导所得的扩增的双嗜型病毒生产细胞PA317/NeoR的滴度亦被提高到2.8×106CFU/ml。此外,PCR证实NeoR基因已整合到两种生产细胞的基因组(图2)。

, 百拇医药
图2 PCR分析NeoR基因的整合
1 PA317/NeoR细胞 2 GP+E86/NeoR细胞 3 HL-60/NeoR细胞 4 K562/NeoR 5 KG-1/NeoR细胞 6 阴性对照 7
2.2 逆转录病毒介导标志基因转移:用滴度约为2.8×106CFU/ml的病毒感染HL-60、K562与KG-1细胞,经G418筛选相应获得抗性细胞HL-60/NeoR、K562/NeoR与KG-1/NeoR。PCR证实,3种转导的白血病细胞均可扩增出NeoR基因特异的347bp片段(图2)。提示逆转录病毒已将NeoR基因成功转移入白血病细胞并整合到基因组。
, 百拇医药
2.3 辅助病毒的检测:用于介导基因转移的逆转录病毒为仅有一次感染能力的复制缺陷型病毒,病毒结构基因(如:gag,pol,env等)不应被包装入病毒颗粒,靶细胞被转导后也无反式结构基因的整合,因而检测靶细胞内的env基因可反映辅助病毒。分别以HL-60/NeoR、K562/NeoR与KG-1/NeoR的基因组DNA(图3)为模板进行巢式PCR扩增,结果如图3所示:3种靶细胞均未扩增出env基因产物(224bp),而对照PA317细胞则为强阳性,说明无辅助病毒产生和转移。在标志基因补救分析实验中,本研究使用的重组病毒不能与NIH3T3/NeoR细胞已含有的病毒顺式结构基因发生反式互补,因而不能将NeoR基因转移至NIH3T3受体细胞,经G418选择后未发现抗性克隆,在功能性检测方面证实本系统的安全性。

, 百拇医药
图3 巢式PCR扩增辅助病毒env基因
1 HL-60/NeoR细胞 2 K562/NeoR细胞 3 KG-1/NeoR细胞 4 PA317细胞 5 pUC19/MspI分子量标准(MBI)
3 讨论
基因治疗可能是治愈遗传病与恶性肿瘤的唯一手段,现已有多项方案进入临床并显示其应用前景[1]。由于Donahue等发现可复制逆转录病毒(RCR)可在免疫受抑的猴体内引发T细胞淋巴瘤[4],所以在人类基因治疗中必须高度重视基因转移系统的安全性,即将产生RCR的可能性降至最低。逆转录病毒介导的基因转移需要包装细胞和复制缺陷型病毒载体,其安全性也可从载体与包装细胞进行改进。LXSN是基因治疗最常用的载体之一,骨架为Moloney鼠白血病病毒(MoMLV),其序列与包装细胞中的反式结构基因同源性较小,且将gag基因起始密码子ATG突变为TAG并切除env基因[5];双嗜型包装细胞PA317中的辅助病毒缺失Ψ包装信号、3’LTR及部分5’LTR,因同源重组产生RCR的可能性很低。本研究采用巢式PCR和补救分析等方法均未检测到RCR的存在,证明是较为安全的。但PA317细胞的病毒结构基因位于同一载体,当导入安全性较低的载体时,仍有产生RCR的可能[6]。为此,新一代的包装细胞,如:GP+envAm12和PG13,将其辅助病毒结构基因分置于两个质粒,至少需三次独立重组事件才能形成完整的病毒基因组,从理论上来说比PA317更为安全。我们也正以GP+envAm12为包装细胞进行基因转移研究。
, http://www.100md.com
高基因转移效率是基因治疗/标记的前提。尽管逆转录病毒可有效地对多种靶细胞(如:造血干/祖细胞、淋巴细胞、肿瘤细胞等)进行基因转移,但与腺病毒相比而言,其病毒滴度显然较低[6],故提高病毒滴度仍是目前研究的重要课题。逆转录病毒滴度主要与病毒RNA转录水平、细胞外半衰期及原病毒拷贝数有关[7]。丁酸钠可活化病毒启动子而增强病毒基因组RNA的转录,提高病毒滴度达2~1000倍;在32℃培养生产细胞则可延长病毒的细胞外半衰期,亦可提高病毒滴度约10倍;而将具不同宿主范围的包装细胞共培养以扩增原病毒拷贝数量是最为简便、有效的方法,部分报道甚至可达1010CFU/ml[6]。本研究以PA317细胞与GP+E86细胞上清相互重复转导,避免了共培养后的选择过程,也使病毒滴度提高14倍,并未发现RCR产生,与文献[6]相近。此外,在更为安全的GP+E86/GP+envAm12系统亦取得类似结果[3]。因此,通过“乒乓效应”来提高病毒的滴度是有效而安全的,对提高逆转录病毒介导的基因转移效率有重要意义。
, http://www.100md.com
NeoR、LacZ和绿色荧光蛋白(GFP)基因是目前最常用的标记基因,主要用于分析基因转移效率、示踪细胞等,其中仅有NeoR基因可用于体外药物选择。目前,基因标记技术在诸多领域已被应用,其取得的实质性进展比基因治疗更为显著。例如:Cornetta等[8]用NeoR基因对慢性髓性白血病患者的骨髓细胞进行标记,发现白血病细胞的转导率明显高于正常对照,提示基因治疗的可行性;该作者对成人急性白血病患者的自体骨髓移植物亦进行了基因标记,并用以分析白血病复发细胞的来源[9];Lu等[10]则用该技术探讨对脐血干/祖细胞进行高效的基因转导。本研究建立的高效、安全的逆转录病毒介导的基因转移系统,可用于对造血细胞的基因标记,以研究CD34+细胞的生物学特性及白血病患者自体干细胞移植后的复发来源,并为恶性肿瘤的基因治疗奠定基础。
国防科技预研项(55.7.3.1.01-1)和江苏省卫生科研基金(H9549)资助课题
, 百拇医药
参考文献
1 Roth JA,Cristiano RJ.Gene therapy for cancer:what have we done and where are we going?J Nat Cancer Inst,1997,89∶21
2 Tafuro S,et al.Rapid retrovirus titration using competitive polymerase chain reaction.Gene Ther,1996,3∶679
3 傅建新,等.逆转录病毒介导高效的白血病细胞基因转移.中华肿瘤杂志,1998,20∶178
4 Donahue RE,et al.Helper virus induced T cell lymphoma in non-human primates after retroviral mediated gene transfer.J Exp Med,1992,176∶1125
, http://www.100md.com
5 Miller AD,Rosman GJ.Improved retroviral vectors for gene transfer and expression.Bio Techniques,1989,7∶980
6 Lynch CM,Miller AD.Production of high-titer helper virus-free retroviral vectors by cocultivation of packaging cells with different host ranges.J Virol,1991,65∶3887
7 Havenga M,et al.Retroviral stem cell gene therapy.Stem Cells,1997,15∶162
8 Cornetta K,et al.Retroviral mediated gene transfer in chronic myelogenous leukaemia.Br J Haematol,1994,87∶308
, http://www.100md.com
9 Cornetta K,et al.Retroviral gene transfer in autologous bone marrow transplantation for adult acute leukemia.Hum Gene Ther,1996,7∶1323
10 Lu L,et al.High efficiency retroviral mediated gene transduction into single isolated immature and replatable CD343+ hematopoietic stem/progenitor cells from human umbilical cord blood.J Exp Med,1993,178∶2089
(1999年6月2日收稿), http://www.100md.com