驻极体技术改进的脂质体包封血红蛋白及其对体外血液流变学性能的影响
作者:邓百明 史向阳 邓劲光 孙曹民 翁维良 王怡
单位:邓百明(北京理工大学 生物功能材料实验室,北京 100081);邓劲光(北京理工大学 生物功能材料实验室,北京 100081);孙曹民(北京理工大学 生物功能材料实验室,北京 100081);史向阳(清华大学 现代应用物理系,北京 100084);翁维良(中国中医研究院 西苑医院,北京 100091);王怡(中国中医研究院 西苑医院,北京 100091)
关键词:生物驻极体;LEH;血栓形成
生物医学工程学杂志000109 摘 要:为了研究脂质体包封血红蛋白(Liposome Encapsulated Hemoglobin, LEH)的不同带电性能对体外血液流变性的影响,用驻极体技术制备了四种不同带电性能的LEH。利用热刺激去极化电流法(Thermally Stimulated Depolarization Current, TSDC)对它们的驻极体性能进行了测试,发现4#LEH(主峰温度Tα=12 ℃,主峰电流Iα=-5.6×10-9A)的性能最好,而且体外血栓成形实验结果表明,添加4#LEH形成血栓重量最小。可见,利用驻极体技术对LEH的表面电性能进行合理的改进,就能改善红细胞及血液的流变性能,有效地抑制体外血栓成形。
, http://www.100md.com
Improved Liposome Encapsulated Hemoglobin by Electret Technology
and Its Influence on the Blood Rheologic Behavior in Vitro
Deng Baiming Deng Jinguang Sun Caomin
(Laboratary of Biomaterials, Beijing Institute of Technology, Beijing 100081)
Shi Xiangyang
(Department of Modern Applied Physics, Tsinghua University, Beijing 100084)
, 百拇医药
Wong Weiliang Wang Yi
(Xi-Tuan Hospital, Chnese Academy of Tradition Chinese Medicine, Beijing 100091)
Abstract:To study the influence of different electret properties of Liposome Encapsulated Hemoglobin(LEH) on the blood rheologic behavior in vitro, four kinds of LEH have been prepared. Their electret properties have been determined by using Thermally Stimulated Depolarization Current(TSDC). The results show that 4# LEH, whose Tα is 12℃ and Iα is -5.6×10-9A, has the best electret property. furthermore, the results of the thrombus formation in vitro also show that the addition of 4# LEH induces the lightest thrombus figuration in vitro. It is obvious that the rational improvement of the electret property of LEH can meliorate the surface charge of blood and effectively inhibit the formation of thrombus.
, http://www.100md.com
Key words:Bioelectret LEH Thrombus figuration▲
近年来,脂质体包封血红蛋白(LEH)作为血液代用品的研究,受到了人们的普遍关注。这主要是由于LEH具有独特的优点[1]:(1)包封在脂质体内的血红蛋白(hemoglobin,Hb)含量高;(2)粘度低,循环周期长;(3)可以控制对氧的亲合力。然而,它同样也存在着一些较难克服的缺点,例如它容易聚集和融合,Hb易泄漏,而且它也易被网状内皮系统(reticuloendothelial system)清除。因此在临床上,LEH的应用受到了限制。
对于提高LEH稳定性的研究,已经有了较多的文献报道[2,3]。一般主要是从脂质体的配方、表面化学修饰、双层膜的物化特性等方面考虑,以期改变LEH的表面电荷和表面特性。利用生物驻极体理论,通过驻极体技术对LEH的驻极体特性进行主动调整,改善其表面电荷特性,尚未有文献报道。本文根据生物组织驻极体特性相互匹配的原则,研究了几种不同带电性能的LEH和天然红细胞的驻极体特性,并用血液流变学方法进行检验,取得了一些有意义的研究结果。
, 百拇医药
1 实验部分
1.1 实验材料
大豆卵磷脂,北京市海淀区微生物培养基制品厂生产。使用前按文献[4]进一步纯化;胆固醇,生化试剂,北京奥博星生物技术责任有限公司生产;谷胱甘肽,中科院上海生化所东风生化技术公司生产;牛血红蛋白(Hb),生化试剂,购于华美生物工程公司。使用时,将其溶解在pH7.4的磷酸缓冲液中,配制成浓度为10%的溶液。其它试剂均为分析纯。
1.2 样品的极化
利用平板电极系统[5],用高压直流电源将样品进行极化处理,样品的极化分为正、负两种,极化电压为10 kv/cm,极化时间为30 min。
1.3 LEH的制备
LEH的制备采用水化法[6,7],具体过程如下:(1)在50 ml烧瓶中,将大豆卵磷脂、胆固醇、谷胱甘肽以摩尔比5∶4∶0.1溶于一定量氯仿中,置于旋转蒸发器中,30 ℃下减压蒸发,直至烧瓶壁上形成脂膜。继续在室温下,减压蒸发2 h,确保除净残余的有机溶剂;(2)将浓度为10%的Hb溶液,分成两部分,一部分用正电场进行极化处理,另一部分则保持自然状态。在烧瓶中加入水相,使磷脂的最终浓度为10 mg/ml,水化15 min。用离心法将未包封的Hb去掉,使溶液中未包封的Hb含量低于0.5%;(3)将制得的LEH溶液分成两部分,一部分在负电场下进行极化,另一部分则保持不变。
, http://www.100md.com
通过以上过程,得到如下4种类型的LEH:
1#LEH:加天然状态(未极化)的水相形成的LEH;
2#LEH:加正极化状态的水相形成的LEH;
3#LEH:加天然状态的水相形成的LEH后,再负极化处理而成;
4#LEH:加正极化状态的水相形成LEH后,再负极化处理而成。
它们的示意图见图1。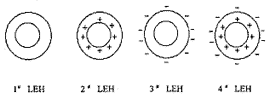
图1 四种LEH的结构示意图
Fig 1 The schematic drawing of the structures for four kinds of LEH
, http://www.100md.com
1.4 TSDC测试
TSDC测试所用仪器为KH-1型热释电仪,中科院化学所生产,测温范围为-170 ℃~260 ℃,以N2保护气氛,液态N2冷却。将红细胞或LEH样品涂在样品室两个电极之间的PP膜上,电极连线接动电容静电计,选择升温速度为β=2 ℃/min,用液N2冷却,然后升温,用PC机采集并处理数据,绘制出TSDC图谱。
1.5 LEH的体外血栓成形实验
实验采用中国中医研究院西苑医院研制的XSN-R Ⅰ型体外血栓形成与血小板粘附两用仪。主机旋转速率为17±0.5 rpm,线速率约为4377 mm/min。血液样品为6例病人的静脉血(由中国中医研究院西苑医院心血管室提供)。实验时温度控制为37 ℃,首先用一次性硅化注射器抽取血液样品,迅速注入到准备好的旋转环内,旋转环内事先注入占血液总体积25%的LEH溶液。然后将注有血液的旋转环装到血栓仪的有机玻璃圆盘上,套到轴上后,开动转动开关,使圆盘转动,秒表计时。此过程需在90 s内完成。15 min后停止转动,取出血栓,在滤纸上放平,吸去血栓表面鲜血后,用分规测量血栓长度,然后用精密扭力天平测血栓的湿重。再将血栓放入烘箱中,64 ℃恒洪烘干20 min后,测量血栓干重。
, http://www.100md.com
1.6 LEH样品和血液样品粘度测试
采用ELD型锥板粘度计(日本东京计器生产),取LEH样品和6例病人的静脉血液1.2~1.5ml,注入已盛有0.1 ml的0.1%的肝素液的干燥试管中。充分摇匀,开启恒温槽开关,令恒温循环水环流样品杯夹层中,当样品杯平板部分加温至25 ℃时,恒温仪绿色指示灯亮。取血液样品1.1 ml置于样品杯中央。以样品杯夹将杯紧固粘在粘度计轴座上。令圆锥以不同速度旋转,分别测出1.92、3.84、38.4、192s-1共四个切速下的粘度值。
测定结束后,卸下样品杯,以蒸馏水清洗样品杯和锥体,用滤纸将杯和锥体擦干,即可进行下一个样品的测定。
2 结果与讨论
2.1 红细胞及LEH样品的驻极体性能测试
, 百拇医药 生物驻极体材料与传统的驻极体材料的最大区别在于生物驻极态的形成离不开水(包括结构水和自由水),因此,生物驻极体材料含有水,有时甚至是溶液。如Hb和红细胞的驻极体特性,只有在溶液(或人体内环境)中谈论才有意义,所以必须对传统的测试方法进行改进。传统的测试方法是用热释电仪样品室中的上下两金属片电极夹住驻极体材料(不能是导体)进行测试。而本研究中的生物材料一般以能导电的溶液形式存在,故需要将两个金属片电极改成两个高分子薄膜[8],才能测试。高分子薄膜采用绝缘材料聚丙烯(PP)无纺布,聚丙烯纤维在拉伸取向成丝过程中,也储存有少量的电荷,为避免对测试结果的影响,需要在实验前对聚丙烯无纺布进行退极化处理,释放其所储存的电荷。
我们测量退极化后的PP膜的TSDC图谱可以看出,它的退极化电流一般在10-14A以内,最大不超过1.6×10-13A,这个电流和噪声电流值很近似,因此可以忽略不计。
图2和图3分别给出了天然人红细胞(human red cell, HRC)和四种不同的LEH的TSDC图谱。
, http://www.100md.com
图2 天然人红细胞的TSDC谱
Fig 2 TSDC spectrum of natural human red cell(HRC)
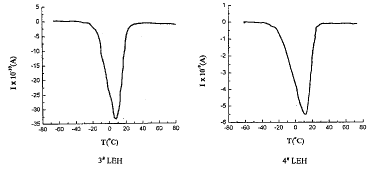
图3 四种LEH的TSDC谱
Fig 3 TSDC spectra of four kinds of LEH
由图2和图3的TSDC谱图,我们可以得到红细胞和四种LEH的主峰温度和主峰电流数据(表1)。
表1 人红细胞和四种LEH主转变峰的电流和温度
Table 1 The electric current and temperature of main transition peak α for HRC and four kinds of LEH
, http://www.100md.com
HRC
1#LEH
2#LEH
3#LEH
4#LEH
Iα(A)
-3.5×10-11
-1.7×10-11
-2.7×10-11
-3.3×10-9
, 百拇医药
-5.6×10-9
Tα(℃)
30
15
23
8
12
由图3和图4可以看出,与天然红细胞的TSDC图谱相比,四种类型的LEH的峰形状均有相似之处。从表1可见,3#LEH和4#LEH的驻极体特性更强,峰值电流值更大,其中尤以4#LEH的峰值电流最大。
2.2 LEH的体外血栓形成实验
, 百拇医药
表2给出了LEH类型与血栓湿重(wet weight, WW)和干重(dry weight,DW)的关系,每例均有空白对照(全血)。将表2的数据对每一类LEH取平均值,再根据表1转换成LEH的驻极体特性与血栓形成的关系,可得到表3的数据。
表2 血栓重量和LEH类型之间的关系
Table 2 The relationship between thrombus weight and LEH type Case
Item
Control
1#LEH
2#LEH
3#LEH
, 百拇医药
4#LEH
1
WW/mg
48.5
44.0
42.0
DW/mg
15.0
10.5
11.7
2
WW/mg
55.5
, 百拇医药
50.5
50.5
DW/mg
12.0
12.0
13.5
3
WW/mg
107.5
186.0
105.0
DW/mg
33.0
, 百拇医药
50.5
28.5
4
WW/mg
109.5
99.5
137.0
DW/mg
33.5
25.0
35.5
5
WW/mg
, http://www.100md.com
109.5
129.5
173.0
DW/mg
33.5
33.0
-
6
WW/mg
50.0
57.5
32.5
DW/mg
, http://www.100md.com
12.0
11.5
40.0
表3 LEH的驻极体性能和其形成血栓之间的关系
Table 3 The relationship between the electret property of LEH and the formation of thrombus Item
Control
1#LEH
2#LEH
3#LEH
, 百拇医药
4#LEH
WW/mg
79.63
120.00
106.00
73.00
69.20
DW/mg
23.17
31.33
26.73
18.17
, 百拇医药
16.00
Iα/A
-3.5×10-11
-1.7×10-11
-2.7×10-11
-3.3×10-9
-5.6×10-9
由表3可见,4#LEH形成的血栓湿重和干重最小。对于这种情况,我们可进行如下的讨论:由于1#LEH和2#LEH的峰值电流比天然人红细胞小(表3),表明它们的驻极体特性较弱,当它们加入到血液中时,可能会削弱血液中红细胞的驻极体特性,从而使形成的血栓比空白对照(全血)大或重;而3#LEH和43LEH的峰值电流比天然人红细胞大,当它们加入到血液中时,将增加血液中红细胞的驻极体特性,从而抑制了血栓的形成,使形成的血栓比对照组要小或轻,其中4#LEH的峰值电流最大,因而它抑制血栓形成的效果最明显。
, 百拇医药
2.3 LEH的粘度测定
由于4#LEH抑制血栓形成最明显,因此本工作测定了它和人体血液粘度与切变率的关系,以期作以对比。图4给出了六例病人的平均血液粘度(A)和4#LEH(B)的粘度与切变率的关系。可以看出,二者的粘度均随切变率的增大而显著下降,4#LEH的粘度与人体血液平均粘度相当。
图4 人血和4#LEH的粘度随剪切率的变化关系
Fig 4 The viscosity change of human blood (A) and 4#LEH (B) with shear rate
根据测得的血液粘度,我们还可以知道红细胞的聚集能力(用聚集指数表示)。在低切变率下,影响血液粘度的因素主要是红细胞的聚集;而在高切变率下,主要因素则是红细胞的变形和取向。根据国际血液学标准化委员会的建议[9],本研究所测的人血的聚集指数为η1.92/η192.0=3.57;4#LEH的聚集指数为2.74。因此可见,此种LEH的抗聚集能力比人体红细胞强。
, 百拇医药
本工作研究了LEH的不同驻极体性能及其对体外血液流变学性能的影响,发现4#LEH能够有效地抑制体外血栓的形成。可见,利用驻极体技术改进LEH的表面电性能,从而改善血液的流变学性能是行之有效的。体内实验的结果将由另文报道。
基金项目:国家自然科学基金资助项目(39570201)
参考文献:
[1] Chang TMS. Art Cells, Blood Subs, and Immob. Biotech, 1994; 22(5)∶7
[2]Szebeni J, Diiorio EE, Hauser H et al. Biochemistry, 1985; 24∶2827
[3]Szebeni J, Hauser H, Eskelson CD et al. Biomat, Art Cells, Art Org, 1988; 16∶301
, 百拇医药
[4]Singleton WS, Gray MS, Brown ML et al. J Am Oil Chem Soc, 1965; 42∶53
[5]Shi XY, Deng BM, Sun CM. Journal of Beijing Institute of Technology, 1997; 6(4)
[6]Beissinger RL, Farmer MC, Gossage JL. Trans Am Soc Art Int Organs, 1986; 32∶589
[7]Vidal-Naquet A, Sullivan TP, Gossage JL et al. Biomaterial Artificial Cells, and Arttificial Organs, 1989; 17∶531
[8]邓劲光.北京理工大学硕士学位论文,1997
[9]翁维良,廖福龙,吴云鹏等.血液流变学研究方法及其应用.北京:科学出版社,1989:79
收稿日期:1998-10-12, 百拇医药
单位:邓百明(北京理工大学 生物功能材料实验室,北京 100081);邓劲光(北京理工大学 生物功能材料实验室,北京 100081);孙曹民(北京理工大学 生物功能材料实验室,北京 100081);史向阳(清华大学 现代应用物理系,北京 100084);翁维良(中国中医研究院 西苑医院,北京 100091);王怡(中国中医研究院 西苑医院,北京 100091)
关键词:生物驻极体;LEH;血栓形成
生物医学工程学杂志000109 摘 要:为了研究脂质体包封血红蛋白(Liposome Encapsulated Hemoglobin, LEH)的不同带电性能对体外血液流变性的影响,用驻极体技术制备了四种不同带电性能的LEH。利用热刺激去极化电流法(Thermally Stimulated Depolarization Current, TSDC)对它们的驻极体性能进行了测试,发现4#LEH(主峰温度Tα=12 ℃,主峰电流Iα=-5.6×10-9A)的性能最好,而且体外血栓成形实验结果表明,添加4#LEH形成血栓重量最小。可见,利用驻极体技术对LEH的表面电性能进行合理的改进,就能改善红细胞及血液的流变性能,有效地抑制体外血栓成形。
, http://www.100md.com
Improved Liposome Encapsulated Hemoglobin by Electret Technology
and Its Influence on the Blood Rheologic Behavior in Vitro
Deng Baiming Deng Jinguang Sun Caomin
(Laboratary of Biomaterials, Beijing Institute of Technology, Beijing 100081)
Shi Xiangyang
(Department of Modern Applied Physics, Tsinghua University, Beijing 100084)
, 百拇医药
Wong Weiliang Wang Yi
(Xi-Tuan Hospital, Chnese Academy of Tradition Chinese Medicine, Beijing 100091)
Abstract:To study the influence of different electret properties of Liposome Encapsulated Hemoglobin(LEH) on the blood rheologic behavior in vitro, four kinds of LEH have been prepared. Their electret properties have been determined by using Thermally Stimulated Depolarization Current(TSDC). The results show that 4# LEH, whose Tα is 12℃ and Iα is -5.6×10-9A, has the best electret property. furthermore, the results of the thrombus formation in vitro also show that the addition of 4# LEH induces the lightest thrombus figuration in vitro. It is obvious that the rational improvement of the electret property of LEH can meliorate the surface charge of blood and effectively inhibit the formation of thrombus.
, http://www.100md.com
Key words:Bioelectret LEH Thrombus figuration▲
近年来,脂质体包封血红蛋白(LEH)作为血液代用品的研究,受到了人们的普遍关注。这主要是由于LEH具有独特的优点[1]:(1)包封在脂质体内的血红蛋白(hemoglobin,Hb)含量高;(2)粘度低,循环周期长;(3)可以控制对氧的亲合力。然而,它同样也存在着一些较难克服的缺点,例如它容易聚集和融合,Hb易泄漏,而且它也易被网状内皮系统(reticuloendothelial system)清除。因此在临床上,LEH的应用受到了限制。
对于提高LEH稳定性的研究,已经有了较多的文献报道[2,3]。一般主要是从脂质体的配方、表面化学修饰、双层膜的物化特性等方面考虑,以期改变LEH的表面电荷和表面特性。利用生物驻极体理论,通过驻极体技术对LEH的驻极体特性进行主动调整,改善其表面电荷特性,尚未有文献报道。本文根据生物组织驻极体特性相互匹配的原则,研究了几种不同带电性能的LEH和天然红细胞的驻极体特性,并用血液流变学方法进行检验,取得了一些有意义的研究结果。
, 百拇医药
1 实验部分
1.1 实验材料
大豆卵磷脂,北京市海淀区微生物培养基制品厂生产。使用前按文献[4]进一步纯化;胆固醇,生化试剂,北京奥博星生物技术责任有限公司生产;谷胱甘肽,中科院上海生化所东风生化技术公司生产;牛血红蛋白(Hb),生化试剂,购于华美生物工程公司。使用时,将其溶解在pH7.4的磷酸缓冲液中,配制成浓度为10%的溶液。其它试剂均为分析纯。
1.2 样品的极化
利用平板电极系统[5],用高压直流电源将样品进行极化处理,样品的极化分为正、负两种,极化电压为10 kv/cm,极化时间为30 min。
1.3 LEH的制备
LEH的制备采用水化法[6,7],具体过程如下:(1)在50 ml烧瓶中,将大豆卵磷脂、胆固醇、谷胱甘肽以摩尔比5∶4∶0.1溶于一定量氯仿中,置于旋转蒸发器中,30 ℃下减压蒸发,直至烧瓶壁上形成脂膜。继续在室温下,减压蒸发2 h,确保除净残余的有机溶剂;(2)将浓度为10%的Hb溶液,分成两部分,一部分用正电场进行极化处理,另一部分则保持自然状态。在烧瓶中加入水相,使磷脂的最终浓度为10 mg/ml,水化15 min。用离心法将未包封的Hb去掉,使溶液中未包封的Hb含量低于0.5%;(3)将制得的LEH溶液分成两部分,一部分在负电场下进行极化,另一部分则保持不变。
, http://www.100md.com
通过以上过程,得到如下4种类型的LEH:
1#LEH:加天然状态(未极化)的水相形成的LEH;
2#LEH:加正极化状态的水相形成的LEH;
3#LEH:加天然状态的水相形成的LEH后,再负极化处理而成;
4#LEH:加正极化状态的水相形成LEH后,再负极化处理而成。
它们的示意图见图1。

图1 四种LEH的结构示意图
Fig 1 The schematic drawing of the structures for four kinds of LEH
, http://www.100md.com
1.4 TSDC测试
TSDC测试所用仪器为KH-1型热释电仪,中科院化学所生产,测温范围为-170 ℃~260 ℃,以N2保护气氛,液态N2冷却。将红细胞或LEH样品涂在样品室两个电极之间的PP膜上,电极连线接动电容静电计,选择升温速度为β=2 ℃/min,用液N2冷却,然后升温,用PC机采集并处理数据,绘制出TSDC图谱。
1.5 LEH的体外血栓成形实验
实验采用中国中医研究院西苑医院研制的XSN-R Ⅰ型体外血栓形成与血小板粘附两用仪。主机旋转速率为17±0.5 rpm,线速率约为4377 mm/min。血液样品为6例病人的静脉血(由中国中医研究院西苑医院心血管室提供)。实验时温度控制为37 ℃,首先用一次性硅化注射器抽取血液样品,迅速注入到准备好的旋转环内,旋转环内事先注入占血液总体积25%的LEH溶液。然后将注有血液的旋转环装到血栓仪的有机玻璃圆盘上,套到轴上后,开动转动开关,使圆盘转动,秒表计时。此过程需在90 s内完成。15 min后停止转动,取出血栓,在滤纸上放平,吸去血栓表面鲜血后,用分规测量血栓长度,然后用精密扭力天平测血栓的湿重。再将血栓放入烘箱中,64 ℃恒洪烘干20 min后,测量血栓干重。
, http://www.100md.com
1.6 LEH样品和血液样品粘度测试
采用ELD型锥板粘度计(日本东京计器生产),取LEH样品和6例病人的静脉血液1.2~1.5ml,注入已盛有0.1 ml的0.1%的肝素液的干燥试管中。充分摇匀,开启恒温槽开关,令恒温循环水环流样品杯夹层中,当样品杯平板部分加温至25 ℃时,恒温仪绿色指示灯亮。取血液样品1.1 ml置于样品杯中央。以样品杯夹将杯紧固粘在粘度计轴座上。令圆锥以不同速度旋转,分别测出1.92、3.84、38.4、192s-1共四个切速下的粘度值。
测定结束后,卸下样品杯,以蒸馏水清洗样品杯和锥体,用滤纸将杯和锥体擦干,即可进行下一个样品的测定。
2 结果与讨论
2.1 红细胞及LEH样品的驻极体性能测试
, 百拇医药 生物驻极体材料与传统的驻极体材料的最大区别在于生物驻极态的形成离不开水(包括结构水和自由水),因此,生物驻极体材料含有水,有时甚至是溶液。如Hb和红细胞的驻极体特性,只有在溶液(或人体内环境)中谈论才有意义,所以必须对传统的测试方法进行改进。传统的测试方法是用热释电仪样品室中的上下两金属片电极夹住驻极体材料(不能是导体)进行测试。而本研究中的生物材料一般以能导电的溶液形式存在,故需要将两个金属片电极改成两个高分子薄膜[8],才能测试。高分子薄膜采用绝缘材料聚丙烯(PP)无纺布,聚丙烯纤维在拉伸取向成丝过程中,也储存有少量的电荷,为避免对测试结果的影响,需要在实验前对聚丙烯无纺布进行退极化处理,释放其所储存的电荷。
我们测量退极化后的PP膜的TSDC图谱可以看出,它的退极化电流一般在10-14A以内,最大不超过1.6×10-13A,这个电流和噪声电流值很近似,因此可以忽略不计。
图2和图3分别给出了天然人红细胞(human red cell, HRC)和四种不同的LEH的TSDC图谱。

, http://www.100md.com
图2 天然人红细胞的TSDC谱
Fig 2 TSDC spectrum of natural human red cell(HRC)


图3 四种LEH的TSDC谱
Fig 3 TSDC spectra of four kinds of LEH
由图2和图3的TSDC谱图,我们可以得到红细胞和四种LEH的主峰温度和主峰电流数据(表1)。
表1 人红细胞和四种LEH主转变峰的电流和温度
Table 1 The electric current and temperature of main transition peak α for HRC and four kinds of LEH
, http://www.100md.com
HRC
1#LEH
2#LEH
3#LEH
4#LEH
Iα(A)
-3.5×10-11
-1.7×10-11
-2.7×10-11
-3.3×10-9
, 百拇医药
-5.6×10-9
Tα(℃)
30
15
23
8
12
由图3和图4可以看出,与天然红细胞的TSDC图谱相比,四种类型的LEH的峰形状均有相似之处。从表1可见,3#LEH和4#LEH的驻极体特性更强,峰值电流值更大,其中尤以4#LEH的峰值电流最大。
2.2 LEH的体外血栓形成实验
, 百拇医药
表2给出了LEH类型与血栓湿重(wet weight, WW)和干重(dry weight,DW)的关系,每例均有空白对照(全血)。将表2的数据对每一类LEH取平均值,再根据表1转换成LEH的驻极体特性与血栓形成的关系,可得到表3的数据。
表2 血栓重量和LEH类型之间的关系
Table 2 The relationship between thrombus weight and LEH type Case
Item
Control
1#LEH
2#LEH
3#LEH
, 百拇医药
4#LEH
1
WW/mg
48.5
44.0
42.0
DW/mg
15.0
10.5
11.7
2
WW/mg
55.5
, 百拇医药
50.5
50.5
DW/mg
12.0
12.0
13.5
3
WW/mg
107.5
186.0
105.0
DW/mg
33.0
, 百拇医药
50.5
28.5
4
WW/mg
109.5
99.5
137.0
DW/mg
33.5
25.0
35.5
5
WW/mg
, http://www.100md.com
109.5
129.5
173.0
DW/mg
33.5
33.0
-
6
WW/mg
50.0
57.5
32.5
DW/mg
, http://www.100md.com
12.0
11.5
40.0
表3 LEH的驻极体性能和其形成血栓之间的关系
Table 3 The relationship between the electret property of LEH and the formation of thrombus Item
Control
1#LEH
2#LEH
3#LEH
, 百拇医药
4#LEH
WW/mg
79.63
120.00
106.00
73.00
69.20
DW/mg
23.17
31.33
26.73
18.17
, 百拇医药
16.00
Iα/A
-3.5×10-11
-1.7×10-11
-2.7×10-11
-3.3×10-9
-5.6×10-9
由表3可见,4#LEH形成的血栓湿重和干重最小。对于这种情况,我们可进行如下的讨论:由于1#LEH和2#LEH的峰值电流比天然人红细胞小(表3),表明它们的驻极体特性较弱,当它们加入到血液中时,可能会削弱血液中红细胞的驻极体特性,从而使形成的血栓比空白对照(全血)大或重;而3#LEH和43LEH的峰值电流比天然人红细胞大,当它们加入到血液中时,将增加血液中红细胞的驻极体特性,从而抑制了血栓的形成,使形成的血栓比对照组要小或轻,其中4#LEH的峰值电流最大,因而它抑制血栓形成的效果最明显。
, 百拇医药
2.3 LEH的粘度测定
由于4#LEH抑制血栓形成最明显,因此本工作测定了它和人体血液粘度与切变率的关系,以期作以对比。图4给出了六例病人的平均血液粘度(A)和4#LEH(B)的粘度与切变率的关系。可以看出,二者的粘度均随切变率的增大而显著下降,4#LEH的粘度与人体血液平均粘度相当。

图4 人血和4#LEH的粘度随剪切率的变化关系
Fig 4 The viscosity change of human blood (A) and 4#LEH (B) with shear rate
根据测得的血液粘度,我们还可以知道红细胞的聚集能力(用聚集指数表示)。在低切变率下,影响血液粘度的因素主要是红细胞的聚集;而在高切变率下,主要因素则是红细胞的变形和取向。根据国际血液学标准化委员会的建议[9],本研究所测的人血的聚集指数为η1.92/η192.0=3.57;4#LEH的聚集指数为2.74。因此可见,此种LEH的抗聚集能力比人体红细胞强。
, 百拇医药
本工作研究了LEH的不同驻极体性能及其对体外血液流变学性能的影响,发现4#LEH能够有效地抑制体外血栓的形成。可见,利用驻极体技术改进LEH的表面电性能,从而改善血液的流变学性能是行之有效的。体内实验的结果将由另文报道。
基金项目:国家自然科学基金资助项目(39570201)
参考文献:
[1] Chang TMS. Art Cells, Blood Subs, and Immob. Biotech, 1994; 22(5)∶7
[2]Szebeni J, Diiorio EE, Hauser H et al. Biochemistry, 1985; 24∶2827
[3]Szebeni J, Hauser H, Eskelson CD et al. Biomat, Art Cells, Art Org, 1988; 16∶301
, 百拇医药
[4]Singleton WS, Gray MS, Brown ML et al. J Am Oil Chem Soc, 1965; 42∶53
[5]Shi XY, Deng BM, Sun CM. Journal of Beijing Institute of Technology, 1997; 6(4)
[6]Beissinger RL, Farmer MC, Gossage JL. Trans Am Soc Art Int Organs, 1986; 32∶589
[7]Vidal-Naquet A, Sullivan TP, Gossage JL et al. Biomaterial Artificial Cells, and Arttificial Organs, 1989; 17∶531
[8]邓劲光.北京理工大学硕士学位论文,1997
[9]翁维良,廖福龙,吴云鹏等.血液流变学研究方法及其应用.北京:科学出版社,1989:79
收稿日期:1998-10-12, 百拇医药