聚丙交酯(PL)/丙交酯-聚乙二醇共聚物(PLEG)共混微球的制备、表征及释药行为
作者:蒋宏亮 朱康杰
单位:蒋宏亮(浙江大学 高分子科学与工程系,杭州 310027);朱康杰(浙江大学 高分子科学与工程系,杭州 310027)
关键词:PL;PLEG;共混;微球;蛋白质的包埋率
生物医学工程学杂志000102 摘 要:PL与PLEG是生物降解、生物相容的高分子材料,利用它们作为药物控释载体已引起人们广泛的重视。我们合成了含不同PEG链段长度的PLEG共聚物,并利用PL与PLEG这两种材料各自的优点制备载有人绒毛促性腺激素(hCG)的共混微球以提高hCG在微球中的包埋率,结果表明采用P(L-co-PEG6000)(90∶10)与PL共混制备得到的微球中,hCG的包埋率高于单独用PL或PLEG制得的微球。hCG的体外释放为突破-缓释过程,符合抗原释放要求。
Preparation, Characterization and Drug Release Characteristics of
, 百拇医药
Poly(lactide)(PL)/Poly(lactide-co-polyethylene glycol)(PLEG) Blend Microspheres
Jiang Hongliang Zhu Kangjie
(Department of Polymer Science and Engineering, Zhejiang University, Hangzhou 310027)
Abstract:PL and PLEG are biodegradable, biocompatible polymers. They have been widely used for controlled release of drugs. We synthesized PLEG copolymers containing PEG segments with various molecular weight and prepared hCG-loaded PL/PLEG blend microspheres to improve hCG entrapment efficiency. It was shown that the hCG entrapment effciency of PL/PLEG microspheres was higher than that of PL or PLEG microspheres when P(L-co-PEG6000)(90∶10) was used. In vitro release test showed that the release of hCG was a burst-slow process, which was thought to be good for antigens to produce antibodies.
, 百拇医药
Key words:Polylactide Poly(lactide-co-polyethylene glycol) Blend Microspheres Entrapment efficiency of protein▲
随着基因工程及化学合成技术的发展,越来越多的多肽、蛋白质药物被研制出来并在临床应用中表现出许多独特的疗效。与传统的小分子药物相比,这类药物存在体内易降解、易失活以及难以在胃肠道内被体内吸收等缺点,阻碍了在临床上方便、广泛和有效地使用。以生物降解性高分子材料为载体材料制成微球,可以实现多肽、蛋白质药物在体内的持续释放,从而避免通常所需的频繁注射的弊端,同时还可制成多途径给药,例如鼻腔给药、直肠给药和口服给药等制剂。目前多肽或蛋白质药物的聚合物微球最常用的制备方法有凝聚-相分离法[1,2]、溶剂挥发法[3~8]和水/油/水乳状液-溶剂挥发法(w/o/w)。Ogawa等人[5,6]通过在乳化前于内水相中加入明胶,将Leuprolide Acetate包埋入PL或聚(丙交酯-共乙交酯)(PLGA)微球中以提高药物包埋率;Jeffery等人[7]考察了卵清蛋白(OVA)/PLGA体系中药物与辅料的比例、乳化剂的浓度、外水相的体积等因素对微球粒径的影响;Yan等人[8]则研究了乳状液制备时搅拌方式对微球的影响如微球粒径、药物包埋率以及微球结构等。尽管采用他们的方法可以在一定程度上提高药物的包埋率,但一般来说微球的粒径也会相应增加,这将限制微球的应用范围;另外由于在微球制备过程中,多肽、蛋白质药物不可避免地要接触到有机溶剂,这有可能导致药物的变性失活。PLEG是一种嵌段型共聚物,具有较长的亲水性PEG链段及疏水性的PL链段[9],因而具有一定的表面活性作用,在制备微球的过程中,PLEG有可能富集于W/O相界面,从而提高乳状液的稳定性,增加蛋白质的包埋率;另外也可以阻止蛋白质与有机溶剂的接触,避免可能的变性失活。与PLEG相比,PL具有较好的机械强度及适宜的玻璃化转变温度。本文报道PL/PLEG共混微球的制备、表征,并以hCG为模型药物,考察了一系列提高蛋白质包埋率的因素,并对微球进行了表征和初步的释药试验结果。
, http://www.100md.com
1 实验部分
1.1 试剂与原料
乳酸为杭州双林化学试剂厂产品。PEG为上海合成洗涤剂二厂生产。hCG由上海计划生育研究所提供。辛酸亚锡购自Sigma公司。Folin-酚、Folin试剂本实验配制。
1.2 丙交酯的合成
在装有蒸馏装置的250 ml三颈瓶中加入一定量氧化锌,用少许水调成糊状,边搅拌边加入乳酸使氧化锌均匀分散。升温至体系沸腾,蒸出反应生成水,减压下继续蒸馏至无出水为止。在高真空度下(1 mmHg),提高温度至240 ℃蒸出浅黄色粘稠馏分,用乙酸乙酯反复重结晶得白色结晶物。熔点127 ℃,得率为60%。
1.3 PLEG的合成[9]
聚合管经铬酸洗液浸泡后,用10%三甲基氯硅烷甲苯溶液处理,丙酮洗涤,干燥后备用。精制和干燥后的PEG与L以一定比例置于聚合管中,加0.06%(W/W)的辛酸亚锡石油醚溶液;脱溶剂后封管在160 ℃下聚合36 h,得到浅黄色透明固体产物。丙酮溶解,水沉淀以除去未聚合的PEG,沉淀物干燥后再用二氯甲烷溶解,甲醇沉淀,真空干燥后得白色块状固体,得率在80%以上。
, http://www.100md.com
1.4 聚合物特性粘度及分子量测定
聚合物的氯仿溶液(0.1 g/25 ml),用内径为0.55 mm的乌氏粘度计于25 ℃恒温水浴中测定粘度。一点法公式计算聚合物的特性粘度。
聚合物分子量由GPC(WATERS 208)在25 ℃、1.5 ml/min流速下测得,溶剂采用四氢呋喃。
1.5 微球制备
将5 ml适当浓度的hCG水溶液乳化于25 ml聚合物的二氯甲烷溶液中,中速搅拌制得W/O乳状液。将该乳状液倾入到100 ml PVA水溶液中,以低速搅拌制得W/O/W乳状液,室温下将有机溶剂蒸发,微球固化后离心收集,双蒸水洗涤三次,真空干燥,收率大于70%。
1.6 微球粒径测定
, http://www.100md.com 微球经超声波分散于蒸馏水中,取一滴置于载玻片上,用粒径分布仪(partizle analyzer luzex 450)测定其粒径,每个样品至少统计1000个微球。
1.7 蛋白质含量的测定[10]
真空干燥的微球称一定量,用含5%SDS 0.1 mol/L氢氧化钠溶液溶解3天以上;离心后吸取1 ml上清液,加入5 ml Folin-酚试剂,混匀后于20 ℃~25 ℃保温10 min;加入0.5 ml Folin试剂,立即振荡,20 ℃~25 ℃下继续保温30 min,在500 nm处测定吸光度。
蛋白质的包埋率=蛋白质的实际包埋量/蛋白质的理论包埋量
1.8 微球的表面形态
真空干燥过的微球置于试样平台上,经喷金后用扫描电镜(HITACA-520型)观察表面形态。
, 百拇医药
1.9 hCG体外释放
称取一定量含hCG微球加入到渗透膜套管中(spectra/POR,molecular porous dialysis membranes, M.W.Cut off=30,000),套管两端封闭后浸没于5 ml双蒸水中于37 ℃恒温振荡器中振荡释放。每天移去双蒸水测定其中hCG含量(Lowry法),并加入5 ml新鲜双蒸水。
2 结果与讨论
2.1 PLEG共聚物的合成
我们合成了不同PEG链段长度及不同共聚组成的PLEG,结果如表1所示。在同一合成条件下,PLEG的分子量随所用PEG分子量增大而增大;随L/PEG加料比减少而减小。这与邓先模等人[11]用SnCl2催化L与PEG聚合的结果一致。Kissel等人[12]提出了有醇存在时L开环聚合机理,可认为PEG端羟基与催化剂协同进攻L羰基,加速L开环,使得链增长中心增多,聚合物分子量降低。
, 百拇医药
表1 PLEG特点
Table 1 PLEG characteristics Polymer
Mn
Mw
[η]
Tg(℃)
P(L-PEG600)(95∶5)
12476
20584
0.196
37
, http://www.100md.com
P(L-PEG1000)(95∶5)
13452
22728
0.227
26
P(L-PEG6000)(95∶5)
33429
84569
0.659
12
P(L-PEG600)(90∶10)
5676
, 百拇医药
9024
0.115
25
P(L-PEG1000)(90∶10)
8064
14422
0.149
11
P(L-PEG6000)(90∶10)
17310
40312
0.339
, 百拇医药
3
2.2 微球的制备
2.2.1 PL/PLEG共混组成比对hCG包埋率的影响 PL(Mn=12600)/PLEG共混组成比对hCG包埋率影响如表2、3所示,可见同一共混组成比,PLEG中PEG链段越短,hCG包埋率越低。这可能是由于短链段PEG合成得到的PLEG分子量较低,与PL共混制备微球时,油相粘度较小,这使得内水相易与外水相融合,导致hCG包埋率降低。对于不同PL/PLEG共混组成比,hCG包埋率随共混比增加而增加,但当共混比为50∶50时都有一最低值,此现象目前尚无法解释。
表2 PL/PLEG(95∶5)共混组成比对hCG包埋率的影响
Table 2 The effect of PL/PLEG(95∶5) blend composition (w/w) on hCG entrapment efficiency(%) PL/PLEG ratio
, 百拇医药
20∶80
50∶50
60∶40
80∶20
P(L-PEG6000)
48.04
39.30
57.69
67.04
P(L-PEG1000)
27.13
10.58
, http://www.100md.com
30.0
35.68
P(L-PEG600)
10.73
9.3
22.5
33.51
表3 PL/PLEG(90∶10)共混组成比对hCG包埋率的影响
Table 3 The effect of PL/PLEG(90∶10) blend composition(w/w) on hCG entrapment efficiency(%) PL/PLEG ratio
20∶80
, http://www.100md.com
50∶50
60∶40
80∶20
P(L-PEG6000)
61.20
58.29
65.69
74.34
P(L-PEG1000)
36.11
31.10
38.87
, http://www.100md.com
47.57
P(L-PEG600)
32.35
21.31
36.90
42.71
2.2.2 PLEG共聚组成比对hCG包埋率的影响 比较PL/PLEG(95∶5)与PL/PLEG(90∶10)的hCG包埋率可以看出,尽管PLEG(90∶10)分子量低于PLEG(95∶5),但前者的共混微球hCG包埋率均高于后者的共混微球。这可能是由于PLEG(90∶10)具有较丰富的PEG链段,亲水与亲油性比PLEG(95∶5)更接近平衡,更易在W/O界面形成界面膜[13],因而尽管内水相液滴粘度前者小于后者,但由于有较稳定的界面膜隔离,使内水相液滴不易与外水相融合,导致hCG包埋率增大。含PEG大于10%的PLEG,由于Tg较低在室温下难以成球未作考察。
, http://www.100md.com
2.2.3 共混作用对hCG包埋率的影响 共混作用对hCG包埋率的影响如图1、2所示。图1可以看出PL/P(L-co-PEG6000)(90∶10)共混微球在所有共混组成比下hCG的包埋率均高于PL微球,图2可以看出PL/P(L-PEG6000)(90∶10)(80∶20)微球在PL分子量分别小于、接近及大于PLEG的分子量的三种情况下hCG的包埋率均高于相应PL微球。而其它的共混微球hCG的包埋率都较PL微球为低(表2、3)。蛋白质药物包埋率的高低取决于微球制备时O/W界面膜的性质,界面膜强度越大,蛋白质的包埋率越高。PL在O/W界面沉淀形成界面不溶膜,某些PLEG由于其一定的两亲性则首先较快地吸附于O/W界面,形成界面吸附膜,然后在O/W界面形成不溶膜;PLEG形成吸附膜的速度较PL形成不溶膜的速度快,但由于亲水性较PL大,在O/W界面沉淀形成不溶膜速度慢。PL/PLEG共混微球中蛋白质的包埋应是这两种效应共同作用的结果。P(L-co-PEG600)及P(L-co-PEG1000)由于PEG链段较短、两亲性弱,不能有效地形成界面吸附膜,另外由于PLEG分子量低,形成界面不溶膜的速度慢,这使得与PL共混微球中hCG包埋率低。P(L-co-PEG6000)(90∶10)具有相对较长、较丰富的PEG链段,较其它的PLEG有较强的两亲性,可以在W/O界面形成更强界面膜,另外由于分子量较高也可以较快的形成界面不溶膜,这两种效应的共同作用使得共混微球中hCG包埋率高于相应其它共混微球,也高于单组分PL微球。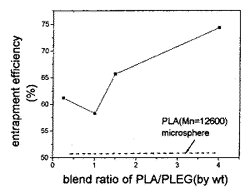
, http://www.100md.com
图1 PL/P(L-co-PEG6000)(90∶10)共混微球中PL含量对hCG包埋率的影响
Fig 1 The dependence of hCG entrapment efficiency on PL content in PL/P(L-co-PEG6000)(90∶10) blend microspheres
图2 共混效应对hCG包埋率的影响。PL∶PLEG=80∶20(用P(L-co-PEG6000)(90∶10)制备微球)
Fig 2 The effect of blending on hCG entrapment efficiency(PL∶PLEG=80∶20,P(L-co-PEG6000)(90∶10) was used)
, http://www.100md.com
2.3 微球表征
2.3.1 微球的粒径 PL/PLEG不同共混组成比下,微球粒径如表4所示。可见,PL/PLEG共混组成比在20∶80~80∶20之间对微球粒径影响不大,而PLE微球粒径较大。这可能是由于PLEG的Tg较低(室温左右或低于室温),微球接近硬化时,由于表面粘度大,碰撞后发生聚集所致。将PL/PLEG共混后可提高Tg,阻止聚集的发生,故粒径减小,对PL/PLEG(80∶20)微球所做的粒径分布分析结果表明,大部分微球粒径在1~5 μm之间,粒径分布较窄(图略)。
表4 PL/PLEG(95∶5)微球粒径
Table 4 PL/PLEG(95∶5) microsphere diameter(μm) PL/PLEG(W/W)
20∶80
, 百拇医药 50∶50
60∶40
80∶20
0∶100
P(L-PEG6000)
5.29
4.98
5.17
4.37
12.9
P(L-PEG1000)
5.63
5.49
, http://www.100md.com
5.21
4.10
/
P(L-PEG600)
4.31
5.27
5.20
4.39
/
2.3.2 微球的形态观察 微球的表面形态影响水化速度,从而影响蛋白质药物的释放速度;在作为药物栓塞剂时,还与栓塞作用有关,表面粗糙的微球易使血液中蛋白质成份在其表面吸附并形成血栓,将病灶附近血管阻塞,实现微球的栓塞作用,相反,微球以注射方式给药时,则要求表面光滑。图3为各种共混组成比的微球扫措电镜照片。PLEG微球表面孔隙度较大且聚集严重(图3左),而PL/PLEG共混微球为具有光滑表面及表面孔隙度较大的微球(图3右)。
, 百拇医药
2.3.3 微球的释放 典型的hCG释放曲线如图4所示。在第一天到第4天的突破效应以后,hCG能够平缓释放近3周。初始的突破可能是位于微球表面的hCG的解吸,而后来的平缓释放则是由于微球的降解所致。根据Stevens等人[14]的研究结果,抗原的释放遵循“突破-缓释”的动力学较平缓释放能够产生更高的抗体滴度,因此PL/PLEG微球很有希望成为一种有效的免疫制剂。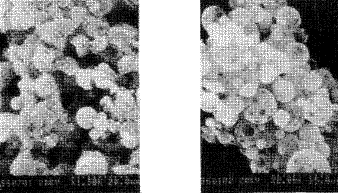
图3 PLEG(左)与PL/PLEG(右)微球的扫描电镜图
Fig 3 SEM photographs of PLEG(Right) and PL/PLEG(Left) microspheres
图4 PL/PLEG(90∶10)(80∶20)微球中hCG释放曲线
, http://www.100md.com
Fig 4 hCG release profile from PL/PLEG(90∶10)(80∶20) microspheres
3 讨 论
选用P(L-PEG6000)与不同分子量的PL共混制备微球,可以更有效的包埋蛋白质;微球具有较小的粒径、较窄的粒径分布及较好的表面形态。hCG从共混微球中的释放遵循“突破-缓释”过程,符合抗原的释放动力学要求。
参考文献:
[1]Ruiz JM, Brusnel JP, Benoft JP. Microcapsulation of peptide: a study of the phase separation of poly(D,L-Lactic acid-co-glycolic acid)copolymers 50/50 by siliconiol. Pharm Res, 1990; 7∶928
, 百拇医药
[2]Nihant N, Grandfils C, Jerome R et al. Microencapsulation by coacervation of poly(lactide--co-glycolide)Ⅳ effect of the processing parameters on coacervation and encapsulation. J Control Rel, 1995; 35∶117
[3]Niwa T, Takeuchi H, Hino T et al. Preparations of biodegradable nanospheres of water-soluble and insoluble drugs with D,L-lactide/glycolide copolymer by a novel spontaneous emulsification solvent diffusion method and drug release behavior. J Control Rel, 1993; 25∶89
, 百拇医药
[4]Wang HT, Shmitt E, FLnagan DR et al. Influence of formulation methods on the in vitro controlled release of protein from polyester microspheres. J Control Rel, 1991; 17∶23
[5]Ogawa Y, Yamamoto M, Okada H et al. A new technique to efficiently entrap leuprolide acetate into microcapsules of polylactic acid or copoly(lactic/glycolic)acid. Chem Pharm Bull, 1988; 36∶1095
[6]Ogawa Y, Yamamoto M, Takada S et al. Controlled release of leuprolide acetate from polylactic acid or copoly(lactic/glycolic) acid microcapsules:influence of molecular weight and copolymer ratio of polymer. Chem Pharm Bull, 1988; 36∶1502
, http://www.100md.com
[7]Jeffery H, Davis SS, O'Hagan DT. The preparation and characterization of poly(lactide-co-glycolide) microspheres Ⅱ the entrapment of a model protein using a (water-in-oil)-in-water emulsion solvent evaporation technique. Pharm Res, 1993; 10∶363
[8]Yan CH, Resau JH, Hewetson J et al. Characterization and morphology analysis of protein-loaded PLGA microparticles prepared by W/O/W emulsion technique. J Control Rel, 1994; 32∶231
, 百拇医药 [9]Zhu KJ, Zhou Linxiang, Yang Shilin. Preparation, characterization and properties of polylactide(PL)-poly(ethylene glycol)(PEG) copolymers:a potential drug carrier. J Apply Polym Sci, 1990; 39∶1
[10]Hora MS, Rana RS, Nunberg JH et al. Release of Human Serum Albumin from poly(lactide-co-glycolide)microspheres. Pharm Res, 1990; 7∶1190
[11]Deng XM, Xiong CD, Cheng LM et al. Synthesis and characterization of block copolymers from D,L-lactide and poly(ethylene glycol) with stannous chloride. J Polym Sci Polyml Lett, 1990; 28∶411
, 百拇医药
[12]Kissel T, Brich Z, Bantle S et al. Parenterol depot-systems on the basis of biodegradable polyesters. J Control Rel, 1991; 16∶27
[13]赵国玺.表面活性剂物理化学.北京:北京大学出版社,1984∶26-27
[14]Stevens VC et al. Development of a delivery system for a birth control vaccine using biodegradable microspheres. In:Kopecek, Jindrich eds,Proc Int Symp Contr Rel Bioact Mater, 19th, 1992∶112-113
收稿日期:1998-05-26
修改日期:1999-02-10, http://www.100md.com
单位:蒋宏亮(浙江大学 高分子科学与工程系,杭州 310027);朱康杰(浙江大学 高分子科学与工程系,杭州 310027)
关键词:PL;PLEG;共混;微球;蛋白质的包埋率
生物医学工程学杂志000102 摘 要:PL与PLEG是生物降解、生物相容的高分子材料,利用它们作为药物控释载体已引起人们广泛的重视。我们合成了含不同PEG链段长度的PLEG共聚物,并利用PL与PLEG这两种材料各自的优点制备载有人绒毛促性腺激素(hCG)的共混微球以提高hCG在微球中的包埋率,结果表明采用P(L-co-PEG6000)(90∶10)与PL共混制备得到的微球中,hCG的包埋率高于单独用PL或PLEG制得的微球。hCG的体外释放为突破-缓释过程,符合抗原释放要求。
Preparation, Characterization and Drug Release Characteristics of
, 百拇医药
Poly(lactide)(PL)/Poly(lactide-co-polyethylene glycol)(PLEG) Blend Microspheres
Jiang Hongliang Zhu Kangjie
(Department of Polymer Science and Engineering, Zhejiang University, Hangzhou 310027)
Abstract:PL and PLEG are biodegradable, biocompatible polymers. They have been widely used for controlled release of drugs. We synthesized PLEG copolymers containing PEG segments with various molecular weight and prepared hCG-loaded PL/PLEG blend microspheres to improve hCG entrapment efficiency. It was shown that the hCG entrapment effciency of PL/PLEG microspheres was higher than that of PL or PLEG microspheres when P(L-co-PEG6000)(90∶10) was used. In vitro release test showed that the release of hCG was a burst-slow process, which was thought to be good for antigens to produce antibodies.
, 百拇医药
Key words:Polylactide Poly(lactide-co-polyethylene glycol) Blend Microspheres Entrapment efficiency of protein▲
随着基因工程及化学合成技术的发展,越来越多的多肽、蛋白质药物被研制出来并在临床应用中表现出许多独特的疗效。与传统的小分子药物相比,这类药物存在体内易降解、易失活以及难以在胃肠道内被体内吸收等缺点,阻碍了在临床上方便、广泛和有效地使用。以生物降解性高分子材料为载体材料制成微球,可以实现多肽、蛋白质药物在体内的持续释放,从而避免通常所需的频繁注射的弊端,同时还可制成多途径给药,例如鼻腔给药、直肠给药和口服给药等制剂。目前多肽或蛋白质药物的聚合物微球最常用的制备方法有凝聚-相分离法[1,2]、溶剂挥发法[3~8]和水/油/水乳状液-溶剂挥发法(w/o/w)。Ogawa等人[5,6]通过在乳化前于内水相中加入明胶,将Leuprolide Acetate包埋入PL或聚(丙交酯-共乙交酯)(PLGA)微球中以提高药物包埋率;Jeffery等人[7]考察了卵清蛋白(OVA)/PLGA体系中药物与辅料的比例、乳化剂的浓度、外水相的体积等因素对微球粒径的影响;Yan等人[8]则研究了乳状液制备时搅拌方式对微球的影响如微球粒径、药物包埋率以及微球结构等。尽管采用他们的方法可以在一定程度上提高药物的包埋率,但一般来说微球的粒径也会相应增加,这将限制微球的应用范围;另外由于在微球制备过程中,多肽、蛋白质药物不可避免地要接触到有机溶剂,这有可能导致药物的变性失活。PLEG是一种嵌段型共聚物,具有较长的亲水性PEG链段及疏水性的PL链段[9],因而具有一定的表面活性作用,在制备微球的过程中,PLEG有可能富集于W/O相界面,从而提高乳状液的稳定性,增加蛋白质的包埋率;另外也可以阻止蛋白质与有机溶剂的接触,避免可能的变性失活。与PLEG相比,PL具有较好的机械强度及适宜的玻璃化转变温度。本文报道PL/PLEG共混微球的制备、表征,并以hCG为模型药物,考察了一系列提高蛋白质包埋率的因素,并对微球进行了表征和初步的释药试验结果。
, http://www.100md.com
1 实验部分
1.1 试剂与原料
乳酸为杭州双林化学试剂厂产品。PEG为上海合成洗涤剂二厂生产。hCG由上海计划生育研究所提供。辛酸亚锡购自Sigma公司。Folin-酚、Folin试剂本实验配制。
1.2 丙交酯的合成
在装有蒸馏装置的250 ml三颈瓶中加入一定量氧化锌,用少许水调成糊状,边搅拌边加入乳酸使氧化锌均匀分散。升温至体系沸腾,蒸出反应生成水,减压下继续蒸馏至无出水为止。在高真空度下(1 mmHg),提高温度至240 ℃蒸出浅黄色粘稠馏分,用乙酸乙酯反复重结晶得白色结晶物。熔点127 ℃,得率为60%。
1.3 PLEG的合成[9]
聚合管经铬酸洗液浸泡后,用10%三甲基氯硅烷甲苯溶液处理,丙酮洗涤,干燥后备用。精制和干燥后的PEG与L以一定比例置于聚合管中,加0.06%(W/W)的辛酸亚锡石油醚溶液;脱溶剂后封管在160 ℃下聚合36 h,得到浅黄色透明固体产物。丙酮溶解,水沉淀以除去未聚合的PEG,沉淀物干燥后再用二氯甲烷溶解,甲醇沉淀,真空干燥后得白色块状固体,得率在80%以上。
, http://www.100md.com
1.4 聚合物特性粘度及分子量测定
聚合物的氯仿溶液(0.1 g/25 ml),用内径为0.55 mm的乌氏粘度计于25 ℃恒温水浴中测定粘度。一点法公式计算聚合物的特性粘度。
聚合物分子量由GPC(WATERS 208)在25 ℃、1.5 ml/min流速下测得,溶剂采用四氢呋喃。
1.5 微球制备
将5 ml适当浓度的hCG水溶液乳化于25 ml聚合物的二氯甲烷溶液中,中速搅拌制得W/O乳状液。将该乳状液倾入到100 ml PVA水溶液中,以低速搅拌制得W/O/W乳状液,室温下将有机溶剂蒸发,微球固化后离心收集,双蒸水洗涤三次,真空干燥,收率大于70%。
1.6 微球粒径测定
, http://www.100md.com 微球经超声波分散于蒸馏水中,取一滴置于载玻片上,用粒径分布仪(partizle analyzer luzex 450)测定其粒径,每个样品至少统计1000个微球。
1.7 蛋白质含量的测定[10]
真空干燥的微球称一定量,用含5%SDS 0.1 mol/L氢氧化钠溶液溶解3天以上;离心后吸取1 ml上清液,加入5 ml Folin-酚试剂,混匀后于20 ℃~25 ℃保温10 min;加入0.5 ml Folin试剂,立即振荡,20 ℃~25 ℃下继续保温30 min,在500 nm处测定吸光度。
蛋白质的包埋率=蛋白质的实际包埋量/蛋白质的理论包埋量
1.8 微球的表面形态
真空干燥过的微球置于试样平台上,经喷金后用扫描电镜(HITACA-520型)观察表面形态。
, 百拇医药
1.9 hCG体外释放
称取一定量含hCG微球加入到渗透膜套管中(spectra/POR,molecular porous dialysis membranes, M.W.Cut off=30,000),套管两端封闭后浸没于5 ml双蒸水中于37 ℃恒温振荡器中振荡释放。每天移去双蒸水测定其中hCG含量(Lowry法),并加入5 ml新鲜双蒸水。
2 结果与讨论
2.1 PLEG共聚物的合成
我们合成了不同PEG链段长度及不同共聚组成的PLEG,结果如表1所示。在同一合成条件下,PLEG的分子量随所用PEG分子量增大而增大;随L/PEG加料比减少而减小。这与邓先模等人[11]用SnCl2催化L与PEG聚合的结果一致。Kissel等人[12]提出了有醇存在时L开环聚合机理,可认为PEG端羟基与催化剂协同进攻L羰基,加速L开环,使得链增长中心增多,聚合物分子量降低。
, 百拇医药
表1 PLEG特点
Table 1 PLEG characteristics Polymer
Mn
Mw
[η]
Tg(℃)
P(L-PEG600)(95∶5)
12476
20584
0.196
37
, http://www.100md.com
P(L-PEG1000)(95∶5)
13452
22728
0.227
26
P(L-PEG6000)(95∶5)
33429
84569
0.659
12
P(L-PEG600)(90∶10)
5676
, 百拇医药
9024
0.115
25
P(L-PEG1000)(90∶10)
8064
14422
0.149
11
P(L-PEG6000)(90∶10)
17310
40312
0.339
, 百拇医药
3
2.2 微球的制备
2.2.1 PL/PLEG共混组成比对hCG包埋率的影响 PL(Mn=12600)/PLEG共混组成比对hCG包埋率影响如表2、3所示,可见同一共混组成比,PLEG中PEG链段越短,hCG包埋率越低。这可能是由于短链段PEG合成得到的PLEG分子量较低,与PL共混制备微球时,油相粘度较小,这使得内水相易与外水相融合,导致hCG包埋率降低。对于不同PL/PLEG共混组成比,hCG包埋率随共混比增加而增加,但当共混比为50∶50时都有一最低值,此现象目前尚无法解释。
表2 PL/PLEG(95∶5)共混组成比对hCG包埋率的影响
Table 2 The effect of PL/PLEG(95∶5) blend composition (w/w) on hCG entrapment efficiency(%) PL/PLEG ratio
, 百拇医药
20∶80
50∶50
60∶40
80∶20
P(L-PEG6000)
48.04
39.30
57.69
67.04
P(L-PEG1000)
27.13
10.58
, http://www.100md.com
30.0
35.68
P(L-PEG600)
10.73
9.3
22.5
33.51
表3 PL/PLEG(90∶10)共混组成比对hCG包埋率的影响
Table 3 The effect of PL/PLEG(90∶10) blend composition(w/w) on hCG entrapment efficiency(%) PL/PLEG ratio
20∶80
, http://www.100md.com
50∶50
60∶40
80∶20
P(L-PEG6000)
61.20
58.29
65.69
74.34
P(L-PEG1000)
36.11
31.10
38.87
, http://www.100md.com
47.57
P(L-PEG600)
32.35
21.31
36.90
42.71
2.2.2 PLEG共聚组成比对hCG包埋率的影响 比较PL/PLEG(95∶5)与PL/PLEG(90∶10)的hCG包埋率可以看出,尽管PLEG(90∶10)分子量低于PLEG(95∶5),但前者的共混微球hCG包埋率均高于后者的共混微球。这可能是由于PLEG(90∶10)具有较丰富的PEG链段,亲水与亲油性比PLEG(95∶5)更接近平衡,更易在W/O界面形成界面膜[13],因而尽管内水相液滴粘度前者小于后者,但由于有较稳定的界面膜隔离,使内水相液滴不易与外水相融合,导致hCG包埋率增大。含PEG大于10%的PLEG,由于Tg较低在室温下难以成球未作考察。
, http://www.100md.com
2.2.3 共混作用对hCG包埋率的影响 共混作用对hCG包埋率的影响如图1、2所示。图1可以看出PL/P(L-co-PEG6000)(90∶10)共混微球在所有共混组成比下hCG的包埋率均高于PL微球,图2可以看出PL/P(L-PEG6000)(90∶10)(80∶20)微球在PL分子量分别小于、接近及大于PLEG的分子量的三种情况下hCG的包埋率均高于相应PL微球。而其它的共混微球hCG的包埋率都较PL微球为低(表2、3)。蛋白质药物包埋率的高低取决于微球制备时O/W界面膜的性质,界面膜强度越大,蛋白质的包埋率越高。PL在O/W界面沉淀形成界面不溶膜,某些PLEG由于其一定的两亲性则首先较快地吸附于O/W界面,形成界面吸附膜,然后在O/W界面形成不溶膜;PLEG形成吸附膜的速度较PL形成不溶膜的速度快,但由于亲水性较PL大,在O/W界面沉淀形成不溶膜速度慢。PL/PLEG共混微球中蛋白质的包埋应是这两种效应共同作用的结果。P(L-co-PEG600)及P(L-co-PEG1000)由于PEG链段较短、两亲性弱,不能有效地形成界面吸附膜,另外由于PLEG分子量低,形成界面不溶膜的速度慢,这使得与PL共混微球中hCG包埋率低。P(L-co-PEG6000)(90∶10)具有相对较长、较丰富的PEG链段,较其它的PLEG有较强的两亲性,可以在W/O界面形成更强界面膜,另外由于分子量较高也可以较快的形成界面不溶膜,这两种效应的共同作用使得共混微球中hCG包埋率高于相应其它共混微球,也高于单组分PL微球。

, http://www.100md.com
图1 PL/P(L-co-PEG6000)(90∶10)共混微球中PL含量对hCG包埋率的影响
Fig 1 The dependence of hCG entrapment efficiency on PL content in PL/P(L-co-PEG6000)(90∶10) blend microspheres

图2 共混效应对hCG包埋率的影响。PL∶PLEG=80∶20(用P(L-co-PEG6000)(90∶10)制备微球)
Fig 2 The effect of blending on hCG entrapment efficiency(PL∶PLEG=80∶20,P(L-co-PEG6000)(90∶10) was used)
, http://www.100md.com
2.3 微球表征
2.3.1 微球的粒径 PL/PLEG不同共混组成比下,微球粒径如表4所示。可见,PL/PLEG共混组成比在20∶80~80∶20之间对微球粒径影响不大,而PLE微球粒径较大。这可能是由于PLEG的Tg较低(室温左右或低于室温),微球接近硬化时,由于表面粘度大,碰撞后发生聚集所致。将PL/PLEG共混后可提高Tg,阻止聚集的发生,故粒径减小,对PL/PLEG(80∶20)微球所做的粒径分布分析结果表明,大部分微球粒径在1~5 μm之间,粒径分布较窄(图略)。
表4 PL/PLEG(95∶5)微球粒径
Table 4 PL/PLEG(95∶5) microsphere diameter(μm) PL/PLEG(W/W)
20∶80
, 百拇医药 50∶50
60∶40
80∶20
0∶100
P(L-PEG6000)
5.29
4.98
5.17
4.37
12.9
P(L-PEG1000)
5.63
5.49
, http://www.100md.com
5.21
4.10
/
P(L-PEG600)
4.31
5.27
5.20
4.39
/
2.3.2 微球的形态观察 微球的表面形态影响水化速度,从而影响蛋白质药物的释放速度;在作为药物栓塞剂时,还与栓塞作用有关,表面粗糙的微球易使血液中蛋白质成份在其表面吸附并形成血栓,将病灶附近血管阻塞,实现微球的栓塞作用,相反,微球以注射方式给药时,则要求表面光滑。图3为各种共混组成比的微球扫措电镜照片。PLEG微球表面孔隙度较大且聚集严重(图3左),而PL/PLEG共混微球为具有光滑表面及表面孔隙度较大的微球(图3右)。
, 百拇医药
2.3.3 微球的释放 典型的hCG释放曲线如图4所示。在第一天到第4天的突破效应以后,hCG能够平缓释放近3周。初始的突破可能是位于微球表面的hCG的解吸,而后来的平缓释放则是由于微球的降解所致。根据Stevens等人[14]的研究结果,抗原的释放遵循“突破-缓释”的动力学较平缓释放能够产生更高的抗体滴度,因此PL/PLEG微球很有希望成为一种有效的免疫制剂。

图3 PLEG(左)与PL/PLEG(右)微球的扫描电镜图
Fig 3 SEM photographs of PLEG(Right) and PL/PLEG(Left) microspheres

图4 PL/PLEG(90∶10)(80∶20)微球中hCG释放曲线
, http://www.100md.com
Fig 4 hCG release profile from PL/PLEG(90∶10)(80∶20) microspheres
3 讨 论
选用P(L-PEG6000)与不同分子量的PL共混制备微球,可以更有效的包埋蛋白质;微球具有较小的粒径、较窄的粒径分布及较好的表面形态。hCG从共混微球中的释放遵循“突破-缓释”过程,符合抗原的释放动力学要求。
参考文献:
[1]Ruiz JM, Brusnel JP, Benoft JP. Microcapsulation of peptide: a study of the phase separation of poly(D,L-Lactic acid-co-glycolic acid)copolymers 50/50 by siliconiol. Pharm Res, 1990; 7∶928
, 百拇医药
[2]Nihant N, Grandfils C, Jerome R et al. Microencapsulation by coacervation of poly(lactide--co-glycolide)Ⅳ effect of the processing parameters on coacervation and encapsulation. J Control Rel, 1995; 35∶117
[3]Niwa T, Takeuchi H, Hino T et al. Preparations of biodegradable nanospheres of water-soluble and insoluble drugs with D,L-lactide/glycolide copolymer by a novel spontaneous emulsification solvent diffusion method and drug release behavior. J Control Rel, 1993; 25∶89
, 百拇医药
[4]Wang HT, Shmitt E, FLnagan DR et al. Influence of formulation methods on the in vitro controlled release of protein from polyester microspheres. J Control Rel, 1991; 17∶23
[5]Ogawa Y, Yamamoto M, Okada H et al. A new technique to efficiently entrap leuprolide acetate into microcapsules of polylactic acid or copoly(lactic/glycolic)acid. Chem Pharm Bull, 1988; 36∶1095
[6]Ogawa Y, Yamamoto M, Takada S et al. Controlled release of leuprolide acetate from polylactic acid or copoly(lactic/glycolic) acid microcapsules:influence of molecular weight and copolymer ratio of polymer. Chem Pharm Bull, 1988; 36∶1502
, http://www.100md.com
[7]Jeffery H, Davis SS, O'Hagan DT. The preparation and characterization of poly(lactide-co-glycolide) microspheres Ⅱ the entrapment of a model protein using a (water-in-oil)-in-water emulsion solvent evaporation technique. Pharm Res, 1993; 10∶363
[8]Yan CH, Resau JH, Hewetson J et al. Characterization and morphology analysis of protein-loaded PLGA microparticles prepared by W/O/W emulsion technique. J Control Rel, 1994; 32∶231
, 百拇医药 [9]Zhu KJ, Zhou Linxiang, Yang Shilin. Preparation, characterization and properties of polylactide(PL)-poly(ethylene glycol)(PEG) copolymers:a potential drug carrier. J Apply Polym Sci, 1990; 39∶1
[10]Hora MS, Rana RS, Nunberg JH et al. Release of Human Serum Albumin from poly(lactide-co-glycolide)microspheres. Pharm Res, 1990; 7∶1190
[11]Deng XM, Xiong CD, Cheng LM et al. Synthesis and characterization of block copolymers from D,L-lactide and poly(ethylene glycol) with stannous chloride. J Polym Sci Polyml Lett, 1990; 28∶411
, 百拇医药
[12]Kissel T, Brich Z, Bantle S et al. Parenterol depot-systems on the basis of biodegradable polyesters. J Control Rel, 1991; 16∶27
[13]赵国玺.表面活性剂物理化学.北京:北京大学出版社,1984∶26-27
[14]Stevens VC et al. Development of a delivery system for a birth control vaccine using biodegradable microspheres. In:Kopecek, Jindrich eds,Proc Int Symp Contr Rel Bioact Mater, 19th, 1992∶112-113
收稿日期:1998-05-26
修改日期:1999-02-10, http://www.100md.com