阻断糖皮质激素受体的雏鸡抵抗地塞米松诱导的免疫抑制作用*
作者:潘兴华 王水琴 陈志龙 黄丽娜
单位:潘兴华 陈志龙 黄丽娜(成都军区昆明总医院医学实验科,昆明650032);王水琴(解放军农牧大学动物医学系)
关键词:糖皮质激素受体;地塞米松;雏鸡;免疫抑制
细胞与分子免疫学杂志990113
摘要 给予雏鸡地塞米松(Dex)10mg~75mg/kg后24h,诱导脾淋巴细胞产生IL-2和IFN诱生的活性,T、B细胞对Con-A的反应性,以及免疫器官(脾脏、胸腺及法氏囊)重量与体重比值均降低(P<0.01)。用50mg/kg的RU486阻断GR后,对Dex诱导的免疫抑制无明显地逆转作用,表现为阻断GR后,给予(10~75)mg/kg的Dex24h,上述免疫参数仍明显低于正常雏鸡(P<0.01),与只给予Dex的雏鸡相比较,无明显差异(P>0.05)。用25mg/kg的RU486阻断GR,对Dex诱导的免疫抑制作用具有明显地逆转作用,阻断GR后再给予(10~75)mg/kg的Dex后24h,上述免疫参数明显高于只给予Dex的雏鸡(P<0.01)。若给予10mg/kg或25mg/kg的Dex时,上述免疫参数接近正常水平,表明Dex对雏鸡的免疫抑制作用主要由GR所介导,给予适当量的RU486阻断GR的功能,有利于雏鸡抵抗糖皮质激素诱导的免疫抑制作用。
, 百拇医药
中国图书资料分类号 R392.2
The effect of blocking glucocorticoid receptor on the dexamethasone-induced immunosup-pression in chickens
Pan Xinghua, Wang Shuiqin1, Chen Zhilong, Huang Lina (Department of Medical Experiment, Kunming General Hospital, Kunming 650032)
Keywords glucocorticoid receptor dexamethasone chicken immunosuppression
Abstract The effects of blocking glucocorticoid receptor (GR) on dexamethasone (Dex)-induced immunosuppression in chickens were studied. Production of IL-2 and IFN by chicken spleen lymphocytes, immune responses of T and B cells to Con-A, and ratios of immune organs'(spleen, thymus and bursa of Fabricius) weight to body weight were reduced after administration of 10 mg~75 mg/kg of Dex to the chickens. Dex-induced immunosuppression could not be reversed on condition that GR was blocked with 50 mg/kg of Ru 486, proved by that the immune indexes of the chicken treated with 10 mg -75 mg/kg of Dex for 24 hours after GR blocking were markedly lower than those of normal chickens, and similar (P > 0.05) to those of the chickens treated with Dex alone. Dex-induced immunosuppresion could be reversed after GR was blocked with 25 mg/kg of RU486, when the above immune indexes in chickens treated with 10 mg~75 mg/kg of Dex for 24 hours after GR blocking were greatly higher than those in chickens treated with Dex alone(P<0.01). Further more, various immune indexes in chickens treated with 10 mg/kg or 25 mg/kg of Dex after GR blocking with 25 mg/kg of Ru 486 were close to those in normal chickens, indicating that immunosuppression of Dex on chickens was mainly mediated via GR mechanism, and GR function blocking with suitable dose of RU486 was beneficial for the chickens to resist glucocorticoid-induced immunosuppression.
, 百拇医药
糖皮质激素(GC)是体内的强效免疫调节因子,对免疫系统的影响极为广泛,同时也是烧伤、创伤、手术等强烈应激引起免疫抑制的主要原因之一。长期的应激反应往往可使体内GC分泌增加,免疫功能抑制,抗病能力下降,成为传染病、肿瘤等疾病发生的重要诱因。现代大规模畜禽饲养管理中,应激病也是常见的疾病,常可引起动物生产性能(指食用动物肉品质量、数量和繁殖力)下降和动物大批死亡等〔1,2〕。对于应激性疾病的防治,目前除消除应激因素和对症治疗外,尚无有效地防治措施。传统认为,GC的生物学作用是由GR所介导,各类免疫细胞均含有丰富的GR,因此阻断GR的功能,改变GR的活性,或减少GR的表达,都有可能有效地阻止GC的免疫抑制作用。另外,我们的前期实验发现,GR可能不仅是GC作用的桥梁,而且可能是GC和免疫系统相互作用的调节者,在内分泌和免疫的相互调节中起重要的作用〔1〕。本研究的目的在于阐明GR的内分泌免疫作用机制和阻断断GR在阻止GC免疫抑制中的意义。
1 材料和方法
, 百拇医药
1.1 主要试剂 RU486为上海计划生育研究所产品,用12%聚乙烯醇胶体溶液(即PVA),配制成不同浓度。Dex为华美公司产品,配制同RU486。伴刀豆球蛋白A(ConA)、乙酸豆寇佛波醇(PMA)、RPMI-1640培养液及MEM培养液,均为美国Technologies公司生产。a-甲基-D-甘露糖苷(aMM)为瑞士生产。3H-胸腺嘧啶核苷(3HTdR)为中国原子能研究所生产,放化纯度大于95%,放射性浓度为37BGq/L,用RPMI-1640培养液1∶50稀释备用。闪烁液2,5-二甲基恶唑5g,1,4-双-〔5-苯基恶唑基-2〕-苯0.3g,加无水乙醇200ml,甲苯800ml。
1.2 实验动物的分组 日龄伊萨褐公雏鸡,购自长春农业科学院,即日于实验室内分笼饲养,经20d健康观察无异常后,随机分为I~Ⅳ4组进行实验。第I组每只皮下注射50mg/kgRU486,第II组每只皮下注射25mg/kgRU486,第Ⅲ组皮下注射等体积的PVA。然后Ⅰ,Ⅱ,Ⅲ组每组分别皮下注射75,50,25和10mg/kgDex各5只作为对照,第Ⅳ组10只,同步注射等体积的PVA作为对照。各组雏鸡注射后24h称重,心脏采血后宰杀,无菌取脾、胸腺和法氏囊称重,分离培养脾淋巴细胞检测其诱生IL-2,IFN的活性和T、B细胞对有丝分裂原的反应性。
, 百拇医药
1.3 IL-2的体外诱生及活性检测 采用生物学活性法〔3〕。制备实验雏鸡脾细胞悬液,用24孔板培养细胞,培养液为RPMI-1640,细胞浓度为2.5×109/L,ConA的浓度为10mg/L。将细胞于40℃、5%CO2下培养24h,离心收集IL-2诱生上清,-40℃保存。按上述方法培养60d龄的雏鸡脾淋巴细胞48h,分离、收集活化的淋巴母细胞,加10g/L的aMM于40℃保温15min,用含20g/LaMM的RPMI1640培养液调细胞浓度至5×109/L,作为检测样品IL2活性的靶细胞。于96孔板中,每孔加入靶细胞悬液50μl,IL-2诱生上清样品50μl。每个样品设1∶2,1∶4,1∶8,1∶16和1∶32,5个稀释度,每个稀释度重复3孔,同时设空白对照和自制参考鸡IL-2样品对照。将细胞于40℃、5%CO2下培养24h,每孔加3H-TdR(0.074BGq/L)50μl,继续培养24h,测定3H-TdR的掺入量。结果以cpm值表示,以1∶16稀释孔中样品的平均cpm值计算结果。
, http://www.100md.com
1.4 脾淋巴细胞IFN诱生活性的检测 采用微量病变抑制法〔4〕。按诱生IL-2的方法诱生IFN,对水泡性口炎病毒(VSV)进行效价测定。在96孔板中,制备10d龄鸡胚传代成纤维细胞,用MEM培养液在培养板上对样品进行连续2倍稀释,每个稀释度设2个复孔,同时设自制参考鸡IFN对照、细胞对照和VSV对照。将细胞置于37℃、5%CO2下培养18h,以MEM洗涤,每孔中加入100μlVSV(100TCID50/ml),细胞对照孔加100μlMEM培养液。继续培养24h,于病毒生长良好时,用倒置显微镜观察细胞病变(PCE)。IFN的效价为出现50%细胞病变效应孔的最高稀释度的倒数(U/ml)。
1.5 T、B细胞增殖活性的检测 按文献〔5,6〕的方法制备脾、法氏囊淋巴细胞悬液,以3H-TdR掺入法测定脾T淋巴细胞对ConA的反应性和法氏囊淋巴细胞对PMA的反应性,结果以刺激指数(SI)表示。
, http://www.100md.com
1.6 免疫器官与体重比的检查 采用常规方法,以雏鸡免疫器官与其体重的比值×100表示。
2 结果
2.1 脾细胞IL-2和IFN诱生活性的变化 应用50mg/kgRU486阻断GR后,注射Dex(10~75mg/kg)的雏鸡脾细胞IL-2和IFN的诱生活性低于正常对照(P<0.01)。与只注射Dex的雏鸡相比较,IL-2诱生活性升高(P<0.05),IFN诱性活性在Dex75mg/kg和50mg/kg组升高(P<0.05),其余P>0.05。用25mg/kgRU486阻断GR后,注射Dex的雏鸡IL2和IFN诱生活性均明显高于只注射同剂量Dex的雏鸡(P<0.05),在Dex75mg/kg组和50mg/kg组低于正常鸡(P<0.05),10mg/kg组和25mg/kg组接近正常雏鸡(P>0.05);随Dex剂量组的减小,IL-2和IFN诱生活性升高,两个Dex剂量间的IL-2和IFN诱生活性相比较差异显著(P<0.05),结果见图1,2。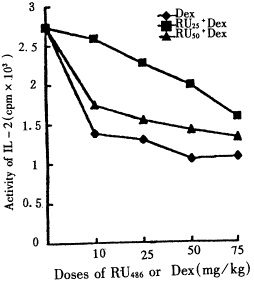

, 百拇医药
图1 阻断GR后Dex诱导的脾细胞IL-2产
生的变化
Fig 1 The changes in Dex-induced IL-2 production after GR blocked with RU486
图2 阻断GR后Dex诱导的脾细胞IFN产生的变化
Fig 2 The changes in Dex-induced IFN production after GR blocked with RU486
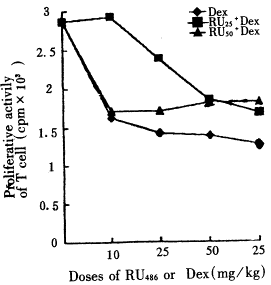
2.2 脾淋巴细胞增殖活性的变化 用50mg/kgRU486阻断GR后,注射Dex的雏鸡T、B细胞对有丝分裂原的反应性低于对照雏鸡(P<0.01)。T细胞的增殖活性与只注射同剂量Dex的鸡相比较无差异(P>0.05)。B细胞增殖活性在75mg/kg和50mg/kgDex组均高于单独注射同剂量Dex的雏鸡,其余无差异(P>0.05)。用25mg/kgRU486阻断GR,并注射Dex雏鸡的T、B细胞,对有丝分裂原的反应性低于健康对照(P<0.05),但除75mg/kgDex组外,都明显高于单独注射同剂量Dex的雏鸡(P<0.01),结果见图3,4。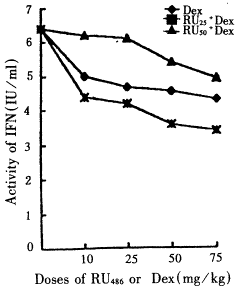
, 百拇医药
图3 阻断GR后Dex诱导的脾T细胞增殖活性
的变化
Fig 3 The changes in proliferative activity of T cells after GR blocked with RU486
图4 阻断GR后Dex诱导的脾B细胞增殖活性
的变化
Fig 4 The changes in proliferative activity of B cells after GR blocked with RU486
2.3 免疫器官与体重比的变化 用50mg/kg的RU486阻断GR后,注射Dex的雏鸡脾脏、胸腺、法氏囊的重量与体重的比值低于正常对照组(P<0.01),法氏囊重量与体重比高于单独注射同剂量Dex的雏鸡(P<0.05),其余略高于单独注射同剂量Dex的雏鸡,但无统计学意义(P>0.05)。用25mg/kgRU486阻断GR后,注射Dex的雏鸡脾脏、胸腺、法氏囊的重量与体重之比值,在10mg/kgDex组与对照组无差异(P>0.05),其余低于正常对照组(P<0.05),但都明显高于只注射同剂量Dex的雏鸡(P<0.05)。
, http://www.100md.com
3 讨论
RU486,又名Miferistone(17B-羟-11B〔4-二甲氨基苯〕-17a丙炔基-1-雌甾-1,9-烯-3-酮),是一种能与GC竞争结合GR但无GC作用的甾类化合物。其对GR的亲和力高,与大鼠GR和亲和力大约是Dex的3倍,而且解离速度慢,因此是一种良好的GR功能阻断剂或GC拮抗剂。本研究中用RU486阻断GR的功能,具有作用确实、结果可靠的特点〔7〕。人们已对GC的免疫抑制作用做了深入地研究,认为GC可选择性地抑制细胞免疫,使免疫器官萎缩,T细胞活性降低,细胞因子合成减少,对ConA,PHA,PWM及抗原诱导的淋巴细胞转化和增殖的作用降低等。其对体液免疫的影响较为复杂,低浓度时起促进作用,高浓度时则抑制〔8〕,本实验的结果与有关报道基本一致。关于体内应用RU486阻断GR功能,对GC免疫调节作用的影响未见报道。我们发现,用50mg/kgRU486阻断GR的功能,不能有效地阻止Dex的免疫抑制作用,表现为阻断GR后,Dex对雏鸡的免疫抑制效应与单独给予Dex的雏鸡无明显差异,与我们体外实验的结果相似〔9〕。Bradly等也认为,10-5mol/L的RU486对人淋巴细胞对ConA的反应性有明显抑制作用,而在10-6和10-7mol/L时无影响。VanVoorhis等体外实验发现,用1~10nmol/LRU486阻断GR后,可拮抗皮质醇对人淋巴细胞增殖的抑制效应,而浓度升高时则可与皮质醇一起抑制淋巴细胞的增殖反应〔9〕,与我们体内实验的结果基本一致。但本实验中没有出现协同抑制效应,我们认为可能是体内多种因素共同作用的结果,详细机制尚需进一步研究。以25mg/kgRU486阻断GR的功能后,给予(10~75)mg/kgDex,虽然所有公雏鸡的免疫指标都部分低于正常对照,但明显高于单独给予同剂量Dex的雏鸡,且有剂量依赖性。减小Dex的剂量,RU486对Dex免疫抑制的逆转作用增加,说明适当量地阻断GR功能,可有效地阻止GC的免疫抑制作用,从而为临床防治GC引起的免疫抑制性疾病提供了新的思路和方法。本研究还进一步证实,GC对雏鸡免疫系统的作用机制与哺乳动物相同,主要也由GR所介导。
, http://www.100md.com
在实践中,由于应激等因素引起的内源性GC产生过多而导致免疫抑制的情况比较多见〔10,11〕,常是影响烧创、创伤、外科手术和感染等应激性疾病防治和畜牧业发展的重要因素,本实验无疑是一种有益的探索。但体内免疫和内分泌系统之间相互调节的关系极为复杂,有关GR在内分泌和免疫网络中的重要意义及应用尚需做深入地研究。GC对免疫系统具有广泛而深刻的影响,而且值得注意的是,体内分泌的GC在活性上与人工合成的GC有较大差异,一定浓度的GC可能有促进免疫功能的作用,是维持正常免疫功能的必需因素。另外,GC对免疫系统的作用具有浓度依赖性、免疫细胞类型的特异性,并受遗传因素和抗原种类及刺激程度的影响。免疫细胞可通过改变GR的表达及活性来调节合适的免疫反应,而且其本身也作为分泌“器官”产生多种细胞因子和激素,而反馈调节免疫细胞的活性,借以维持正常的免疫功能〔12〕。因此,合适含量的功能性GR对维持免疫细胞的活性具有重要的意义。从本实验的结果来看,采用25mg/kgRU486阻断GR功能,来防治鸡GC的免疫抑制作用较为合适。同步实验表明,给予雏鸡50mg/kgRU486,可使外周血淋巴细胞GR的结合容量下降60%左右,而给予雏鸡25mg/kg的RU486时,外周血淋巴细胞GR的结合容量下降30%左右。一般GR的功能被阻断30%时,对淋巴细胞的活性无影响,而且可以有效地逆转一定剂量的Dex诱导的免疫抑制作用。雏鸡免疫系统的组成和发育与哺乳动物相似,因此,本研究有可能为人和哺乳动物应激性疾病的防治提供新的思路。
, http://www.100md.com
*国家自然科学基金资助项目,NO.39670549
作者简介:潘兴华,男,35岁,主治医师,硕士
昆明市大观路44号,Tel.(0871)4074661
参考文献
[1]潘兴华,王水琴,牛廷献.应激对免疫功能的影响.中国兽医杂志,1996;22(1):52~53
[2]金伯泉主编.细胞与分子免疫学.西安:世界图书出版公司,1995:133~134
[3]Schnetzler M, Oommen A, Nowak JS,et al. Characterization of chicken T cell growth factor. Eur Immunol, 1983; 13: 560~563
, 百拇医药
[4]杨贵贞主编.免疫生物工程纲要与技术.长春:吉林科技出版社,1993:28~29
[5]Thiel H J, Burkhardt E. Development of optimal conditions for the stimulation of chicken peripheral blood lymophocytes by PHA in the microculture system. Vet Immunopathol, 1984; 6:327~329
[6]徐彦波.雏鸡感染鸡传染性贫血后细胞因子和免疫功能的变化及对新城疫苗免疫的影响〔博士论文〕.东北农业大学,1993;6:19~22
[7]Philibert D, Costerousse G, Gaillard Moguilewsky M,et al. From RU486 towards dissociated antiglucocorticoid and antiprogesterone. Front Horm Res, 1991; 19:1~ 17
, 百拇医药
[8]潘兴华,王水琴,陈志龙.体外阻断GR功能对雏鸡脾淋巴功能活性及Dex免疫抑制的影响.细胞与分子免疫学杂志,1997;13(2):8~10
[9]Van Voorhis B, Anderson D, Hill J. The effects of RU486 on immune function and steroid induced immuno-suppression in vitro. J Chin Endocr Metab, 1989; 69:1195~ 1197
[10]Harbuz M S, Lightman SL. Stress and hypothalamo-pitui tary-adrenal axis: acute, chronic and immunological activation. J Endocrinol, 1992; 134:327~ 329
[11]Conrad RP. Pathology of lymphoid organs with emphasis on immunosupression. Vet Immunol Immunopathol, 1991; 30:31~ 33
[12]Blaock JE. The syntax of immune-neuroendocrine communication. Immunol Today, 1994; 15:504~ 505
(收稿 1998—06—18 修回 1998—09—14), 百拇医药
单位:潘兴华 陈志龙 黄丽娜(成都军区昆明总医院医学实验科,昆明650032);王水琴(解放军农牧大学动物医学系)
关键词:糖皮质激素受体;地塞米松;雏鸡;免疫抑制
细胞与分子免疫学杂志990113
摘要 给予雏鸡地塞米松(Dex)10mg~75mg/kg后24h,诱导脾淋巴细胞产生IL-2和IFN诱生的活性,T、B细胞对Con-A的反应性,以及免疫器官(脾脏、胸腺及法氏囊)重量与体重比值均降低(P<0.01)。用50mg/kg的RU486阻断GR后,对Dex诱导的免疫抑制无明显地逆转作用,表现为阻断GR后,给予(10~75)mg/kg的Dex24h,上述免疫参数仍明显低于正常雏鸡(P<0.01),与只给予Dex的雏鸡相比较,无明显差异(P>0.05)。用25mg/kg的RU486阻断GR,对Dex诱导的免疫抑制作用具有明显地逆转作用,阻断GR后再给予(10~75)mg/kg的Dex后24h,上述免疫参数明显高于只给予Dex的雏鸡(P<0.01)。若给予10mg/kg或25mg/kg的Dex时,上述免疫参数接近正常水平,表明Dex对雏鸡的免疫抑制作用主要由GR所介导,给予适当量的RU486阻断GR的功能,有利于雏鸡抵抗糖皮质激素诱导的免疫抑制作用。
, 百拇医药
中国图书资料分类号 R392.2
The effect of blocking glucocorticoid receptor on the dexamethasone-induced immunosup-pression in chickens
Pan Xinghua, Wang Shuiqin1, Chen Zhilong, Huang Lina (Department of Medical Experiment, Kunming General Hospital, Kunming 650032)
Keywords glucocorticoid receptor dexamethasone chicken immunosuppression
Abstract The effects of blocking glucocorticoid receptor (GR) on dexamethasone (Dex)-induced immunosuppression in chickens were studied. Production of IL-2 and IFN by chicken spleen lymphocytes, immune responses of T and B cells to Con-A, and ratios of immune organs'(spleen, thymus and bursa of Fabricius) weight to body weight were reduced after administration of 10 mg~75 mg/kg of Dex to the chickens. Dex-induced immunosuppression could not be reversed on condition that GR was blocked with 50 mg/kg of Ru 486, proved by that the immune indexes of the chicken treated with 10 mg -75 mg/kg of Dex for 24 hours after GR blocking were markedly lower than those of normal chickens, and similar (P > 0.05) to those of the chickens treated with Dex alone. Dex-induced immunosuppresion could be reversed after GR was blocked with 25 mg/kg of RU486, when the above immune indexes in chickens treated with 10 mg~75 mg/kg of Dex for 24 hours after GR blocking were greatly higher than those in chickens treated with Dex alone(P<0.01). Further more, various immune indexes in chickens treated with 10 mg/kg or 25 mg/kg of Dex after GR blocking with 25 mg/kg of Ru 486 were close to those in normal chickens, indicating that immunosuppression of Dex on chickens was mainly mediated via GR mechanism, and GR function blocking with suitable dose of RU486 was beneficial for the chickens to resist glucocorticoid-induced immunosuppression.
, 百拇医药
糖皮质激素(GC)是体内的强效免疫调节因子,对免疫系统的影响极为广泛,同时也是烧伤、创伤、手术等强烈应激引起免疫抑制的主要原因之一。长期的应激反应往往可使体内GC分泌增加,免疫功能抑制,抗病能力下降,成为传染病、肿瘤等疾病发生的重要诱因。现代大规模畜禽饲养管理中,应激病也是常见的疾病,常可引起动物生产性能(指食用动物肉品质量、数量和繁殖力)下降和动物大批死亡等〔1,2〕。对于应激性疾病的防治,目前除消除应激因素和对症治疗外,尚无有效地防治措施。传统认为,GC的生物学作用是由GR所介导,各类免疫细胞均含有丰富的GR,因此阻断GR的功能,改变GR的活性,或减少GR的表达,都有可能有效地阻止GC的免疫抑制作用。另外,我们的前期实验发现,GR可能不仅是GC作用的桥梁,而且可能是GC和免疫系统相互作用的调节者,在内分泌和免疫的相互调节中起重要的作用〔1〕。本研究的目的在于阐明GR的内分泌免疫作用机制和阻断断GR在阻止GC免疫抑制中的意义。
1 材料和方法
, 百拇医药
1.1 主要试剂 RU486为上海计划生育研究所产品,用12%聚乙烯醇胶体溶液(即PVA),配制成不同浓度。Dex为华美公司产品,配制同RU486。伴刀豆球蛋白A(ConA)、乙酸豆寇佛波醇(PMA)、RPMI-1640培养液及MEM培养液,均为美国Technologies公司生产。a-甲基-D-甘露糖苷(aMM)为瑞士生产。3H-胸腺嘧啶核苷(3HTdR)为中国原子能研究所生产,放化纯度大于95%,放射性浓度为37BGq/L,用RPMI-1640培养液1∶50稀释备用。闪烁液2,5-二甲基恶唑5g,1,4-双-〔5-苯基恶唑基-2〕-苯0.3g,加无水乙醇200ml,甲苯800ml。
1.2 实验动物的分组 日龄伊萨褐公雏鸡,购自长春农业科学院,即日于实验室内分笼饲养,经20d健康观察无异常后,随机分为I~Ⅳ4组进行实验。第I组每只皮下注射50mg/kgRU486,第II组每只皮下注射25mg/kgRU486,第Ⅲ组皮下注射等体积的PVA。然后Ⅰ,Ⅱ,Ⅲ组每组分别皮下注射75,50,25和10mg/kgDex各5只作为对照,第Ⅳ组10只,同步注射等体积的PVA作为对照。各组雏鸡注射后24h称重,心脏采血后宰杀,无菌取脾、胸腺和法氏囊称重,分离培养脾淋巴细胞检测其诱生IL-2,IFN的活性和T、B细胞对有丝分裂原的反应性。
, 百拇医药
1.3 IL-2的体外诱生及活性检测 采用生物学活性法〔3〕。制备实验雏鸡脾细胞悬液,用24孔板培养细胞,培养液为RPMI-1640,细胞浓度为2.5×109/L,ConA的浓度为10mg/L。将细胞于40℃、5%CO2下培养24h,离心收集IL-2诱生上清,-40℃保存。按上述方法培养60d龄的雏鸡脾淋巴细胞48h,分离、收集活化的淋巴母细胞,加10g/L的aMM于40℃保温15min,用含20g/LaMM的RPMI1640培养液调细胞浓度至5×109/L,作为检测样品IL2活性的靶细胞。于96孔板中,每孔加入靶细胞悬液50μl,IL-2诱生上清样品50μl。每个样品设1∶2,1∶4,1∶8,1∶16和1∶32,5个稀释度,每个稀释度重复3孔,同时设空白对照和自制参考鸡IL-2样品对照。将细胞于40℃、5%CO2下培养24h,每孔加3H-TdR(0.074BGq/L)50μl,继续培养24h,测定3H-TdR的掺入量。结果以cpm值表示,以1∶16稀释孔中样品的平均cpm值计算结果。
, http://www.100md.com
1.4 脾淋巴细胞IFN诱生活性的检测 采用微量病变抑制法〔4〕。按诱生IL-2的方法诱生IFN,对水泡性口炎病毒(VSV)进行效价测定。在96孔板中,制备10d龄鸡胚传代成纤维细胞,用MEM培养液在培养板上对样品进行连续2倍稀释,每个稀释度设2个复孔,同时设自制参考鸡IFN对照、细胞对照和VSV对照。将细胞置于37℃、5%CO2下培养18h,以MEM洗涤,每孔中加入100μlVSV(100TCID50/ml),细胞对照孔加100μlMEM培养液。继续培养24h,于病毒生长良好时,用倒置显微镜观察细胞病变(PCE)。IFN的效价为出现50%细胞病变效应孔的最高稀释度的倒数(U/ml)。
1.5 T、B细胞增殖活性的检测 按文献〔5,6〕的方法制备脾、法氏囊淋巴细胞悬液,以3H-TdR掺入法测定脾T淋巴细胞对ConA的反应性和法氏囊淋巴细胞对PMA的反应性,结果以刺激指数(SI)表示。
, http://www.100md.com
1.6 免疫器官与体重比的检查 采用常规方法,以雏鸡免疫器官与其体重的比值×100表示。
2 结果
2.1 脾细胞IL-2和IFN诱生活性的变化 应用50mg/kgRU486阻断GR后,注射Dex(10~75mg/kg)的雏鸡脾细胞IL-2和IFN的诱生活性低于正常对照(P<0.01)。与只注射Dex的雏鸡相比较,IL-2诱生活性升高(P<0.05),IFN诱性活性在Dex75mg/kg和50mg/kg组升高(P<0.05),其余P>0.05。用25mg/kgRU486阻断GR后,注射Dex的雏鸡IL2和IFN诱生活性均明显高于只注射同剂量Dex的雏鸡(P<0.05),在Dex75mg/kg组和50mg/kg组低于正常鸡(P<0.05),10mg/kg组和25mg/kg组接近正常雏鸡(P>0.05);随Dex剂量组的减小,IL-2和IFN诱生活性升高,两个Dex剂量间的IL-2和IFN诱生活性相比较差异显著(P<0.05),结果见图1,2。


, 百拇医药
图1 阻断GR后Dex诱导的脾细胞IL-2产
生的变化
Fig 1 The changes in Dex-induced IL-2 production after GR blocked with RU486
图2 阻断GR后Dex诱导的脾细胞IFN产生的变化
Fig 2 The changes in Dex-induced IFN production after GR blocked with RU486
2.2 脾淋巴细胞增殖活性的变化 用50mg/kgRU486阻断GR后,注射Dex的雏鸡T、B细胞对有丝分裂原的反应性低于对照雏鸡(P<0.01)。T细胞的增殖活性与只注射同剂量Dex的鸡相比较无差异(P>0.05)。B细胞增殖活性在75mg/kg和50mg/kgDex组均高于单独注射同剂量Dex的雏鸡,其余无差异(P>0.05)。用25mg/kgRU486阻断GR,并注射Dex雏鸡的T、B细胞,对有丝分裂原的反应性低于健康对照(P<0.05),但除75mg/kgDex组外,都明显高于单独注射同剂量Dex的雏鸡(P<0.01),结果见图3,4。


, 百拇医药
图3 阻断GR后Dex诱导的脾T细胞增殖活性
的变化
Fig 3 The changes in proliferative activity of T cells after GR blocked with RU486
图4 阻断GR后Dex诱导的脾B细胞增殖活性
的变化
Fig 4 The changes in proliferative activity of B cells after GR blocked with RU486
2.3 免疫器官与体重比的变化 用50mg/kg的RU486阻断GR后,注射Dex的雏鸡脾脏、胸腺、法氏囊的重量与体重的比值低于正常对照组(P<0.01),法氏囊重量与体重比高于单独注射同剂量Dex的雏鸡(P<0.05),其余略高于单独注射同剂量Dex的雏鸡,但无统计学意义(P>0.05)。用25mg/kgRU486阻断GR后,注射Dex的雏鸡脾脏、胸腺、法氏囊的重量与体重之比值,在10mg/kgDex组与对照组无差异(P>0.05),其余低于正常对照组(P<0.05),但都明显高于只注射同剂量Dex的雏鸡(P<0.05)。
, http://www.100md.com
3 讨论
RU486,又名Miferistone(17B-羟-11B〔4-二甲氨基苯〕-17a丙炔基-1-雌甾-1,9-烯-3-酮),是一种能与GC竞争结合GR但无GC作用的甾类化合物。其对GR的亲和力高,与大鼠GR和亲和力大约是Dex的3倍,而且解离速度慢,因此是一种良好的GR功能阻断剂或GC拮抗剂。本研究中用RU486阻断GR的功能,具有作用确实、结果可靠的特点〔7〕。人们已对GC的免疫抑制作用做了深入地研究,认为GC可选择性地抑制细胞免疫,使免疫器官萎缩,T细胞活性降低,细胞因子合成减少,对ConA,PHA,PWM及抗原诱导的淋巴细胞转化和增殖的作用降低等。其对体液免疫的影响较为复杂,低浓度时起促进作用,高浓度时则抑制〔8〕,本实验的结果与有关报道基本一致。关于体内应用RU486阻断GR功能,对GC免疫调节作用的影响未见报道。我们发现,用50mg/kgRU486阻断GR的功能,不能有效地阻止Dex的免疫抑制作用,表现为阻断GR后,Dex对雏鸡的免疫抑制效应与单独给予Dex的雏鸡无明显差异,与我们体外实验的结果相似〔9〕。Bradly等也认为,10-5mol/L的RU486对人淋巴细胞对ConA的反应性有明显抑制作用,而在10-6和10-7mol/L时无影响。VanVoorhis等体外实验发现,用1~10nmol/LRU486阻断GR后,可拮抗皮质醇对人淋巴细胞增殖的抑制效应,而浓度升高时则可与皮质醇一起抑制淋巴细胞的增殖反应〔9〕,与我们体内实验的结果基本一致。但本实验中没有出现协同抑制效应,我们认为可能是体内多种因素共同作用的结果,详细机制尚需进一步研究。以25mg/kgRU486阻断GR的功能后,给予(10~75)mg/kgDex,虽然所有公雏鸡的免疫指标都部分低于正常对照,但明显高于单独给予同剂量Dex的雏鸡,且有剂量依赖性。减小Dex的剂量,RU486对Dex免疫抑制的逆转作用增加,说明适当量地阻断GR功能,可有效地阻止GC的免疫抑制作用,从而为临床防治GC引起的免疫抑制性疾病提供了新的思路和方法。本研究还进一步证实,GC对雏鸡免疫系统的作用机制与哺乳动物相同,主要也由GR所介导。
, http://www.100md.com
在实践中,由于应激等因素引起的内源性GC产生过多而导致免疫抑制的情况比较多见〔10,11〕,常是影响烧创、创伤、外科手术和感染等应激性疾病防治和畜牧业发展的重要因素,本实验无疑是一种有益的探索。但体内免疫和内分泌系统之间相互调节的关系极为复杂,有关GR在内分泌和免疫网络中的重要意义及应用尚需做深入地研究。GC对免疫系统具有广泛而深刻的影响,而且值得注意的是,体内分泌的GC在活性上与人工合成的GC有较大差异,一定浓度的GC可能有促进免疫功能的作用,是维持正常免疫功能的必需因素。另外,GC对免疫系统的作用具有浓度依赖性、免疫细胞类型的特异性,并受遗传因素和抗原种类及刺激程度的影响。免疫细胞可通过改变GR的表达及活性来调节合适的免疫反应,而且其本身也作为分泌“器官”产生多种细胞因子和激素,而反馈调节免疫细胞的活性,借以维持正常的免疫功能〔12〕。因此,合适含量的功能性GR对维持免疫细胞的活性具有重要的意义。从本实验的结果来看,采用25mg/kgRU486阻断GR功能,来防治鸡GC的免疫抑制作用较为合适。同步实验表明,给予雏鸡50mg/kgRU486,可使外周血淋巴细胞GR的结合容量下降60%左右,而给予雏鸡25mg/kg的RU486时,外周血淋巴细胞GR的结合容量下降30%左右。一般GR的功能被阻断30%时,对淋巴细胞的活性无影响,而且可以有效地逆转一定剂量的Dex诱导的免疫抑制作用。雏鸡免疫系统的组成和发育与哺乳动物相似,因此,本研究有可能为人和哺乳动物应激性疾病的防治提供新的思路。
, http://www.100md.com
*国家自然科学基金资助项目,NO.39670549
作者简介:潘兴华,男,35岁,主治医师,硕士
昆明市大观路44号,Tel.(0871)4074661
参考文献
[1]潘兴华,王水琴,牛廷献.应激对免疫功能的影响.中国兽医杂志,1996;22(1):52~53
[2]金伯泉主编.细胞与分子免疫学.西安:世界图书出版公司,1995:133~134
[3]Schnetzler M, Oommen A, Nowak JS,et al. Characterization of chicken T cell growth factor. Eur Immunol, 1983; 13: 560~563
, 百拇医药
[4]杨贵贞主编.免疫生物工程纲要与技术.长春:吉林科技出版社,1993:28~29
[5]Thiel H J, Burkhardt E. Development of optimal conditions for the stimulation of chicken peripheral blood lymophocytes by PHA in the microculture system. Vet Immunopathol, 1984; 6:327~329
[6]徐彦波.雏鸡感染鸡传染性贫血后细胞因子和免疫功能的变化及对新城疫苗免疫的影响〔博士论文〕.东北农业大学,1993;6:19~22
[7]Philibert D, Costerousse G, Gaillard Moguilewsky M,et al. From RU486 towards dissociated antiglucocorticoid and antiprogesterone. Front Horm Res, 1991; 19:1~ 17
, 百拇医药
[8]潘兴华,王水琴,陈志龙.体外阻断GR功能对雏鸡脾淋巴功能活性及Dex免疫抑制的影响.细胞与分子免疫学杂志,1997;13(2):8~10
[9]Van Voorhis B, Anderson D, Hill J. The effects of RU486 on immune function and steroid induced immuno-suppression in vitro. J Chin Endocr Metab, 1989; 69:1195~ 1197
[10]Harbuz M S, Lightman SL. Stress and hypothalamo-pitui tary-adrenal axis: acute, chronic and immunological activation. J Endocrinol, 1992; 134:327~ 329
[11]Conrad RP. Pathology of lymphoid organs with emphasis on immunosupression. Vet Immunol Immunopathol, 1991; 30:31~ 33
[12]Blaock JE. The syntax of immune-neuroendocrine communication. Immunol Today, 1994; 15:504~ 505
(收稿 1998—06—18 修回 1998—09—14), 百拇医药