抗胃癌单克隆抗体识别的噬菌体呈现肽与天然抗原的关系
作者:徐立 金伯泉 樊代明
单位:徐立(第四军医大学西京医院消化病研究所);金伯泉(免疫学教研室,陕西西安710032);樊代明(第四军医大学西京医院消化病研究所)
关键词:胃癌相关抗原;抗原模拟;噬菌体表面呈现;;竞争抑制
细胞与分子免疫学杂志000209
中图号:R392.11R735.2 文献标识码:B
文章编号:1007-8738(2000)02-0119-02
噬菌体呈现的随机肽库已成功地用于筛选B细胞或T细胞表位。为进一步研究胃癌相关抗原与相应单克隆抗体(mAb)结合的结构基序及其相互作用,我所通过两株胃癌mAbMG7和MGb2筛选噬菌体呈现的随机九肽库,获得一些可与mAb结合的噬菌体呈现肽。我们采用竞争抑制实验,研究了这些肽与天然胃癌相关 抗原的关系。
, 百拇医药
1 材料和方法
1.1 材料 胃癌mAbMG7和MGb2由本所研制[1,2],通过筛选噬菌体呈现的随机九肽库[3,4],获得可与相应mAb结合的噬菌体呈现肽[5,6]。
1.2 方法
1.2.1 噬菌体呈现肽竞争抑制试验 将纯化的噬菌体分别与相应的mAb4℃孵育过夜。然后在ELISA酶标板中,加入表达胃癌相关抗原MG7和MGb2的KATOIII胃癌细胞(1×104/孔),用丙酮-福
尔马林固定液固定30s,再加入含50g/LBSA的10mmol/LPBS(pH7.4),37℃封闭2h。每孔中分别加入噬菌体与mAb的混合液100μL,37℃孵育30min,用PBST/PBS洗板。依次加入生物素-抗鼠二抗及亲和素与HRP标记的生物素复合物,常规孵育和洗涤。最后以TMB显色、2mol/LH2SO4终止反应。在酶标仪上读取波长450nm的A值。同时设阴性对照1孔(加入纯化的非重组噬菌体与mAb预孵的混合物),阳性对照1孔(加入细胞与mAb预孵的混合物),及无 竞争抑制1孔(即直接加入抗体)。
, 百拇医药
抑制率(%)=〔(无竞争抑制孔A450nm值-竞争抑制孔A450nm值)/无竞争抑制孔A450nm值〕×100%
1.2.2 肿瘤细胞竞争抑制试验 用纯化的mAbMG7和MGb2分别包被聚乙二烯珠子,封闭后加不同稀释度的胃癌细胞KatoIII和阳性噬菌体颗粒,并以空载体作为阴性对照,于37℃孵育2h。以PBST/PBS反复洗涤后,用酸洗脱法回收与mAb结合的噬菌体,感染宿主菌,计算克隆形成数(cfu)。
2 结果
噬菌体呈现的抗原模拟肽对天然抗原与胃癌mAb结合的抑制率在50%~80%之间,见表1和图1;天然抗原则可完全抑制模拟肽与胃癌mAb的结合。结果还提示,当模拟肽与各自相应的mAb孵育时,随着细胞密度的增加,与mAb结合的噬菌体数目逐渐减少,见表2和图2;而当呈现肽与非相应mAb孵育时,mAb结合 的噬菌体数目与细胞的密度改变无关。
, http://www.100md.com
表1 噬菌体呈现肽ELISA竞争抑制试验A450nm值 mAb
无竞争
阳性
阴性
克隆1
克隆2
MG7
1.397
0.119
1.219
0.483
0.366
, http://www.100md.com
MGb2
1.126
0.106
1.008
0.479
0.506
表2 肿瘤细胞竞争抑制试验的洗脱克隆数 细胞数
空载体
G*-MG7
B*-MGb2
G-MGb2
B-MG7
, 百拇医药
1×102
63
9.6×104
3.5×104
85
77
1×103
58
3.2×104
8.6×103
102
, http://www.100md.com
60
1×104
69
8.0×103
5.2×103
97
66
1×105
64
4.2×103
7.9×102
, http://www.100md.com
83
50
1×106
45
96
88
75
54
*G,B分别代表与mAbMG7和MGb2结合的噬菌体呈现肽.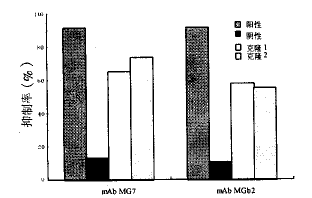
图1 噬菌体呈现肽竞争抑制试验的抑制率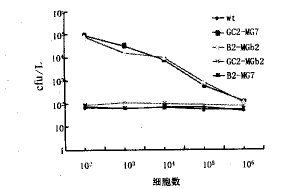
, http://www.100md.com
图2 肿瘤细胞与阳性噬菌体的竞争抑制试验
3 讨论
肿瘤相关抗原与正常细胞上抗原分子十分相似,应用mAb技术可区别二者之间的细微差异。那么体现这种差异的分子是什么呢?鉴于肿瘤抗原的研究正由天然蛋白大分子向亚单位、表位多肽过渡[7,8],我们通过用胃癌mAbMG7和MGb2筛选噬菌体呈现的随机九肽库,已获得一些可与mAb结合的噬菌体呈现肽。为进一步明确噬菌体呈现肽与细胞表达的天然胃癌抗原间的关系,我们采用竞争抑制实验进行了探讨。结果提示,噬菌体呈现肽与mAb的结合位点,位于细胞表面天然抗原与mAb结合位点之中,而且两株mAb识别的表位之间无交叉反应。
基金项目:国家杰出青年基金,No.39525020
作者简介:徐立,女,30岁,博士生,西安市长乐西路15号,Tel.(029)3375227
, 百拇医药
参考文献:
〔1〕樊代明,张学庸,陈希陶,等.抗低分化胃癌细胞系MKN-46-9单克隆抗体的制备及免疫组化鉴定〔J〕.解放军医学杂 志,1988;13:12-15.
〔2〕樊代明,张学庸,陈希陶,等.抗胃印戒细胞癌株KATOIII单克隆抗体MGb1和MGb2的建立及其免疫组化初步鉴定〔J〕.中华 消化杂志,1988,8(1):25-29.
〔3〕 Luzzago A,Felici,F,Tramontano A, et al. Mimicking of discontinuous epitopes by phage displayed peptides.I.Epitope mapping of human H ferritin using a phage library of constrained peptides〔 J〕 . Gene,1993; 128(1): 51-57.
, http://www.100md.com
〔4〕Felici,F, Luzzago A, Folgori A, et al. Mimicking of discontinuous epitopes by phage- displayed peptides. II.Selection of clones recognized by a protective monoclonal antibody against the Bordetella pertussis toxin from phagepeptide libraries〔 J〕 . Gene, 1993; 128(1): 21- 27.
〔5〕徐立,金伯泉,樊代明,等.胃癌相关抗原MG7-Ag模拟肽表位的筛选及测序分析〔J〕.中华医学杂志,2000;30(4):67- 71.
〔6〕徐立,金伯泉,樊代明,等.用随机肽库筛选胃癌相关抗原MGb2-Ag模拟肽表位.中华消化杂志,1999;19(6):15-18.
, http://www.100md.com
〔7〕 Cortese R, Felici,F, Galfre G. Epitope discovery using peptide libraries displayed on phage〔 J〕 . TrendsBiotechnol, 1994; 12(7): 262- 267.
〔8〕 Gevorkian G, Manoutcharian K, Almagro JC, et al. Identification of autoimmune thrombocytopenicpurpura- related epitopes using phage- display peptide library〔 J〕 . Clin Imm- unol Immunopathol, 1998;86(3): 305- 309.
收稿日期:1999-05-28
修回日期:1999-08-23, http://www.100md.com
单位:徐立(第四军医大学西京医院消化病研究所);金伯泉(免疫学教研室,陕西西安710032);樊代明(第四军医大学西京医院消化病研究所)
关键词:胃癌相关抗原;抗原模拟;噬菌体表面呈现;;竞争抑制
细胞与分子免疫学杂志000209
中图号:R392.11R735.2 文献标识码:B
文章编号:1007-8738(2000)02-0119-02
噬菌体呈现的随机肽库已成功地用于筛选B细胞或T细胞表位。为进一步研究胃癌相关抗原与相应单克隆抗体(mAb)结合的结构基序及其相互作用,我所通过两株胃癌mAbMG7和MGb2筛选噬菌体呈现的随机九肽库,获得一些可与mAb结合的噬菌体呈现肽。我们采用竞争抑制实验,研究了这些肽与天然胃癌相关 抗原的关系。
, 百拇医药
1 材料和方法
1.1 材料 胃癌mAbMG7和MGb2由本所研制[1,2],通过筛选噬菌体呈现的随机九肽库[3,4],获得可与相应mAb结合的噬菌体呈现肽[5,6]。
1.2 方法
1.2.1 噬菌体呈现肽竞争抑制试验 将纯化的噬菌体分别与相应的mAb4℃孵育过夜。然后在ELISA酶标板中,加入表达胃癌相关抗原MG7和MGb2的KATOIII胃癌细胞(1×104/孔),用丙酮-福
尔马林固定液固定30s,再加入含50g/LBSA的10mmol/LPBS(pH7.4),37℃封闭2h。每孔中分别加入噬菌体与mAb的混合液100μL,37℃孵育30min,用PBST/PBS洗板。依次加入生物素-抗鼠二抗及亲和素与HRP标记的生物素复合物,常规孵育和洗涤。最后以TMB显色、2mol/LH2SO4终止反应。在酶标仪上读取波长450nm的A值。同时设阴性对照1孔(加入纯化的非重组噬菌体与mAb预孵的混合物),阳性对照1孔(加入细胞与mAb预孵的混合物),及无 竞争抑制1孔(即直接加入抗体)。
, 百拇医药
抑制率(%)=〔(无竞争抑制孔A450nm值-竞争抑制孔A450nm值)/无竞争抑制孔A450nm值〕×100%
1.2.2 肿瘤细胞竞争抑制试验 用纯化的mAbMG7和MGb2分别包被聚乙二烯珠子,封闭后加不同稀释度的胃癌细胞KatoIII和阳性噬菌体颗粒,并以空载体作为阴性对照,于37℃孵育2h。以PBST/PBS反复洗涤后,用酸洗脱法回收与mAb结合的噬菌体,感染宿主菌,计算克隆形成数(cfu)。
2 结果
噬菌体呈现的抗原模拟肽对天然抗原与胃癌mAb结合的抑制率在50%~80%之间,见表1和图1;天然抗原则可完全抑制模拟肽与胃癌mAb的结合。结果还提示,当模拟肽与各自相应的mAb孵育时,随着细胞密度的增加,与mAb结合的噬菌体数目逐渐减少,见表2和图2;而当呈现肽与非相应mAb孵育时,mAb结合 的噬菌体数目与细胞的密度改变无关。
, http://www.100md.com
表1 噬菌体呈现肽ELISA竞争抑制试验A450nm值 mAb
无竞争
阳性
阴性
克隆1
克隆2
MG7
1.397
0.119
1.219
0.483
0.366
, http://www.100md.com
MGb2
1.126
0.106
1.008
0.479
0.506
表2 肿瘤细胞竞争抑制试验的洗脱克隆数 细胞数
空载体
G*-MG7
B*-MGb2
G-MGb2
B-MG7
, 百拇医药
1×102
63
9.6×104
3.5×104
85
77
1×103
58
3.2×104
8.6×103
102
, http://www.100md.com
60
1×104
69
8.0×103
5.2×103
97
66
1×105
64
4.2×103
7.9×102
, http://www.100md.com
83
50
1×106
45
96
88
75
54
*G,B分别代表与mAbMG7和MGb2结合的噬菌体呈现肽.

图1 噬菌体呈现肽竞争抑制试验的抑制率

, http://www.100md.com
图2 肿瘤细胞与阳性噬菌体的竞争抑制试验
3 讨论
肿瘤相关抗原与正常细胞上抗原分子十分相似,应用mAb技术可区别二者之间的细微差异。那么体现这种差异的分子是什么呢?鉴于肿瘤抗原的研究正由天然蛋白大分子向亚单位、表位多肽过渡[7,8],我们通过用胃癌mAbMG7和MGb2筛选噬菌体呈现的随机九肽库,已获得一些可与mAb结合的噬菌体呈现肽。为进一步明确噬菌体呈现肽与细胞表达的天然胃癌抗原间的关系,我们采用竞争抑制实验进行了探讨。结果提示,噬菌体呈现肽与mAb的结合位点,位于细胞表面天然抗原与mAb结合位点之中,而且两株mAb识别的表位之间无交叉反应。
基金项目:国家杰出青年基金,No.39525020
作者简介:徐立,女,30岁,博士生,西安市长乐西路15号,Tel.(029)3375227
, 百拇医药
参考文献:
〔1〕樊代明,张学庸,陈希陶,等.抗低分化胃癌细胞系MKN-46-9单克隆抗体的制备及免疫组化鉴定〔J〕.解放军医学杂 志,1988;13:12-15.
〔2〕樊代明,张学庸,陈希陶,等.抗胃印戒细胞癌株KATOIII单克隆抗体MGb1和MGb2的建立及其免疫组化初步鉴定〔J〕.中华 消化杂志,1988,8(1):25-29.
〔3〕 Luzzago A,Felici,F,Tramontano A, et al. Mimicking of discontinuous epitopes by phage displayed peptides.I.Epitope mapping of human H ferritin using a phage library of constrained peptides〔 J〕 . Gene,1993; 128(1): 51-57.
, http://www.100md.com
〔4〕Felici,F, Luzzago A, Folgori A, et al. Mimicking of discontinuous epitopes by phage- displayed peptides. II.Selection of clones recognized by a protective monoclonal antibody against the Bordetella pertussis toxin from phagepeptide libraries〔 J〕 . Gene, 1993; 128(1): 21- 27.
〔5〕徐立,金伯泉,樊代明,等.胃癌相关抗原MG7-Ag模拟肽表位的筛选及测序分析〔J〕.中华医学杂志,2000;30(4):67- 71.
〔6〕徐立,金伯泉,樊代明,等.用随机肽库筛选胃癌相关抗原MGb2-Ag模拟肽表位.中华消化杂志,1999;19(6):15-18.
, http://www.100md.com
〔7〕 Cortese R, Felici,F, Galfre G. Epitope discovery using peptide libraries displayed on phage〔 J〕 . TrendsBiotechnol, 1994; 12(7): 262- 267.
〔8〕 Gevorkian G, Manoutcharian K, Almagro JC, et al. Identification of autoimmune thrombocytopenicpurpura- related epitopes using phage- display peptide library〔 J〕 . Clin Imm- unol Immunopathol, 1998;86(3): 305- 309.
收稿日期:1999-05-28
修回日期:1999-08-23, http://www.100md.com